Hans Journal of Ophthalmology
Vol.04 No.01(2015), Article ID:14898,8
pages
10.12677/HJO.2015.41001
The Role of Collagen-Binding Integrin β1 in Scleral Remodelling during Induced Myopia and Recovery
Yuan Wang, Xian Yang*, Jing Liu, Qing Wang, Guibo Liu
Department of Ophthalmology, The Affiliated Hospital of Qingdao University, Qingdao Shandong
*通讯作者。
Email: *yangxian_zhao@126.com
Received: Feb. 8th, 2015; accepted: Feb. 22nd, 2015; published: Mar. 2nd, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To investigate the role of collagen-binding integrin β1 in sclera remodeling process of the guinea pig form-deprivation myopia (FDM). Methods: 128 young guinea pigs, aged 2 to 3 weeks, were randomized into experimental group (n = 64) and normal control group (n = 64). FDM models were monocular deprived by placement of a facemask over the right eye in the experimental group, and the fellow eyes served as the contralateral control eyes. The guinea pigs in the normal control group were raised with both eyes untreated. The FDM eyes were monocular deprived for 1, 2 and 4 weeks, and recovered 1, 3, 5, 7, 14 days after occluding for 4 weeks. Optical measurements and axial length were accomplished at all of the time points. The histological analysis was applied to assess the posterior sclera changes, and immunohistochemical staining and quantitative real-time PCR (QRT-PCR) were applied to investigate the expression of integrin β1 protein and mRNA. Results: After 2 and 4 weeks, compared with the fellow eyes and the normal control group, the refraction diopter of the experimental group was (−3.00 ± 0.50) D and (−5.50 ± 1.08) D, and the axial length elongated (0.22 ± 0.06) mm and (0.49 ± 0.11) mm, showing significant differences respectively (P < 0.05); but in 1 week, the statistics showed no difference among those groups (P > 0.05). After re-exposure, the right eyes of guinea pigs in the experimental group experienced re-normalization and the refraction was rapidly recovered in the initial 7 days (P > 0.05); the axial length gradually shortened, and it was statistically non-significant after 14-day recovery (P > 0.05). The morphological observation of sclera found that the posterior sclera collagen fiber arrangement of guinea pigs with FDM was disordered and the sclera became thinner. Scleral integrin β1 mRNA and protein expression in FDM eyes were significantly lower than those in the controls after monocular deprived 1 week (P < 0.05). One day after occlusion had been removed, the expression of integrin β1 was up-regulated but lower than that in the controls (P < 0.05), and the difference was non-significant after 7-day recovery (P > 0.05). The difference of all the above statistics between contralateral control eyes and the normal control group was not remarkable (P > 0.05). Conclusion: Form-deprivation myopia was able to be induced by monocular covering. Guinea pigs aged 2 to 3 weeks with form-deprivation can experience re-normalization after recovery, along with the shortening of the axial length. The main recovery stage of ocular biometric parameters was in the initial 7 days. The expression of integrin β1 in FDM sclera was found to be lower, but could be restored during the recovery period. This suggests that collagen- binding integrin β1 may be involved in the pathogenesis of myopia, and further study needs to be done on the mechanism of the scleral remodeling in myopia.
Keywords:Myopia, Integrin, Sclera, Form-Deprivation Myopia (FDM), Recovery

胶原相关整合素β1在形觉剥夺性近视诱导及恢复期中调节巩膜重塑作用的研究
王园,杨先*,刘静,王青,刘桂波
青岛大学附属医院眼科,山东 青岛
Email: *yangxian_zhao@126.com
收稿日期:2015年2月8日;录用日期:2015年2月22日;发布日期:2015年3月2日

摘 要
目的:探讨豚鼠形觉剥夺性近视(form-deprivation myopia,FDM)模型中巩膜胶原相关整合素β1在巩膜重塑中的作用。方法:2~3周龄三色豚鼠128只,分为实验组(n = 64)和正常对照组(n = 64)。实验组采用头套法遮盖右眼进行形觉剥夺,左眼则为自身对照,正常对照组双眼不予任何处理。实验组依据形觉剥夺l周、2周、4周不同时间建立不同近视诱导和进展过程中的动物模型。并通过对形觉剥夺4周动物去除遮盖物,依据去遮盖时间l天、3天、5天、7天及14天建立不同时间点FDM恢复期的动物模型。在各个时间点对各组动物分别进行检测:带状光检影测量屈光度值;游标卡尺测量眼轴长度;苏木素–伊红(HE)染色观察后极部巩膜组织形态学变化;实时荧光定量聚合酶链反应(QRT-PCR)、免疫组织化学方法检测后极部巩膜胶原相关整合素β1 mRNA及蛋白表达情况。结果:形觉剥夺2周、4周后,实验组右眼分别诱导出(−3.00 ± 0.50) D及(−5.50 ± 1.08) D的相对近视,眼轴分别拉长(0.22 ± 0.06) mm及(0.49 ± 0.11) mm,与自身对照组及正常对照组相比,组间差异均有统计学意义(P均 < 0.05);形觉剥夺1周时,实验眼屈光度、眼轴长度与自身对照眼、正常对照眼相比无显著性差异(P > 0.05)。去遮盖后,豚鼠右眼重新正视化,与自身对照、正常对照眼相比,去遮盖7天时屈光度差值差异无显著性(P > 0.05);右眼眼轴长度缩短,14天时眼轴长度差值差异无显著性(P > 0.05)。巩膜形态学观察见形觉剥夺性近视眼豚鼠后极部巩膜胶原纤维排列紊乱,巩膜变薄;QRT-PCR及免疫组织化学染色显示,实验组右眼形觉剥夺l周后眼球后部巩膜整合素β1 mRNA及蛋白表达明显减少,差异有统计学意义(P < 0.05),去遮盖1天后表达开始上调,但仍低于对照组(P < 0.05),7天时与对照组相比较,差异无统计学意义(P > 0.05)。自身对照组的上述所有检测指标与正常对照组相比,均无明显差异(P > 0.05)。结论:单眼遮盖可以导致FDM的发生;2~3周龄豚鼠去除形觉剥夺后可以重新进行正视化,伴随眼轴长度缩短;去遮盖7天内为眼生物学参数恢复的主要时期;豚鼠形觉剥夺时,后极部巩膜整合素β1表达减少,去遮盖后表达上调,提示整合素β1可能参与了形觉剥夺性近视的发生,其影响巩膜重塑的机制有待进一步研究。
关键词 :近视,整合素,巩膜,FDM,恢复期

1. 引言
近视是常见的眼科疾病,高度近视可导致视网膜病变甚至有致盲的可能,已成为近年眼科视光学研究的热点。巩膜是与近视发生关系最为密切的眼组织之一,眼球在视觉发育及正视化阶段能够根据外界视觉环境改变精确地调控巩膜细胞外基质(extracellular matrix, ECM)主动重塑,使其弹性、承载力减弱,以调节眼轴生长速度,促使近视眼轴加长,使之与眼屈光状态相适应。巩膜主要由I型胶原组成,由成纤维细胞分泌,I型胶原的合成和降解是发生巩膜重塑的主要特征[1] -[3] 。因此检测影响胶原合成和降解的关键因子十分必要。整合素家族是主要的细胞–基质粘附分子,在结缔组织ECM重塑和生物化学改变中起了重要作用 [4] 。整合素是一种跨膜糖蛋白,识别I型胶原的α1 (1)链的天冬氨酸–甘氨酸–丙氨酸(Asp-Gly-Glu-Ala, DGEA)序列,与之结合并产生一系列的生物学效应,能够调节胶原合成 [5] ,是胶原纤维联合的关键。最近有研究发现人巩膜成纤维细胞中整合素参与其胶原的合成 [6] 。因此胶原相关整合素也许是巩膜成纤维细胞最关键的受体。目前,在近视形成和发病机制中,有关整合素在巩膜重塑中的变化和作用的研究少见报道,且国内外关于整合素与近视眼的相关性研究均缺乏恢复期的研究。
本实验通过单眼遮盖法建立豚鼠形觉剥夺性近视模型,观察在近视诱导、形成、进展以及恢复过程中眼球生物参数及眼后极部巩膜组织形态学及超微结构的变化,研究巩膜细胞外基质中胶原与巩膜重塑的相关性,探讨整合素受体β1在巩膜重塑、近视发生、恢复过程中的调控作用,为研究整合素在近视眼发病过程中的相关作用机制提供依据,对研究人类青少年近视的发生规律和临床治疗都有一定指导意义。
2. 材料和方法
2.1. 实验动物
2~3周龄普通级三色豚鼠128只(购自济南章丘市金丰肉兔养殖专业合作社,由青岛大学医学院动物实验中心饲养),体重120~170 g,雌雄不限,健康,无眼疾。双眼屈光检查无近视状态,无明显屈光参差(单眼屈光度在+1.00~+7.00 D之间,且双眼屈光参差 < 2.00 D)。每笼饲养2~3只,控制25℃~30℃的环境温度,予以12/12h光照(500 lux)。给予充足专用豚鼠饲料,每天定时喂食新鲜蔬菜以补充维生素C,自由进水。本实验经青岛大学医学院动物伦理委员会批准,实验动物的使用和喂养符合ARVO声明。
2.2. 实验方法
2.2.1. 豚鼠FDM及恢复期模型的建立
按随机数字表法编号,把做好编号的豚鼠分为实验组(n = 64)和正常对照组(n = 64)。实验组采用半透明乳胶头套(苏州乳胶厂生产的6号乳白色半透明无毒乳胶气球)诱导豚鼠FDM,头套以颈部、嘴部为固定部位,暴露豚鼠对侧眼、双耳及口鼻,不影响摄食和进水,遮盖眼能自由瞬目,不压迫眼睑。选用动物的右眼作为实验眼,对侧眼作为自身对照眼。正常对照组双眼不予任何处理。实验组依据形觉剥夺l周、2周、4周不同时间建立不同近视诱导和进展过程中的动物模型。并通过对形觉剥夺4周动物去除遮盖物,依据去遮盖时间l天、3天、5天、7天及14天建立不同时间点FDM恢复期的动物模型。FDM及恢复期各组动物成功建立后,检查所有动物眼的屈光度、眼轴长度,并取后巩膜组织进行检测。
2.2.2. 观察指标和方法
1) 屈光度、眼轴长度测量所有实验动物在实验前和不同时间点时在睫状肌麻痹状态下用带状光检影,连续测量3次,取等效球镜度平均值。将各组豚鼠的右眼屈光度值(D)记录下来。然后10%水合氯醛腹腔注射,过量麻醉法处死动物后,迅速取出眼球,游标卡尺测量眼轴长度。角膜前顶点与眼球后极部之间的直线距离即为眼轴长,测量3次后,记录其平均值,精确到0.02 mm。
2) 免疫组织化学染色法检测巩膜整合素蛋白表达在各个实验组中各取4只豚鼠眼球,予常规石蜡包埋。所有组织蜡块于近后极部连续切片4张,每张切片厚3~5 μm,1张用于苏木素–伊红(HE)染色,1张作阴性对照,2张用于免疫组化染色(integrinβ1兔抗鼠多克隆抗体:博奥森公司)。镜下观察各组标本中整合素β1的显色程度,分布范围及密度,以细胞核或细胞浆然染成棕黄色为阳性。
3) 实时荧光定量PCR检测整合素β1 mRNA表达各组取4只豚鼠眼球在显微镜下将眼前节组织及玻璃体去除,分离出视网膜和脉络膜组织,在视盘的颞侧5 mm处取巩膜组织块,大小约5 mm × 5 mm,于−80℃冰箱保存。取冻存组织标本加1 ml Trizol快速研磨,常规提取总RNA。采用紫外分光光度计分别测定光密度OD260与OD280,OD260与OD280的比值在1.8~2.0之间,表明提取的RNA蛋白污染很少,可用于后续逆转录反应。逆转录获得cDNA。以cDNA为模板,PCR扩增的整合素β1目的基因应用primer design基因分析软件设计引物,并由TaKaRa生物公司合成。整合素β1上、下游引物分别为:5’-ACTCCCTTTCTTCAGAGGTCATTTT-3’,5’-GTCCCGTTTACCCCGTTCTT-3’,产物片段长为97 bp;内参β-actin上、下游引物分别为:5’-GGCACCAGGGAGTCATGGTA-3’,5’-TGGGGTATTTCAGGGTCAGG-3’,产物片段长为96 bp。Syber Green荧光定量PCR检测:PCR热循环参数为95℃30S,95℃5S,然后二步反应:60℃30S,95℃15s,进行40个循环,于每个循环的第二步(95℃15s)收集荧光信号。扩增完毕后,进入结果分析界面,以β-actin为内参照基因,与对照组相比,得到目的基因表达的相对定量值RQ ( )。
)。
2.2.3. 统计学方法
应用SPSS17.0统计软件包,双眼比较采用配对t检验,组间比较采用单因素方差分析,两两比较采用LSD检验。
3. 结果
3.1. 屈光度、眼轴长度结果
表1示形觉剥夺前后及恢复期各个时间点的实验眼和自身对照眼、正常对照眼屈光状态和眼轴长度的变化。实验前豚鼠屈光度约为+3.00 D的远视,各组间、组内双眼间屈光度和眼轴长度无显著性差异(P > 0.05)。形觉剥夺1周时,实验眼屈光度、眼轴长度与自身对照眼、正常对照眼相比无显著性差异(P > 0.05)。随形觉剥夺时间延长,遮盖眼组屈光度由实验前远视渐变为近视,眼轴明显增长。形觉剥夺2周、4周后,实验组右眼分别诱导出(−3.00 ± 0.50) D及(−5.50 ± 1.08) D的相对近视,眼轴分别拉长(0.22 ± 0.06) mm及(0.49 ± 0.11) mm,与自身对照组及正常对照组相比,组间差异显著(P < 0.01)。
去遮盖后,豚鼠右眼重新正视化,与自身对照、正常对照眼相比,恢复1天时屈光度、眼轴长度差值差异显著(P < 0.05)。恢复3天时,剥夺眼屈光力恢复37%,眼轴长度恢复26%,至恢复7天屈光度差值差异无显著性(P > 0.05),眼轴长之间差异仍有显著性(P < 0.05)。恢复14天时,实验眼眼轴长度缩短,与自身对照、正常对照眼相比,差异无显著性(P > 0.05)。
各组巩膜HE切片染色变化见图1。巩膜HE切片染色成纤维细胞核呈蓝紫色,梭形或长圆形,细胞
Table 1. Refraction diopter and the axial length in different groups of guinea pigs (± s)
表1. 各组豚鼠眼形觉剥夺前后及恢复期各个时间点屈光度、眼轴长度的比较(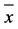 ± s)
± s)
注:与自身对照组比较:*P < 0.05;与正常对照组比较:#P < 0.05。

 (a)(b)
(a)(b)
 (c)(d)
(c)(d)
Figure 1. The HE staining of the posterior sclera in different groups of guinea pigs
图1. 各组豚鼠后极部巩膜HE染色图片(HE × 400):(a)为形觉剥夺2周组正常对照眼;(b)为形觉剥夺2周组实验眼;(c)为形觉剥夺4周组正常对照眼;(d)为形觉剥夺4周组实验眼
外基质呈粉红色。对照眼的巩膜自赤道部向后极部逐渐增厚,实验眼缺乏这种特征,实验眼巩膜的组织学变化集中于后极部,2周时实验眼巩膜变薄,胶原纤维排列稍紊乱,4周时变化较明显,可见巩膜胶原纤维排列紊乱、扭曲,粗细不均,密度减低,纤维间隙变大。成纤维细胞胞核扭曲变形。
3.3. 免疫组织化学染色结果
图2、表2示巩膜整合素β1蛋白表达的变化。正常豚鼠巩膜可见整合素β1的蛋白表达,巩膜成纤维细胞内阳性细胞胞浆为棕黄色,染色明显。在豚鼠视觉剥夺后,随遮盖时间延长,巩膜整合素β1蛋白表达逐渐下调,胞浆着色减弱,与对照眼相比,差异有显著统计学意义(P < 0.05)。去遮盖后,整合素β1表达逐渐上升,到恢复7天时与对照眼比较已无明显统计学差异(P > 0.05)。自身对照眼的表达与正常对照眼巩膜表达无差异(P > 0.05)。


 (a)(b) (c)
(a)(b) (c)

 (d)(e) (f)
(d)(e) (f)
Figure 2. The immunohistochemical staining of the posterior sclera in different groups of guinea pigs
图2. 各组豚鼠后极部巩膜免疫组织化学染色图片(×400):(a)为阴性对照;(b)为正常阳性对照;(c)为遮盖2周实验眼;(d)为遮盖4周实验眼;(e)为恢复7天实验眼;(f)为恢复14天实验眼
Table 2. The posterior scleral integrin β1 protein expression in different groups of guinea pigs
表2. 各组豚鼠后极部巩膜整合素β1蛋白表达的变化
注:与正常对照组比较:*P > 0.05,**P < 0.05。
3.4. 巩膜整合素β1 mRNA的表达变化
荧光定量PCR结果显示,各组巩膜组织均有胶原相关整合素β1 mRNA的表达。形觉剥夺1周后,即可观察到整合素β1 mRNA表达下调,与正常对照组及自身对照组比较,差异有统计学意义(t = 39, P < 0.05)。近视诱导4周时,整合素β1 mRNA表达下降更加明显(t = 63, P < 0.01)。在近视诱导4周后的恢复期,整合素β1表达逐渐上升,到恢复7天时与对照眼比较已无明显统计学差异(t = 2, P > 0.05)。自身对照眼的表达与正常对照眼巩膜表达无差异(t = 1, P > 0.05)。各组豚鼠眼后极部巩膜整合素β1 mRNA的表达分别见图3。
4. 讨论
论实验性近视发生时存在巩膜胶原的主动重塑,主要发生在后部巩膜,造成眼球主动扩张,以眼轴伸长和后巩膜变薄为特征。巩膜成纤维细胞的增殖和ECM的重塑导致了巩膜生物力学特性的改变,进而导致眼轴的延长 [7] - [9] 。整合素受体家族是主要的细胞–基质粘附分子,表达于大多数细胞表面,是细胞外基质的主要受体,其主要作用为调控细胞与细胞之间、细胞与细胞外基质之间的相互作用,可将信号导入细胞内,同时将细胞对信号的反应传达出细胞,从而调控细胞的形态、运动、存活和增殖 [10] ,在结缔组织ECM重塑和生物化学改变中起了重要作用 [4] 。本研究采用头套法成功建立近视动物模型,应用免疫组织化学染色法、QRT-PCR法观察和研究实验性近视诱导、进展和恢复期各个阶段巩膜整合素β1的蛋白和mRNA变化,为近视的研究提供新的思路。
豚鼠巩膜结构与人类相似,而且与人类一样,出生时为远视状态,模糊的视觉刺激通过多种机制促进眼球发育,眼轴延长,使物像聚焦于视网膜上,这一过程即“正视化”。本研究发现形觉剥夺性近视的豚鼠在去遮盖后能够快速重新正视化,屈光度恢复的主要时期为7天内,同时伴随眼轴长度缩短,14天时双眼生物学参数差异已无统计学意义。尽管形觉剥夺的时间及其诱导的近视的严重程度会影响恢复的潜力,但是青少年动物仍然普遍具有从形觉剥夺性近视中恢复的能力。
巩膜主要由I型胶原组成,由成纤维细胞分泌,I型胶原的合成、降解和胶原直径的改变是发生巩膜重塑的主要特征 [1] - [3] 。本实验观察到,光镜下豚鼠实验眼后极部巩膜较对照眼变薄,成纤维细胞密度降低,细胞核形态不规则,胶原纤维排列紊乱、粗细不均、间隙变大,形觉剥夺4周时改变最为明显。说明实验性近视眼可能是由于胶原纤维合成的紊乱,新纤维尚未成熟,成纤维细胞密度降低,巩膜变薄,引起巩膜生物力学特性的改变,最终导致眼轴的延长。
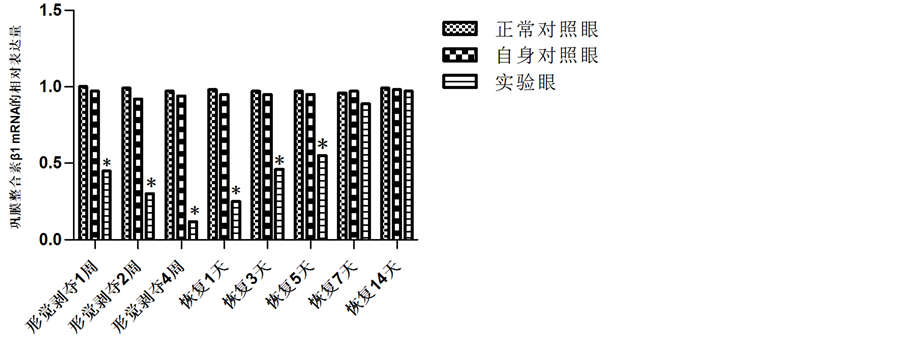
Figure 3. The posterior scleral integrin β1 mRNA expression in different groups of guinea pigs
图3. 各组豚鼠眼后极部巩膜整合素β1 mRNA的表达(与正常对照组及自身对照组比较:*P < 0.05)
由于胶原蛋白是巩膜细胞外基质中的主要成分,并且在近视的形成过程中有着显著变化,因此检测影响胶原合成和降解的关键因子十分必要。很多研究表明,在许多其他系统组织中,整合素在细胞外基质的重塑过程中起着至关重要的作用。近来有研究发现整合素参与了豚鼠离焦性近视眼早期的巩膜重塑过程 [11] ,整合素与巩膜ECM代谢、功能表达密切相关。2006年Metlapally [12] 首次阐明树鼠巩膜中整合素受体亚型表达谱,发现哺乳动物巩膜可表达13种整合素,表明整合素为巩膜组织中的重要组成成分,并发挥着重要作用。McBrien等 [13] 经实验证实,在树鼠巩膜上存在整合素的表达,随后研究人员在动物实验中发现,在近视诱导阶段整合素表达下调,而在近视复原阶段整合素表达回到基线水平,这提示胶原相关整合素可能参与了近视眼的发生。在本研究近视眼动物模型中,随着遮盖时间的延长,及屈光度、眼轴和巩膜形态学的改变,胶原相关整合素β1蛋白及mRNA表达在近视诱导1周时就明显减弱,4周时下降更加明显。在近视恢复1天后,整合素β1表达开始上调,表明整合素β1参与调节眼球生长机制,早于眼轴的改变,但与对照眼相比,仍处于较低水平,至恢复7天时,整合素β1恢复至对照眼水平。此结果表明,整合素β1可能参与近视眼的形成,并提示形觉剥夺后可下调巩膜整合素β1基因的转录水平,进而导致整合素β1蛋白合成的减少,通过级联效应引起巩膜主动重塑,眼轴延长,形成近视。
整合素β1对胶原的作用可能与细胞因子如TGF-β相关 [14] [15] 。有研究报道,TGF-β2可诱导体外培养的人晶状体上皮细胞整合素β1表达增多,并激活整合素β1介导的下游信号转导通路-ERK/MAPK信号通路 [16] 。另外,Pozzi利用基因敲除动物模型表明,α1β1受体可通过Shc生长途径正调控细胞增殖 [17] 。近来胡守龙等 [6] 利用整合素α1β1、α2β1抗体阻断人巩膜成纤维细胞整合素α1β1和α2β1的作用后,人巩膜成纤维细胞增殖减低。因此在本研究近视诱导期观察到整合素β1水平下降,可能降低了成纤维细胞的增殖,从而影响了胶原蛋白的分泌,纤维排列紊乱,巩膜变薄、弹性下降,可扩张性增大,引起眼轴特征性延长,形成近视。
根据以上研究我们认为,在近视眼发病过程中,整合素β1很可能是通过影响巩膜成纤维细胞的胶原合成,从而改变其细胞外基质的组成和胶原纤维的排列,促使巩膜变薄,引起巩膜发生主动重塑,进而使之发生一系列的病理改变。由于实验条件有限,且时间仓促,实验设计还不够完善,整合素对胶原的具体调控机制尚不清楚,因此整合素在近视眼形成过程中确切的相关机制还有待进一步研究。
文章引用
王 园,杨 先,刘 静,王 青,刘桂波, (2015) 胶原相关整合素β1在形觉剥夺性近视诱导及恢复期中调节巩膜重塑作用的研究
The Role of Collagen-Binding Integrin β1 in Scleral Remodelling during Induced Myopia and Recovery. 眼科学,01,1-9. doi: 10.12677/HJO.2015.41001
参考文献 (References)
- 1. Gentle, A., Liu, Y., Martin, J.E., Conti, G.L. and McBrien, N.A. (2003) Collagen gene expression and the altered ac-cumulation of scleral collagen during the development of high myopia. Journal of Biological Chemistry, 278, 16587- 16594.
- 2. McBrien, N.A., Cornell, L.M. and Gentle, A. (2001) Structural and ultrastructural changes to the sclera in a mammalian model of high myopia. Investigative Ophthalmology Visual Science, 42, 2179-2187.
- 3. Siegwart Jr, J.T. and Norton, T.T. (2002) The time course of changes in mRNA levels in tree shrew sclera during induced myopia and recovery. Investigative Ophthalmology Visual Science, 43, 2067-2075.
- 4. Schwartz, M.A. and DeSimone, D.W. (2008) Cell adhesion receptors in mechanotransduction. Current Opinion in Cell Biology, 20, 551-556.
- 5. Friedrichs, J., Manninen, A., Muller, D.J., et al. (2008) Galectin-3 regulates integrin alpha2beta1-mediated adhesion to collagen-I and -IV. Journal of Biological Chemistry, 283, 32264-32272.
- 6. 胡守龙, 崔冬梅, 于刚 (2013) 胶原相关整合素对人巩膜成纤维细胞增殖和胶原合成的影响. 眼科新进展, 6, 501-504.
- 7. Rada, J.A., Achen, V.R., Penugonda, S., Schmidt, R.W. and Mount, B.A. (2000) Proteoglycan composition in the human sclera during growth and aging. Investigative Ophthalmology Visual Science, 41, 1639-1648.
- 8. Cui, W., Bryan, M.R., Sweet, P.M. and McDonnell, P.J. (2004) Changes in gene expression in response to mechanical strain in human scleral fibroblasts. Experimental Eye Research, 78, 275-284.
- 9. Rada, J.A., Johnson, J.M., Achen, V.R. and Rada, K.G. (2002) Inhibition of scleral pro-teoglycan synthesis blocks deprivation-induced axial elongation in chicks. Experimental Eye Research, 74, 205-215.
- 10. Hynes, R.O. (1992) Integrins: Versatility, modulation, and signaling in cell adhesion. Cell, 69, 11-25.
- 11. Tian, X.D., Cheng, Y.X., Liu, G.B., Guo, S.F., Fan, C.L., Zhan, L.H. and Xu, Y.C. (2013) Expressions of type I collagen, α2 integrin and β1 integrin in sclera of guinea pig with defocus myopia and inhibitory effects of bFGF on the formation of myopia. International Journal of Ophthalmology, 6, 54-58.
- 12. Metlapally, R., Jobling, A.I., Gentle, A. and McBrien, N.A. (2006) Characterization of the integrin receptor subunit profile in the mammalian sclera. Molecular Vision, 12, 725-734.
- 13. McBrien, N.A., Metlapally, R., Jobling, A.I. and Gentle, A. (2006) Expression of collagen-binding integrin receptors in the mammalian sclera and their regulation during the development of myopia. Investigative Ophthalmology & Visual Science, 47, 4674-4682.
- 14. Riikonen, T., Koivisto, L., Vihinen, P. and Heino, J. (1995) Transforming growth factor-β regulates collagen gel contraction by increasing α2β1 integrin expression in osteogenic cells. Journal of Biological Chemistry, 270, 376-382.
- 15. Szulgit, G., Rudolph, R., Wandel, A., Tenenhaus, M., Panos, R. and Gardner, H. (2002) Alterations in fibroblast α1β1 integrin collagen receptor expression in keloids and hypertrophic scars. Journal of Investigative Dermatology, 118, 409-415.
- 16. 朱艳, 朱玉广, 张立华, 钟莹莹, 杜孝楠, 张荣, 王杰 (2012) 整合素β1介导的ERK/MAPK通道在人晶状体上皮细胞转分化中的作用. 眼科新进展, 4, 318-321.
- 17. Pozzi, A., Wary, K.K., Giancotti, F.G. and Gardner, H.A. (1998) Integrin α1β1 mediates a unique collagen-dependent proliferation pathway in vivo. Journal of Cell Biology, 142, 587-594.
