Hans Journal of Ophthalmology
Vol.
11
No.
04
(
2022
), Article ID:
58703
,
8
pages
10.12677/HJO.2022.114036
地夸磷索钠治疗白内障术后干眼的 研究进展
袁雪1,2,蔡岩2*
1新疆医科大学研究生院,新疆 乌鲁木齐
2中国人民解放军新疆军区总医院眼科,新疆 乌鲁木齐
收稿日期:2022年11月1日;录用日期:2022年11月21日;发布日期:2022年12月5日

摘要
伴随我国人口老龄化及人民群众对视觉质量的需求不断提高,白内障手术人数也随之增加,尽管该手术方式效果明显,但在临床中仍存在着部分患者在术后出现干眼症状,主要表现为眼干不适、存在异物感等,严重者可出现角膜上皮损伤,导致患者视力受到严重的损害。当下临床中主要采用的治疗方式为:物理治疗干预、对症使用药物以及激光治疗等。虽然治疗方法多样,但仍然有部分患者在临床治疗后症状并没有得到明显的改善,全球学者对此进行了不懈研究,发现P2Y2受体激动剂地夸磷索钠(diquafosol tetrasodium, DQS)可刺激黏蛋白的释放、促进脂质的形成、增加泪液的产生等以稳定泪膜,具有极其重要的临床意义,能够有效地缓解白内障患者术后不适症状。本文总结DQS在治疗白内障术后干眼方面的相关研究,目的在于可以起到良好的临床治疗效果,为白内障术后患者眼表功能的恢复提供一定帮助。
关键词
地夸磷索钠,P2Y2受体激动剂,白内障手术,干眼

Research Progress of Diquafosol Tetrasodium in the Treatment of Dry Eye after Cataract Surgery
Xue Yuan1,2, Yan Cai2*
1Graduate School of Xinjiang Medical University, Urumqi Xinjiang
2Department of Ophthalmology, General Hospital of Xinjiang Military Region of PLA, Urumqi Xinjiang
Received: Nov. 1st, 2022; accepted: Nov. 21st, 2022; published: Dec. 5th, 2022

ABSTRACT
With population aging in our country and the people’s demand for visual quality enhances unceasingly, the number of cataract surgery also will increase, while the operation effect is obvious, there are still some patients in clinical in hand after the dry eye symptoms, the main manifestation of dry eye discomfort, such as foreign body sensation, serious can appear corneal epithelium damage, cause vision in patients with severe damage. At present, the main clinical treatment methods are: physical therapy intervention, symptomatic use of drugs and laser therapy. Although there are various treatment methods, there are still some patients whose symptoms do not improve significantly after clinical treatment. Scholars around the world have carried out unremitting research on this, and found that the P2Y2 receptor agonist diquafosol tetrasodium, DQS can stimulate the release of mucin, promote the formation of lipids and increase the production of tears to stabilize the tear film, which has extremely important clinical significance and can effectively relieve the discomfort symptoms of cataract patients after surgery. This article summarizes the related research of DQS in the treatment of dry eye after cataract surgery, aiming to play a good clinical treatment effect and provide some help for the recovery of ocular surface function of patients after cataract surgery.
Keywords:Diquafosol Tetrasodium, P2Y2 Receptor Agonist, Cataract Surgery, Dry Eye

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着我国人口老龄化日趋严峻,需行白内障手术的患者也急剧增加。目前,白内障超声乳化联合人工晶体植入术在临床中有极高的应用价值,能够有效的治疗白内障患者临床症状,但在术后患者会出现一些并发症,例如干眼等。白内障术后干眼是指白内障手术后出现泪液分泌异常或者泪膜稳定性下降并伴随有组织功能异常,并由此导致眼部各种不适症状和(或)视功能障碍的眼表疾病 [1]。据统计,白内障术后6个月内约32%的患者出现干眼症状,其中10%的患者症状严重 [2],造成其身心不适,也在一定程度上影响了手术效果 [3]。当前国内针对白内障患者的手术方式较多,但白内障术后出现干眼的情况并没有得到改善。DQS是一种P2Y2受体激动剂,其特点在于能够有效的提升黏蛋白的分泌、促进脂质的形成、增加泪液的产生等作用。2003年美国食品及药物管理局公布DQS可用作干眼的治疗,其相关研究逐渐展开,其安全性得到了充分肯定 [4]。
2. 白内障术后干眼的原因及机制
2.1. 手术相关因素
2.1.1. 手术切口的位置和大小
在针对白内障患者行手术治疗时切口位置可分为透明角膜切口、巩膜隧道切口、角巩膜缘隧道切口等。透明角膜切口可直接损伤角膜神经纤维,有效降低角膜的敏感度,从而加快泪液蒸发的速度 [5]。另外,角膜切口也会导致角膜表面规则性显著降低,进而间接导致泪膜稳定性下降 [6]。李盼盼等 [7] 对200例白内障患者进行研究,结果显示透明角膜单切口相较透明角膜双切口对角膜的损害度更低,患者在接受临床治疗后眼部功能更能早期恢复,由此说明白内障手术选择的切口越小、越少,术后出现干眼的可能性就越低。孟克青等 [8] 研究发现在考虑了同等手术切口大小的前提下,角巩膜缘切口的优势在于其对泪膜稳定性的影响并不大,在术后出现干眼的发生率较低。
2.1.2. 显微镜下的暴露时间
术中开睑器的使用导致角膜长时间暴露,且术中为了保持角膜透明给予角膜冲水等操作,都可能造成角膜上皮受损。而白内障患者年龄一般偏大,角膜上皮损伤愈合能力相对较弱,也可能导致术后干眼的发生 [9]。
2.1.3. 术中超声能量作用
超声乳化白内障吸除术(Phacoemulsification, PHACO)中超声探头通过高频振动产生能量并将混浊晶状体完全震碎,尽管能量大部分都被震碎的晶状体吸收,但仍有一部分能量会使泪膜稳定性下降。Han等 [10] 对接受PHACO的患者进行术后干眼和睑板腺功能的评估发现,术后1、3月的眼部主观症状、干眼客观指标及上下睑缘异常显著增加,睑脂分泌在术后3月下降。
2.1.4. 炎症因子的释放
白内障手术可进一步促进炎症细胞聚集,从而释放大量炎症因子,其中以干扰素-γ (IFN-γ)升高最为突出 [11],IFN-γ可以阻断杯状细胞分泌黏蛋白。同时白介素-8 (IL-8)、白介素-6 (IL-6)及肿瘤坏死因子-α (TNF-α)等和干眼发生密切相关,目前p38MAPK信号通路通过IL-6介导炎症诱发干眼的模型已被建立 [12]。
2.1.5. 飞秒激光
目前在临床中白内障患者行手术治疗时经常会联合应用飞秒激光治疗方式,这种方式的优势在于能够有效的保障手术的精准度与安全性,但是这种治疗方式在保证角膜切口的规则性方面优势度不高 [13]。且有研究表明飞秒激光辅助白内障手术对术后患者早期眼表功能的负面影响较PHACO大,在手术之后患者更容易出现干眼症状 [14]。
2.1.6. 围手术期药物
白内障患者围手术期连续长期使用各种抗生素、散瞳药、表面麻醉剂以及某些非甾体抗炎药等均可能造成角膜上皮细胞变性和对结膜杯状细胞功能进一步损害 [15],研究显示在手术过程中通过使用表面麻醉剂类药物在方便手术开展的同时,也很容易导致患者角膜干燥甚至出现上皮脱落,可能会影响术后切口的恢复 [16]。除此以外一部分药物中还加入苯扎氯胺等防腐剂,可能会导致黏蛋白的黏附能力大大降低,从而影响泪膜稳定性;非甾体抗炎滴眼液属于非特异性环氧酶(COX)抑制剂,能够有效的阻断引起炎症反应的COX,但其还阻断了维持眼表正常生理的COX,因此可能会使眼表正常生理功能受到影响。
2.2. 全身因素
白内障患者主要为年龄较高的群体,这部分患者容易出现焦躁不安、抑郁等表现,而这些异常的心理反应往往会使白内障术后干眼发生率提高 [17]。宦会娟等 [18] 研究证实年龄、性别、结缔组织病、糖尿病等均和白内障术后干眼的发生有直接或间接的关联性。ElA等 [19] 报道指出,随着年龄的增长白内障患者术后出现干眼的机率会大大提升。白梦天等 [20] 研究表明糖尿病患者白内障术后干眼的主观症状及客观指标均较年龄相关性白内障患者差。由此可见白内障术后干眼的发生与年龄、糖尿病等众多因素密切相关。
3. DQS化学结构及作用
3.1. DQS化学结构式:见图1
P2Y2受体属于嘌呤受体家族,能够在许多系统中通过引发细胞内质网释放产生Ca2+来促进多种重要组织细胞的生理功能,主要包括参与调节各种免疫反应、血小板聚集、脂质代谢等 [21]。Cowlen等 [22] 研究结果显示眼部存在P2Y2受体,如结膜上皮(包括结膜杯状细胞)、角膜上皮、眼睑和睑板腺等。DQS是第二代尿苷核苷酸类似物P2Y2受体激动剂,它是天然存在的高度水溶性二核苷酸多磷酸盐的成员。其在室温下稳定,这种稳定性归因于二核苷酸结构和不稳定末端磷酸基团的丢失。DQS用腺苷代替尿苷,四磷酸二腺苷提高了DQS的选择性,仅激活P2Y2和P2Y4受体 [23]。
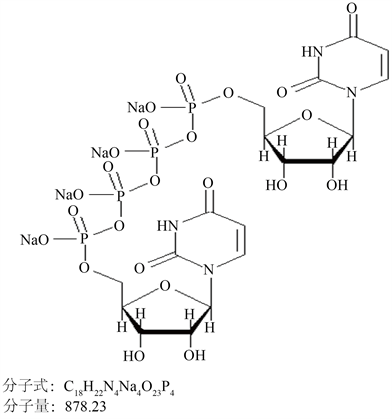
Figure 1. DQS chemical structure formula
图1. DQS化学结构式
3.2. DQS作用
DQS可诱导激活眼表的特异性P2Y2受体,提高细胞内游离Ca2+含量,从而促使细胞膜上与Cl−通道耦联的水通道蛋白进一步开放,促进液体的跨浓度梯度转运,进而诱导泪腺细胞、副泪腺细胞、结膜杯状细胞分泌水和黏蛋白 [24]。DQS增加脂质生成的能力不太成熟,但研究表明P2Y2存在于睑板腺中,并且DQS诱导培养的睑板腺细胞中脂质含量明显增加 [25]。综上所述,DQS的总体作用是通过协调产生水、黏蛋白和脂质来提供快速的、受体介导的眼表再水化,从而恢复泪膜的天然成分。
4. DQS在白内障术后干眼中的应用
4.1. DQS促进黏蛋白的分泌
白内障手术切口和医务人员在手术中的操作情况可能会导致一部分角膜缘干细胞、结膜杯状细胞功能受到影响,从而降低分泌的黏蛋白含量,但DQS可同时提高分泌型和跨膜型黏蛋白的表达,两种蛋白对维持眼表正常生理功能必不可少。Jun等 [26] 研究证明DQS可改善结膜杯状细胞密度,进而增加黏蛋白分泌。Hori等 [27] 研究对比了DQS与另一种促分泌剂对家兔结膜杯状细胞中分泌型黏蛋白MUC5AC浓度影响的实验中,仅有DQS组MUC5AC浓度增加。DQS可进一步促进跨膜型黏蛋白的表达,在体外培养人离体角膜上皮细胞中分别加入浓度不同的DQS溶液,在三个小时后针对mRNA表达情况进行检测,从而评估MUC1、MUC4和MUC16基因在体外表达情况,结果显示和对照组相比,通过DQS处理后角膜上皮细胞内上述三种基因的体外表达浓度都有不同程度的提升 [28]。Kaido等 [29] 对白内障术后干眼患者应用DQS治疗,1个月后发现泪膜破裂时间(tear film break up time, BUT)延长、患者的视敏度和高阶相差等视觉质量指标均改善。
4.2. DQS促进脂质的形成、增加泪液的产生稳定泪膜
白内障手术切口可明显破坏部分角膜神经纤维,因被破坏的部分神经纤维无法及时有效的运输乙酰胆碱,而造成术后角膜感觉下降、瞬目次数急剧减少,泪液蒸发显著增加,同时由于白内障切口愈合速度延缓和角膜上皮细胞代谢活性下降,使泪膜受到严重影响 [30]。尽管目前白内障手术技术逐渐成熟,但手术切口仍不可避免地会影响角膜曲率及光滑度,从而使泪膜各层之间张力平衡性受到影响,造成泪膜稳定性降低 [31]。EI A等 [19] 研究显示白内障术后会导致睑板腺功能下降,术后1个月泪膜脂质层厚度(Thickness of lipid layer of tear film, LLT)较基线明显变薄。Ikeda等 [32] 研究表明在睑板腺功能障碍(meibomianglanddysfunction, MGD)大鼠模型中,应用DQS后能提高睑板腺中脂滴的量,进而起到稳定泪膜的作用。Guo等 [33] 研究表明通过使用DQS后能够有效的降低睑板腺缺失,有效缓解睑板腺开口受阻、睑缘毛细血管扩张等情况,在临床中白内障术后干眼患者应用DQS之后能够有效快速使LLT提高。Yokoi等 [34] 对DQS在正常人水液分泌中的作用进行了研究,受试者双眼分别滴DQS以及人工泪液,DQS使用15 min后,眼球湿润感明显,眼球表面的水液明显增加。
4.3. DQS抑制炎症反应
白内障手术切口的制备、手术器械反复进出切口等操作均可造成中性粒细胞和巨噬细胞等炎性细胞的聚集,释放一系列的炎症因子,从而抑制结膜杯状细胞分泌黏蛋白。当黏蛋白分泌减少时,泪膜则无法均匀分布于角膜上皮表面,造成BUT下降,而在手术后眼表微环境的改变以及炎症因子的存在又会导致眼表功能受到影响,因此产生恶性循环 [35]。Kim等 [36] 研究表明,DQS能通过抑制炎症因子转录与蛋白表达过程,从而有效抑制其在白内障术后干眼中的作用。
4.4. DQS促进角膜上皮修复
手术操作时间长、显微镜灯光照射、开睑器的使用及术中给予角膜冲水等均会使角膜上皮受损。此外,白内障患者围手术期用药过度也可导致角结膜上皮细胞和结膜杯状细胞损伤,甚至角结膜上皮细胞出现点状脱落 [37]。目前认为P2Y2受体可能通过四磷酸二腺苷结构促进角膜上皮损伤修复。DQS的主要功能是通过激发P2Y2受体而引起细胞内的Ca2+转移酶和调节表皮细胞生长的受体活化以及通过激发细胞外信号调节酪氨酸激酶的磷酸化而促使损伤角膜上皮的修复 [38]。在白内障手术4周之前使用DQS可以提高手术中角膜湿润度 [39],在围手术期避免干眼造成的眼表改变。
白内障术后由于围手术期相关因素可能会产生混合型干眼,在一项随机对照临床试验中,纳入86例白内障术后干眼的患者,分别采用DQS和玻璃酸钠对照干预,DQS治疗组BUT、角膜荧光素染色评分(corneal fluorescein staining score, CFSS)在整个试验观察期均优于玻璃酸钠组 [40]。此外,Koh等 [41] 发现:相较于玻璃酸钠,滴用DQS后短期视觉效果更佳。
5. 总结
白内障术后干眼是由多种因素共同导致的,在手术过程中有很多因素都是不可避免的。因此,对白内障术后干眼采取有效的治疗手段是至关重要的。区别于传统人工泪液,DQS是目前中国唯一具有促进黏蛋白分泌作用的局部促泌药物,其针对白内障术后干眼的发生机制进行治疗,同时促进水液、脂质的分泌能够提升泪膜稳定性。此外,还能够有效地促进角膜上皮的修复、抑制炎症因子在干眼发病机制中的表达等作用。由此可见,DQS在干眼治疗方面前景广阔,我们期待其广泛应用于白内障术后干眼患者的治疗。
基金项目
新疆军区总医院北京路医疗区重点培育科研项目,项目编号:2021jzbj1033。
文章引用
袁 雪,蔡 岩. 地夸磷索钠治疗白内障术后干眼的研究进展
Research Progress of Diquafosol Tetrasodium in the Treatment of Dry Eye after Cataract Surgery[J]. 眼科学, 2022, 11(04): 259-266. https://doi.org/10.12677/HJO.2022.114036
参考文献
- 1. 亚洲干眼协会中国分会, 海峡两岸医药卫生交流协会眼科学专业委员会眼表与泪液病学组, 中国医师协会眼科医师分会眼表与干眼学组. 中国干眼专家共识: 定义和分类(2020年) [J]. 中华眼科杂志, 2020, 56(6): 418-422.
- 2. Iglesias, E., Sajnani, R., Levitt, R.C., Sarantopoulos, C.D. and Galor, A. (2018) Epidemiology of Persistent Dry Eye-Like Symptoms after Cataract Surgery. Cornea, 37, 893-898.
https://doi.org/10.1097/ICO.0000000000001491 - 3. 王晓艳. 白内障术后干眼发病原因及诊治研究[J]. 医学信息, 2020, 33(22): 68-70.
- 4. Tauber, J., Davitt, W.F., Bokosky, J.E., et al. (2004) Double-Masked, Plaebo-Controlled Safety and Efficacy Trial of Diquafosol Tetrasodium (INS365) Ophthalmic Solution for the Treatment of Dry Eye. Cornea, 23, 784-792.
https://doi.org/10.1097/01.ico.0000133993.14768.a9 - 5. Stepp, M.A., Pal-Ghosh, S., Tadvalkar, G., et al. (2018) Reduced Intraepithelial Corneal Nerve Density and Sensitivity Accompany Desiccating Stress and Aging in C57BL/6 Mice. Experimental Eye Research, 169, 91-98.
https://doi.org/10.1016/j.exer.2018.01.024 - 6. 刘鑫, 胡萍, 庄东梅, 朱超, 苏冠方, 张辉. 白内障术后干眼发生的相关因素及治疗研究进展[J]. 中华眼视光学与视觉科学杂志, 2018, 20(10): 635-640.
- 7. 李盼盼, 管宇, 陈诵惟, 等. 2.4mm透明角膜单切口超声乳化白内障吸出术对角膜的影响[J]. 眼科新进展, 2019, 39(1): 53-57.
- 8. 孟克青, 许衍辉, 董玮. 不同切口方式白内障超声乳化联合人工晶体植入术后干眼症的临床研究[J]. 中国现代医学杂志, 2017, 27(3): 108-111.
- 9. 张洁, 赵勇, 王雁. 白内障术后发生干眼的影响因素[J]. 国际眼科杂志, 2020, 20(7): 1171-1174.
- 10. Han, K.E.,Yoon, S.C., Ahn, J.M., et al. (2014) Evaluation of Dry Eye and Meibomian Gland Dysfunction after Cataract Surgery. American Journal of Ophthalmology, 157, 1144-1150.
https://doi.org/10.1016/j.ajo.2014.02.036 - 11. Park, Y., Hwang, H.B. and Kim, H.S. (2016) Observation of Influence of Cataract Surgery on the Ocular Surface. PLOS ONE, 11, e0152460.
https://doi.org/10.1371/journal.pone.0152460 - 12. Ma, X., Zou, J., He, L. and Zhang, Y. (2014) Dry Eye Management in a Sjögren’s Syndrome Mouse Model by Inhibition of p38-MAPK Pathway. Diagnostic Pathology, 9, Article No. 5.
https://doi.org/10.1186/1746-1596-9-5 - 13. Pereira, A., Somani, S., Tam, E.S., Chiu, H. and Maini, R. (2019) Comparison of Surgically Induced Astigmatism and Corneal Morphological Features between Femtosecond Laser and Manual Clear Corneal Incisions. Journal of Refractive Surgery, 35, 796-802.
https://doi.org/10.3928/1081597X-20191024-02 - 14. Shao, D., Zhu, X., Sun, W., et al. (2018) Effects of Femtosecond Laser-Assisted Cataract Surgery on Dry Eye. Experimental and Therapeutic Medicine, 16, 5073-5078.
https://doi.org/10.3892/etm.2018.6862 - 15. 高巍, 董宇晨, 张凤, 赵梅生. 白内障超声乳化术后干眼症药物治疗的临床疗效[J]. 中国老年学杂志, 2015, 35(6): 1528-1530.
- 16. 张琳琳. 超声乳化白内障摘出并人工晶状体植入术后发生角膜水肿的影响因素回顾性分析[J]. 当代医学, 2018, 24(1): 123-125.
- 17. 杨嘉瑞, 江晓丹, 吕会斌, 李学民. 干眼与焦虑的诊断方法及二者相关性的研究现状[J]. 中华眼科医学杂志, 2016, 6(4): 182-186.
- 18. 宦会娟. 小牛血去蛋白提取物眼用凝胶联合玻璃酸钠滴眼液治疗白内障术后干眼的效果观察[J]. 河南医学研究, 2017, 26(17): 3121-3122.
- 19. El, A., Majzoub, S., Vandermeer, G. and Pisella, P.-J. (2018) Influence of Cataract Surgery on Meibomian Gland Dysfunction. Journal Français d’Ophtalmologie, 41, e173-e180.
https://doi.org/10.1016/j.jfo.2018.03.001 - 20. 白梦天, 康刚劲. 糖尿病性白内障超声乳化手术后泪膜变化研究[J]. 重庆医学, 2018, 47(7): 926-928, 932.
- 21. Abbracchio, M.P., Burnstock, G., Boeynaems, J.M., et al. (2006) International Union of Pharmacology LVIII: Update on the P2Y G Protein-Coupled Nucleotide Receptors: From Molecular Mechanisms and Pathophysiology to Therapy. Pharmacological Reviews, 58, 28l-341.
https://doi.org/10.1124/pr.58.3.3 - 22. Cowlen, M.S., Zhang, V.Z., Warnock, L., et al. (2003) Localization of Ocular P2Y2 Receptor Gene Expression by in Situ Hybridization. Experimental Eye Research, 77, 77-84.
https://doi.org/10.1016/S0014-4835(03)00068-X - 23. Pendergast, W., Yerxa, B.R., Douglass, J.G., et al. (2001) Synthesis and P2Y Receptor Activity of a Series of Uridine Dinucleoside 5’-Polyphosphates. Bioorganic & Medicinal Chemistry Letters, 11, 157-160.
https://doi.org/10.1016/S0960-894X(00)00612-0 - 24. Li, Y., Kuang, K., Yerxa, B., et al. (2001) Rabbit Conjunctival Epithelium Transports Fluid, and P2Y22 Receptor Agonists Stimulate Cl−and Fluid Secretion. American Journal of Physiology-Cell Physiology, 281, C595-C602.
https://doi.org/10.1152/ajpcell.2001.281.2.C595 - 25. Wen, Q., Kuang, K., Yerxa, B. and Fischbarg, J. (2002) Effects of P2Y2 Agonists on Lipid Secretion by Cultured Rabbit Meibocytes. Investigative Ophthalmology & Visual Science, 43, 3146.
- 26. Jun, I., Choi, S., Lee, G.Y., et al. (2019) Effects of Preservative-Free 3% Diquafosol in Patients with Pre-Existing Dry Eye Disease after Cataract Surgery: A Randomized Clinical Trial. Scientific Reports, 9, Article No. 12659.
https://doi.org/10.1038/s41598-019-49159-0 - 27. Hori, Y., Kageyama, T., et al. (2017) Comparison of Short-Term Effects of Diquafosol and Rebamipide on Mucin 5AC Level on the Rabbit Ocular Surface. Journal of Ocular Pharmacology and Therapeutics, 33, 493-497.
https://doi.org/10.1089/jop.2016.0092 - 28. 王怡丽. 地夸磷索钠滴眼液的作用机制及临床应用[J]. 中华实验眼科杂志, 2020, 38(12): 1087-1090.
- 29. Kaido, M., Uchino, M., Kojima, T., Dogru, M. and Tsubota, K. (2013) Effects of Diquafosol Tetrasodium Administration on Visual Function in Short Break-Up Time Dry Eye. Journal of Ocular Pharmacology and Therapeutics, 29, 595-603.
https://doi.Org/10.1089/Jop.2012.0246 - 30. Cruzat, A., Qazi, Y. and Hamrah, P. (2017) In Vivo Confocal Microscopy of Corneal Nerves in Health and Disease. The Ocular Surface, 15, 15-47.
https://doi.org/10.1016/j.jtos.2016.09.004 - 31. Wu, X., Ma, Y., Chen, X., et al. (2021) Efficacy of Bandage Contact Lens for the Management of Dry Eye Disease after Cataract Surgery. International Ophthalmology, 41, 1403-1413.
https://doi.org/10.1007/s10792-021-01692-6 - 32. Ikeda, K., Simsek, C., Kojima, T., et al. (2018) The Effects of 3% Diquafosol Sodium Eye Drop Application on Meibomian Gland and Ocular Surface Alterations in the Cu, Zn-Superoxide Dismutase-1 (Sod1) Knockout Mice. Graefe’s Archive for Clinical and Experimental Ophthalmology, 256, 739-750.
https://doi.org/10.1016/j.jfo.2018.03.001 - 33. Guo, Y., Ha, J.Y., Piao, H.L., Sung, M.S. and Park, S.W. (2020) The Protective Effect of 3% Diquafosol on Meibomian Gland Morphology in glaucoma Patients Treated with Prostaglandin Analogs: A 12-Month Follow-Up Study. BMC Ophthalmology, 20, Article No. 277.
https://doi.org/10.1186/s12886-020-01550-6 - 34. Yokoi, N., Kato, H. and Kinoshita, S. (2014) Facilitation of Tear Fluid Secretion by 3% Diquafosol Ophthalmic Solution in Normal Human Eyes. American Journal of Ophthalmology, 157, 85-92.
https://doi.org/10.1016/j.ajo.2013.09.009 - 35. Perez, V.L., Stern, M.E. and Pflugfelder, S.C. (2020) Inflammatory Basis for Dry Eye Disease Flares. Experimental Eye Research, 201, Article ID: 108294.
https://doi.org/10.1016/j.exer.2020.108294 - 36. Kim, Y.H., Yang, I.J., Nguyen, L., et al. (2020) Effect of Diquafosol on Hyperosmotic Stress-Induced Tumor Necrosis Factor-α and Interleukin-6 Expression in Human Corneal Epithelial Cells. Korean Journal of Ophthalmology, 34, 1-10.
https://doi.org/10.3341/kjo.2019.0046 - 37. Hanyuda, A., Negishi, K., Tsubota, K., Tsubota, K. and Ayaki, M. (2020) Persistently Worsened Tear Break-Up Time and Keratitis in Unilateral Pseudophakic Eyes after a Long Postoperative Period. Biomedicines, 8, Article No. 77.
https://doi.org/10.3390/biomedicines8040077 - 38. Byun, Y.S., Yoo, Y.S., Kwon, J.Y., et al. (2016) Diquafosol Promotes Corneal Epithelial Healing via Intracellular Calcium-Mediated ERK Activation. Experimental Eye Research, 143, 89-97.
https://doi.org/10.1016/j.exer.2015.10.013 - 39. Miyake, G., Ota, I., Miyake, K., Zako, M. and Iwaki, M. (2014) Effects of Topical Diquafosol Pretreatment on Intraoperative Corneal Wetting. Journal of Cataract & Refractive Surgery, 40, 1682-1688.
https://doi.org/10.1016/j.jcrs.2014.02.035 - 40. Park, D.H., Chung, J.K., Seo, D.R. and Lee, S.J. (2016) Clinical Effects and Safety of 3% Diquafosol Ophthalmic Solution for Patients with Dry Eye after Cataract Surgery: A Randomized Controlled Trial. American Journal of Ophthalmology, 163, 122-131.
https://doi.org/10.1016/j.ajo.2015.12.002 - 41. Koh, S., Maeda, N., Ikeda, C., et al. (2013) Effect of Instillation of Eyedrops for Dry Eye on Optical Quality. Investigative Ophthalmology & Visual Science, 54, 4927-4933.
https://doi.org/10.1167/iovs.13-12409
NOTES
*通讯作者。