Botanical Research
Vol.05 No.03(2016), Article ID:17715,7
pages
10.12677/BR.2016.53010
The Dynamic Changes and Origin Analysis of Reactive Oxygen Species during Isolation and Culture of Citrus reticulata Blanco Protoplasts
Xiaoyong Xu, Yihui Zhang, Yuping Ling
School of Horticulture and Plant Protection, Yangzhou University, Yangzhou Jiangsu

Received: May. 3rd, 2016; accepted: May. 20th, 2016; published: May. 30th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In order to uncover the mechanisms underlying different regeneration capacity of protoplasts, we analyzed the dynamic changes and origin of reactive oxygen species (ROS) during isolation and culture of Citrus reticulata Blanco protoplasts. The dynamic changes of ROS were analyzed by fluorescent markers, and ROS origin was investigated by ROS indicators. The results showed that ROS signals were visible in the cytoplasm and cell membrane of protoplasts; compared with mesophyll protoplasts, callus protoplasts contained significantly lower level of ROS during isolation, but significantly higher level of ROS during culture; a significant decrease in the level of ROS during isolation and culture of callus protoplasts was observed after DPI or NaN3 treatment. Our findings indicate ROS plays a crucial mediating role in protoplast regeneration of Citrus reticulata.
Keywords:Protoplast, Reactive Oxygen Species, DPI, NaN3

椪柑原生质体分离与培养过程中活性氧动态变化及来源分析
徐小勇,张一卉,凌裕平
扬州大学园艺与植物保护学院,江苏 扬州

收稿日期:2016年5月3日;录用日期:2016年5月20日;发布日期:2016年5月30日

摘 要
分析原生质体分离与培养过程中活性氧(ROS)的动态变化与来源,对揭示原生质体再生能力差异的机制具有重要意义。本研究采用荧光标记法分析了ROS在椪柑原生质体分离与培养中的动态变化,同时通过ROS抑制剂处理探究了其ROS的来源。结果表明,ROS分布在原生质体的细胞质和细胞膜上;分离阶段愈伤组织原生质体的ROS水平显著低于叶肉原生质体,但在培养阶段显著高于叶肉原生质体;DPI与NaN3处理均显著降低了原生质体分离与培养过程中的ROS水平。因此,ROS在椪柑原生质体再生中具有重要调控作用。
关键词 :原生质体,活性氧,DPI,NaN3

1. 引言
原生质体是采用机械法或酶解法去掉细胞壁的裸露细胞。目前已知植物原生质体及其衍生系统便于进行各种细胞及遗传操作,已成功用于体细胞杂交、遗传转化、基因瞬时表达、蛋白质互作等方面 [1] - [3] 。但是由于不同植物之间、不同基因型之间、不同外植体之间原生质体再生能力存在很大差异,不少植物(一些禾谷类作物、部分豆科作物、银杏等)、某些基因型(葡萄与梨主要栽培种等)、常用外植体(大多数禾谷类作物叶片、柑橘叶片等)的原生质体目前尚不能再生或再生难。因此,植物原生质体的再生能力问题已成为限制了这项技术广泛应用的关键瓶颈。
柑橘原生质体主要由愈伤组织和叶片分离而来,但只有愈伤组织来源的原生质体能持续分裂并再生植株,叶肉原生质体目前不能分裂再生,还不可单独用于柑橘遗传改良 [4] [5] 。迄今,这两种类型原生质体再生能力差异的机制尚不清楚。已有研究表明,ROS引起的氧化胁迫可能是造成不可再生型原生质体再生难的原因,然而另一方面ROS作为信号分子,对原生质体再生具有重要的调控作用,抑制其产生会导致原生质体不可分裂再生 [6] - [9] 。本文采用荧光标记法分析了ROS在椪柑原生质体分离与培养中的动态变化,同时通过ROS抑制剂处理探究了其ROS的来源,以期了解ROS在柑橘原生质体中的作用,为调控原生质体再生奠定理论基础。
2. 材料与方法
2.1. 植物材料
椪柑(Citrus reticulata Blanco)胚性愈伤组织在液体培养基(MT + 0.5 mg/l ME + 1.5 mg/l谷胺酰氨 + 50 g/l蔗糖)悬浮培养4代后用于原生质体分离;从椪柑果实中挑出饱满种子接种于MT培养基上,取充分展开的叶片用于原生质体分离。
2.2. 椪柑原生质体分离与培养
原生质体的分离与纯化参照Xu等 [9] 的方法,稍作修改。
愈伤组织原生质体的分离:取适量愈伤组织于培养皿中,分别加入2 mL的0.7 mol/L EME培养基(MT + 0.7 mol/L蔗糖 + 0.5 g /L ME)和酶液(2%纤维素酶R-10 + 2%离析酶R-10 + 12.8%甘露醇 + 0.011% NaH2PO4 + 0.12% MES + 0.36% CaC12∙2H2O)。封口膜封口,28℃暗条件下酶解18~20 h。
叶肉原生质体的分离:用手术刀片将试管苗叶片切成1~2 mm宽的条状,之后放入预先加入2 mL 0.6 mol/L EME (MT + 0.6 mol/L蔗糖 + 0.5 g/L ME)培养基中,最后加入2 mL酶液(2%纤维素酶R-10 + 2%离析酶R-10 + 10.9%甘露醇 + 0.011% NaH2PO4 + 0.12% MES + 0.36% CaC12∙2H2O)。封口膜封口,28℃暗条件下酶解20~24 h。
酶解完成后的原生质体(酶解混合物)通过孔径为45 μm的不锈钢筛网过滤,并用CPW13洗涤、离心。然后采用CPW13/CPW26界面梯度离心,用吸管将两液面间的原生质体带吸出。最后将原生质体悬浮于液体培养基MA (MT + 0.15 M蔗糖 + 0.45 M甘露醇 + 40 mg/L腺嘌呤)中,封口转入28℃恒温培养箱培养。
2.3. 原生质体分离与培养中ROS的动态分析体分离与培养
使用荧光探针2,7-二氯二氢荧光素乙酰乙酸(H2DCF DA)分析细胞中ROS分布与水平。先取1 mL原生质体悬浮液,加入5 μL的0.2 mM H2DCF DA溶液,混匀避光孵育15~20 min。然后用缓冲液洗去原生质体表层的多余探针,重复两次。取一滴原生质体溶液于干净载玻片上,加盖玻片后,迅速用激光共聚焦显微镜(激发波长K = 460~490 nm,发射波长K = 510~520 nm)观察,拍照。实验重复3次,选择其中有代表性样本进行分析。荧光亮度采用Image J软件进行分析,数据采用SPSS软件进行差异显著性分析。
2.4. ROS抑制剂处理观察原生质体的活性氧变化
取1.5 ml原生质体悬浮液,加入1 μL的25 mM NADPH氧化酶特异性抑制剂二苯基氯化碘盐(Diphenylene iodonium, DPI)或1 μL的5 M过氧化物酶抑制剂叠氮化钠(NaN3),混匀培养10 min或30 min后,1000 rpm离心10 min,弃上清,留原生质体沉淀,再用MA培养液离心洗涤1次。对处理后的原生质体悬浮液,加入5 μL H2DCF DA溶液,混匀避光孵育15~20 min。同上步骤进行活性氧的观察与分析。
3. 结果与分析
在不少植物原生质体分离与培养过程,研究人员发现ROS积累现象 [9] - [12] 。因此,本研究以椪柑原生质体分离与培养过程中的五个重要时间点进行了ROS相关分析,包括酶解2小时、酶解4小时、酶解6小时、培养4天和培养8天。
3.1. 原生质体分离与培养中ROS的亚细胞定位与时空变化研究
在植物细胞中,叶绿体、线粒体和过氧化物体是产生ROS的主要部位,其他一些具有高度氧化活性或强烈电子传递作用的细胞器或部位也都可以产生ROS。在椪柑愈伤组织原生质体分离过程中(图1(a)~(c)),原生质体的细胞质和细胞膜上检测到较弱的ROS荧光信号;而培养的4~8天内,ROS荧光信号在细胞膜和细胞器中较强(图1(d),图1(e))。叶肉原生质体在分离与培养过程中,ROS荧光信号未有明显变化,且多数出现在细胞质和细胞膜上,叶绿体上较少(如图2)。
利用ROS荧光探针,使用共聚焦显微镜检测,既可以定位ROS,通过细胞内的荧光强度分析也能反映细胞的总体ROS水平。本研究采用Image J软件分析了原生质体ROS荧光强度。结果表明,在愈伤组织原生质体分离过程中,原生质体内ROS水平降低,在培养过程中呈先上升后下降,培养阶段的原生质体与分离阶段的原生质体其ROS水平之间存在显著差异;叶肉原生质体在分离阶段ROS水平显著高于
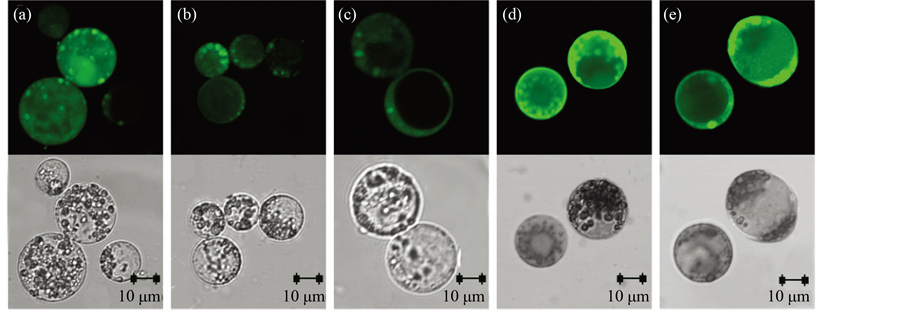
Figure 1. The detection of ROS signal during isolation and culture of callus protoplasts from Citrus reticulata Blanco (a: enzymolysis time of 2 hours; b: enzymolysis time of 4 hours; c: enzymolysis time of 6 hours; d: 4 days after protoplast culture; e: 8 days after protoplast culture)
图1. 椪柑愈伤组织原生质体分离与培养过程中的ROS的检测(a:酶解2小时;b:酶解4小时;c:酶解6小时;d:培养4天;e:培养8天)
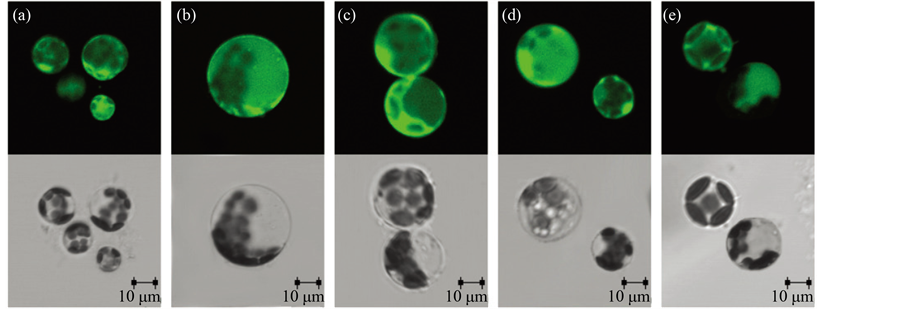
Figure 2. The detection of ROS signal during isolation and culture of mesophyll protoplasts from Citrus reticulata Blanco (a: enzymolysis time of 2 hours; b: enzymolysis time of 4 hours; c: enzymolysis time of 6 hours; d: 4 days after protoplast culture; e: 8 days after protoplast culture)
图2. 椪柑叶肉原生质体分离与培养过程中的ROS的检测(a:酶解2小时;b:酶解4小时;c:酶解6小时;d:培养4天;e:培养8天)
愈伤组织原生质体,而在培养阶段ROS水平显著低于愈伤组织原生质体。其中,愈伤组织原生质体的ROS荧光亮度值在酶解6小时最低,为20.47%,在培养4天时最高,达69.99%;而叶肉原生质体的ROS荧光亮度值在培养8天时最低,为29.62%,在酶解2小时最高,达50.7% (图3)。
3.2. DPI与NaN3处理后原生质体分离与培养中ROS动态变化研究
为了探明愈伤组织原生质体中ROS的来源,本研究使用了不同ROS抑制剂处理观察了ROS动态变化(图4,图5)。结果表明,在所检测的四个时间点(酶解2小时、培养4天、培养8天和培养12天) DPI处理与NaN3处理都显著降低了ROS水平。其中,DPI处理与对照相比,分别降低了8.1%、8.6%、7.7%、7.5%;NaN3处理则分别降低了8.6%、18.2%、13.9%、10.9%。值得注意的是,除了酶解2小时的检测点,其他检测点DPI处理后的ROS水平显著低于NaN3处理。据此推测,在愈伤原生质体分离与培养过程中其ROS产生源有NADPH氧化酶和过氧化物酶。此外,定位分析表明,与对照相比DPI处理的原生质体中细胞质ROS荧光信号减弱明显,NaN3处理的原生质体中细胞质和细胞膜ROS荧光信号减弱明显。

Figure 3. The detection of ROS level during isolation and culture of two kinds of protoplasts from Citrus reticulata Blanco
图3. 椪柑两种原生质体分离与培养过程中的ROS水平变化
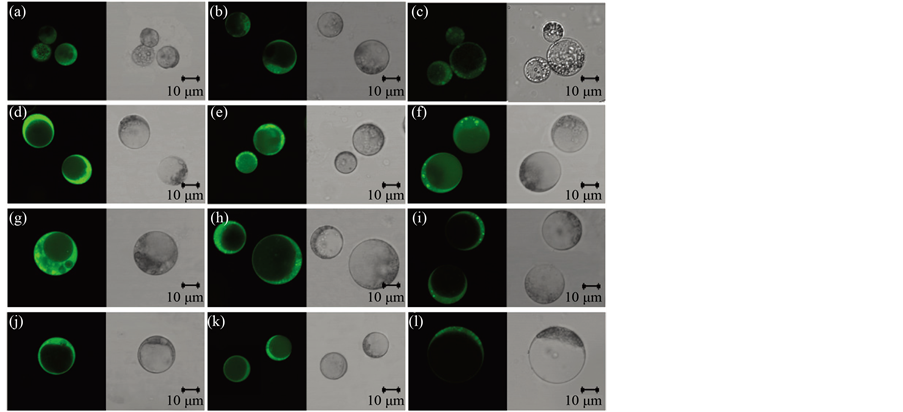
Figure 4. The detection of ROS signal of protoplasts after DPI or NaN3 treatment (a, d, g, j: comparison for enzymolysis time of 2 hours, 4 days, 8 days,12 days after protoplast culture; b, e, h, k: DPI addition; c, f, i, l: NaN3 addition)
图4. DPI与NaN3处理后原生质体中ROS的检测(a,d,g,j:分别为酶解2小时,培养4天,培养8天,培养12天的对照;b,e,h,k:分别为对应于对照的DPI处理;c,f,i,l:分别为对应于对照的NaN3处理)
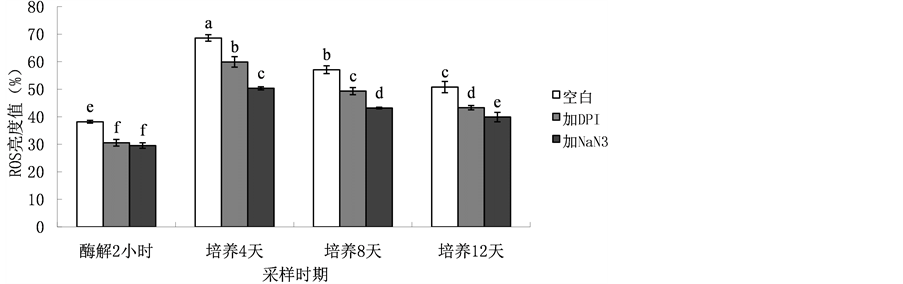
Figure 5. The detection of ROS level of protoplasts after DPI or NaN3 treatment
图5. DPI与NaN3处理后原生质体中ROS水平的变化
4. 讨论
活性氧在原生质体再生中具有双重作用,一方面植物原生质体分离与培养过程中产生活性氧,活性氧的大量累积会导致ROS清除酶系统失衡,由此产生过氧化胁迫致使原生质体活力下降和大量解体死亡 [7] [13] [14] ;另一方面适宜的ROS水平是细胞壁重建和细胞分裂的基础 [10] [15] 。例如,Papadakis和Roubelakid-Angelakis [16] 比较了烟草原生质体和葡萄原生质体的活性氧含量变化,发现分裂能力强的烟草原生质体的H2O2含量比分裂能力弱的葡萄原生质体高,认为适量的H2O2有助细胞分裂。Petřivalský等 [17] 发现当黄瓜原生质体培养基中加入外源性H2O2,会导致原生质体内源性ROS水平急剧下降、细胞活力显著降低及细胞分裂抑制,间接地证实了ROS在原生质体再生中的关键作用。本研究中,椪柑可分裂的愈伤组织原生质体在培养4~8天内,其ROS水平是不可分裂的叶肉原生质体的2倍,而这个时期正是愈伤组织原生质体细胞壁再生与分裂启动的重要节点 [18] 。另外,原生质体的细胞膜和细胞质中有明显的ROS荧光信号(图1)。因此,我们推测ROS参与原生质体的细胞壁重建和细胞分裂,在椪柑原生质体再生中具有重要调控作用。
在正常生长条件下,植物细胞内ROS处于一个较低的水平,但胁迫会导致ROS水平的升高。非生物胁迫所诱导的ROS主要来自于叶绿体、线粒体和过氧化物酶体;生物胁迫所诱导的ROS主要来自于细胞膜NADPH氧化酶和细胞壁过氧化物酶 [18] 。而原生质体分离与培养过程是一种特殊的逆境过程,因为原生质体的酶解过程在某种程度上类似于病原物释放的胞外酶对侵染细胞的壁降解,另外培养中的裸露原生质体易遭受到类似于一些非生物胁迫表现出的渗透压逆境。目前已初步清楚,在原生质体分离和培养过程中,ROS产生源有NADPH氧化酶和/或过氧化物酶 [12] [15] 。在本研究中,两种抑制剂处理均降低了原生质体分离与培养过程中的ROS水平,表明椪柑愈伤组织原生质体其活性氧产生源有NADPH氧化酶和过氧化物酶。但是这两种ROS产生源是否参与了原生质体的再生调控还有待进一步研究。
5. 结论
ROS主要分布在椪柑原生质体的细胞质和细胞膜上;在原生质体分离阶段,愈伤组织原生质体的ROS水平显著低于叶肉原生质体,但在培养阶段显著高于叶肉原生质体;DPI与NaN3处理均显著降低了原生质体分离与培养过程中的ROS水平。
基金项目
国家自然科学基金(31372025);江苏省自然科学基金(BK20131228);扬州大学研究生科研创新计划(CXLX_1425)。
文章引用
徐小勇,张一卉,凌裕平. 椪柑原生质体分离与培养过程中活性氧动态变化及来源分析
The Dynamic Changes and Origin Analysis of Reactive Oxygen Species during Isolation and Culture of Citrus reticulata Blanco Protoplasts[J]. 植物学研究, 2016, 05(03): 67-73. http://dx.doi.org/10.12677/BR.2016.53010
参考文献 (References)
- 1. Eeckhaut, T., Lakshmanan, P.S., Deryckere, D., Bockstaele, E. and Huylenbroeck, J. (2013) Progress in Plant Protoplast Research. Planta, 238, 991-1003. http://dx.doi.org/10.1007/s00425-013-1936-7
- 2. Yu, C.C., Wang, L.L., Chen, C., He, C.L., Hu, J., Zhu, Y.G. and Huang, W.C. (2014) Protoplast: A More Efficient System to Study Nucleo-Cytoplasmic Interactions. Biochemical and Biophysical Research Communications, 450, 1575-1580. http://dx.doi.org/10.1016/j.bbrc.2014.07.043
- 3. Duarte, P., Ribeiro, D., Carqueijeiro, I., Bettencourt, S. and Sotto-mayor, M. (2016) Protoplast Transformation as a Plant-Transferable Transient Expression System. Methods in Molecular Biology, 1405, 137-148. http://dx.doi.org/10.1007/978-1-4939-3393-8_13
- 4. Tusa, N., Ferrauto, G. and Calderaro, E. (1992) Investiga-tions on Protoplast Regeneration from Leaves of Monoembryonic and Polyembryonic Citrus Species. Procedings of International Citrus Congress, Acireale, 8-13 March 1992, 180-182.
- 5. 徐小勇, 刘继红. 紫外线灭活的原生质体作为饲养层培养柑橘原生质体的研究[J]. 江苏农业科学, 2009(6): 74-75.
- 6. Pasternak, T.P., Ötvös, K., Domoki, M. and Fehér, A. (2007) Linked Activation of Cell Division and Oxidative Stress Defense in Alfalfa Leaf Protop-last-Derived Cells Is Dependent on Exogenous Auxin. Plant Growth Regulation, 51, 109-117. http://dx.doi.org/10.1007/s10725-006-9152-0
- 7. Papadakis, A.K. and Roubelakis-Angelakis, K.A. (2002) Oxidative Stress Could Be Responsible for the Recalcitrance of Plant Protoplasts. Plant Physiology and Biochemistry, 40, 549-559. http://dx.doi.org/10.1007/s10725-006-9152-0
- 8. de Marco, A. and Roubelakis-Angelakis, K.A. (1996) Hydrogen Peroxide Plays a Bivalent Role in the Regeneration of Protoplasts. Journal of Plant Physiology, 149, 109-114. http://dx.doi.org/10.1016/S0176-1617(96)80181-7
- 9. Xu, X.Y., Xie, G.S., He, L., Zhang, J.J., Xu, X.L., Qian, R., Liang, G.H. and Liu, J.H. (2013) Differences in Oxidative Stress, Antioxidant Systems, and Microscopic Analysis between Regenerating Callus-Derived Protoplasts and Recalcitrant Leaf Mesophyll-Derived Protoplasts of Citrus reticulata Blanco. Plant Cell, Tissue and Organ Culture, 114, 161- 169. http://dx.doi.org/10.1007/s11240-013-0312-4
- 10. Papadakis, A.K., Siminis, C.I. and Roubelakis-Angelakis, K.A. (2001) Reduced Activity of Antioxidant Machinery Is Correlated with Suppression of Totipotency in Plant Protoplasts. Plant Physiology, 126, 434-444. http://dx.doi.org/10.1104/pp.126.1.434
- 11. Yasuda, K., Watanabe, Y. and Watanabe, M. (2007) Generation of Intracellular Reactive Oxygen Species during the Isolation of Brassica napus Leaf Protoplasts. Plant Biotechnology, 24, 361-366. http://dx.doi.org/10.5511/plantbiotechnology.24.361
- 12. Tewari, R.K., Watanabe, D. and Watanabe, M. (2012) Chloroplastic NADPH Oxidase-Like Activity-Mediated Perpetual Hydrogen Peroxide Generation in the Chloroplast Induces Apoptotic-Like Death of Brassica napus Leaf Protoplasts. Planta, 235, 99-110. http://dx.doi.org/10.1007/s00425-011-1495-8
- 13. 王丽莉, 贾敬芬. 小麦原生质体分离过程中生理状态的变化[J]. 植物生理学报, 1994(20): 393-398.
- 14. Cutler, A.J., Saleem, M. and Wang, H. (1991) Cereal Protoplast Re-calcitrance. In Vitro Cellular & Developmental Biology-Plant, 27, 104-111. http://dx.doi.org/10.1007/BF02632192
- 15. De Marco, A. and Roubelakis-Angelakis, K.A. (1996) The Complexity of Enzymic Control of Hydrogen Peroxide Concentration May Affect the Regeneration Potential of Plant Protoplasts. Plant Physiology, 110, 137-145.
- 16. Papadakis, A.K. and Roubelakis-Angelakis, K.A. (1999) The Generation of Active Oxygen Species Differs in Tobacco and Grapevine Mesophyll Protoplasts. Plant Physiology, 121, 197-205. http://dx.doi.org/10.1104/pp.121.1.197
- 17. Petřivalský, M., Vaníčková, P., Ryzí, M., Navrátilová, B., Piterková, J., Sedlářová, M. and Luhová, L. (2012) The Effects of Reactive Nitrogen and Oxygen Species on the Regeneration and Growth of Cucumber Cells from Isolated Protoplasts. Plant Cell, Tissue and Organ Culture, 108, 237-249. http://dx.doi.org/10.1007/s11240-011-0035-3
- 18. Apel, K. and Hirt, H. (2004) Reactive Oxygen Species: Meta-bolism, Oxidative Stress, and Signal Transduction. Annual Review of Plant Biology, 55, 373-399. http://dx.doi.org/10.1146/annurev.arplant.55.031903.141701