Botanical Research
Vol.07 No.03(2018), Article ID:24398,8
pages
10.12677/BR.2018.73030
Study on Antioxidant Activity in Vitro of Extract from Phellodendron amurense Leaves
Chunjing Wang, Yuhong Zhang*
Key Laboratory of Forest Plant Ecology of Ministry of Education, Northeast Forestry University, Harbin Heilongjiang

Received: Mar. 19th, 2018; accepted: Apr. 11th, 2018; published: Apr. 18th, 2018

ABSTRACT
Aim: To investigate antioxidant activities in vitro of different polarity fractions of extract from ethanol extract of Phellodendron amurense leaves. 4 extractions were obtained in different fractions by using different polarities of solvents such as petroleum ether, ethyl acetate, butanol and water. The antioxidant activity capacity of 4 different polarity fractions from ethanol extract of P. amurense leaves was evaluated by detecting scavenging abilities for 1,1-diphenyl-2-trinitrophenylhydrazine (DPPH) radical, hydroxyl radical (•OH), ABTS+• radical and Ferric Reducing Antioxidant Power method (FRAP) assay. The results showed that the different fractions of extract from P. amurense leaves had revealed antioxidant activity and showed a significant concentration-effect relationship (p < 0.05). The antioxidant effects of 4 fractions from P. amurense leaves all had different antioxidant effects in different reaction systems. There were differences in antioxidant activities among 4 fractions. Extracts of ethyl acetate fraction and butanol fraction had better scavenging effects than petroleum ether fraction and water fraction for DPPH, •OH, ABTS+• and FRAP. The extract from the ethyl acetate and butanol of P. amurense has a strong antioxidant activity and is a source of natural antioxidants.
Keywords:Phellodendron amurense Leaves, Antioxidant Activity, Ethanol Extract, DPPH, Hydroxyl Radical, ABTS, FRAP
黄檗叶提取物的体外抗氧化活性研究
王春晶,张玉红*
东北林业大学森林植物生态学教育部重点实验室,黑龙江 哈尔滨

收稿日期:2018年3月19日;录用日期:2018年4月11日;发布日期:2018年4月18日

摘 要
目的:探究黄檗叶醇提物不同极性溶剂提取物的体外抗氧化活性。采用有机溶剂萃取法将黄檗提取物分为石油醚相、乙酸乙酯相、正丁醇相和水相4个不同提取物,通过对1,1-二苯基-2-三硝基苯肼(DPPH)、羟自由基(•OH)、ABTS+•清除能力以及铁离子(Fe3+)还原能力(FRAP法)的测定,比较评价黄檗叶70%醇提取物不同极性组分的抗氧化活性能力。结果表明黄檗叶不同溶剂提取物均具一定的抗氧化活性,并呈现显著剂量效应关系(p < 0.05);其抗氧化效果因反应体系的不同而不同,且不同溶剂提取物的抗氧化活性有差异。乙酸乙酯相和正丁醇相提取物对DPPH、•OH和ABTS+•的清除能力和对铁离子(Fe3+)还原能力均优于石油醚和水相提取物。黄檗叶乙酸乙酯相和正丁醇相提取物的抗氧化作用较强,是天然抗氧化剂的来源。
关键词 :黄檗叶,抗氧化活性,乙醇提取物,DPPH,羟自由基,ABTS,FRAP

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
黄檗(Phellodendron amurense)别名黄波萝,为芸香科(Rutaceae)黄檗属(Phellodendron)植物,主要分布于我国东北三省及华北地区,是中国特有种,国家II级重点保护野生植物 [1] 。与胡桃楸(Juglans mandshurica)、水曲柳(Fraxinus mandschurica)并称“东北三大硬阔”。黄檗与其同属植物黄皮树(Phellodendron chinense)的内干燥树皮入药,俗称“关黄柏”和“川黄柏”,临床研究主要用于抗菌抗炎,泻火除蒸,清热燥湿,解毒疗疮等作用 [2] 。现代研究表明,黄檗的主要药用有效成分为生物碱类,主要发挥药理作用的是小檗碱。黄檗及小檗碱在对癌症、糖尿病、降血压 [3] [4] 等方面有较好疗效。因此具有重要的经济和药用价值。作为我国名贵传统中药——关黄柏的唯一来源,黄檗受到极大的关注。由于种子休眠和自身有萌发抑制物质存在等因素 [5] ,黄檗种群呈衰退态势,保护濒危药用植物已迫在眉睫。
最新研究显示,在正常的生命活动过程中,机体内的多种生理活动代谢产物都会产生自由基,因其具有未配对的电子对而异常不稳定,若其发生氧化会对细胞极其不利,从而引发一些疾病,如心血管疾病、癌症等 [6] [7] [8] ,进而影响个体寿命。抗氧化剂能够与不稳定的自由基发生反应,保护机体自身不受损害,因而受到极大的追捧。但长时间摄入人工合成的抗氧化剂会产生一定的毒副作用,与保健、养生的初衷相违背,因此,寻找合适的天然抗氧化剂就显得尤为重要。这也为传统药用植物的保健功能开辟了一条新途径。目前,科学界对抗氧化方面的研究进展已经取得了一定的成果,已有较为成熟、成体系的抗氧化测定方法,对于一些植物的抗氧化机制研究的也比较深入,研究显示,许多从植物中提取的天然抗氧化剂效果较好 [9] [10] [11] 。但对黄檗的体外抗氧化研究还不是很完善,本研究有助于更加清晰的分辨黄檗体外抗氧化作用能力。合理高效利用黄檗这一珍稀资源。本实验选用DPPH法、清除羟自由基能力、ABTS法、FRAP法四种体外抗氧化方法,通过不同溶剂下黄檗叶提取物对不同测定方法的结果分析,总结其体外抗氧化能力的强弱,以此来衡量黄檗提取物的抗氧化价值。
2. 材料与方法
2.1. 材料与试剂
实验材料:本实验所用黄檗叶均为2016年9月采摘于东北林业大学城市林业示范基地中40年生黄檗植物。黄檗叶子于阴暗处通风干燥,自然晒干后粉碎机粉碎,过40目筛备用。
试剂:2,4,6-三吡啶基三嗪(2,4,6-three pyridyl three triazine, TPTZ)、DPPH (1,1-二苯基-2-三硝基苯肼)、ABTS、抗坏血酸(vc)均购买于德国Sigma-Aldrich公司;其余试剂、药品均为分析纯。
2.2. 仪器与设备
722型可见分光光度计(上海精科);1102型紫外可见分光光度计(上海天美);RE52A型旋转蒸发仪(上海亚荣生化仪器厂);循环水式多用真空泵(河南省予华仪器有限公司);石英比色皿(中国制造);高速万能粉碎机FW-80(北京市永光明医疗仪器厂);电子恒温水浴锅(天津市泰斯特仪器有限公司)。
2.3. 实验方法
2.3.1. 黄檗叶处理及提取方法
精确称取粉碎过筛的黄檗叶子1000 g,用70%的乙醇溶液以料液比1:15的体积比超声浸提,每次浸提时间为180 min,功率100 w,温度设定在40℃,浸提两次。抽滤、将两次浸提液合并,并高度浓缩,依次用石油醚、乙酸乙酯、正丁醇进行萃取。将得到的每一相有机萃取溶剂及水相浓缩干燥,得到各萃取相干物质。
最终测得黄檗叶不同提取相干物质的量:石油醚相21 g、乙酸乙酯相79 g、正丁醇相68.4 g、水相108.8 g。称取各提取相干物质配置成不同浓度梯度待测样品液,备用。
2.3.2. DPPH自由基清除作用的测定
参照Brand-williams [12] 和胡喜兰 [13] 的方法,有所改动。取上述配好备用的不同浓度梯度的各相提取液1.5 ml,分别与0.1 mmol/L DPPH乙醇溶液混合并震荡均匀,室温条件下避光放置30 min,于517 nm下测定样品的吸光度,此为A0管;以1.5 ml的无水乙醇替代A0管中的DPPH溶液,此为A1管;以等量的蒸馏水代替A0管中的样品液,此为A2管。分别测定其吸光度,并计算其清除率。并计算其IC50值。清除率 = [1 − (A0 − A1)/A2] × 100%。
2.3.3. •羟自由基(•OH)清除能力的测定
参照陈留勇 [14] 、高波 [15] 的方法。精确称取1 mL 8.8 mmol/L FeSO4于试管中,依次加入1mL 9.1 mmol/L的水杨酸溶液、1 mL样品溶液、5 mL蒸馏水,震荡混匀后加入1 mL 0.06% H2O2,继续震荡混匀并置于黑暗条件下37℃水浴30 min。于510 nm处测定吸光度,此为A管;将A管中H2O2替换成等量蒸馏水,此为A1管;将A管中样品溶液替换成等量蒸馏水,此为A0管。清除率 = [1 − (A − A1)/A0] × 100%以上试剂均需现配现用。
2.3.4. 铁离子(Fe3+)还原能力(FRAP法)测定
测定参照Park [16] 等的实验方法。制备0.1 mol/L的醋酸盐缓冲液(pH = 3.6);用40 mmol/L的HCl配制浓度为10 mmol/L的TPTZ,以及20 mmol/L的FeCl3溶液;将上述三种溶液以体积比为10:1:1的比例混合,制备FRAP工作液备用。
称取待测样品溶液0.1 mL,加入2.45 mL FRAP工作液震荡混匀,于室温、黑暗条件下放置30 min,于593 nm处测定并记录吸光度。
2.3.5. ABTS+•清除能力测定
参考Tai Zhigang [17] 等的实验方法。将7 mmol/L的ABTS水溶液与2.45 mmol/L过硫酸钾水溶液以体积比为1:1的比例混合,在室温、避光条件下放置12~16 h,形成ABTS自由基储备液,并与乙醇以体积比为1:80的比例混合,在734 nm处测定吸光值为0.7 ± 0.02,将制备好的ABTS混合液于30℃条件下预热备用。现用现配。
取上述配好备用的不同浓度梯度的各相提取液0.2 mL加入4 mL ABTS混合液震荡混匀,于室温、避光条件下放置30 min,在734 nm处测定吸光度此,此为A1管;以0.2 mL蒸馏水替代A1管中的样品溶液,此为A0管;以4 mL蒸馏水替代A1管中的ABTS混合液,此为A2管。计算清除率。清除率 = (A0 A1 + A2)/A0 × 100%。
2.4. 数据处理
所有抗氧化反指标数据至少重复测定3次,采用Excel 2007软件进行统计分析,并对所得数据进行单因素方差分析。
3. 结果与分析
3.1. 黄檗叶提取物各相对DPPH自由基清除能力
从图1中数据可以看出,黄檗叶4个不同溶剂提取物对DPPH均有清除能力,且呈显著量效关系。不同溶剂提取物的清除DPPH自由基能力存在差异,同种溶剂提取物随着浓度的增大抗氧化能力有所提升,相同浓度下石油醚对DPPH的清除率最小,其次是水提取物,正丁醇提取物,乙酸乙酯提取物清除率最大。在浓度为1.0 mg/mL时,石油醚、乙酸乙酯、正丁醇和水相提取物对DPPH的清除率分别是65.1%、81.31%、76.59%和70.26%,且差异不显著(p > 0.05)。IC50值(清除率达到50%时的相应浓度)也与清除率相一致,石油醚提取物最大,乙酸乙酯提取物的最小。4个溶液提取物的IC50值分别为0.80 mg/mL、0.11 mg/mL、0.14 mg/mL和0.38 mg/mL (表1)。
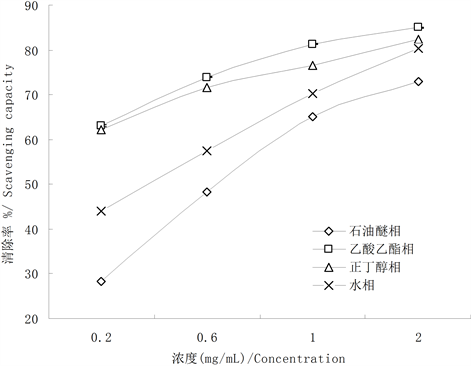
Figure 1. Scavenging capacities for DPPH of extraction of different fraction from P. amurense leaves
图1. 黄檗叶各相提取物对DPPH的清除能力
3.2. 黄檗叶提取物对羟自由基(•OH)的清除作用
从图2中可以看出,黄檗叶各相提取物均表现出不同程度的清除羟自由基的能力,并且都具有较为明显的量效关系。在相同低浓度下(0.2和0.6 mg/mL),以石油醚相和正丁醇提取物对·OH自由基的清除率较乙酸乙酯和水相提取物小,但差异不显著(p > 0.05)。当提取物浓度为1.0 mg/mL时,乙酸乙酯相和正丁醇相提取物对·OH自由基的清除率高于和石油醚相和水相提取物,但差异不显著(p > 0.05)。当提取物浓度为2.0 mg/mL时,乙酸乙酯相和正丁醇相提取物对•OH自由基的清除率明显高于和石油醚相和水相提取物,并且差异显著(p < 0.05)。从IC50值上来看,乙酸乙酯相和正丁醇相提取物的IC50值显著低于石油醚相和水相提取物(表1),说明,乙酸乙酯相和正丁醇相提取物对羟自由基(•OH)的清除作用要优于石油醚相和水相提取物。
3.3. 黄檗叶提取物对ABTS+•清除能力
从图3中可以看出,黄檗叶各相提取物对ABTS+•均表现出不同程度的清除能力,并且都具有明显
Table 1. IC50 of scavenging capacities for free radicals and FRAP of extraction of different fraction from P. amurense leaves
表1. 黄檗叶各相提取物的清除能力和对铁离子还原能力的IC50值
注:表中竖相相同小写字母表示差异不显著,不同小写字母则表示差异显著(p < 0.05)。
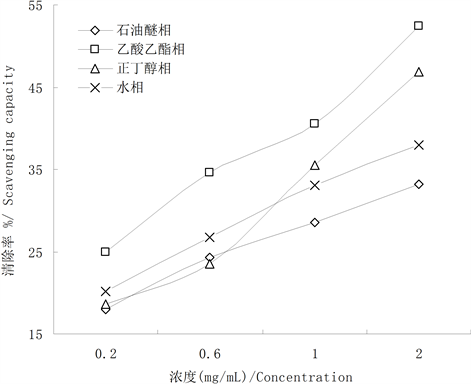
Figure 2. Scavenging capacities for •OH of extraction of different fraction from P. amurense leaves
图2. 黄檗叶各相提取物对•OH自由基清除作用

Figure 3. Scavenging capacities for ABTS+• of extraction of different fraction from P. amurense leaves
图3. 黄檗叶各相提取物对ABTS+•自由基清除作用
的剂量关系。在浓度较低的情况下,各相提取对ABTS+•的清除能力相对较低,并且差异不显著(p < 0.05)。随着浓度升高,逐渐表现差异性,在浓度为2.0 mg/mL时,乙酸乙酯相与正丁醇相对ABTS+•的清除能力最好,其次为水相提取物,石油醚的清除率最小,并且表现出显著性差异(p < 0.05)。在浓度为1.0 mg/mL时,石油醚、乙酸乙酯、正丁醇和水相提取物对ABTS+•的清除率分别是41.67%、80.61%、85.23%和55.22%。这也在它们各自IC50值得到验证(表1)。
3.4. 黄檗叶提取物的铁离子还原能力(FRAP)
抗氧化剂或抗氧化物质能够将Fe3+还原为Fe2+,与TPTZ结合生成一种蓝色络合物,这种络合物在波长593 nm处有最大吸收,其吸光度越大,表明这种抗氧化物质的抗氧化活性越强 [18] 。从图4得出,黄檗叶各相提取物不同浓度下均表现出不同程度对铁离子的还原能力,并且随浓度升高,表现出的还原能力越强。在相同浓度下,石油醚相提取物对铁离子还原能力最弱,其次是水相提取物、乙酸乙酯相提取物,正丁醇相提取物(1.0 ml/mL浓度除外)对铁离子还原能力最强。从IC50值上来看,乙酸乙酯相和正丁醇相提取物的IC50值也是最小,分别为0.28 ml/mL和0.30 ml/mL,且差异不显著(p > 0.05) (表1)。
4. 讨论
抗氧化作用与人类的健康密切相关,当人体中产生过多的自由基或者抗氧化途径出现障碍时,就会导致细胞受损,引起衰老、心脏病、癌症等多种疾病。自由基是人类在生命活动进行时产生的一种活性分子,在代谢正常时,机体内的过氧化物酶(POD)、超氧化物歧化酶(SOD)等及其它抗氧化物质可通过一系列生理生化反应来及时清除过多的自由基,以避免自由基过多对细胞、组织造成损害 [6] 。消除人体产生的过多的自由基,不仅要通过人体自身的清除系统,还可以通过补充抗氧化剂,而化学合成的抗氧化剂存在一定的毒副作用。因此,从植物中寻找低毒、高效的天然抗氧化剂用于预防和减轻人体与之相关疾病的发生、发展,也日益受到人们的关注,已有的研究表明许多植物中的天然提取物被证明具有较好的抗氧化活性 [9] [11] [19] 。

Figure 4. The Ferric Reducing Ability of Plasma (FRAP) of extraction of different fraction from P. amurense leaves
图4. 黄檗叶各相提取物的铁离子还原能力
黄檗叶提取物体外抗氧化实验研究表明:黄檗叶的石油醚、乙酸乙酯、正丁醇和水4个不同溶剂提取物均具有抗氧化活性,且它们的抗氧化活性差别较大,其中以乙酸乙酯和正丁醇相提取物的活性较强,其次是水相,石油醚相提取物的抗氧化活性最弱。不同溶剂提取物的抗氧化作用不同,其对不同类型的自由基有选择性作用。这从各相的IC50值也很好的得以验证(表1)。IC50值越低,表示出其抗氧化活性越强。乙酸乙酯相和正丁醇相提取物在清除DPPH和ABTS+•时的IC50值在0.1~0.4 mg/mL之间,虽与阳性对照Vc的IC50值(0.04~0.11 mg/mL)有显著性差异(p < 0.05),但已经表现出较强的抗氧化活性了。而FRAP法是测定样品总的还原能力,并不是针对某一种自由基的清除能力,它用来反映的是样品总的抗氧化活性,乙酸乙酯相和正丁醇相提取物的IC50值也分别是0.28 mg/mL和0.30 mg/mL,说明乙酸乙酯和正丁醇相提取物总抗氧化活性也较强。这可能与黄檗叶提取物的不同溶剂提取物中所含主要抗氧化成分的种类和结构有关。而乙酸乙酯相和正丁醇相提取物的提取得率相对也较高,因此,可进一步分离鉴定其有效成分,确定黄檗叶抗氧化作用的物质基础。
基金项目
国家自然科学基金面上项目(No. 31370630)和国家林业公益性行业专项(201104066)资助。
文章引用
王春晶,张玉红. 黄檗叶提取物的体外抗氧化活性研究
Study on Antioxidant Activity in Vitro of Extract from Phellodendron amurense Leaves[J]. 植物学研究, 2018, 07(03): 233-240. https://doi.org/10.12677/BR.2018.73030
参考文献
- 1. 郭巧生. 药用植物栽培学[J]. 北京: 高等教育出版杜, 2004.
- 2. 国家药典委员会. 中华人民共和国药典(一部) [M]. 北京: 化学工业出版社, 2005: 99-100.
- 3. Yin, J., Ye, J.P. and Jia, W.P. (2012) Effects and Mechanisms of Berberine in Diabetes Treatment. Acta Pharmaceutica Sinica B, 2, 327-334.
https://doi.org/10.1016/j.apsb.2012.06.003 - 4. 张冠英, 董瑞娟, 廉莲. 川黄柏、关黄柏的化学成分及药理活性研究进展[J]. 沈阳药科大学学报, 2012, 29(10): 812-821.
- 5. 张玲, 张东来, 邓晓华. 黄檗雌雄植株增殖培养性别差异研究[J]. 森林工程, 2017, 33(6): 11-14.
- 6. Devasagayam, T.P.A., Tilak, J.C., Boloor, K.K., et al. (2004) Free Radicals and Antioxidants in Human Health: Current Status and Future Prospects. Journal of the Association of Physicians of India, 52, 794-804.
- 7. Kim, J.W. and Minamikawa, T. (1997) Hydroxyl Radical-Scavenging Effects of Spices and Scavengers from Brown Mustard (Brassica nigra). Bioscience, Biotechnology, and Biochemistry, 61, 118-123.
https://doi.org/10.1271/bbb.61.118 - 8. Wang, H., Cao, G. and Prior, R.L. (1996) Total Antioxidant Capacity of Fruits. Journal of Agricultural and Food Chemistry, 44, 701-705.
https://doi.org/10.1021/jf950579y - 9. Krishnaiah, D., Sarbatly, R. and Nithyanandam, R. (2011) A Review of the Antioxidant Potential of Medicinal Plant Species. Food and Bioproducts Processing, 89, 217-233.
https://doi.org/10.1016/j.fbp.2010.04.008 - 10. 刘德江, 申健, 田立娟, 等. 野生与栽培蓝靛果果实提取物的体外抗氧化活性[J]. 经济林研究, 2013, 31(3): 103-106.
- 11. Li, S., Li, S.K., Gan, R.Y., et al. (2013) Antioxidant Capacities and Total Phenolic Contents of Infusions from 223 Medicinal Plants. Industrial Crops and Products, 51, 289-298.
https://doi.org/10.1016/j.indcrop.2013.09.017 - 12. Brand-Williams, W., Cuvelier, M.E. and Berset, C. (1995) Use of a Free Radical Method to Evaluate Antioxidant Activity. LWT-Food Science and Technology, 28, 25-30.
https://doi.org/10.1016/S0023-6438(95)80008-5 - 13. 胡喜兰, 韩照祥, 陶莹, 等. DPPH•法测定17种植物的抗氧化活性[J]. 食品科技, 2006, 31(10): 264-268.
- 14. 陈留勇, 孟宪军, 贾薇, 等. 黄桃水溶性多糖的抗肿瘤作用及清除自由基提高免疫活性研究[J]. 食品科学, 2004, 25(2): 167-170.
- 15. 高波. 孔石莼中体外抗氧化活性物质的研究[D]: [硕士学位论文]. 哈尔滨: 哈尔滨工业大学, 2013.
- 16. Park, Y.S., Namiesnik, J., Vearasilp, K., et al. (2014) Bioactive Compounds and the Antioxidant Capacity in New Kiwi Fruit Cultivars. Food Chemistry, 165, 354-361.
https://doi.org/10.1016/j.foodchem.2014.05.114 - 17. Tai, Z., Cai, L., Dai, L., et al. (2011) Antioxidant Activity and Chemical Constituents of Edible Flower of Sophora viciifolia. Food Chemistry, 126, 1648-1654.
https://doi.org/10.1016/j.foodchem.2010.12.048 - 18. Benzie, I.F.F. and Strain, J.J. (1996) The Ferric Reducing Ability of Plasma (FRAP) as a Measure of “Antioxidant Power”: The FRAP Assay. Analytical Biochemistry, 239, 70-76.
https://doi.org/10.1006/abio.1996.0292 - 19. Duduku, K., Rosalam, S. and Rajesh, N. (2011) A Review of the Antioxidant Potential of Medicinal Plant Species. Food and Bioproducts Processing, 89, 217-233.
https://doi.org/10.1016/j.fbp.2010.04.008
