Journal of Advances in Physical Chemistry
Vol.05 No.01(2016), Article ID:16936,8
pages
10.12677/JAPC.2016.51001
Preparation and Characterization of Liposomes Embedded with Hydrophobic Fe3O4 Nano-Particles
Limin Han1, Lizhi Pan2, Xianfeng Chu2, Xingping Zhou1
1College of Chemistry, Chemical Engineering and Biotechnology, Donghua University, Shanghai
2Blasting and Coating Department, Shanghai Waigaoqiao Shipbuilding Co., LTD., Shanghai

Received: Jan. 27th, 2016; accepted: Feb. 14th, 2016; published: Feb. 18th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Magnetic liposomes not only have good biocompatibility but also have excellent magnetic properties, so it is widely used in tumor tissue to enhance MR angiography in order to achieve prevention and early diagnosis of tumors. Here, we describe synthesis of magnetic nano-composite liposomes (HMLs) by a thin film dispersing method, based on hydrophobic magnetite (Fe3O4) nanoparticles. We studied the effect of lipid concentration, lecithin and cholesterol mass ratio for the properties of HMLs. The results showed that the size of the HMLs containing Fe3O4-OA NPs mainly in a sandwich-structure is 125.3 ± 12.9 nm obtained by transmission electron microscopy (TEM) and dynamic light scattering (DLS). The optimized prescription of HMLs has been obtained by orthogonal tests in which encapsulation efficiency of Fe is used as index and phenanthroline absorption spectrophotometry is used to determine Fe content. The results showed that the best prescription pre- paration process of HMLs is: 0.5 - 2.0 mg/mL of lecithin, and [lecithin]:[cholesterol] = 2:1 - 6:1 (w/w). And while the initial Fe concentration in the solution varied from 0.25 to 3.0 mg/mL, an effective Fe3O4 NPs loading was achieved, with encapsulation efficiency (EE%) from 91.0% to 71.0%. In a word, the results affirm the HMLs possess high Fe concent and can be potentially used to enhance Magnetic Resonance Imaging (MRI) in tumor tissues.
Keywords:Nano-Magnetic Liposomes, Hydrophobic Fe3O4 Nanoparticles, Thin Film Dispersing Method, MRI

以疏水性Fe3O4纳米粒子为基的脂质体的制备及表征
韩利敏1,潘立志2,楚险峰2,周兴平1
1东华大学化学化工与生物工程学院,上海
2上海外高桥造船有限公司涂装部,上海

收稿日期:2016年1月27日;录用日期:2016年2月14日;发布日期:2016年2月18日

摘 要
磁性脂质体既有脂质体良好生物相容性的优势又具有磁性质而被广泛地用于肿瘤组织的MR增强造影,以实现对肿瘤的预防和早期诊断。本文运用经典的薄膜分散法制备出了一种结构较为新颖的磁性脂质体即负载疏水性Fe3O4纳米粒子的脂质体。研究了脂浓度、卵磷脂和胆固醇质量比等因素对磁性脂质体的性能影响,并通过TEM、DLS等手段进行形貌和粒径表征。另外,我们采用邻菲罗啉分光光度法测定Fe含量,以包封率为指标,对影响制备HMLs的因素进行正交实验。结果表明:当脂质体的浓度维持在0.5~2.0 mg/mL,卵磷脂和胆固醇的质量比在2:1~6:1之间时,所得脂质体复合体的稳定性良好,形貌及大小分布均匀,主要呈现夹心式形貌,粒径为125.3 ± 12.9 nm;当初始铁浓度为0.5~3.0 mg/mL时,HMLs的包封率为90%~71.0%。并且HMLs拥有很高的铁含量,这表明其作可潜在的用作肿瘤磁共振成像(MRI)造影剂以增强肿瘤造影的效果。
关键词 :纳米磁性脂质体,疏水性Fe3O4纳米粒子,薄膜分散法,磁共振成像

1. 引言
脂质体是一种类似于生物膜的人工膜,具有很好的生物相容性。当其与磁性纳米Fe3O4粒子(Magnetic Fe3O4 NPs)结合时,不仅可以牢固地结合在纳米颗粒表面,而且还可以显著改善壳聚糖包覆地磁性纳米颗粒作为MRI造影剂所引起的过敏反应、稳定性差[1] [2] 等不足,从而增加MR图像的对比度,提高疾病诊断的准确性和灵敏度。Zhang等人 [3] 发现,使用脂质体作为修饰剂能显著提高磁性粒子的标记效率,增加磁性粒子的摄取率,使得MR图像对比度提高,并更加准确地检测出微小病灶。磁性脂质体是一种用于网状内皮系统的对比剂,可用于肝、脾、淋巴结及骨髓等富含网状内皮细胞的组织和器官的MR增强扫描 [4] 。
就结构分类而言,磁性脂质体大致可以分为以下两种类型:1) 亲水性的磁性纳米粒子包封于脂质体的内水核中(MLs-W is liposomes with hydrophilic Fe3O4 NPs in the inner aqueous core);2) 疏水性磁性纳米颗粒嵌入磷脂双分子层中(Hydrophobic Magnetic Fe3O4 NPs-Liposomes HMLs)。目前大多数研究是倾向于MLs-W的探索 [5] [6] ,而对HMLs的研究则很少涉及。但是对于MLs-W而言,有磁含量不高,MRI成像效果差;磁性粒子的密度较大、易沉降、易引发一些对生物体的毒性效应等缺点 [7] 。为此本文将疏水性Fe3O4 NPs与脂质体结合,组装出一种结构较为新颖的磁性脂质体,利用其结构特点避免和解决上述问题。在本文中,首先采用油水界面法制备疏水性Fe3O4 NPs;其次采用薄膜分散法将之前所制备的疏水性磁性纳米粒子包载入脂质体内部(图1)。
2. 实验部分
2.1. 试剂与仪器
试剂:氯化高铁、七水合硫酸亚铁、环己烷、油酸、氨水、无水乙醇、氯仿、大豆卵磷脂(SPC)、胆固醇(CH)、无水甲醇、氯化钠及磷酸盐缓冲液等均为分析纯;氮气(99.9%);超纯水应用于整个实验过程。
仪器:电子分析天平(BS-124S赛多利斯仪器系统有限公司),恒温磁力搅拌器(S21-2上海司乐仪器有限公司),超声波清洗器(SK2200H上海科导超声仪器有限公司),高速离心机(Centrifuge5810德国艾本德股份有限公司),循环水式多用真空泵(SHB-III上海豫康科教仪器设备有限公司),旋转蒸发仪(ZX-98上海鲁伊工贸有限公司),透射电子显微镜(HT7700日本日立),超导临床磁共振系统(3T Signa HDxt GE公司),傅里叶红外光谱仪(Avatar380美国热电集团)。
2.2. 疏水性磁性Fe3O4纳米粒子(Fe3O4 NPs)的制备
本文以FeCl3·6H2O和FeSO4·7H2O的混合液为水相,环己烷为油相,通过一种新颖的油水界面法来制备疏水性Fe3O4纳米粒子。将混合液置于室温水浴中,搅拌均匀之后,加入油酸为表面活性剂对其进行疏水性修饰,最后再逐滴加入6.0 M的氨水10 mL,在氮气保护下搅拌反应4 h。反应结束后移除水浴,继续在氮气保护下陈化1 h,之后通过磁分离用超纯水和无水乙醇交替洗涤3~5次,将其分散在氯仿中,保存备用。
2.3. 负载疏水性Fe3O4 NPs的脂质体(HMLs)的制备
采用经典的薄膜分散法制备HMLs 1) 取100 mg SPC和25 mg CH充分溶解于含有20 mL氯仿-甲醇混合溶剂的(体积比为2:1)茄形瓶中,接着向上述混合液中加入适量的Fe3O4-OA NPs氯仿溶液,混合均匀;2) 将上述盛有混合液的茄形瓶置于45℃水浴中旋转蒸发2.0 h直至形成均匀透明的薄膜;3) 向含有干燥磷脂膜的茄形瓶中加入50 mL PBS缓冲液(pH = 7.2),放置在磁力搅拌器上搅拌4.0 h至膜完全脱落,并通过超声分散使其形成半透明混悬液液。最后将所得的混悬液通过滤膜过滤和透析纯化,即得到HMLs,如图2所示。
3. 结果和讨论
3.1. FT-IR分析
图3是油水界面法制备的Fe3O4 NPs的红外吸收图。其反应条件为:体系中的总铁浓度为1.0 M,氨水浓度为6 M,反应时间为4 h,其中油酸的用量分别为2.0 mL、1.0 mL及0.5 mL。由图所示,不同油酸量合成产物的特征峰基本一致,可明显看到Fe-O键(604.95 cm−1)和油酸基团 (1416 cm−1和1525.43 cm−1)的特征吸收峰,这表明油酸已被修饰到了Fe3O4 NPs的表面。同时,随着油酸量的增加,1416 cm−1和1525.43 cm−1处的吸收峰明显增强,说明合成的Fe3O4-OA NPs被油酸包覆得更完全。另外,由于油酸的烷烃链存在使其具有疏水性,由图中的插图可观察到Fe3O4-OA NPs很稳定地存在于有机溶剂中。以上分析说明油酸被成功地修饰到了Fe3O4 NPs的表面,使其具有疏水性。
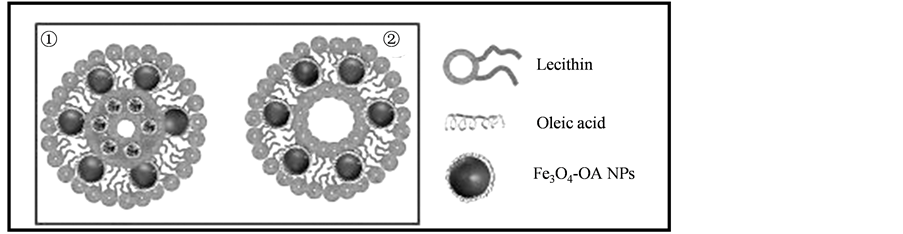
Figure 1. Schematic model for magnetoliposomes with Fe3O4-OA NPs in lipid bilayer
图1. 磷脂膜中包载Fe3O4-OA NPs的脂质体示意图
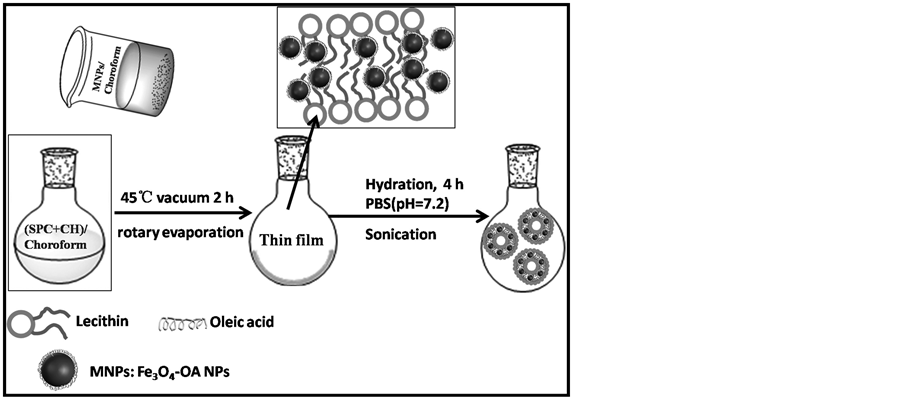
Figure 2. Formation process of HMLs for MR imaging
图2. HMLs的合成流程图

Figure 3. FT-IR spectrum of Fe3O4-OA NPs
图3. Fe3O4-OA NPs红外曲线图
3.2. HMLs的Zeta电势及水动力直径测试结果
表面电势的测量可表征磁性脂质体的表面修饰情况,电势测定结果(表1)表明,空白脂质体(Blank Liposomes, BLs)的表面电势仅为−3.8 mV,当脂质体包载磁性粒子之后,其表面电势达到了−26.4 mV,这主要是由于Fe3O4-OA NPs表面存有大量活性基团,从而导致磁性脂质体的表面电势与空白脂质体差异更明显 [8] ,这一结果初步说明疏水性Fe3O4-OA NPs已被包载入了脂质体中。
3.3. DPH荧光探针法确定HMLs的结构
DPH是一种线性结构分子,处于磷脂膜中烷烃基链较密集的疏水区内。当DPH探针包载于磷脂双分子层中时,它所处于环境的微粘度受磷脂膜的流动性影响。如表2所示,与BLs和MLs-W相比,在298 K时,HMLs中DPH各向异性值明显下降,脂质体的微粘度变小。这是因为磷脂双分子层的内部载入了Fe3O4-OA NPs,使磷脂膜的结构变得较为松散,膜的流动性和通透性增加,导致微粘度变小,各向异性值下降。而MLs-W中的DPH各向异性值与BLs的相似,亲水性磁性纳米粒子位于脂质体的内水相,未对磷脂膜的微粘度产生影响,因此DPH的各向异性值几乎未发生改变。以上结果进一步说明疏水性Fe3O4-OA NPs已成功地包载于磷脂双分子层的内部。
温度为318 K时,三类脂质体的DPH各向异性值没有发生明显差异,这可能是在较高温度下,磷脂膜处于流动性较强的液晶态,此温度下磁性粒子对膜的流动影响不大 [9] 。
3.4. 反应条件对用薄膜分散法合成HMLs的影响
用薄膜分散法制备HMLs的过程中,有诸多因素影响反应结果,本文将围绕体系的脂浓度、卵磷脂和胆固醇的质量比及Fe初始浓度等常见因素进行深入探讨。
3.4.1. 脂浓度对HMLs粒径及形貌的影响
图4是薄膜分散法制备的具有不同脂浓度的HMLs的TEM图,其反应条件为:体系中的初始Fe浓度为1.0 mg/mL,[SPC]:[CH] = 4:1 (w/w),水化时间为4 h。从图中可以观察到,当脂质体的水化浓度为0.5 mg/mL时制备的HMLs形貌成球形,但成型量较少,产量低。而当水化浓度为1.0~2.0 mg/mL时,所
Table 1. Zeta potentials of BLs and HMLs
表1. 空白脂质体和磁性脂质体的表面电势
Table 2. The DPH anisotropy loaded in liposomes in different temperatures
表2. 不同温度下的三种脂质体中DPH各向异性值
备注:BLs为空白脂质体,MLs-W为负载亲水性磁性粒子的磁性脂质体,HMLs为负载疏水性磁性纳米粒子的脂质体。Notes: BLs is blank liposomes; MLs-W is liposomes with hydrophilic Fe3O4 NPs in the inner aqeous core; HMLs load with Hydrophobic Magnetic Fe3O4 NPs-Liposomes
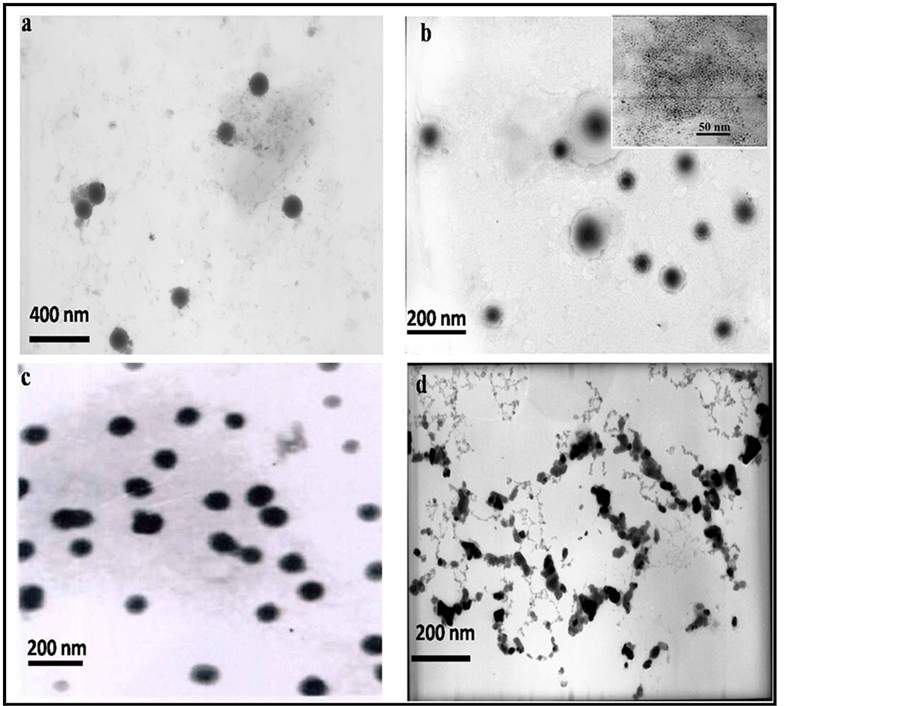
Figure 4. TEM micrographs of HMLs with various lipid concentrations. (a: 0.5 mg/mL, b: 1.0 mg/mL, c: 2.0 mg/mL, d: 4.0 mg/mL)
图4. 不同脂浓度下制备的HMLs TEM图。(a: 0.5 mg/mL; b: 1.0 mg/mL; c: 2.0 mg/mL; d: 4.0 mg/mL)
得HMLs分散均一,大部分成球形,表面平滑完整,几乎无粘附团聚现象。当水化浓度继续增大至4.0 mg/mL时,制备的HMLs出现了严重的融合和粘附团聚现象,几乎无成形。通过对比结果,当脂质体的浓度维持在0.5~2.0 mg/mL,得到的HMLs成型最好,形貌特征与S. Park等 [7] [9] 报道的表征磷脂膜中包载疏水性银纳米粒子的脂质体形貌有较为相似。另外,从图4(b)中的右上角插图可以观察到油水界面法所制备的Fe3O4 NPs分散均一,粒径大小约为4.3 nm。有文献报道 [10] 这一尺寸的纳米颗粒可包载于脂质体的磷脂双分子层中。
3.4.2. 卵磷脂与胆固醇质量比对HMLs的稳定性影响
为了考察所制备样品的稳定,所测样品均是放置一月之后测其粒径。其反应条件为:体系中的初始铁浓度为1.0 mg/mL,脂浓度为1.0 mg/mL,水化时间为4 h。图5和图6分别是用不同的卵磷脂和胆固醇的质量比所制备的HMLs的表观和粒径变化图,从左到右比值依次为0,2:1,4:1,6:1。从图中可以看出,当卵磷脂和胆固醇的比值为0,HMLs产生絮状沉淀,从粒径变化图中亦可得到验证,此时的样品粒径比较大,分散性较差。当比值为2:1~4:1时,可以观察到无絮状沉淀产生,呈现清澈透明的状态,粒径约为125 nm。当比值为6:1时,出现少许沉淀,但是粒径大小和分散性与2:1~4:1时相比变化不显著。以上现象说明,添加适量的胆固醇,有利于增强脂质体的稳定性。

Figure 5. Appearance pictures of HMLs obtained with different mass ratio of SPC and CH (From left to right ratios were 0, 2:1, 4:1, 6:1)
图5. 不同卵磷脂和胆固醇质量比下(从左到右比值依次为0,2:1,4:1,6:1)得到的HMLs的外观图片
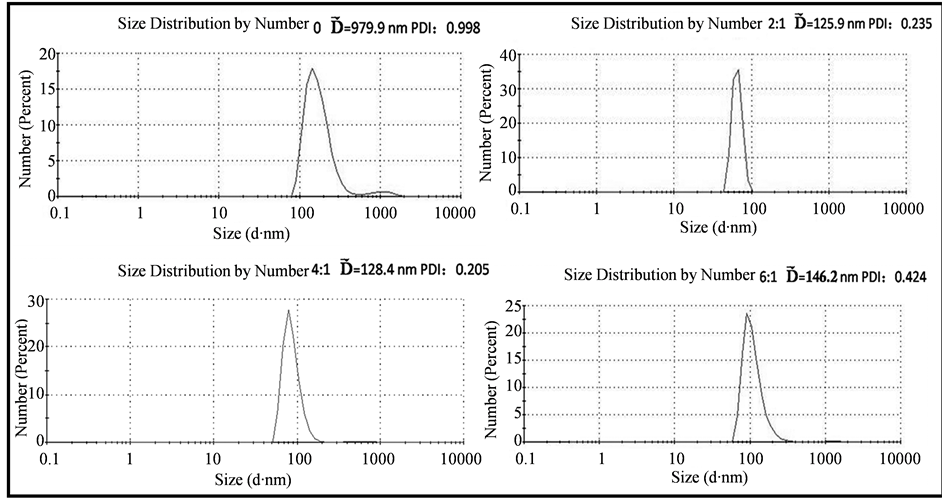
Figure 6. Hydrodynamic size of HMLs with different mass ratio of CH to SPC
图6. 不同卵磷脂和胆固醇质量比下制备的HMLs的水动力粒径大小
3.5. 磁性脂质体的包封率测量
本文采用基于Fe2+的邻菲罗啉染色法测定HMLs中的Fe含量。测试结果显示当初始Fe浓度为0.25、0.5、1.0及3.0 mg/mL时,包封率为91%~71%。从测试结果可以发现随着初始Fe浓度的增大,HMLs的包封率有所下降,当最高初始浓度为3.0 mg/mL时,磁性脂质体的包封率为71%,但仍比报道的包载亲属性磁性纳米粒子的包封率(20%~60%) [10] 高出很多。以上结果说明HMLs能够显著的提高磁性粒子的包封率和磁性粒子在脂质体的含量,从而提供足够的磁强度,为其作为MRI造影剂的应用打下基础。
4. 结论
采用油水界面法成功的制备出了分散均匀,纯度高的疏水性Fe3O4纳米颗粒。红外测试表明油酸分子成功的修饰到了Fe3O4纳米颗粒表面,可稳定的存在于有机溶剂中。采用薄膜分散法将Fe3O4-OA纳米颗粒成功地包载入了脂质体的双分子层内部。TEM观察和磁性脂质体中DPH荧光各向异性值变化结果确定了Fe3O4-OA NPs在脂质体中的位置。通过比较BLs和HMLs的Zeta电位,可以发现HMLs的Zeta电位由于表面带有油酸分子的磁性粒子而变得更负,表示疏水性Fe3O4-OA纳米颗粒成功的载入了脂质体中。对影响制备HMLs的因素探索结果表明,最佳反应条件是:体系脂浓度为1.0 mg/mL,Fe初始浓度为1.0 mg/mL,卵磷脂和胆固醇的质量比为4:1时。所得到的HMLs包封率高、稳定性最好、尺寸均一,平均粒径大小为123 nm。
基金项目
上海市经信委15XI-1-28。
文章引用
韩利敏,潘立志,楚险峰,周兴平. 以疏水性Fe3O4纳米粒子为基的脂质体的制备及表
Preparation and Characterization of Liposomes Embedded with Hydrophobic Fe3O4 Nano-Particles[J]. 物理化学进展, 2016, 05(01): 1-8. http://dx.doi.org/10.12677/JAPC.2016.51001
参考文献 (References)
- 1. Mornet, S., Portier, J. and Duguet, E. (2005) A Method for Synthesis and Functionalization of Ultrasmall Superpara-magnetic Covalent Carriers Based on Maghemite and Dextran. Journal of Magnetism and Magnetic Materials, 293, 127-134. http://dx.doi.org/10.1016/j.jmmm.2005.01.053
- 2. Mornet, S., Vasseur, S., Grasset, F., et al. (2004) Magnetic Nanoparticle Design for Medical Diagnosis and Therapy. Journal of Materials Chemistry, 14, 2161-2175. http://dx.doi.org/10.1039/b402025a
- 3. Zhang, Z., van den Bos, E.J., Wielopolski, P.A. de Jong-Popijus, M., Duncker, D.J. and Krestin, G.P. (2004) High- Resolution Magnetic Resonance Imaging of Iron-Labeled Myoblasts Using a Standard 1.5-T Clinical Scanner. Magma, 17, 201-209. http://dx.doi.org/10.1007/s10334-004-0054-8
- 4. 许乙凯. 磁共振对比剂的发展概况及存在问题[J]. 南方医科大学学报, 2002, 9(9): 769-971.
- 5. Prajapati, B.G. (2007) A Review on PEGylated Liposome in Cancer Therapy and in Delivery of Biomaterial. Pharmaceutical Reviews, 6, 153-161.
- 6. Hanuš, J., Ullrich, M., Dohnal, J., et al. (2013) Remotely Controlled Diffusion from Magnetic Liposome Microgels. Langmuir, 29, 4381-4387. http://dx.doi.org/10.1021/la4000318
- 7. Park, S. (2005) Effects of Silver Nanoparticles on the Fluidity of Bilayer in Phospholipid Liposome. Colloids and Surfaces B: Biointerfaces, 44, 117-122. http://dx.doi.org/10.1016/j.colsurfb.2005.06.002
- 8. Frascione, D., Diwoky, C., Almer, G., et al. (2012) Ultrasmall Superparamagnetic Iron Oxide (USPIO)-Based Liposomes as Magnetic Resonance Imaging Probes. Nano-medicine, 7, 2349-2359.
- 9. Qiu, D., An, X., Chen, Z., et al. (2012) Microstructure Study of Liposomes Decorated by Hydrophobic Magnetic Nanoparticles. Chemistry and Physics of Lipids, 165, 563-570. http://dx.doi.org/10.1016/j.chemphyslip.2012.06.004
- 10. Hohner, A., David, M.P.C. Dlera, R. (2010) Controlled Solvent-Exchange Deposition of Phoslipid Memnranes onto Solid Surface. Biointerphases, 5, 1-8. http://dx.doi.org/10.1116/1.3319326
