Journal of Advances in Physical Chemistry
Vol.07 No.02(2018), Article ID:24030,11
pages
10.12677/JAPC.2018.72005
Application of Inorganic Nanomaterials in Imaging Diagnosis
Huayang Feng1,2, Miaoning Ren1, Bingbing Fan1, Jingguo Li1,2*
1School of Materials Science and Engineering, Zhengzhou University, Zhengzhou Henan
2Zhengzhou University People’s Hospital, Zhengzhou Henan

Received: Feb. 24th, 2018; accepted: Mar. 7th, 2018; published: Mar. 14th, 2018

ABSTRACT
Inorganic nanomaterials, a major part of most contrast media, have received wide attention due to their strong ability to enhance the contrast between the affected area and the surrounding tissue. In recent years, some inorganic nanomaterials such as magnetic iron oxide materials, nano gold materials, mesoporous silica materials and so on have been widely applied to magnetic resonance imaging, CT imaging, fluorescence imaging and so on. This article reviews the physicochemical properties of the above materials, the synthesis methods and their application in the field of imaging diagnosis, and gives a corresponding outlook for the research in this field.
Keywords:Magnetic Iron Oxide, Mesoporous Silica, Gold Nanoparticles, Up-Conversion Nanomaterials, Semiconductor Quantum Dots, Imaging Diagnosis, Dual Mode Imaging
无机纳米材料在成像诊断方面的应用
冯华阳1,2,任苗柠1,范冰冰1,李景果1,2*
1郑州大学材料科学与工程学院,河南 郑州
2郑州大学人民医院,河南 郑州

收稿日期:2018年2月24日;录用日期:2018年3月7日;发布日期:2018年3月14日

摘 要
无机纳米材料是大多数造影剂的主要部分,起到增强病患部位与周围组织对比度的作用,引起了生物、化学、物理和材料等各领域科学家的广泛关注。其种类包括用于磁共振成像(MRI)的磁性氧化铁材料,用于CT成像和光热治疗的纳米金材料,可与无机造影材料复合的介孔二氧化硅材料,用作无背影荧光成像的上转换发光材料和半导体量子点荧光材料。本文主要综述了以上材料的物理化学特性、合成方法及其在成像诊断方面的应用,并对该领域的研究进行了相应的展望。
关键词 :磁性氧化铁,介孔氧化硅,金纳米颗粒,上转换纳米材料,半导体量子点,成像诊断,双模态成像

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
用于成像诊断的纳米材料分为无机材料和有机材料。无机纳米颗粒由于本身的一些性质可以在各种成像模式中产生对比度,而有机纳米颗粒,由于结构与体内组织相似,大多数不能产生对比度,所以他们大多数用来作治疗载体,目前大多数纳米颗粒呈现出诊断和治疗相结合的特性 [1] 。其中研究的比较多的有用于MRI成像的磁性氧化铁材料,用于CT成像和光热治疗的金纳米颗粒材料,可与功能化无机材料复合的介孔二氧化硅材料,用作无背影荧光成像的上转换发光材料和半导体量子点荧光材料(图1)。由于磁共振成像是在特殊磁场中人体内氢原子核在射频脉冲作用下产生信号的,所以像氧化铁这种具有特殊磁性的物质就可以通过改变氢原子所处磁场的磁性来改变信号,从而产生对比效果。而CT成像主要是根据人体不同组织的密度差异,对X射线的吸收能力不同来进行成像的。而金纳米颗粒由于具有高的密度,对X射线有较强的吸收,因此可以被应用于CT成像造影剂。介孔氧化硅由于具有较多的微孔,可以通过与其他的功能新组分复合用作磁共振成像和CT成像等成像方式的造影剂。由于上转换发光材料和半导体量子点的发射波长可调并且介于可见光的范围,因此他们可以被广泛地应用到荧光成像中。鉴于人们对各类造影材料的研究深度不同,所关注的重点也不相同,所以在各部分中将采用不同的行文结构分别进行介绍。

Figure 1. Inorganic nanomaterials and their applications in imaging
图1. 无机纳米材料及其影像方面的应用
2 磁性氧化铁
磁性氧化铁主要是Fe3O4和γ-Fe2O3,而磁性氧化铁的纳米颗粒不仅可生物降解、毒性低,还可以通过调控粒径的大小来控制磁性。
2.1. 磁性氧化铁的物理化学特性
块状的Fe3O4是亚铁磁性的,居里转变温度为858 K,是多磁畴结构的。当其尺寸小于100 nm时,就变成了单磁畴结构,矫顽力达到了最大;当尺寸降低到20 nm时,Fe3O4磁性纳米颗粒的磁化强度被热能随机化,从而转变为超顺磁性。超顺磁性转变的温度为blocking temperature (TB),
(K是磁各向性系数,kb是玻尔兹曼常数,V是纳米颗粒的体积),
2.2. 磁性氧化铁的合成方法
目前已经发展出很多合成磁性氧化铁颗粒的方法,其中比较有代表性的是Hyeon课题组率先采用可以合成高度均一且在医学上适用的氧化铁(Fe2O3)纳米颗粒的“高温分解法”,即将反应物缓慢地加热到高温,再将油酸、五羰基铁和二辛醚在100℃混合后,缓慢升温至沸点320℃ [2] 。由于原位生成的油酸复合物致使最终形成了高度分散的Fe2O3纳米颗粒,虽然方法简单,但最终形成了高度分散的Fe2O3纳米粒子。
若想让磁性氧化铁纳米颗粒应用到成像诊断,还需要对其表面进行改性处理,用两亲性聚合物在水中自组装形成胶束来包裹磁性纳米颗粒或者将其表面的疏水配体交换成亲水配体是使其成为水溶和生物相容纳米颗粒常用的方法 [3] 。
2.3. 磁性氧化铁的应用
也正因为这些优异的性质以及较为成熟的和改性的方法,Fe3O4和γ-Fe2O3 磁性氧化铁纳米颗粒在生物医学上有着广泛的应用,其中包括细胞跟踪、生物传感、成像诊断、药物传输等(图2) [4] 。本文主要介绍其用作MRI造影剂在磁共振造影方面的应用。
MRI造影剂按增强类型分为T1增强和T2增强的造影剂。超顺磁性氧化铁纳米颗粒可以用作T2增强的MRI造影剂 [5] 。它通过缩短组织内氢核的T2横向弛豫时间,使T2加权像变暗,与周围组织形成对比,来增强对比度。但T2造影剂标记的肿瘤或病变组织产生的黑暗信号可能与血液等黑暗部分混淆,影响诊断。所以对于分辨率有较高要求的成像来说,T1造影剂比T2造影剂更适合。具有大量未成对电子(包括Gd3+,Mn2+,Fe3+)的顺磁性化合物是理想的T1造影剂。因为T1对比效应是由于水分子的质子与造影剂的电子自旋之间的相互作用引起的。而较低的尺寸更有助于T1模式下的成像。而较为成熟的合成工艺使得磁性氧化铁纳米颗粒在MRI造影剂上有广阔的应用前景。
大量的有关磁性氧化铁纳米颗粒的研究也被报道了出来。Zhen等先以乙酰丙酮铁为前驱体,使其在2-吡咯烷酮中分解,得到了粒径分布比较均匀水溶性的Fe3O4纳米颗粒,平均粒径5 nm。为了提高磁性氧化铁的生物相容性,他们又在反应的过程中加入了甲基封端的聚乙二醇(mPEG)作为修饰,合成出了粒径为10 nm左右的水溶性Fe3O4纳米颗粒,得到的纳米颗粒具有良好的生物相容性,可以用作磁共振造影剂 [6] 。
3. 介孔氧化硅
介孔氧化硅材料是内部具有较多微孔结构的氧化硅,作为药物载体,其生物相容性较好并且具有优
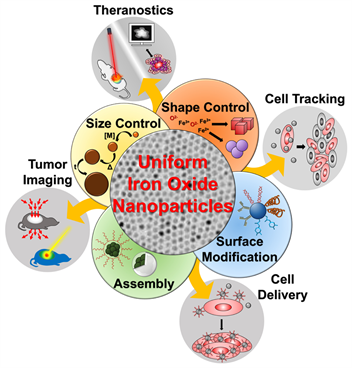
Figure 2. Biomedical applications of Magnetic iron oxide nanoparticles [2]
图2. 磁性氧化铁纳米粒子在生物医学领域的应用 [2]
异的生物可降解性,近几年在药物运输和成像诊断等生物医药领域受到越来越多人的关注 [7] 。
3.1. 介孔氧化硅的物理化学特性
传统的介孔氧化硅密度较低,孔容量和比较面积较大,与有机载体相比,具有较好的热稳定性和化学稳定性,高的装载量,在药物输送上显示出独特的优势。
3.2. 介孔氧化硅基复合造影剂的合成方法
随着纳米合成化学的发展,各种功能化的介孔氧化硅被合成出来,它是通过将一些磁性材料或者荧光材料与介孔氧化硅复合得到的 [8] [9] (图3)。将具有特殊功能的材料复合到介孔氧化硅中的有两种方法:一种是包覆法,即以正硅酸乙酯等一些含硅的有机溶剂为前驱体,通过溶胶凝胶的方法在功能性纳米粒子表面包覆上一层介孔氧化硅;另一种是修饰法,在预先制备好的介孔氧化硅的表面通过共价键结合修饰上一些功能性纳米粒子。
3.3. 介孔氧化硅基复合造影剂的应用
介孔氧化硅基复合造影材料通过添加不同的功能组分广泛应用于肿瘤等的靶向MRI成像,荧光成像等。目前,研究的最多的介孔氧化硅复合纳米生物材料是介孔磁性氧化硅纳米材料。它是通过将磁性氧化铁纳米颗粒复合到介孔氧化硅中来实现MRI成像的。与磁性氧化铁纳米颗粒的复合可以将磁特性引入到介孔氧化硅材料中,赋予MRI成像造影的能力 [10] 。如果将介孔氧化硅和荧光材料复合到一起,就可以实现荧光成像,Lo等将FDA批准的可用于临床的吲哚花青绿有机荧光素通过静电作用吸附到用三甲铵修饰的介孔氧化硅材料的孔道中,作为对人体有较强穿透能力的近红外光激发的对比剂,可用于人体的荧光成像 [9] 。Evan Phillips等人将124I标记的二氧化硅颗粒,与可进行分子靶向的cRGDY肽和染料Cy5复合制成的124I-cRGDY-PEG-C点粒子,进行荧光成像和的正电子发射断层扫描成像(PET)双模态成像,可以用于病人检测,癌症分期等。证明了相对于标准的用于PET成像的放射性示踪剂18F-氟脱氧葡萄糖(18F-FDG),其不仅毒性小,灵敏度高,还有良好的清除率和特异性 [11] 。
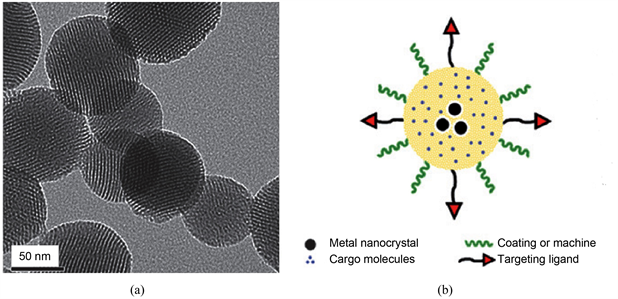
Figure 3. (a) Transmission electron microscope images of the difunctional mesostructured silica nanoparticles; (b) arious components such as fluorescent molecules, targeting ligands, molecular machines, and metal nanocrystals can be incorporated on the silica support to create a multifunctional system [7]
图3. (a) 二官能介孔结构二氧化硅纳米粒子的透射电子显微镜图像;(b) 诸如荧光分子,靶向配体,分子机器和金属纳米晶体之类的许多组分可以结合到二氧化硅载体上以创建多功能系统 [7]
4. 金纳米颗粒
金纳米颗粒即指三个维度都在纳米级别的金的微小颗粒,有金纳米球和金纳米棒等。
4.1. 金纳米颗粒的物理化学特性
金纳米颗粒具有高电子密度,对X射线有较强的衰减作用,被广泛的应用于CT造影。而其表面等离子体共振效应,以及可调节吸收波长,使其成为有前景的光声成像造影剂,并且有希望用于肿瘤等的热疗。金纳米颗粒表面还可以通过各种化学键与多种生物大分子联合,而且不影响其生物活性 [12] 。临床上应用的金纳米颗粒需要有均一的尺寸,可控的形状(图4)。
4.2. 金纳米颗粒的合成方法
金纳米颗粒的制备措施包括物理法和化学法 [12] [13] 。物理法是利用各种物理方法将块状的固体金分散成金纳米颗粒,包括高能球磨法、激光消融法、电分散法和真空沉积法等。物理法虽然容易得到粒径可调和形状可控的金纳米颗粒,但通常需要特殊的设施和技术,成本较高,制备过程较复杂。常用的化学方法包括氧化还原法、微乳液法和晶种生长法。氧化还原法就是在含有高价金离子的溶液中加入还原剂,金离子被还原而变成单质金纳米颗粒,该方法简单且容易得到稳定的金纳米颗粒。微乳液法是在氧化还原法的基础上进行改进的方法,它先将表面活性剂溶解到有机溶剂中,当其浓度达到临界胶束浓度时,就会自发组成一个个亲水极性头向内、疏水有机链向外的胶束,其内部的亲水腔可以被当作微小的反应容器,来进行高价金离子的还原反应,这种方法操作复杂,但是可以得到粒径较小的金纳米颗粒。晶种生长法是以氧化还原法制备的金纳米颗粒为晶种,再加入一定的金盐,利用金纳米颗粒表面的自催化反应使晶种继续生长,此方法可以制备出粒径分布均一的金纳米颗粒,通过调节金盐和金核的比例,还可以实现对其粒径大小的控制。
4.3. 金纳米颗粒的应用
金纳米颗粒由于易于制备,而且具有体内循环时间长、毒性低、材料表面容易结合靶向分子等优点,

Figure 4. Types, preparation methods, characteristics and applications of gold nanoparticles
图4. 金纳米颗粒的种类、制备方法、特性及应用
被广泛应用于分子影像学。最常见的就是用于CT造影,相对于人体组织,金纳米颗粒对X射线有较强的吸收 [14] ,并且是传统的碘剂化合物的2.7倍,因而能够大大提高CT成像的对比度,是最有前景的CT造影剂。2004年,Smilowit等合成了粒径均一的金纳米簇用于体内CT成像,体内注射金纳米簇后,可以清楚地辨别出100 μm以下的血管,实验结果证明,金纳米簇能使明显增强CT对比度 [15] 。2012年,王等人制备树枝状大分子包裹的纳米金纳米颗粒,将其用于血管系统的成像,并对比了传统碘海醇(iohexol),其成像效果远超碘海醇,对X射线有很强的吸收 [16] 。金纳米颗粒造影增强效果一般与聚集在单位体积组织中金的总表面积成正比。由于粒径越小的金纳米颗粒,比表面积越高,从而粒子表面散射越强,将会有更好的 CT 造影增强效果。通过改变核心和壳体的相对大小,金纳米颗粒的壳体的光学吸收可以被调整到近红外光谱范围(690~900 nm),在近红外区可以做强吸收剂或散射体,能够进行荧光成像和光热治疗 [17] 。杨等人合成了表面聚乙二醇化的金纳米颗粒,相较于由美国食品和药物管理局批准应用于临床的吲哚菁绿(靛青绿)indocyanine green (ICG),金纳米颗粒具有更长的体内循环时间,更好的生物相容性,以及更强的近红外吸收能力,更有利于应用在光声成像上 [18] 。
5. 上转换纳米材料
上转换纳米材料(Upconversion nanoparticles, UCNPs),是一种能将低能量的光子转换成高能量光子的功能材料,特别是掺镧(Ln)的上转换纳米颗粒,是目前可用于生物成像的新一代造影剂。材料所吸收光子的能量低于发射光子的能量是上转换发光材料的最大的特点,它是通过使用掺杂到主体晶格中的三价镧系元素离子的长寿命和阶梯状能级,利用多个光子的连续吸收并释放产生更高能量的光子,所以称为上转换材料 [19] 。一般来说,上转换纳米发光材料主要由主体基质、敏化剂和活化剂三个部分组成。常用的基质材料包括氟化物、氧化物和氯化物等。
5.1. 上转换发光材料的物理化学特性
相比于传统的荧光探针,如有机染料和量子点,上转换发光材料不仅具有狭窄的发射带宽,可调节的发射光谱,高的光稳定性,较长的发光寿命和较低的细胞毒性的优点,而且它在成像过程中没有背景信号,使得它具有非常高的成像灵敏度 [20] 。
5.2. 上转换发光材料的合成方法
目前为止,研究者们已经发明出了很多合成上转换发光纳米材料的方法,主要有水热法,高温热分解法,溶剂热法等。水热法可以在较低的温度下合成结晶良好的结构各异的UCNPs。而高温热分解和溶剂热合成方法可以合成单分散尺寸,高质量的高结晶度和亮的上转换荧光的UCNPs [21] 。然而通过以上方法合成出来的UCNPs,通常因为表面包裹了有机配体而不溶于水,进而影响其临床医学上的应用,所以必须对化学方法合成出来UCNPs进行表面修饰。目前为止,有很多方法被用作修饰 UCNP,包括配位体交换、配位体氧化反应、主客交互作用、层层自组装以及两亲性聚合物和介孔氧化硅包裹法 [22] (图5)。
5.3. 上转换发光材料的应用
上转换发光纳米材料由于具有较高的化学稳定性、窄的带隙发射和良好的光稳定性等优异特性,并且在近红外光的激发下具有良好的组织穿透性、没有背景荧光的干扰、而且对生物体无损伤,在医学影像学等方面有着广阔的应用前景。2008年,张等人首先证明了利用PEI包被的NaYF4:Yb/Er纳米粒子用于动物体内成像的有效性,并显示出比QD更深的组织成像优势 [23] 。众所周知,多色成像是体内同时识别不同组织的有效策略,随着UCNPs的设计和制备技术的提升,上转换发光材料的发射光谱可以很准确的调整,王等人首次利用NaYF4:Yb/Er/La纳米棒进行体内多色成像的研究 [24] 。Liu等人也报道了一个调整发射峰颜色的方法:选择Tm3+或Er3+作为活化剂,Yb3+作为敏化剂,通过改变镧系元素的掺杂浓度,来精细地调节发射峰 [25] 。由于单一成像方式不能获得一个病灶的全部信息,因此多模态成像技术的成为了目前研究的重点。钆(Gd3+)作为一种造影剂被广泛地用于磁共振成像,通过将稀土元素掺杂进含有 Gd的主体基质中,许多上转换材料同时具有了UCL成像和磁共振成像的能力。Hyeon课题组首次使用掺杂稀土元素和钆的上转换复合材料实现了对乳腺癌细胞的双模态成像 [26] 。
6. 半导体量子点
半导体量子点(Quantum Dot,简称QD)是一种由Ⅲ-Ⅴ族和Ⅱ-Ⅵ族元素组成的纳米材料,(如CdTe、CdSe、ZnSe、InAs、InP等)。当半导体晶体颗粒的三个维度的尺寸都不大于该半导体材料的激子波尔半径的两倍时,其电子能级就会由准连续变为分立,晶体颗粒就会处于量子受限(quan-tum confinement)状态,因而也称为量子点 [27] 。
6.1. 半导体量子点的物理化学特性
量子点作为一种荧光物质与传统的荧光试剂相比,有着其独特的一些优点:宽吸收,荧光发射可调,
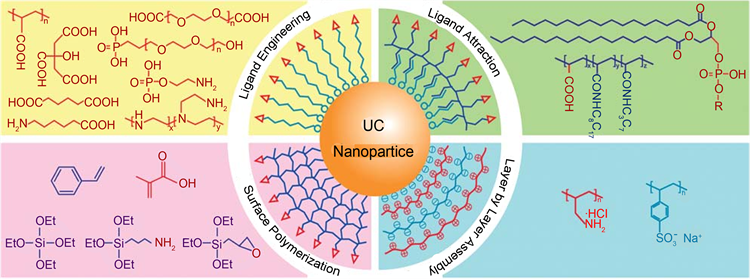
Figure 5. Typical strategies and surface molecules (monomers) used for making hydrophilic UC nanoparticles with pendant functional groups. (Copyright 2010, Royal Society of Chemistry) [22]
图5. 几种典型的上转换发光纳米颗粒表面修饰方法(版权2010,英国皇家化学会) [22]
窄荧光峰,荧光寿命长且稳定。通过改变半导体量子点的大小和组成,可以获得波长从近紫外直到远红外区的荧光。例如,通过改变ZnSe量子点的尺寸,其可以发射从近紫外到蓝色的荧光 [28] ;而不同尺寸的CdSe量子点的可以发射覆盖整个可见光区域的荧光;InAs和InP量子点则分别可以在近红外和远红外发射荧光 [29] 。用量子点代替有机荧光染料,可以提高的荧光成像的效率。大多数有机染料具有窄的吸收波段和宽的荧光发射波段(图6(a)),而量子点可以吸收宽波长范围的光,发射波长范围却非常窄(图6(b)) [30] 。现代医学研究有时往往需要用到多色成像,对于有机染料来说,由于发射波段较宽,很容易出现信号交叠现象,影响其临床上的应用。而使用量子点时,由于具有较窄并且可调的荧光发射,使得多色成像简单可行 [31] 。
6.2. 半导体量子点的合成方法
经过十多年的不断改进,研究者们发明了很多合成量子点的方法,主要有物理法和化学法,且以化学法合成量子点为主。而化学法主要有两种:一种是采用胶体化学的方法在水溶液中合成,另一种是在有机体系中合成。在水溶液中直接合成量子点,具有成本较低、操作简单、易重复、表面性质可控,容易引入功能性基团并且生物相容性好等优点,但在水溶液中合成的量子点的晶化程度较低,荧光效率也不高,并且粒径分布较宽,所以在有机体系中合成量子点的方法得到了发展 [32] 。CdSe纳米晶体的制备是一个最成功的例子。1993年,Bawendi等初次使用三辛基硒化膦和二甲基镉作为前体,并使用三辛基氧化膦作为配位溶剂,合成出具有高发光效率的硒化镉(CdSe)量子点,并且通过离心的方法得到了CdSe纳米颗粒,其量子产率约为10% [33] 。
6.3. 半导体量子点的应用
这些独特的光学特性以及成熟的合成方法使量子点成为了一种良好的荧光探针。1998年,聂书明研究小组合成出了水溶性的半导体量子点,并通过表面活性基团与抗体和核酸等生物分子共价偶联,作为生物探针用作生物标记,实现了半导体量子点在生物学方面的重大突破 [34] 。2004年,其研究小组又首次实现了用量子点同时在活体内的定位和成像,他们将量子点用聚乙二醇修饰后负载在单克隆抗体上,利用其主动靶向的荧光成像来检测获得肿瘤大小和位置的信息 [35] 。总之,随着半导体量子点有关研究的不断深入,它们将会在成像诊断中扮演越来越重要的角色。

Figure 6. Excitation (dashed) and fluorescence (solid) spectra of (a) fluorescein and (b) a typical semiconductor quantum dot sample [30]
图6. 荧光素(a)和半导体量子点(b)的吸收光谱(虚线)和荧光光谱(实线) [30]
7. 两种多种无机纳米材料复合的联合成像
近年来,一系列非侵入性成像技术比如,磁共振成像(magnetic resonance image,MRI),正电子发射断层扫描成像(single-photon emission computed tomography, SPECT),计算机断层扫描成像(computed tomography,CT),光声层析成像(photoacoustic tomography,PAT),光学成像等成像方式已经成为临床上诊断各类疾病至关重要的方法。然而,单一的成像方式不能获得某一病灶的全部信息 [36] 。利用双模态成像方式,可以取长补短,弱化单一成像方式的缺陷,强化不同成像方式的优势。在过去的几年里,科研人员已经成功开发出各种各样功能化结合的纳米复合材料,应用于CT/MRI、荧光/MRI和MRI/SPECT等双模态成像。
7.1. 应用于CT/MRI双模态成像纳米复合材料
核壳结构Fe3O4@Au是目前研究的比较多的CT/MRI双模态造影剂 [37] 。金壳的存在使材料具有很强的CT对比增强效果。而Fe3O4则赋予了材料成为MRI造影剂的能力。朱等人以四水合氯金酸(HAuCl4∙4H2O)为前驱体,在油胺(OAm)中将其还原还原合成了尺寸均一的金纳米颗粒(AuNPs);然后将五羰基铁(Fe(CO)5)高温分解在其表面,成功地合成异质结构的 Au-Fe3O4复合纳米材料 [38] 。体内的实验数据结果表明 Au-Fe3O4纳米复合材料具有较好的 CT/MRI双模态对比增强效果。
7.2. 应用于荧光/MRI双模态成像纳米复合材料
荧光成像是光学活体成像(option in vivo imaging)技术的一种,近年来得到迅猛发展,是生物医学检测领域发展最快的前沿科技之一,它能够在无创条件下对活体进行成像跟踪实时监控。荧光成像和MRI成像具有不同的灵敏度、空间分辨率和成像深度:荧光成像灵敏度高但是空间分辨率有限;MRI能够得到高空间分辨率的非侵入式成像。帅课题组用聚乙二醇和聚已内酯嵌段共聚物制备成胶束,负载上CdSe量子点和SPIO,制备出了同时具有磁学和光学现象效果的纳米颗粒,并对其性能进行了一些研究。其课题组又用合成出的聚乙二醇和聚天冬氨酸嵌段共聚物制备成胶束,并且负载上SPIO和基因药物,用于MRI和生物发光的双模态成像追踪下的诊断与治疗,显示出良好的诊疗一体化效果 [39] 。Hyeon课题组首次将稀土元素掺杂进含有 Gd 的主体基质中制备出了掺杂稀土元素和钆的上转换复合材料,同时具有了上转换荧光成像和磁共振成像的能力 [26] 。
7.3. 应用于SPECT/MRI双模态成像纳米复合材料
SPECT(正电子发射断层扫描成像)是核医学的CT技术,因为它是对从病人体内发射的γ射线成像,故又称发射型计算机断层成像术(Emission Computed Tomography,ECT)。由于MRI的空间分辨率高但是灵敏度低,SPECT的灵敏度高但是分辨率低。利用MRI和SPECT优势互补的特性,将MRI和SPECT这两种成像模式相结合,形成MRI/SPECT双模态成像 [40] 。顾课题组将Fe3O4-Ag磁性纳米颗粒与放射性同位素(125I)相结合,合成出了一种新型的双模态纳米探针——Fe3O4-Ag125I异质结构的纳米颗粒,用于 MRI 和 SPECT 双模态成像。从小鼠体内SPECT图像看出,纳米材料特异性地聚集在肝脾中。这些异质结构复合纳米颗粒将会在成像诊断领域有更广阔的发展空间 [41] 。
8. 结论与展望
多年来,研究人员一直都在探索有应用前景的新方法,以提高癌症等疾病治疗率及影像学研究的有效性。成像技术是推动生物医学研究发展的核心动力,各种对造影材料性能的改进提高了成像的清晰度和分辨率,使医生获得更丰富的成像信息,大大推进了临床医学影像学的发展,而不同成像模式复合的多模态成像,以及成像与治疗结合的诊疗一体化的方式将成为未来无机造影材料研究的重点。
基金项目
本研究获得国家自然科学基金项目(21504082)资助。
文章引用
冯华阳,任苗柠,范冰冰,李景果. 无机纳米材料在成像诊断方面的应用
Application of Inorganic Nanomaterials in Imaging Diagnosis[J]. 物理化学进展, 2018, 07(02): 37-47. https://doi.org/10.12677/JAPC.2018.72005
参考文献
- 1. Park, S., Aalipour, A., Vermesh, O., et al. (2017) Towards Clinically Translatable In Vivo Nanodiagnostics. Nature Reviews Materials, 2, 17014. https://doi.org/10.1038/natrevmats.2017.14
- 2. Hyeon, T., Lee, S.S., Lee, S.S., et al. (2001) Synthesis of Highly Crystalline and Monodisperse Maghemite Nanocrystallites without a Size-Selection Process. Cheminform, 123, 12798. https://doi.org/10.1021/ja016812s
- 3. Song, H.-T., et al. (2005) Surface Modulation of Magnetic Nanocrystals in the Development of Highly Efficient Magnetic Resonance Probes for Intracellular Labeling. Journal of the American Chemical Society, 127, 9992-9993. https://doi.org/10.1021/ja051833y
- 4. Ling, D., Lee, N. and Hyeon, T. (2015) Chemical Synthesis and Assembly of Uniformly Sized Iron Oxide Nanoparticles for Medical Applications. Accounts of Chemical Research, 48, 1276-1285. https://doi.org/10.1021/acs.accounts.5b00038
- 5. Kim, B.H., Lee, N., Kim, H., et al. (2011) Large-Scale Synthesis of Uniform and Extremely Small-Sized Iron Oxide Nanoparticles for High-Resolution T1 Magnetic Resonance Imaging Contrast Agents. Journal of the American Chemical Society, 133, 12624-12631. https://doi.org/10.1021/ja203340u
- 6. Li, Z., Wei, L., Gao, M.Y., et al. (2010) One-Pot Reaction to Synthesize Biocompatible Magnetite Nanoparticles. Advanced Materials, 17, 1001-1005. https://doi.org/10.1002/adma.200401545
- 7. Liong, M., Angelos, S., Choi, E., et al. (2009) Mesostructured Multifunctional Nanoparticles for Imaging and Drug Delivery. Journal of Materials Chemistry, 19, 6251-6257. https://doi.org/10.1039/b902462j
- 8. Chen, Y., Chen, H., Sun, Y., et al. (2011) Multifunctional Mesoporous Composite Nanocapsules for Highly Efficient MRI-Guided High-Intensity Focused Ultrasound Cancer Surgery. Angewandte Chemie, 50, 12505-12509. https://doi.org/10.1002/anie.201106180
- 9. Lee, C.-H., Cheng, S.-H., Wang, Y.-J., et al. (2009) Near-Infrared Mesoporous Silica Nanoparticles for Optical Imaging: Characterization and In Vivo Biodistribution. Advanced Functional Materials, 19, 215-222. https://doi.org/10.1002/adfm.200800753
- 10. 施剑林, 陈雨, 陈航榕. 多功能介孔氧化硅基纳米诊疗剂的研究进展[J]. 无机材料学报, 2013, 28(1): 1-11.
- 11. Phillips, E., Penatemedina, O., Zanzonico, P.B., et al. (2014) Clinical Translation of an Ultrasmall Inorganic Optical-PET Imaging Nanoparticle Probe. Science Translational Medicine, 6, 260ra149. https://doi.org/10.1126/scitranslmed.3009524
- 12. Daniel, M.C. and Astruc, D. (2004) Gold Nanoparticles: Assembly, Supramolecular Chemistry, Quantum-Size-Related Properties, and Applications toward Biology, Catalysis, and Nanotechnology. Chemical Reviews, 104, 293. https://doi.org/10.1021/cr030698+
- 13. Sepúlveda, B., Angelomé, P.C., Lechuga, L.M., et al. (2009) LSPR-Based Nanobiosensors. Nanotoday, 4, 244-251. https://doi.org/10.1016/j.nantod.2009.04.001
- 14. Okuno, M. and Hamaguchi, H. (2010) Multifocus Confocal Raman Microspectroscopy for Fast Multimode Vibrational Imaging of Living Cells. Optics Letters, 35, 4096-4098. https://doi.org/10.1364/OL.35.004096
- 15. Hainfeld, J.F., Slatkin, D.N. and Smilowitz, H.M. (2004) The Use of Gold Nanoparticles to Enhance Radiotherapy in Mice. Physics in Medicine & Biology, 49, 309-315. https://doi.org/10.1088/0031-9155/49/18/N03
- 16. Wang, H., Zheng, L., Guo, R., et al. (2012) Den-drimer-Entrapped Gold Nanoparticles as Potential CT Contrast Agents for Blood Pool Imaging. Nanoscale Research Letters, 7, 1-8. https://doi.org/10.1186/1556-276X-7-190
- 17. Bardhan, R., Lal, S., Joshi, A., et al. (2011) Theranostic Nanoshells: From Probe Design to Imaging and Treatment of Cancer. Accounts of Chemical Research, 44, 936-946. https://doi.org/10.1021/ar200023x
- 18. Yang, X., Stein, E., Wei, X., et al. (2008) Photoacoustic Tomography with Novel Optical Contrast Agents Based on Gold Nanocages or Nanoparticles Containing Near-Infrared Dyes. Proceedings of SPIE—The International Society for Optical Engineering, 6856, 1-10. https://doi.org/10.1117/12.762401
- 19. Chen, G., Qiu, H., Prasad, P.N. and Chen, X. (2014) Upconversion Nanoparticles: Design, Nanochemistry, and Applications in Theranostics. Chemical Reviews, 114, 5161-5214. https://doi.org/10.1021/cr400425h
- 20. Haase, M. and Schfer, H. (2011) Upconverting Nanoparticles. An-gewandte Chemie International Edition, 50, 5808-5829. https://doi.org/10.1002/anie.201005159
- 21. Gu, Z., et al. (2013) Recent Advances in Design and Fabrication of Upconversion Nanoparticles and Their Safe Theranostic Applications. Advanced Materials, 25, 3758-3779. https://doi.org/10.1002/adma.201301197
- 22. Wang, F., Banerjee, D., Liu, Y., et al. (2010) Upconversion Nanoparticles in Biological Labeling, Imaging, and Therapy. Analyst, 135, 1839-1854.
- 23. Chatterjee, D.K., Rufaihah, A.J. and Zhang, Y. (2008) Upconversion Fluorescence Imaging of Cells and Small Animals Using Lanthanide Doped Nanocrystals. Biomaterials, 29, 937. https://doi.org/10.1016/j.biomaterials.2007.10.051
- 24. Yu, X., Li, M., Xie, M., et al. (2010) Dopant-Controlled Synthesis of Water-Soluble Hexagonal NaYF4, Nanorods with Efficient Upconversion Fluorescence for Multicolor Bioimaging. Nano Research, 3, 51-60. https://doi.org/10.1007/s12274-010-1008-2
- 25. Wang, F. and Liu, X. (2008) Upconversion Multicolor Fi-ne-Tuning: Visible to Near-Infrared Emission from Lanthanide-Doped NaYF4 Nanoparticles. Journal of the American Chemical Society, 130, 5642-5643. https://doi.org/10.1021/ja800868a
- 26. Park, Y.I., et al. (2009) Nonblinking and Nonbleaching Upconverting Nanoparticles as an Optical Imaging Nanoprobe and T1 Magnetic Resonance Imaging Contrast Agent. Advanced Materials, 21, 4467-4471. https://doi.org/10.1002/adma.200901356
- 27. 余启钰, 刘春艳. 用于生物标记的半导体量子点研究[J]. 影像科学与光化学, 2006, 24(5): 382-390.
- 28. Hines, M.A. and Guyot-Sionnest, P. (1998) Bright UV-Blue Luminescent Colloidal ZnSe Nanocrystals. The Journal of Physical Chemistry B, 102, 3655-3657.
- 29. Prieto, J.A., Armelles, G., Groenen, J., et al. (1999) Size and Strain Effects in the E1-Like Optical Transitions of InAs/InP Self-Assembled Quantum Dot Structures. Applied Physics Letters, 74, 99-101. https://doi.org/10.1063/1.122963
- 30. Bruchez Jr, M., Moronne, M., Gin, P., Weiss, S. and Alivisatos, A.P. (1998) Semiconductor Nanocrystals as Fluorescent Biological Labels. Science, 281, 2013-2015. https://doi.org/10.1126/science.281.5385.2013
- 31. Han, M., Gao, X., Su, J.Z. and Nie, S. (2001) Quan-tum-Dot-Tagged Microbeads for Multiplexed Optical Coding of Biomolecules. Nature Biotechnology, 19, 631-635. https://doi.org/10.1038/90228
- 32. Gaponik, N., et al. (2002) Efficient Phase Transfer of Luminescent Thi-ol-Capped Nanocrystals: From Water to Nonpolar Organic Solvents. Nano Letters, 2, 803-806. https://doi.org/10.1021/nl025662w
- 33. Murray, C.B., Norris, D.J. and Bawendi, M.G. (1993) Synthesis and Characterization of Nearly Monodisperse Semiconductor Nanocrystallites. Journal of the American Chemical Society, 115, 8706-8715. https://doi.org/10.1021/ja00072a025
- 34. Robert, E.B., Andrew, M.S. and Nie, S.M. (2004) Quantum Dots in Biology and Medicine. Journal of Physics E, 25, 1-12.
- 35. Gao, X., Cui, Y., Levenson, R.M., et al. (2004) In Vivo Cancer Targeting and Imaging with Semiconductor Quantum Dot. Nature Biotechnology, 22, 969-976. https://doi.org/10.1038/nbt994
- 36. Louie, A. (2010) Multimodality Imaging Probes: Design and Challenges. Chemical Reviews, 110, 3146-3195. https://doi.org/10.1021/cr9003538
- 37. Kim, D., Yu, M.K., Lee, T.S., et al. (2011) Amphiphilic Polymer-Coated Hybrid Nanoparticles as CT/MRI Dual Contrast Agents. Nanotechnology, 22, 155101. https://doi.org/10.1088/0957-4484/22/15/155101
- 38. Zhu, J., Lu, Y., Li, Y., et al. (2014) Synthesis of Au-Fe3O4 Heterostructured Nanoparticles for In Vivo Computed Tomography and Magnetic Resonance Dual Model Imaging. Nanoscale, 6, 199. https://doi.org/10.1039/C3NR04730J
- 39. Wu, C., Li, J., Pang, P., et al. (2014) Polymeric Vector-Mediated Gene Transfection of MSCs for Dual Bioluminescent and MRI Tracking In Vivo. Biomaterials, 35, 8249-8260. https://doi.org/10.1016/j.biomaterials.2014.06.014
- 40. Suchý, M., Bartha, R. and Hudson, R.H.E. (2013) “Click” Chemistry toward Bis(DOTA-Derived) Heterometallic Complexes: Potential Bimodal MRI/PET(SPECT) Molecular Imaging Probes. RSC Advances, 3, 3249-3259. https://doi.org/10.1039/c3ra23260c
- 41. Zhu, J., Zhang, B., Tian, J., et al. (2015) Synthesis of Heterodimer Radionuclide Nanoparticles for Magnetic Resonance and Single-Photon Emission Computed Tomography Dual-Modality Imaging. Nanoscale, 7, 3392-3395. https://doi.org/10.1039/C4NR07255C
NOTES
*通讯作者。