Journal of Advances in Physical Chemistry
Vol.
09
No.
04
(
2020
), Article ID:
38941
,
7
pages
10.12677/JAPC.2020.94004
甲醛在单层六方氮化硼的吸附
吕乃霞,顾登,赵方玉
兴义民族师范学院生物与化学学院,贵州 兴义

收稿日期:2020年11月5日;录用日期:2020年11月20日;发布日期:2020年11月27日

摘要
采用密度泛函方法计算了甲醛在完整六方氮化硼表面及缺陷表面的吸附,结果表明,甲醛在B边位吸附能力最强,其次为N空位及N边位。椅式边位也可形成较强的化学吸附,但是在完整表面及B空位只能形成弱的物理吸附。因此,包含缺陷位的六方氮化硼有望成为消除或检测甲醛气体的潜在材料。
关键词
密度泛函,甲醛,六方氮化硼,吸附
The Adsorption of Formaldehyde on the Hexagonal Boron Nitride Monolayer
Naixia Lv, Deng Gu, Fangyu Zhao
College of Biology and Chemistry, Xingyi Normal University for Nationalities, Xingyi Guizhou

Received: Nov. 5th, 2020; accepted: Nov. 20th, 2020; published: Nov. 27th, 2020

ABSTRACT
The adsorption of formaldehyde on the hexagonal boron nitride has been studied by density functional theory. The calculation results indicate the B-edge sites are the favorite sites for H2CO binding, then are the N-vacancy and N-edge sites. The trapping of H2CO on the arm-edge is also strong, however, the weak interactions can be observed on the pristine and B-vacancy sites of h-BN. The h-BN involving defects will be expected a potential nanomaterial for the formaldehyde removing or detecting.
Keywords:Density Functional, Formaldehyde, h-BN, Adsorption

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
近年来,六方氮化硼(h-BN)作为一种新型二维材料,其特殊的机械性能及电子性质引起了人们的关注 [1] [2] [3]。单层的h-BN结构与石墨烯类似,B、N原子交替排列形成正六边形。h-BN的热稳定性、绝缘性、宽带隙等特点使它在材料领域有许多潜在的应用。特别是它的高比表面积,使其成为气敏传感器的理想材料之一。目前,已有许多研究报道了掺杂h-BN的气敏特性 [4] [5] [6] [7] [8]。借助于密度泛函理论(DFT) Samadizadeh [4] 等研究了掺杂Al的氮化硼对N2O气体分子的吸附;Zhang等 [5] 利用第一性原理的研究表明CO在缺陷位及Al掺杂的氮化硼纳米片上,可形成稳定的化学作用。因此h-BN在电子器件及气体传感领域有广阔的应用前景。
甲醛(H2CO)是一种常见的室内污染气体,能引发包括白血病在内的多种疾病,严重危害人们的健康。目前已有文献 [9] [10] [11] [12] [13] 报道氮化硼应用于甲醛的吸附。例如,Ye的实验表明h-BN材料对H2CO表现出超高的吸附性能 [9]。Noorizadeh [10] 的理论计算表明H2CO在氮化硼完美表面吸附作用很小,但是在Al掺杂表面形成较强的吸附。Cuba-Supanta等 [11] 计算了H2CO在氢化的h-BN的吸附,计算表明H2CO容易吸附在B端裸露的表面。实际的氮化硼纳米材料可能存在结构上的缺陷,例如空位、边位、吸附原子等,这些缺陷位点对纳米材料的化学性质有显著的影响 [14] [15] [16] [17] [18]。因此本文考察了H2CO在完整的h-BN表面及各种缺陷位的吸附情况,旨在探究H2CO在h-BN吸附的可能性,为设计氮化硼基甲醛检测及消除的新型分子器件提供理论依据。
2. 计算模型与计算方法
选用B27N27簇模型模拟h-BN单层,边缘的原子全部用H原子饱和,如图1(a)所示。在此模型的基础上,分别去掉一个中心N或B原子,可得到N及B空位的模型,分别为图1(b)~(c)。图1(d)~(f)分别用于模拟h-BN的椅式边位、N边位及B边位。
选用色散矫正的密度泛函方法(B3LYP + D3),采用6-311G(d, p)基组进行计算。对所有的原子坐标进行全优化,并结合频率确认该结构没有虚频。计算采用Gaussian16程序包完成 [19]。
吸附能用公式(1)计算:
(1)
其中,E(H2CO_h-BN)代表甲醛吸附在氮化硼的总能量,E(H2CO)代表甲醛分子的总能量,E(h-BN)代表六方氮化硼的总能量。由此公式定义的吸附能负值表示热力学稳定的体系。
3. 计算结果与讨论
3.1. 计算模型的优化结构
图1(a)为完整的h-BN单层结构,计算所得B-N键长为1.448 Å,与实验值1.44 Å [17] 接近。图1(b)、(c)分别为N、B空缺位结构。两个空缺位构型仍基本保持平面构型,并没有发生重构。在N空位构型中,三个相邻的B-B键长分别为2.273 Å、2.273 Å及2.291 Å。在B空位构型中,三个相邻的N-N键长分别为2.739 Å 2.739 Å及2.833 Å,与文献报道较为一致 [18]。图1(d)~(f)为椅式边位、N边位及B边位。从优化构型来看,椅式边位稍有变形:B-N键长为1.295 Å,与完整表面的B-N键长相比,缩短了0.153 Å,这可能是由于边位的B原子上有悬空键,更易与附近的N原子成键。另外值得注意的是,边位上的B-N键不再保持水平,其中的N原子相对于B原子略有上移。图1(e)为N边位的优化构型,边位的B-N键长为1.422 Å,与完整表面的B-N键相差不大。图1(f)为B边位的优化构型,相邻的两个B-N键长分别为1.371 Å及1.481 Å。
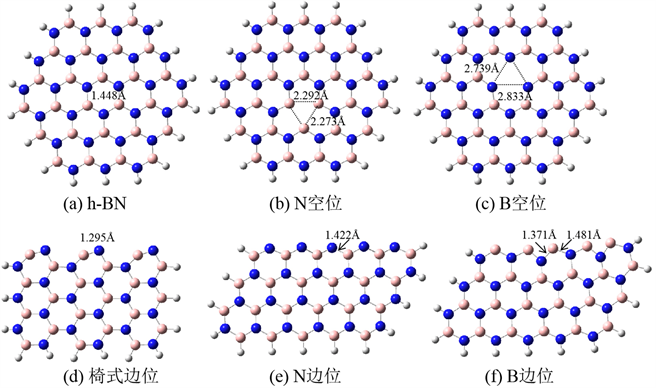
Figure 1. The optimized structures of the computational models
图1. 计算模型的优化结构
3.2. 甲醛在完美氮化硼表面及边位氮化硼上的吸附
图2给出了甲醛(H2CO)在完美及边位h-BN的吸附构型,表1给出了相应的吸附能。图2(a)为甲醛在完美h-BN表面的吸附结构。甲醛分子以垂直方式吸附于BN表面,吸附高度为2.939 Å,吸附能仅为3.4 kcal/mol,是较弱的物理吸附。
图2(b)为甲醛在N边位的吸附构型。甲醛分子中的羰基吸附在相邻的两个边位N上,形成五元环的吸附构型,并且形成的C-N及O-N吸附距离较短,分别为1.461、1.431 Å。吸附后甲醛分子的构型变化较大,C=O键长由气相的1.207 Å拉伸到1.457 Å。说明羰基上的双键已被破坏,原来的平面构型转变为三角锥形,因此吸附后C原子的杂化类型由原来的sp2转变为sp3杂化。从吸附能来看,甲醛吸附后放热69.6 kcal/mol,是强的化学吸附。因此N边位是较好的吸附位点。
图2(c)为甲醛在B边位的吸附构型。与N边位的吸附构型类似,甲醛在B边位也形成五元环的吸附构型,形成的C-B及O-B吸附距离分别为1.608、1.370 Å。其中B-O键长接近HBO3中的B-O键长1.361 Å [20],因此可认为形成了较强的B-O键。吸附后甲醛中的羰基键长为1.474 Å,说明原来的双键已经被破坏,甲醛不再是平面构型。计算得到的吸附能为−131.5 kcal/mol,是非常强的化学吸附。因此B边位对甲醛的吸附能力比N边位更强。这可能是B边位容易形成稳定的B-O键导致的。
图2(d~f)为甲醛在椅式边位的吸附构型。其中,(d)是甲醛以O原子吸附在B位,形成的B-O距离为1.588 Å,甲醛中的C=O键长为1.233 Å,与气相相比相差不大,甲醛仍保持平面构型,可以推测此吸附的吸附强度不大。计算的吸附能为−17.9 kcal/mol,与上述边位的吸附能相比较弱,但仍为化学吸附。(e)是甲醛以C=O基吸附在两个相邻的BN结构单元的B和N原子上,形成六元环的结构。甲醛分子中的C=O键拉伸为1.358 Å,且吸附后变为非平面型,可以推测是较强的化学吸附,吸附能为−34.7 kcal/mol也印证了这一点。(f)是甲醛分子以C=O基吸附在BN的一个六边形结构单元上,形成四元环的结构。C-N及O-B吸附距离分别为1.459、1.399 Å,甲醛中的C=O键长伸长到1.456 Å,H2CO不再保持平面构型,说明吸附作用非常强烈,导致甲醛中的双键被破坏。吸附能为−55.5 kcal/mol,是较强的化学吸附。
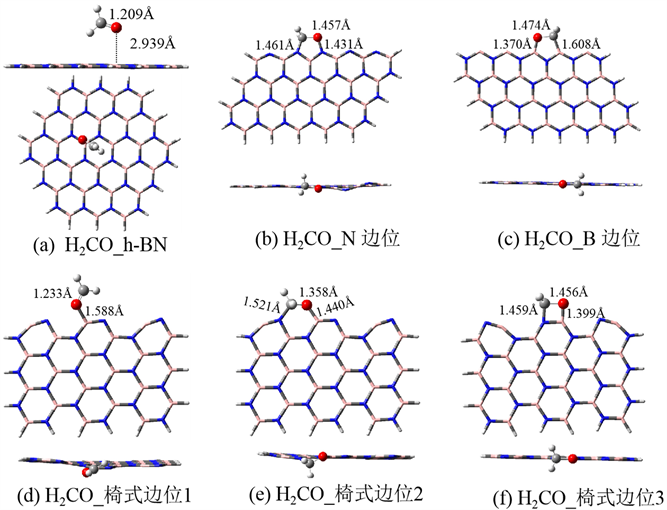
Figure 2. The adsorption structures of formaldehyde on the perfect and edge sites of h-BN
图2. 甲醛(H2CO)在h-BN完整表面及边位的吸附构型
3.3. 甲醛在h-BN空缺位的吸附
图3为甲醛在氮化硼空缺位的吸附构型。图3(a)为甲醛在B空位的吸附结构,甲醛近似平行地吸附在B空位,但是吸附后甲醛的结构几乎没有变化,吸附高度为2.869 Å,吸附能为−4.8 kcal/mol,是弱的物理吸附。与B空位的吸附完全不同,甲醛在N空位的吸附构型如图3(b)所示。甲醛以C-O端吸附在空缺位的两个相邻的B原子上,吸附后甲醛的C=O键长削弱,拉伸到1.437 Å;形成了一个新的B-O键,键长为1.373 Å。因此,甲醛在N空位的吸附很强,吸附能为−75.6 kcal/mol。甲醛在两个空缺位的吸附完全不同,这可能是由于B及N缺位的电子结构完全不同引起的 [21]。另外,N空位容易形成B-O键,导致吸附更易进行。
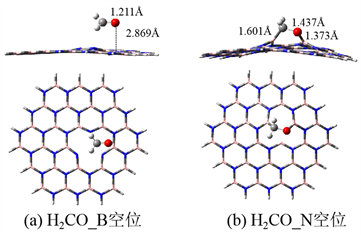
Figure 3. The adsorption structures of formaldehyde on the vacancy of h-BN
图3. 甲醛(H2CO)在h-BN空位的吸附构型
计算表明,甲醛在h-BN的完整表面的吸附较弱,但是h-BN可能存在丰富的边位不饱和位及点缺陷位,使得H2CO容易在这些位置被捕获,形成稳定的化学吸附。在本文讨论的缺陷位中,B边位对甲醛的吸附能最大,其次为N空位,N边位,及椅式边位。虽然椅式边位的吸附相对较弱,但是,椅式边位可以提供丰富的吸附位点,使得H2CO容易在此位置吸附。从吸附构型来看化学吸附会导致H2CO的C=O削弱,C的杂化由sp2转变为sp3,吸附后H2CO不再是平面构型。吸附过程中一旦形成B-O键,会导致能量下降,体系更为稳定,因此是形成化学吸附的主要驱动力。
从表1可以看出,稳定的吸附体系均伴随明显的电子转移。比如当甲醛吸附在B边位、N空位时,甲醛分子明显带负电,说明电荷由h-BN体系向吸附物种转移,导致较强的吸附作用。当甲醛吸附在N边位、椅式位1时,甲醛分子带正电,说明电荷由甲醛向氮化硼体系转移。因此不管电荷转移的方向如何,只要发生明显的电荷转移,将导致较强的化学吸附。
Table 1. The adsorption energy, adsorption distance and charges for H2CO on h-BN
表1. H2CO在h-BN的吸附能、吸附高度及电荷
4. 结论
本文利用密度泛函B3LYP方法计算了甲醛在h-BN表面及缺陷位的吸附构型及吸附能。计算表明,甲醛在完整表面的吸附能力很弱,但是在不饱和位及缺陷位吸附较强,能形成有效的化学吸附。按照吸附能大小,甲醛在缺陷位的吸附由强到弱依次为B边位 > N空位 > N边位 > 椅式边位。因此有望设计以h-BN为基底的甲醛检测或消除材料。
致谢
感谢江苏大学高性能计算平台。
基金项目
黔西南州科技项目(2019-2-51);贵州省普通高等学校青年科技人才成长项目黔教合(KY字[2019]220)。
文章引用
吕乃霞,顾 登,赵方玉. 甲醛在单层六方氮化硼的吸附
The Adsorption of Formaldehyde on the Hexagonal Boron Nitride onolayer[J]. 物理化学进展, 2020, 09(04): 31-37. https://doi.org/10.12677/JAPC.2020.94004
参考文献
- 1. 李秀玲, 武晓君. 低维氮化硼纳米材料[J]. 中国科学技术大学学报, 2014, 44(5): 389-402.
- 2. Jiang, X.F., Weng, Q., Wang, X.B., et al. (2015) Recent Progress on Fabrications and Applications of Boron Nitride Nanomaterials: A Review. Journal of Materials Science & Technology, 31, 589-598. https://doi.org/10.1016/j.jmst.2014.12.008
- 3. Deng, D., Novoselov, K.S., Fu, Q., et al. (2016) Catalysis with Two-Dimensional Materials and Their Heterostructures. Nature Nanotechnology, 11, 218-230. https://doi.org/10.1038/nnano.2015.340
- 4. Samadizadeh, M., Peyghan, A.A. and Rastegar, S.F. (2015) Sensing Behavior of BN Nanosheet toward Nitrous Oxide: A DFT Study. Chinese Chemical Letters, 8, 1042-1045. https://doi.org/10.1016/j.cclet.2015.05.048
- 5. Zhang, Y.H., Zhou, K.G., Gou, X.C., et al. (2010) Effects of Dopant and Defect on the Adsorption of Carbon Monoxide on Graphitic Boron Nitride Sheet: A First-Principles Study. Chemical Physics Letter, 484, 266-270. https://doi.org/10.1016/j.cplett.2009.11.051
- 6. Behmagham, F., Vessally, E., Massoumi, B., et al. (2016) A Computational Study on the SO2 Adsorption by the Pristine, Al, and Si Doped BN Nanosheets. Superlattices and Microstructures, 100, 350-357. https://doi.org/10.1016/j.spmi.2016.09.040
- 7. Li, H., Chen, Z., Fang, X., et al. (2015) Absorption of NH3 on Pristine and Defected Boron Nitride Nanosheets: A First Principle Study. Superlattices and Microstructures, 88, 371-376. https://doi.org/10.1016/j.spmi.2015.09.035
- 8. 王若曦, 张冬菊, 刘成卜. 钴掺杂氮化硼纳米管吸附氯酚类污染物的理论研究[J]. 物理化学学报, 2015, 31(5): 877-884.
- 9. Ye, J.W., Zhu, X.F., Cheng, B., et al. (2017) Few-Layered Graphene-Like Boron Nitride: A Highly Efficient Adsorbent for Indoor Formaldehyde Removal. Environmental Science & Technology Letters, 4, 20-25. https://doi.org/10.1021/acs.estlett.6b00426
- 10. Noorizadeh, S. and Shakerzadeh, E. (2012) Formaldehyde Adsorption on Pristine, Al-Doped and Mono-Vacancy Defected Boron Nitride Nanosheets: A First Principles Study. Computational Materials Science, 56, 122-130. https://doi.org/10.1016/j.commatsci.2012.01.017
- 11. Cuba-Supanta, G., Guerrero-Sánchez, J., Rojas-Tapia, J., et al. (2019) Formaldehyde Trapping by Radical Initiated Reaction on Hydrogenated Boron Nitride. Applied Surface Science, 484, 470-478. https://doi.org/10.1016/j.apsusc.2019.04.001
- 12. Liu, S.Y., Jiao, X.Q. and Zhang, G.Y. (2019) First Principle Study of the Adsorption of Formaldehyde Molecule on Intrinsic and Doped BN Sheet. Chemical Physics Letters, 726, 77-82. https://doi.org/10.1016/j.cplett.2019.04.041
- 13. Shakerzadeh, E. (2016) A DFT Study on the Formaldehyde (H2CO and (H2CO)2) Monitoring Using Pristine B12N12 Nanocluster. Physica E, 78, 1-9. https://doi.org/10.1016/j.physe.2015.11.038
- 14. Arabieh, M. and Taghipour, Y. (2018) Adsorption Modes of Molecular Iodine on Defected Boron Nitrides: A DFT Study. Applied Surface Science, 434, 604-612. https://doi.org/10.1016/j.apsusc.2017.10.232
- 15. Lv, N.X., Sun, L.H., Chen, L.L., et al. (2019) The Mechanism of Thiophene Oxidation on Metal Free Two-Dimensional Hexagonal Boron Nitride. Physical Chemistry Chemical Physics, 21, 21867-21874. https://doi.org/10.1039/C9CP03758F
- 16. Rajendran, A., Fan, H.X., Feng, J., et al. (2020) Desulfurization on Boron Nitride and Boron Nitride-Based Materials. Chemistry—An Asian Journal, 15, 2038-2059. https://doi.org/10.1002/asia.202000479
- 17. Stehle, Y., Meyer, H.M., Unocic, R.R., et al. (2015) Synthesis of Hexagonal Boron Nitride Monolayer: Control of Nucleation and Crystal Morphology. Chemistry of Materials, 27, 8041-8047. https://doi.org/10.1021/acs.chemmater.5b03607
- 18. Azevedo, S., Kaschny, J.R. and de Castilho, C.M.C. (2007) A Theoretical Investigation of Defects in a Boron Nitride Monolayer. Nanotechnology, 18, Article ID: 495707. https://doi.org/10.1088/0957-4484/18/49/495707
- 19. Frisch, M.J., Trucks, G.W., Schlegel, H.B., et al. (2016) Gaussian. 16 Edition, Gaussian, Inc., Wallingford.
- 20. 刘影, 郝伟, 卢昊. 硼酸晶体结构分析及拉曼光谱测试[J]. 光散射学报, 2014, 26(2): 144-147.
- 21. Azevedo, S., Kaschny, J.R., de Castilho, C.M.C., et al. (2009) Electronic Structure of Defects in a Boron Nitride Monolayer. The European Physical Journal B, 67, 507-512. https://doi.org/10.1140/epjb/e2009-00043-5
