Asian Case Reports in Oncology
Vol.05 No.02(2016), Article ID:18149,12
pages
10.12677/ACRPO.2016.52003
Study of Perpheral Neutrophil to Lymphocyte Ratio (NLR) in Different Stages Prognosis of Colorectal Cancer
Duanduan Yin1, Zhenzhen Wang2, Yanhong Yang1*, Qianying Li2, Bo Feng2, Yue Feng2, Xiaoyu Wang2
1The First Hospital of Qinhuangdao, Qinhuangdao Hebei
2Chengde Medical College Graduate School, Chengde Hebei

Received: Jul. 8th, 2016; accepted: Jul. 22nd, 2016; published: Jul. 29th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: The study investigates NLR to evaluate at different stages prognosis of colorectal cancer, then provides individualized treatment and prolong survival theoretical basis for colorectal cancer patients. Methods: Add up all colorectal cancer patients who meet the requirements, and choose NLR = 2.54 as study intercept according to the ROC curve. All the patients were divided into low NLR and high NLR groups, then clinical features and prognosis of survival of the two groups would be compared. Results: Univariate analysis showed that: There was no significant difference in the basic features besides age between low NLR and high NLR groups (P < 0.05). There was statistically significant difference in clinical features (white blood cell count before treatment, TNM staging) between the two groups (P < 0.05). There were statistically significant differences in 1- and 3-year survival rate, overall survival (OS) and 3-year progression-free survival (PFS) between the two groups (P < 0.05). Multivariate analysis confirmed: NLR and TNM staging were independent risk factors for colorectal cancer prognosis. Conclusion: NLR is correlated with age, the white blood cell count before treatment and TNM staging in prognostic factors of colorectal cancer.
Keywords:Colorectal Cancer, Neutrophil/Lymphocyte Ratio (NLR), Prognostic Factors, Overall Survival, Progression Free Survival

外周血中性粒细胞与淋巴细胞比值(NLR)与结直肠癌不同期别预后的研究
尹端端1,王真真2,杨雁鸿1*,李倩影2,冯博2,冯悦2,王小玉2
1秦皇岛市第一医院,河北 秦皇岛
2承德医学院研究生院,河北 承德
Email: *17090070599@163.com
收稿日期:2016年7月8日;录用日期:2016年7月22日;发布日期:2016年7月29日

摘 要
目的:探讨NLR评价结直肠癌不同分期预后的价值,为结直肠癌患者开展个体化治疗、延长生存期提供理论依据。方法:统计符合要求的结直肠癌患者,依据ROC曲线取得NLR = 2.54值为本课题的研究截点,并分为低、高NLR两组,比较两组患者在临床特征及预后生存期的差异。结果:单因素分析证实:低、高NLR组在除年龄外的其他基本特征间差异无统计学意义(P < 0.05);在临床特征(治疗前白细胞计数、TNM分期)方面比较差异有统计学意义(P < 0.05);治疗前低NLR组与高NLR组患者的1、3年生存率、总生存期(OS)、3年无进展生存期(PFS)差异均有统计学意义(P < 0.05)。多因素分析证实:NLR和TNM分期方法分别是结直肠癌的独立危险预后因素。结论:NLR与结直肠癌相关预后因素中的年龄、治疗前白细胞计数、TNM分期相关。
关键词 :结直肠癌,中性粒细胞/淋巴细胞比值(NLR),预后因素,总生存期,无进展生存期

1. 引言
目前越来越多的证据支持的肿瘤相关系统性炎症反应在癌症进展中不可小觑的地位 [1] 。NLR定义为外周血中性粒细胞绝对值与淋巴细胞绝对值的比值,是可以客观反映机体内环境中炎症的动态指标。因其相对容易评估,在结直肠癌的个性化风险评估取得一席之地。最新研究指出,中性粒细胞与淋巴细胞的生物学特征对肿瘤进展预后影响重大。这使得我们有必要对以中性粒细胞及淋巴细胞为代表的炎症因素在肿瘤相关预后炎症中的作用进行客观评价。目前多项临床研究发现,外周血NLR水平与乳腺癌 [2] 、青年肝癌 [3] 、胃肠间质瘤 [4] 、宫颈癌 [5] 等多种肿瘤预后相关。综上,有越来越多的证据表明,NLR水平可用于预测多种类型的癌症的生存期。
本论文研究目的即探讨外周血中性粒细胞/淋巴细胞比值(NLR)与结直肠癌临床特征相关性以及总生存期(OS)、无进展生存期(PFS)之存在相关性,客观评价外周血NLR水平在结直肠癌患者中的预后价值。
2. 材料与方法
2.1. 临床资料
回顾性分析选取2006年10月1日至2012年10月1日于秦皇岛市第一医院确诊且治疗随访资料完整的结直肠癌患者,其中直肠癌患者共359例,其中男性患者204例,女性患者155例。均接受本院系统治疗前均未接受过化学治疗、放射治疗、生物免疫学治疗、手术治疗以及其他抗肿瘤治疗和(或)影响血细胞计数指标的治疗的首诊首治患者;依据组织病理学证实为结直肠癌;静脉血采集规定时限为治疗前1周内;各项血常规计数正常(白细胞、中性粒细胞及淋巴细胞绝对值计数正常),无感染等因素影响;血液学、肝肾功能正常,无免疫系统疾病及严重的内科疾病;接受正规治疗且完成相应疗程并进行有效评价;随访3年或随访期间因本病死亡,随访结果可靠完整。
2.2. 纳入标准
就诊于秦皇岛市第一医院,接受本院系统治疗前均未接受过化学治疗、放射治疗、生物免疫学治疗、手术治疗以及其他抗肿瘤治疗和(或)影响血细胞计数指标的治疗的首诊首治患者;依据组织病理学证实为结直肠癌;静脉血采集规定时限为治疗前1周内;各项血常规计数正常(白细胞、中性粒细胞及淋巴细胞绝对值计数正常),无感染等因素影响;血液学、肝肾功能正常,无免疫系统疾病及严重的内科疾病;接受正规治疗且完成相应疗程并进行有效评价;随访3年或随访期间因本病死亡,随访结果可靠完整。
2.3. 排除标准
患有两种或两种以上原发肿瘤;治疗过程中出现不可逆转的重度骨髓抑制、感染等重大并发症;未完成规定治疗疗程及未按医嘱进行正规治疗;已行血常规检查因检验问题出现差异而影响结果;无完整的随访及治疗资料;无治疗完整的血常规检查结果。
2.4. 数据收集及记录
收集结直肠癌患者基本特征方面资料——性别、年龄、肿瘤史、吸烟史、饮酒史、家族史;临床病例特征资料——治疗前白细胞计数、TNM分期(病理分期采取美国联合肿瘤委员会AJCC第七版)、CEA、CA-199;治疗方法——根治术、姑息术、化疗;总生存期;无进展生存期。
治疗前1周内采集静脉血,以流式细胞技术法检测血常规(采用法国ABX五分类血细胞计数仪RENTRA 60分析血样),得出白细胞、中性粒细胞和淋巴细胞三种细胞绝对值。根据公式得出外周血NLR值(NLR = 中性粒细胞绝对值/淋巴细胞绝对值)。
2.5. 观察指标及随访
所有观察对象均经正规方案治疗,且完成相应治疗并经有效评价。所有患者以电话、短信、住院病历资料等方式定期随访,每位患者确诊第一、第二年每三个月全面复查一次,第三年每半年全面复查一次,评价病情变化以影像学及病理学为主要依据,病情进展通过CT、核磁共振、超声、内镜、PET/CT以及病理活检中至少一项证实,随访日期截止至2015年10月1日。
总生存期(OS)指从该患者确诊为结直肠癌直至因该病死亡或随访结束的总时间。无进展生存期(PFS)是指从确诊为结直肠癌直至经影像学(MRI、CT、超声、PET/CT、骨ECT等)、内镜或病理学确诊病情进展或患者死亡的总时间。
2.6. NLR临界值的确定
SPSS 19.0建立受试者工作特征曲线(receiver operating characteristic curve, ROC曲线),兼顾敏感性和特异性,约登指数(Youden index)最大的切点为临界点,确定NLR临界值。依据外周血NLR值评估患者总体生存情况的ROC曲线,当NLR = 2.54时,灵敏度为54.46%,特异度为65.89%,临界值最大为0.20。NLR对预后生存情况ROC曲线下面积为0.60 (P < 0.05),具有一定的诊断意义。依据ROC曲线NLR = 2.54,将359例的结直肠癌患者分为两组,低NLR组:NLR ≤ 2.54者为216例;高NLR组:NLR > 2.54者为143例(具体详见表1、图1)。
2.7. 统计分析
SPSS 19.0软件统计分析,分类资料比较采用χ2检验或Fisher确切概率法,组间计数、计量资料比较采用χ2检验或t检验。采用生存分析采用Kaplan-Meier描绘生存曲线,Log-rank检验比较不同组之间生存差异;多因素分析采用Cox比例风险模型。统计分析认为P < 0.05为差异有统计学意义。
3. 结果
3.1. 低NLR组与高NLR组在基本特征方面的比较
本研究符合标准入组病例共359例,其中男性204例,女性155例,年龄分布为29~94岁。收集两组患者完整病例资料、治疗资料及随访情况。通过观察及对比两组患者在年龄、性别、肿瘤史、吸烟史、饮酒史、家族史的差异,得出结论。结果显示两组在年龄差异存在统计学意义(P < 0.05),性别、肿瘤史、吸烟史、饮酒史、家族史两组比较均无统计学差异(具体详见表2)。
3.2. 低NLR组与高NLR组临床病例特征方面的比较
治疗前白细胞计数、TNM分期方面比较,两组差异均有统计学意义(P < 0.05) (具体详见表3)。

Figure 1. Colorectal cancer area under the ROC curve and its hypothesis testing
图1. ROC曲线下的大肠癌面积及其假设检验
Table 1. The area under the ROC curve test
表1. ROC曲线试验下的面积
Table 2. Basic characteristics of low NLR group and high NLR group
表2. 低NLR组和高NLR组基本特征
Table 3. Low NLR group compared with high NLR group in the clinical cases features
表3. 低NLR组高NLR组临床特征比较
3.3. 低NLR组与高NLR组生存分析
3.3.1. 总体生存分析
(1) 1年生存分析
通过观察359例患者1年生存情况,得出以下结论:总体1年生存率为94.70%。其中低NLR组216例,1年生存率为99.53%;高NLR组143例,1年生存率为87.41%,两组1年生存率比较差异具有统计学意义(P < 0.05)。低NLR组平均生存时间为11.98个月,高NLR组为11.44个月。1年总生存期曲线差异存在统计学意义(P < 0.05) (表4、图2)。
(2) 3年生存分析
通过观察359例患者3年生存情况,得出以下结果:总体3年生存率为69.80%。其中低NLR组216例,3年生存率为78.70%,高NLR组143例,3年生存率为61.53%,两组3年生存率比较差异具有统计学意义(P < 0.05);低NLR组平均生存时间为33.11个月,高NLR组为27.99个月。3年总生存期曲线差异存在统计学意义(P < 0.05) (具体详见表5、图3)。

Figure 2. 1-year overall survival of low NLR group and high NLR group
图2. 低NLR组和高NLR组1年总生存率

Figure 3. 3-year overall survival of low NLR group and high NLR group
图3. 低NLR组和高NLR组3年总体生存率
Table 4. 1-year overall survival of low NLR group and high NLR group
表4. 低NLR组和高NLR组1年总生存率
Table 5. 3-year overall survival of low NLR group and high NLR group
表5. 低NLR组和高NLR组3年总生存率
3.3.2. 3年无进展生存期分析
通过观察359例患者3年无进展生存情况,得出以下结果:低NLR组的3年无进展生存时间分别为23.21个月,高NLR组为18.37个月,两组无进展生存期比较差异存在统计学意义(P < 0.05)。3年无进展生存期曲线差异存在统计学意义(P < 0.05) (具体详见表6、图4)。
3.3.3. 不同治疗方法对于结肠癌患者3年生存分析
各种不同治疗方法比较,经根治术治疗低、高NLR两组3年生存率分别为82.14%、65.29%,低NLR组患者3年生存率显著升高,优于高NLR组,差异存在统计学意义(P < 0.05)。姑息术及化疗3年生存率比较差异无统计学意义(具体详见表7)。
3.4. 低NLR组与高NLR组预后因素Cox回归分析
多因素分析结直肠癌患者的预后风险因素。将影响患者预后的临床病例参数包括NLR、TNM分期、治疗方法引入Cox风险比例模型进行多因素分析。分析结果显示,有统计学证据表明NLR > 2.54的确是结直肠癌患者的独立危险预后因素之一。另外,TNM分期也是结直肠癌患者的独立危险预后因素(具体详见表8)。
4. 讨论
回顾性分析秦皇岛市第一医院359例患者外周血NLR与结直肠癌预后相关性,我们发现NLR与肿瘤的预后相关并且是独立的不良预后因素。面对结直肠癌不断攀升的发病率及死亡率,可否将外周血NLR作为结直肠癌预后相关指标,讨论如下。
Hanahan和Weinberg曾提出癌症的6大标志:失控的复制、促血管生成、逃脱凋亡、自身有足够的生长信号、对生长抑制剂不敏感以及侵袭转移。目前肿瘤学研究学者建议加入一条:癌症相关炎症。因为炎症微环境是促癌发生转移的重要因素 [6] 。肿瘤宿主免疫状况是肿瘤炎症微环境中影响肿瘤进展的重要一环 [7] 。肿瘤细胞、正常组织细胞、间质细胞、炎性细胞等细胞群组构成肿瘤微环境,经细胞因子、信号通路、信号传导等相互作用建立复杂的调控机制 [8] ,在肿瘤的免疫应答过程中炎症免疫细胞发挥着不同的功效 [9] 。主流观点认为肿瘤病理、分化程度、转移程度、TNM分期等诸多因素影响肿瘤预后。有大量文献表明,机体炎性反应与肿瘤预后存在相关性,肿瘤患者预后、生存质量与机体自身的炎症状态息息相关 [10] 。如同“血管生成抑制剂有时会促进肿瘤播散” [11] ,肿瘤相关炎症细胞既能吞噬杀灭防御
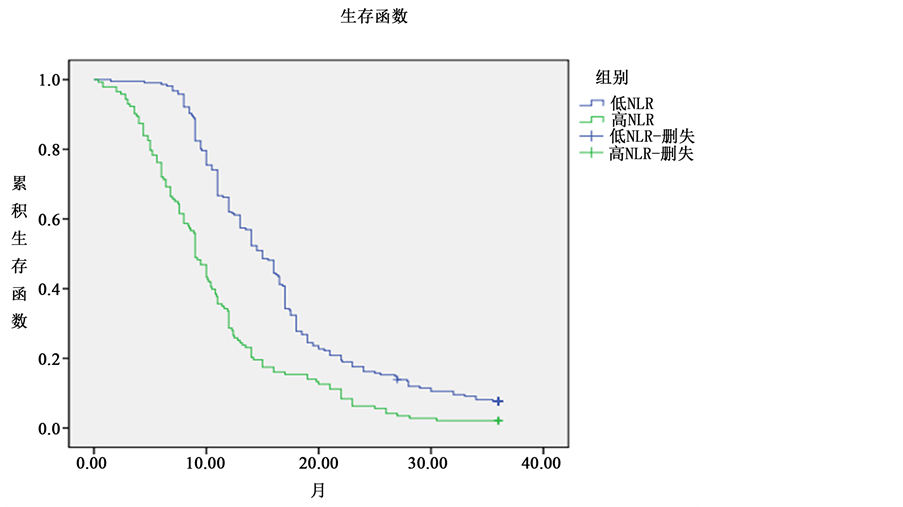
Figure 4. Progression free survival of low NLR group and high NLR group
图4. 低NLR组和高NLR组的无进展生存期
Table 6. 3-year progression free survival of low NLR group and high NLR group
表6. 低NLR组和高NLR组3年无进展生存率
Table 7. Survival rate of low NLR group and high NLR group in different treatments
表7. 低NLR组和不同处理高NLR组生存率
Table 8. Cox-regression analysis of colorectal cancer prognosis factors
表8. 结直肠癌预后因素Cox回归分析
肿瘤细胞的发生发展并导致其消亡;同时也因刺激肿瘤营养微血管生成及分泌肿瘤生长刺激因子等形成促进肿瘤发生发展以及远处转移从而导致患者不良预后。故炎症常常是癌症的“倡导者”,同时“也参与抗癌之战” [12] 。相关研究表明,肿瘤浸润微环境包括除肿瘤细胞和正常组织细胞及间质之外存在多种免疫细胞中性粒细胞、淋巴细胞、巨噬细胞、NK细胞、细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTL)、抗原提呈细胞(APC)及树突状细胞(DC)等 [13] 、间质细胞及基质细胞。这些免疫细胞既能识别和杀伤肿瘤感染的细胞活性,增加效应细胞活性、吞噬杀伤肿瘤细胞、抑制促肿瘤繁殖活性;又可对肿瘤产生贡献,通过促进肿瘤细胞增殖的肿瘤发生、入侵或转移,从而产生巨大影响。在癌症相关的炎症反应中,中性粒细胞提供血管生成和生长因子的主要来源,这有助于肿瘤恶化;淋巴细胞通过细胞毒性T淋巴细胞控制宿主的免疫反应细胞死亡和细胞因子的产生,从而抑制肿瘤细胞的扩散。肿瘤自身的异体表型刺激机体产生炎症细胞游走趋化局部浸润进而吞噬肿瘤细胞,导致肿瘤系统及其周边组织的崩溃瓦解,产生一系列破坏崩解的连锁反映,这些不良事件可以引起更广泛而持久的非特异性炎症反应链条,炎症介质可以改变正常细胞内环境的稳定性,破坏细胞膜的极性,导致细胞水肿变性,最终破裂凋亡;与之相反的是某些炎症细胞(如中性粒细胞)可分泌促肿瘤生长因子及趋化因子,如若机体自身免疫力太差就会促肿瘤行为增强导致肿瘤进一步扩增。趋化因子及细胞因子等炎症介质则造成正常细胞DNA氧化损伤突变凋亡,异常过度分泌促肿瘤生长因子,增加血管通透性,促进肿瘤发展进程、血管生成及远处转移。炎症连锁反应可以进一步诱导相关细胞的异常增殖分化、渗出、趋化、聚集,加剧这一反应过程。基因异常及炎症微环境的刺激正常细胞失控增殖,而修复程序的失常导致支持细胞癌变。肿瘤既受到炎症的制约,也离不开肿瘤炎症微环境的支持 [14] 。外周血NLR高水平导致结直肠癌不良预后可能与升高的中性粒细胞水平和(或)降低的淋巴细胞水平相关,机制如下:
1) 中性粒细胞过度增加,广泛浸润于肿瘤相关微环境,分泌多种促瘤物质利于肿瘤微循环形成,招募肿瘤细胞增殖,促血管生成和适应性免疫反应,涉及干预肿瘤细胞的增长繁殖等生物学行为,刺激肿瘤细胞发生进展,导致肿瘤恶化 [15] 。肿瘤微环境中性粒细胞浸润增多导致预后不良。
2) 外周血NLR升高的结直肠癌患者预后较差,与肿瘤微环境下浸润淋巴细胞减少相关。T淋巴细胞和B淋巴细胞可维持免疫功能正常运作直接或间接抑制肿瘤细胞 [16] 。淋巴细胞抑制肿瘤的增殖以及转移的生物学行为是通过介导细胞毒性作用以及释放细胞因子产生抗瘤作用。中性粒细胞增多可能通过抑制自然杀伤细胞和T淋巴细胞活性以达到免疫抑制目的,淋巴细胞中具有免疫活性的免疫细胞减少,功能降低,尤其是CD3、CD4细胞活性降低,致使肿瘤免疫功能低下,增加肿瘤复发转移的风险 [17] - [19] 。故淋巴细胞的相对减少致使机体抵抗肿瘤能力大幅减弱 [20] 。
因此,高NLR水平反映了中性粒细胞促瘤能力增强和(或)淋巴细胞免疫水平减弱,无论发生上面的任何一种情况,都会导致结直肠癌进展预后欠佳。外周血中性粒细胞分泌的炎症细胞因子可建立一个肿瘤微环境,促进肿瘤的发展进展;外周循环淋巴细胞减少表示吞噬抗肿瘤细胞减少,免疫抑制降低,肿瘤细胞逃逸。外周血NLR是促肿瘤炎性反应和抗肿瘤免疫间的平衡状态。任何原因导致的中性粒细胞增多和(或)淋巴细胞减少均可导致天平倾斜动态平衡被打破,正常免疫功能受损,促瘤因子增多,预后欠佳。
本次课题研究结果显示,治疗前的结直肠癌外周血NLR水平可以预测肿瘤预后,较高的外周血NLR水平导致结直肠癌患者OS及PFS降低预后不良,是结直肠癌一个风险因素复发和限制生存的因素。外周血NLR水平升高表示抗癌作用的削弱和促癌作用的增强,治疗前的较高外周血NLR水平可导致结直肠癌患者不良预后,与多位专家学者意见异曲同工不谋而合。2012年,饶慧兰等 [21] 将首诊为结直肠癌并行根治性手术治疗的229例患者NLR是负性影响结直肠癌预后的因素,结果发现高水平NLR值与临床分期具有相关性。王智等 [22] 称术前NLR > 3.98结直肠癌预后不良,外周血高NLR水平与术前白细胞计数、肿瘤大小、组织分化程度、浸润深度、淋巴结转移、同时性肝转移、腹膜种植、TNM分期、根治术均有相关性。本研究发现采用根治术治疗结直肠癌患者低NLR组3年生存率显著高于高NLR组,存活时间更长,预后较好,且外周血NLR与结直肠癌发生的年龄、治疗前白细胞计数、肿瘤部位、肿瘤大小、淋巴结转移(N)、TNM分期存在相关性。李芳飘等 [23] 认为术前高NLR水平是结直肠癌患者重要的独立预后指标。直肠癌患者术前外周血NLR水平可以预测患者术后生存情况,高NLR水平者预示预后生存状况不佳。本文结论得出高NLR组结直肠癌患者生存期短,预后不良。国外的专家学者也对NLR水平与结直肠癌的预后相关性进行深入研究,结果如预期所料,NLR水平与结直肠癌预后呈紧密相关性。Cetin等 [24] FOLFIRI或XELOX化疗治疗结直肠癌的临床试验中发现,治疗前大于正常上限值的外周血中性粒细胞水平使患者死亡的风险概率提高两倍,外周血NLR水平是结直肠癌低生存率的独立预测指标。同期报道称,结直肠癌患者行结直肠癌根治术的围手术期外周血NLR水平升高预示较差临床预后 [25] 。经本论文统计分析外周血NLR值与不同治疗方法比较对结直肠癌患者预后相关性分析中发现,行根治术的结直肠癌患者低NLR组生存期更长,尚未得出与姑息治疗及化疗相关,考虑与入组病人结构比差异较大及病例数目较少有关。另有Meta分析研究发现术前NLR水平升高与结直肠癌生存期息息相关,NLR水平将作为结直肠癌的一个新兴敏感预后指标 [26] 。日本相关学者研究发现NLR > 2.5的结直肠癌肝转移患者进行手术治疗预后较差 [27] 。同时期日本其他学者研究也发现术前高NLR水平可能被认为是一个可靠的生物标志物,提示晚期结直肠癌术后预后不佳 [28] 。Absenger [29] 对504例晚期结肠癌患者进行分析,报道称NLR > 2.5的结直肠癌II、III期患者,进行手术治疗后,无进展生存时间(PFS)明显缩短。同时有相关报道称,对于结直肠癌II、III期的患者,NLR > 3患者PFS为83个月,NLR < 3为132个月,因此得出结论:NLR可能是一个独立的预后标志物 [30] 。本论文亦可得出相应结论高NLR组患者PFS较低NLR组生存期明显缩短。Proctor MJ [31] 等人的观点也支持上述结论,并有相关研究得出结论:1) 行直肠癌根治术的患者,术前NLR值与TNM分期有关。2) 术前NLR > 3的结直肠癌患者较NLR ≤ 3生存时间短、预后差。本论文同时也考虑得出外周血NLR值与结直肠癌TNM分期相关,因为TNM分期同样是结直肠癌的独立预后因素,但是两者的交互作用是否对结直肠癌预后有相关性本文并未得出相关结论。蒋雷从OS与PFS方面论述了NLR水平与转移性结直肠癌的关系中提到,NLR > 3对PFS有预测价值,是OS的独立预后因素。本文结直肠癌涵盖早期直至晚期转移的患者,从宏观角度证实外周血NLR高水平导致结直肠癌不良预后。以上论文观点均支持NLR水平有望成为预测结直肠癌预后的新兴指标。
目前学者对结直肠癌外周血NLR水平高值仍有不同声音。依据文献界定NLR > 3.98有临床统计意义,然而也有认为NLR > 3,甚至界定为NLR > 2.5才有临床价值。不管怎样,可以确定的是,NLR的升高与结直肠癌患者的预后存在密切的联系。至于NLR高值的界定,就需要对大量各型肿瘤临床数据的统计分析提高对NLR高值界定的判断。本研究对NLR标记物进行分类定义的ROC曲线分析兼顾了测量的灵敏度和特异度。我相信ROC曲线分析与特定疾病死亡作为一个终点是更好的预后变量。本文科学的验证NLR值为2.54与结直肠癌OS及PFS相关,可指导结直肠癌预后,利于NLR值与结直肠癌间的检测诊断和推广应用。
经本篇论文证实,外周血NLR水平可能成为有效评价结直肠癌生存预后的独立预测分子标记,为医生提供针对结直肠癌预后动态观测机体免疫状况和评估预后风险价值的指标,延长预后生存。
本研究为回顾性实验研究,通过回顾外周血NLR与结直肠癌患者预后的关系,我们可以得出以下结论,外周血细胞计数是常用的一种简单易行、快捷、方便的化验方法,且成本低廉。外周血NLR的监测可以作为结直肠癌有价值的临床生化评价预后指标,增加了对结直肠癌预后判断的准确性,又不增加患者经济心理负担。因此,NLR值的监测评估对结直肠癌患者有一定的临床参考意义。
文章引用
尹端端,王真真,杨雁鸿,李倩影,冯 博,冯 悦,王小玉. 外周血中性粒细胞与淋巴细胞比值(NLR)与结直肠癌不同期别预后的研究
Study of Perpheral Neutrophil to Lymphocyte Ratio (NLR) in Different Stages Prognosis of Colorectal Cancer[J]. 亚洲肿瘤科病例研究, 2016, 05(02): 27-38. http://dx.doi.org/10.12677/ACRPO.2016.52003
参考文献 (References)
- 1. 赵敏. 炎性反应在肿瘤发生发展中的作用[J]. 吉林医学, 2014, 35(7): 1488-1490.
- 2. 朴美慈, 金仁顺. 术前NLR PLR与乳腺癌预后的相关性[J]. 中国肿瘤临床, 2015, 42(23): 1128-1131.
- 3. 郭智兴, 韦玮, 钟崇, 等. 青年肝癌患者术前中性粒细胞与淋巴细胞比值与预后的相关性[J]. 癌症, 2009, 28(11): 1203-1208.
- 4. 金鑫, 冯利, 李富广, 等. 血清中性粒细胞/淋巴细胞比值与胃肠间质瘤患者预后的关系及其临床意义[J]. 中国普外基础与临床杂志, 2013, 20(8): 910-914.
- 5. 廖雪芬, 庞芹. 术前中性粒细胞/淋巴细胞比值与宫颈癌患者预后的关系[J]. 医学理论与实践, 2016, 29(4): 433-435.
- 6. Mantovani, A. (2009) Cancer Inflaming Metastasis. Nature, 457, 36-37. http://dx.doi.org/10.1038/457036b
- 7. Coussens, L.M. and Werb, Z. (2002) Inflammation and Cancer. Nature, 420, 860-867. http://dx.doi.org/10.1038/nature01322
- 8. Witz, I.P. (2008) Yin-Yang Activities and Vicious Cycles in the Tumor Mi-cro-Environment. Cancer Research, 68, 9- 13. http://dx.doi.org/10.1158/0008-5472.CAN-07-2917
- 9. Li, H.C., Fan, X.L. and Oughton, J. (2007) Tumor Microenvironment: The Role of the Tumor Stroma in Cancer. J Cell Biochem, 101, 805-815. http://dx.doi.org/10.1002/jcb.21159
- 10. 刘天聪. 肿瘤相关中性粒细胞对肿瘤生长的双重作用[J]. 微生物学免疫学进展, 2013, 41(22): 69-72.
- 11. Hayden, E.C. (2009) Cutting off Cancer’s Supply Lines (Special Report). Nature, 45, 686-687. http://dx.doi.org/10.1038/458686b
- 12. Sinla, G. (2003) Bacterial Battalions Join War against Cancer. Nature Medicine, 9, 12-29.
- 13. 刘德锋, 孟翔凌. 肿瘤相关中性粒细胞的研究进展[J]. 中华临床医师杂志(电子版), 2013, 7(2): 797-798.
- 14. Mantovani, A., Allavena, P., Sica, A., et al. (2008) Cancer-Related Inflammation. Nature, 45, 436-444. http://dx.doi.org/10.1038/nature07205
- 15. 武庆, 周海梦, 李旭辉. 浸润性中性粒细胞在促进肿瘤进展中的作用[J]. 生物化学与生物物理进展, 2015, 42(5): 410-418.
- 16. 李健, 叶定伟, 姚旭东. 术前血小板/淋巴细胞比值判断上尿路尿路上皮癌临床分期及预后的价值[J]. 中国癌症杂志, 2013, 23(6): 457-461.
- 17. Kokawa, K., Mikami, Y., Sakata, H., et al. (2009) Clinical Outcome and Prognostic Factors in Borderline Tumors of the Ovary. Results from 17 Years’ Experience in the Kinki District of Japan (1990-2006). European Journal of Gynaecological Oncology, 30, 155-161.
- 18. Poncelet, C., Fauvet, R., Yazbeck, C., Coutant, C. and Darai, E. (2010) Impact of Serum Tumor Marker Determination on the Management of Women with Borderline Ovarian Tumors: Multivariate Analysis of a French Multicentre Study. European Journal of Surgical Oncology, 36, 1066-1072. http://dx.doi.org/10.1016/j.ejso.2010.07.004
- 19. Kelly, P.J., Archbold, P., Price, J.H., Cardwell, C. and McCluggage, W.G. (2010) Serum CA19.9 Levels Are Commonly Elevated in Primary Ovarian Mucinous Tumours but Cannot Be Used to Predict the Histological Subtype. Journal of Clinical Pathology, 63, 169-173. http://dx.doi.org/10.1136/jcp.2009.072355
- 20. 胡秦妮, 张玉琴, 邓芝云. 中性粒细胞与淋巴细胞比值预测急性胰腺炎严重程度的意义[J]. 国际检验医学杂志, 2013, 34(23): 3119-3121.
- 21. Rao, H.L., Chen, J.W., Li, M., et al. (2012) Increased Intratumoral Neutrophil in Colorectal Carcinomas Correlates Closely with Malignant Phenotype and Predicts Patients’ Adverse Prognosis. PLoS ONE, 7, e30806. http://dx.doi.org/10.1371/journal.pone.0030806
- 22. 王智, 马晋平, 林建伟. 术前中性粒细胞与淋巴细胞比值与结直肠癌患者预后的关系[J]. 消化肿瘤杂志, 2011, 4(3): 246-250.
- 23. 李芳飘. 外周血中性/淋巴细胞比例对直肠癌患者手术预后的预测价值[J]. 重庆医学, 2014, 43(8): 925-929.
- 24. Cetin, B., Kaplan, M.A., Berk, V., et al. (2012) Prognostic Factors for Overall Survival in Patients with Metastatic Colorectal Carcinoma Treated with Vascular Endothelial Growth Factor-Targeting Agents. Asian Pacific Journal of Cancer Prevention, 13, 1059-1063. http://dx.doi.org/10.7314/APJCP.2012.13.3.1059
- 25. Kubo, T., Ono, S., Ueno, H., Shinto, E., Yamamoto, J. and Hase, K. (2014) Impact of the Perioperative Neutrophil-to- Lymphocyte Ratio on the Long-Term Survival Following an Elective Resection of Colorectal Carcinoma. International Journal of Colorectal Disease, 29, 109-112. http://dx.doi.org/10.1007/s00384-014-1964-1
- 26. Malietzis, G., Giacometti, M., Kennedy, R.H., Athanasiou, T., Aziz, O. and Jenkins, J.T. (2014) The Emerging Role of Neutrophil to Lymphocyte Ratio in Determining Colorectal Cancer Treatment Outcomes: A Systematic Review and Meta-Analysis. Annals of Surgical Oncology, 5, 245-251.
- 27. Yoshioka, S., Kubo, M., Yanagisawa, K., et al. (2013) Clinical Significance of Neutrophil to Lymphocyte Ratio in Colorectal Cancer Patients Receiving Adjuvant Chemotherapy Combined with Polysaccharide-K. Gan to Kagaku Ryoho. Cancer & Chemotherapy, 40, 2086-2088.
- 28. Shibutani, M., Maeda, K., Nagahara, H., et al. (2013) Significance of Preoperative Neutrophil-to-Lymphocyte Ratio as a Predictor of Prognosis in Patients with Stage IV Colorectal Cancer. Gan to Kagaku Ryoho. Cancer & Chemotherapy, 40, 1603-1605.
- 29. Absenger, G., Szkandera, J. and Stotz, M. (2013) Preoperative Neutrophil-to-Lymphocyte Ratio Predicts Clinical Outcome in Patients with Stage II and III Colon Cancer. Anticancer Research, 33, 4591-4594.
- 30. Absenger, G., Szkandera, J., Pichler, M., et al. (2013) A Derived Neutrophil to Lymphocyte Ratio Predicts Clinical Outcome in Stage II and III Colon Cancer Patients. British Journal of Cancer, 109, 395-400. http://dx.doi.org/10.1038/bjc.2013.346
- 31. Proctor, M.J., McMillan, D.C., Morrison, D.S., Fletcher, C.D., Horgan, P.G. and Clarke, S.J. (2012) A Derived Neutrophil to Lymphocyte Ratio Predicts Survival in Patients with Cancer. British Journal of Cancer, 107, 695-709. http://dx.doi.org/10.1038/bjc.2012.292
NOTES
*通讯作者.
