International Journal of Ecology
Vol.
07
No.
04
(
2018
), Article ID:
27144
,
9
pages
10.12677/IJE.2018.74023
Research Progress on the Secondary Metabolites from Dinoflagellate Prorocentrum Spp.
Yueyue Li1,2, Xiaoqing Tian1,3*, Chengqi Fan1, Yanan Lu1
1East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai
2Shanghai Ocean University, Shanghai
3Key Laboratory of East China Sea Fishery Resources Exploitation, Ministry of Agriculture, Shanghai

Received: Sep. 25th, 2018; accepted: Oct. 10th, 2018; published: Oct. 17th, 2018

ABSTRACT
Prorocentrum spp. is one of the biological provenances for the formation of marine red tides. It has an important impact on the marine ecological balance and human health. The Prorocentrum genus is rich in metabolites, including polyketides with cyclic polyether, macrolide and alkaloid skeletons, steroids and some. In this paper, the types, structures and bioactivities of metabolites recently obtained from Prorocentrum spp. were summarized, and the prospect of its research was also discussed in order to provide the basis for further study of this genus.
Keywords:Prorocentrum, Secondary Metabolite, Bioactivity
原甲藻属甲藻代谢产物 研究进展
李月月1,2,田晓清1,3*,樊成奇1,陆亚男1
1中国水产科学研究院东海水产研究所,上海
2上海海洋大学,上海
3农业部东海渔业资源开发利用重点实验室,上海

收稿日期:2018年9月25日;录用日期:2018年10月10日;发布日期:2018年10月17日

摘 要
原甲藻是形成海洋赤潮的生物种源之一,对海洋生态平衡和人类健康都有重要的影响。原甲藻的代谢产物丰富,主要有环状聚醚、大环内酯、生物碱等多种骨架类型的聚酮类化合物,以及甾醇等。本文总结了最近从原甲藻中得到的代谢产物的类型、结构以及生物活性,并对其研究前景进行展望,以期对原甲藻的进一步研究提供依据。
关键词 :原甲藻,次级代谢产物,生物活性

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
海洋中存在着大量化学结构新颖、生物活性多种多样、作用机制独特的代谢产物。近几十年来,海洋天然产物越来越受到科学家的重视。甲藻(dinoflagellate)又称双鞭毛藻,为海洋微藻,个体通常约几十微米大小,是主要的赤潮生物之一 [1]。其在生物学上的分类地位比较特殊,既介于动物与植物之间,又介于真核生物和原核生物之间,许多学者称之为“介核生物”或“间核生物” [2]。甲藻产生的有毒次生代谢产物,又称甲藻毒素,历来引起人们的广泛关注。在甲藻的各个种属中,原甲藻属(Prorocentrum)一直备受关注。该属分布几乎遍及世界各大海区,我国的渤海、东海、香港和南沙群岛等水域均有分布,是海洋浮游生物的一个重要类群,在海洋生态系中占有重要的地位 [3]。原甲藻是导致赤潮的重要生物之一,其代表产物大田软海绵酸(okadaic acid, OA)及其衍生物鳍藻毒素-1 (Dinophysistoxin-1, DTX-1)是腹泻性贝毒(Diarrhetic shellfish poisoning, DSP)的主要组分,腹泻性贝毒研究现状:腹泻性贝毒引起的中毒不但可能危害海洋生态平衡,还会通过海洋食物链的富集威胁人类健康 [4]。除了OA和DTX-1,还有多种具有生物活性的化合物也已从原甲藻中被报道 [5] ,其中包括OA、DTX-1等腹泻性贝毒及其结构类似物,而prorocentrolide、prorocentrolide B等生物碱则属于环亚胺类毒素成分,另有新颖的大环内酯骨架的聚酮类化合物、链状多烯/多羟基化合物等。本文对原甲藻代谢产物的类型、结构以及其生物活性最新研究进展进行了简要的归纳总结,以期作为进一步研究原甲藻的基础和依据。
2. 原甲藻代谢产物的类型
2.1. 聚酮类
文献 [5] 综述了原甲藻属2010年前的36个聚酮类成分,包括典型的腹泻性贝毒OA、DTX-1(图1)等26个结构类似物,典型的环亚胺类毒素prorocentrolide、prorocentrolide B (图2)等代谢产物6个,Hoffmanniolide和Formosalides A、B等大环内酯成分3个,以及链状多烯/多羟基化合物prorocentin。近年原甲藻聚酮类新结构代谢产物文献报道较少,主要原因在于新结构成分在培养体系中往往含量极低,且结构非常复杂。
Chung-Kuang Lu等2010年报道了一个新的线型碳链化合物Prorocentin-4(1,图3),链上具有两个不

Figure 1. Structures of typical DSPs
图1. 典型腹泻性贝毒的结构
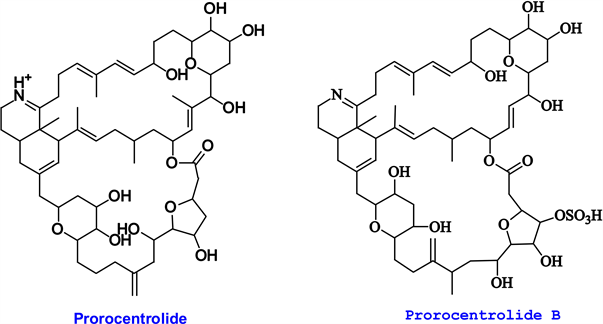
Figure 2. Structures of typical CIs
图2. 典型环亚胺毒素的结构
相邻的四氢呋喃环,手性基团比prorocentin少 [6]。从P. hoffmannianum分离培养出来的Prorocentrol,是一个结构复杂的链状多烯/多羟基化合物(2,图3),具有30个羟基,1个酮和8个双键,立体构型暂未完全确定 [7]。A Reum Yang等从P. lima中培养分离出一种新型的聚酮化合物Limaol(3,图3),它的结构中包含四氢吡喃,1,3,5,7-四(亚甲基)庚烷亚基和八氢-3'H-螺旋[吡喃-2,2'-吡喃并[3,2-b]吡喃]等片段 [8]。从P. belizeanum的中培养分离出来的Belizentrin,是前所未有的多不饱和/多羟基化的大环内酰胺,具有高度氧化的侧链 [9]。
2.2. 甾醇类
采用毛细管气相色谱-质谱联用技术,从P. micans Ehrenberg、P. minimum (Pavillard) Schiller、P. balticum (Lev.) Lemm和P. mexicanum Tafall四种原甲藻提取物中分析了甾醇类成分 [10] ,具有分属于2类骨架的共6种母核和14种侧链片段(图4);鉴定了24种化合物,其中化合物5是新的甾醇,黑海甾醇(18, dinosterol)是P. balticum、P. minimum的主要甾醇成分,而胆甾醇(7, cholesterol)是P. micans、P. mexicanum的主要甾醇成分。
3. OA及其衍生物的产生机制
OA可能是在甲藻叶绿体中合成的并贮存于叶绿体中,很可能是甲藻光合作用的直接产物 [11] ;但有

Figure 3. Structures of recently reported polyketides (1-4)
图3. 最新报道的聚酮类化合物(1-4)的结构
人认为,OA及其衍生物贮存于胞质周围的液泡中。单位细胞中OA的量与细胞脂质水平、叶绿素浓度密切相关;随培养时间的延长逐渐增加,至静止期时达到最大。DSP合成后以低毒性的硫酸盐形式DTX-4贮存于胞内,然后以酸性活性形式OA分泌于水体,从而构成细胞对OA毒性的自我保护体系。DSP分子中的所有碳均来自乙酸盐和乙醇酸盐,其碳骨架通过聚酮化合物合成酶(PKS)合成,非常独特。与放线菌多醚的合成不同,OA的生物合成中可能存在氧化机(Oxidation mechanism) [12]。不少学者认为,DSP是由藻细胞内共生细菌生成的。但Zhou [13] 等对利玛原甲藻超微结构研究显示,这种共生细菌可能并不存在。同时,DSP在无菌、有菌环境下均可由Prorocentrum产生,细菌可能并不参与DSP的生物合成;但也有从利玛原甲藻中分离得到海洋细菌的报道。目前为止,对原甲藻的产毒机制还不是完全清楚。
4. 生物活性
对原甲藻代谢产物的研究主要集中在其毒理学特性,OA及其衍生物是典型的腹性贝毒。其中,DTX1的LD50和LD99分别为166、160 μg/kg。DTX-3的LD50和LD99均为500 μg/kg [14] ;而OA对小鼠腹腔注射LD50为192 μg/kg,对人体有害剂量为1.0~1.5 μg OA/kg体重或者50 μg OA当量/人;OA还是蛋白磷酸酶PP1和PP2A的特异性抑制剂,能诱导多种细胞凋亡,致使细胞周期变化,能促进肿瘤,对神经系统、胚胎发育有不利影响 [15] [16]。但也有体内外实验显示并不具有严重的心脏毒性 [17]。
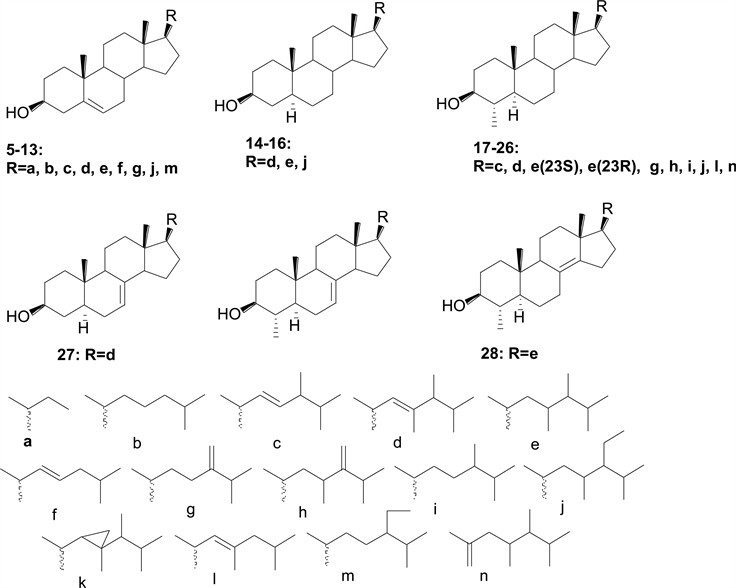
Figure 4. Structures of steroids (5-28)
图4. 甾醇类化合物(5-28)的结构
4.1. 对蛋白磷酸酶PP1和PP2A的特异性抑制
OA是一种强有力的蛋白磷酸酶抑制剂,可特异性地抑制PPI和PP2A,使蛋白质过磷酸化,破坏细胞生物机能和许多种细胞的调亡,从而对生物的多种生理功能造成影响。如腹泻、小肠上皮细胞的腹泻性退化和促进癌变的发展 [18]。
4.2. 细胞毒作用
OA的主要已知靶细胞标是几类蛋白磷酸酶,在关键的细胞进程的调节中,包括细胞骨架结构的生长,分裂,死亡和维持,起着核心作用 [19]。OA对蛋白磷酸酶的抑制作用使许多细胞蛋白质的磷酸化状态被严重改变,这可能最终导致调节过程的崩溃和各种细胞被破坏。因此,细胞即使暴露在低浓度的OA中也会造成细胞改变。一般认为这些毒性作用与磷酸酶的抑制有关 [20]。然而,这种毒素的细胞和分子效应并不总是能够通过这种抑制来解释清楚,并且不能够排除不同于磷酸酶的其它靶细胞的存在。事实上,在几种海洋生物中,除了磷酸酶以外的可以和OA结合的蛋白已经得到了证明 [21]。
关于OA的细胞毒性作用最广泛的报道是诱导细胞凋亡。已知OA可以在包括肠细胞,神经元细胞,肝细胞,肺细胞,血细胞等许多细胞类型中引起生长抑制或凋亡。涉及该过程的机制包括特异性基因表达的改变,线粒体膜电位的降低,多种胱天蛋白酶同种型的活化,细胞色素C从线粒体膜间释放到胞质溶胶,抑制蛋白质合成和破坏细胞骨架 [22]。Tergau, F等 [23] 使用没有蛋白磷酸酶抑制活性的OA衍生物来做细胞治疗,没有观察到细胞凋亡率的增加。因此,这些作用似乎都和OA抑制磷酸酶活性的能力直接相关。
然而,OA诱导的细胞毒性作用在不同细胞类型中变化非常大。例如,Rubiolo等 [24] 研究了OA在两种肝细胞系(HepG2和Clone9)中的细胞毒性作用,发现对两种类型的细胞周期有不同影响。OA阻止G2/M中的Clone9的细胞周期并诱导异常有丝分裂,而G0/G1期的HepG2细胞分裂则被阻止。毒素对细胞周期蛋白和细胞周期蛋白依赖性激酶的基因表达的影响对于两种细胞系也是不同的:Clone9细胞中细胞周期蛋白A,B和D的表达增加,但在HepG2细胞中细胞周期蛋白A和B的减少。此外,Valdiglesias等 [25] 报道了在暴露于OA的神经元细胞的S期的清除细胞周期停滞,但在相同暴露条件下,在肝细胞或淋巴细胞中没有观察到这种停滞。
其它代谢产物中,Prorocentrol在16 μg/mL对P388细胞株具有较弱的细胞毒性 [7] ,Limaol细胞毒性相对于OA较弱,对肝细胞癌细胞株HepG2、结肠腺癌细胞株HCT-116和神经母细胞瘤细胞株Neuro2a的IC50值分别为3.7、7.3和9.6 μM;OA对这三种细胞的IC50值分别为0.54,0.67和0.85 μM [8]。
4.3. 对神经系统的作用
OA并没有被归类为神经毒素,但越来越多的研究报道了OA的神经毒性作用,不论是在神经元细胞和动物系统中,通常都与神经元凋亡,蛋白质高磷酸化和形态学改变有关。持续暴露在5~100 nM浓度范围的OA中12或24 h,可以诱导人的TR14和NT2-N神经瘤细胞凋亡 [24]。在几种神经细胞类型,包括小鼠和人类神经母细胞瘤细胞,大鼠皮质神经元和衍生自早产大鼠脑皮层的神经元培养物中,都观察到了OA蛋白的磷酸化和积累 [25] [26] [27] [28]。在长期暴露于OA后,可在大鼠中诱发一些阿尔茨海默病样的神经病理学征象,在八周的时间内,在小鼠大脑不断注射入OA,产生了神经元蛋白再分配,导致了严重的记忆障碍 [29]。在其他啮齿动物研究中也观察到了暴露于OA导致的记忆缺陷 [30]。在OA治疗的成年大鼠中也发现磷酸化tau蛋白增加,Tau蛋白质等负责微管稳定,维持长期增强,学习和记忆,其异常磷酸化形式被认为是阿尔茨海默病的病理特征之一 [31]。因此,OA目前被看作用于预防和治疗阿尔茨海默病和其他痴呆形式的潜在药物 [32]。
为了研究Belizentrin对神经元生存和功能的可能的生物学作用,Jos G. Napolitano等 [9] 使用了小脑细胞的原代培养物,培养的神经元暴露于Belizentrin导致神经元网络完整性的强烈变化,并随之使细胞死亡。浓度为100 nM时,神经元有明显的断裂,而暴露浓度超过300 nM就会引起神经元体细胞完全退化。
4.4. 对免疫系统的作用
目前为止,关于OA的免疫毒性的研究还不是很多。之前有报道,在低浓度的OA (0.05 μg/mL)的刺激下,人的单核细胞产生白细胞介素1(IL-1)会发生改变,中等浓度(0.1~1.0 μg/mL)和更高浓度下会导致细胞的死亡 [33]。OA可以抑制IL-1的产生,甚至是改变IL-1的基因表达。在小鼠T淋巴细胞的体外研究表明,低浓度OA (5 nM)诱导这些细胞中T细胞受体(TCR)表达水平的下调,损害T细胞活化,从而影响免疫反应 [34]。小鼠口服OA (17.8 μg/kg)后,观察到不同了的免疫毒性作用,包括胸腺形态的改变和萎缩,淋巴室和血管的出血 [35]。研究结果表明低剂量的OA能够诱导免疫刺激和全身免疫毒性,并且能够通过招募粒细胞,和更多数量的活性巨噬细胞,在这些动物中激活炎症细胞应答并增加对细胞因子的免疫反应性 [36]。
4.5. 肿瘤促进和致癌性
OA、DTX-1和DTX-3是肿瘤促进因子,到目前为止对OA的研究,显示出它有明显的致癌潜力。在试验中无论是口服 [37] 或是涂抹在皮肤上 [38] ,OA在大鼠腺体的小鼠皮肤和粘膜的两阶段致癌实验中显示出了其具有肿瘤促进活性。此外,OA作为肿瘤启动子的作用有一部分是通过转录因子AP-1介导的,c-jun的NH2末端缺失(称为TAM-67)阻断OA诱导的AP-1的活化并且保护免受OA促进的肿瘤的发生 [39]。OA具有的几种基因毒性和细胞毒性作用,包括造成DNA链断裂,DNA加合物,细胞周期改变,凋亡,氧化损伤,这些如果不能被修复,就有可能造成基因组不稳定性进而导致严重病态(包括癌症) [40]。赵哲等 [41] 在研究生长因子β1 (TGF-β1)诱导B细胞淋巴瘤细胞株Raji细胞凋亡效应及机制时,使用添加OA预处理过的Raji细胞可显著抑制TGF-β1对Raji细胞诱导凋亡的作用,100、200 nM的OA分别预处理后细胞凋亡率明显下降,TGF-β1组为(60 ± 5)%,而干预组分别为(32 ± 4)%、(24 ± 3)%,且均P < 0.05。OA促进肿瘤与它对蛋白磷酸酶的抑制性有密切的关系。PP2A通过阻断细胞周期、调控端粒酶活性、抑制不受控制的细胞生长等途径抑制肿瘤扩散,具有抑癌作用。而OA会抑制蛋白磷酸酶PP2A从而造成对肿瘤的促进 [42]。但有报道认为,PP2A可使抑癌蛋白去磷酸化失活,抑制细胞凋亡,促进肿瘤生长 [43] ,因此也认为OA同时还具有显著的抗肿瘤活性。
Sheu等 [44] 己证明OA可诱导小鼠皮肤的鸟氨酸脱竣酶(oD)C和大鼠胃腺的(oD)C加速癌变发生(腺状增生和腺癌)。Valdiglesias等 [45] 在用OA处理人神经元细胞的试验中评估了癌症起始和生长中有关的几种基因的表达水平。结果表明许多基因在或长或短的时间(3,6,和24 h)内都发生了改变。癌症的过程很复杂,需要对其进行更深一步的研究。Manerio等 [46] 为OA受损贝类的消费者与不同癌症发病率之间潜在关系,提供了可能的分子学解释。
5. 结论和展望
国内外对原甲藻属的研究报道主要集中在其分类鉴定、生长特性影响因子及赤潮监测等方面。特别是国内,虽然近年开始关注其生物活性,但是对于其化学成分和生物活性等方面的研究报道仍然不多,特别是国内,这极大制约了对该属的资源利用。对于原甲藻的代表产物OA及其衍生物仍然不够充分,尽管在过去几十年有不少关于OA的报道,但是在这种毒素的作用机制的知识方面仍然存在重要的差距:缺乏关于免疫毒性,胚胎毒性和致畸性的信息,缺乏评估的研究OA对动物物种或人类的慢性或亚慢性作用,由于缺乏关于潜在的非磷酸蛋白酶靶标的鉴定的研究,因此对于细胞毒性仍然存在争议。作为一个产物丰富的藻种,原甲藻的毒性对生态环境和人类健康所带来的损害,与此同时,还有它的作为抗肿瘤药物的潜在可能性,都会促进学者对其进行不断的深入研究。并且随着研究深入,一定会对其有更深入的了解,使其得到更广泛的开发和利用。
基金项目
中国水产科学研究院中央级公益性科研院所基本科研业务费(2016GH11)。
文章引用
李月月,田晓清,樊成奇,陆亚男. 原甲藻属甲藻代谢产物研究进展
Research Progress on the Secondary Metabolites from Dinoflagellate Prorocentrum Spp.[J]. 世界生态学, 2018, 07(04): 213-221. https://doi.org/10.12677/IJE.2018.74023
参考文献
- 1. 贾睿, 黄孝春, 郭跃伟. 前沟藻属海洋甲藻的化学成分及生物活性研究进展[J]. 中国天然药物, 2006, 4(1): 15-24.
- 2. 宋阳, 龙丽娟, 吴军. 海洋前沟藻属甲藻的次生代谢产物及其生物活性[J]. 中草药, 2004, 35(10): 1194-1196.
- 3. 杨美华, 陈士林, 吴剑威, 等. 海洋原甲藻属甲藻的研究进展[J]. 中国现代中药, 2007(11): 31-35.
- 4. 丁君. 赤潮毒素中腹泻性贝毒和麻痹性贝毒的研究及进展[J]. 大连水产学院学报, 2001(3): 212-218.
- 5. Hu, W.M., Xu, J., Sinkkonen, J., et al. (2010) Polyketides from Marine Dinoflagellates of the Genus Prorocentrum, Biosynthetic Origin and Bioactivity of Their Okadaic Acid Analogues. Mini-Reviews in Medicinal Chemistry, 10, 51-61. https://doi.org/10.2174/138955710791112541
- 6. Lu, C.-K., Chen, Y.-M. and Wang, S.-H. (2010) Prorocentin-4, a Novel Linear Polyketide from a Marine Dinoflagellate Prorocentrum sp. Tetrahedron Letters, 51, 6911-6914. https://doi.org/10.1016/j.tetlet.2010.10.116
- 7. Sugahara, K., et al. (2011) Prorocentrol, a Polyoxy Linear Carbon Chain Compound Isolated from the Toxic Dinoflagellate Prorocentrum hoffmainnianum. Journal of Organic Chemistry, 76, 3131-3138. https://doi.org/10.1021/jo102585k
- 8. Yang, A.R., et al. (2017) Limaol: A Polyketide from the Benthic Marine Dinoflagellate Prorocentrum lima. Journal of Natural Products, 80, 1688-1692. https://doi.org/10.1021/acs.jnatprod.7b00127
- 9. Domínguez, H.J., Napolitano, J.G., et al. (2014) Belizentrin, a Highly Bioactive Macrocycle from the Dinoflagellate Prorocentrum belizeanum. Organic Letters, 16, 4546-4549.
- 10. Volkman, J.K., Rijpstra, W.I.C., de Leeuw, J.W., et al. (1999) Sterols of Four Dinoflagellates from the Genus Prorocentrum. Phytochemistry, 52, 659-668. https://doi.org/10.1016/S0031-9422(99)00251-4
- 11. Zhou, J. and Fritz, L. (1994) Okadaic Aid Antibody Localizes to Chloroplasts in the DSP-Toxin-Producing Dinoflagellates Prorocentrum lima Dodge and Prorocentrun maculoaum. Phycologia, 33, 455-461. https://doi.org/10.2216/i0031-8884-33-6-455.1
- 12. 杨维东, 彭喜春, 刘洁生, 等. 腹泻性贝毒研究现状[J]. 海洋科学, 2005(5): 66-72.
- 13. Zhou, J. and Fritz, L. (1993) Ultrastrustura of Two Toxic Marine Dinoflagellates, Prorocentrum lima and Prorocentrun maculoaum. Phycologia, 32, 444-450. https://doi.org/10.2216/i0031-8884-32-6-444.1
- 14. 高丽娜, 马丹. 麻痹性贝毒和腹泻性贝毒的性质及检测技术研究探讨[J]. 现代渔业信息, 2011(3): 11-13.
- 15. Valdiglesias, V., Prego-Faraldo, M.V., Pásaro, E., et al. (2013) Okadaic Acid: More than a Diarrheic Toxin. Marine Drugs, 11, 4328-4349. https://doi.org/10.3390/md11114328
- 16. Ferron, P.J., Dumazeau, K., Beaulieu, J.F., et al. (2016) Combined Effects of Lipo-philic Phycotoxins (Okadaic Acid, Azapsiracid-1 and Yessotoxin) on Human Intestinal Cells Models. Toxins, 8, 50. https://doi.org/10.3390/toxins8020050
- 17. Ferreiro, S.F., Carrera, C., Vilariño, N., et al. (2015) Acute Cardiotoxicity Evaluation of the Marine Biotoxins OA, DTX-1 and YTX. Toxins, 7, 1030-1047. https://doi.org/10.3390/toxins7041030
- 18. 孟宪梅, 卢士英, 林超, 等. 大田软海绵酸致病性及检测方法研究进展[J]. 中国畜牧兽医, 2011(2): 152-156.
- 19. Berven, G., Seatre, F., Halvorson, K., et al. (2001) Effect of Diarrhetic Shellfish Toxin, Okadaic Acid, on Cytoskeletal Element, Viability and Functionality of Rat Liver and Intestinal Cells. Toxicon, 39, 349-362. https://doi.org/10.1016/S0041-0101(00)00137-9
- 20. Valdiglesias, V., Laffon, B. and Pásaro, E. (2011) Okadaic Acid Induces Morphological Changes, Apoptosis and Cell Cycle Alterations in Different Human Cell Types. Environmental Monitoring and As-sessment, 13, 1831-1840. https://doi.org/10.1039/c0em00771d
- 21. Sugiyama, N., Konoki, K. and Tachibana, K. (2007) Isolation and Characterization of Okadaic Acid Binding Proteins from the Marine Sponge Halichondria okadai. Biochemistry, 46, 11410-11420. https://doi.org/10.1021/bi700490n
- 22. 黄爱君, 黄海燕, 庄志雄, 等.大田软海绵酸对HL-7702肝细胞毒性效应的研究[J]. 安徽农业科学, 2010(10): 5251-5253.
- 23. Kiguchi, K., Glesne, D., Chubb, C.H., et al. (1994) Differential Induction of Apoptosis in Human Breast Tumor Cells by Okadaic Acid and Related Inhibitors of Protein Phosphatases 1 and 2A. Cell Growth & Differentiation, 5, 995-1004.
- 24. Rubiolo, J.A., López-Alonso, et al. (2011) Okadaic Acid and Dinophysis Toxin 2 Have Differential Toxicological Effects in Hepatic Cell Lines Inducing Cell Cycle Arrest, at G0/G1 or G2/M with Aberrant Mitosis Depending on the Cell Line. Archives of Toxicology, 85, 1541-1550. https://doi.org/10.1007/s00204-011-0702-5
- 25. Das, V. and Miller, J.H. (2012) Microtubule Stabilization by Peloruside A and Paclitaxel Rescues Degenerating Neurons from Okadaic Acid-Induced Tau Phosphor-ylation. European Journal of Neuroscience, 35, 1705-1717.
- 26. Chen, Z., Chen, B., Xu, W.F., et al. (2012) Effects of PTEN Inhibi-tion on Regulation of Tau Phosphorylation in an Okadaic Acid-Induced Neurodegeneration Model. International Journal of Devel-opmental Neuroscience, 30, 411-419. https://doi.org/10.1016/j.ijdevneu.2012.08.003
- 27. Chen, Y., Wang, C., Hu, M., et al. (2012) Effects of Ginkgolide A on Okadaic Acid-Induced Tau Hyperphosphorylation and the PI3K-Akt Signaling Pathway in N2a Cells. Planta Medica, 78, 1337-1341. https://doi.org/10.1055/s-0032-1314965
- 28. Cho, M.H., Kim, D.H., Choi, J.E., et al. (2012) Increased Phosphorylation of Dynamin-Related Protein 1 and Mitochondrial Fission in Okadaic Acid-Treated Neurons. Brain Research, 1454, 100-110. https://doi.org/10.1016/j.brainres.2012.03.010
- 29. Arendt, T., Holzer, M., Fruth, et al. (1995) Paired Helical Filament-Like Phosphorylation of Tau, Deposition of Beta/A4-Amyloid and Memory Impairment in Rat Induced by Chronic Inhibition of Phospha-tase 1 and 2A. Neuroscience, 69, 691-698. https://doi.org/10.1016/0306-4522(95)00347-L
- 30. Kamat, P.K., Tota, et al. (2012) A Study on Neuroinflammatory Marker in Brain Areas of Okadaic Acid (ICV) Induced Memory Impaired Rats. Life Sciences, 90, 713-720. https://doi.org/10.1016/j.lfs.2012.03.012
- 31. Ferrer, I., Gomez-Isla, Puig, B., et al. (2005) Current Advances on Dif-ferent Kinases Involved in Tau Phosphorylation, and Implications in Alzheimer’s Disease and Tauopathies. Alzheimer’s Research, 2, 3-18. https://doi.org/10.2174/1567205052772713
- 32. Yoon, S.Y., Choi, J.E., Ham, J.H., et al. (2012) zVLL-CHO at Low Concen-trations Acts as a Calpain Inhibitor to Protect Neurons against Okadaic Acid-Induced Neurodegeneration. Neuroscience Letters, 509, 33-38. https://doi.org/10.1016/j.neulet.2011.12.042
- 33. 王伟. 腹泻性贝类毒素的研究进展[J]. 农家科技, 2011(4): 82-83.
- 34. Martín-López, A. and Gallardo-Rodríguez (2012) Cytotoxicity of Yessotoxin and Okadaic Acid in Mouse T Lymphocyte Cell lineEL-4. Toxicon, 60, 1049-1056. https://doi.org/10.1016/j.toxicon.2012.07.008
- 35. Franchinia, A., Marchesini, E., Poletti, R., et al. (2005) Swiss Mice CD1 Fed on Mussels Contaminated by Okadaic Acid and Yessotoxins: Effects on Thymus and Spleen. European Journal of Histochemistry, 49, 179-188.
- 36. Ito, E., Ohkusu, M., Terao, K., et al. (1997) Effects of Repeated Injections of Palytoxin on Lymphoid Tissues in Mice. Toxicon, 35, 679-688. https://doi.org/10.1016/S0041-0101(96)00184-5
- 37. 李勇, 杨雁, 史清文, 等. 海洋毒素研究进展[J]. 天然产物研究与开发, 2011(3): 582-589.
- 38. Fujiki, H., Suganuma, M., Suguri, H., et al. (1988) Diarrhetic Shellfish Toxin, Dinophysistoxin-1, Is a Potent Tumor Promoter on Mouse Skin. Japanese Journal of Cancer Research, 79, 1089-1093. https://doi.org/10.1111/j.1349-7006.1988.tb01531.x
- 39. Thompson, E.J., MacGowan, J., Young, M.R., Colburn, N. and Bowden, G.T. (2002) Dominant Negative c-jun Specifically Blocks Okadaic Acid-Induced Skin Tumor Promotion. Cancer Research, 62, 3044-3047.
- 40. Vanessa, V., María, V.P., Eduardo, P., Josefina, M., et al. (2013) Okadaic Acid: More than a Diarrheic Toxin. Marine Drugs, 11, 4328-4349.
- 41. 赵哲, 刘莉, 刘琨, 等. PP2A对转化生长因子β1诱导的淋巴瘤细胞凋亡的影响[J]. 华中科技大学学报(医学版), 2017(1): 55-59.
- 42. 赵晓芳, 计融. 腹泻性贝类毒素研究进展[J]. 中国热带医学杂志, 2006(1): 157-157.
- 43. 周明, 张学景, 蔡于琛, 等. 蛋白磷酸酶1和2A抑制剂的研究进展[J]. 中国药学杂志, 2007, 42(5): 324-328.
- 44. Cordier, S., Monfort, C., Miossec, L., et al. (2000) Ecological Analysis of Digestive Cancer Mortality Related to Contamination by Diarrhetic Shellfish Poisoning Toxins along the Coasts of France. Environmental Research, 84, 145-150. https://doi.org/10.1006/enrs.2000.4103
- 45. Valdiglesias, V., Fernández-Tajes, J., Pásaro, E., et al. (2013) Okadaic Acid Induces Alterations in the Expression Level of Cancer-Related Genes. Ecotoxicology and Environmental Safety, 92, 303-311. https://doi.org/10.1016/j.ecoenv.2013.03.009
- 46. Manerio, E., Rodas, V.L. and Costas, E. (2008) Shellfish Consumption, a Major Risk Factor for Colorectal Cancer. Medical Hypotheses, 70, 409-412. https://doi.org/10.1016/j.mehy.2007.03.041
附录一 注释列表
NOTES
*通讯作者。
