Advances in Microbiology
Vol.07 No.01(2018), Article ID:23961,11
pages
10.12677/AMB.2018.71001
Study on Response Surface Methodology as an Approach for Optimization of Microwave-Assisted Extraction and Antioxidant Activities of Polysaccharides from Ceriporia lacerate
Ting Yao, Xue Sun, Ruicheng Xu, Yanliang Chu, Na Wang*
College of Biotechnology, Jiangsu University of Science and Technology, Zhenjiang Jiangsu
*通讯作者。

Received: Feb. 9th, 2018; accepted: Feb. 23rd, 2018; published: Mar. 2nd, 2018

ABSTRACT
Crude polysaccharides were analyzed from the mycelium of Ceriporia lacerate isolated and identified in our laboratory. According to the single-factor experiments, response surface methodology (RSM) based on a central composite design (CCD) was applied for the optimization of microwave-assisted extraction process. The antioxidant activities of crude polysaccharides were also detected in this paper. The test results indicated that the optimum extraction conditions were obtained as follows: microwave time 30 s, microwave power 480 W, ratio of sample to water 1:20, extract time 30 min and extract temperature 35˚C. Under these conditions, the predictive and verified values of maximal yield of polysaccharides were 6.523% and 6.437%, respectively. Crude polysaccharides from the mycelium of Ceriporia lacerate showed a certain amount of antioxidant activity. The antioxidant capacity of polysaccharide and its concentration had good dose-effect relationship. With the increase of concentration, the antioxidant activities became stronger. Crude polysaccharides had strong anti-lipid peroxidation and scavenging superoxide anion radical effects, but weak in reducing effects. At the same time, scavenging effects of hydroxyl free radicals and hydrogen peroxide were also good. Crude polysaccharides from the mycelium of Ceriporia lacerate had natural antioxidant capacity, and had some realistic practical significance to develop multi-functional antioxidant products.
Keywords:Ceriporia lacerate, Polysaccharide, Response Surface Methodology, Microwave, Antioxidant Activity
响应曲面法优化撕裂蜡孔菌多糖的微波辅助提取工艺及抗氧化活性研究
姚婷,孙雪,许瑞程,褚衍亮,王娜*
江苏科技大学生物技术学院,江苏 镇江
收稿日期:2018年2月9日;录用日期:2018年2月23日;发布日期:2018年3月2日

摘 要
本论文以实验室自行筛选并鉴定的一株撕裂蜡孔菌为材料,以多糖得率为评价指标,在单因素试验的基础上,利用响应曲面法的中心组合设计,对菌丝体多糖的微波辅助提取工艺进行优化,并对多糖的体外抗氧化活性进行了研究。结果表明:以水为浸提溶剂,微波辅助提取多糖的最优条件为微波时间30 s、微波功率480 W、液料比1:20、浸提时间30 min、浸提温度35℃。在此条件下菌丝体多糖得率预测值为6.523%,实测值为6.437%。体外抗氧化试验结果证实菌丝体多糖具有一定的抗氧化活性,抗氧化能力与浓度间有很好的量效关系,浓度越大,抗氧化能力越强。其中菌丝体多糖的抗脂质过氧化能力和清除超氧阴离子自由基能力较强,对羟自由基和过氧化氢的清除效果较好,但还原能力较弱。撕裂蜡孔菌菌丝体多糖具有天然的抗氧化能力,在开发多糖类天然抗氧化剂用品方面具有一定的现实意义。
关键词 :撕裂蜡孔菌,多糖,响应曲面法,微波,抗氧化活性

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
多糖(Polysaccharide)是一类由单糖脱水缩合而成的天然高分子化合物,分子量从几千到几百万不等 [1] ,是生物体内重要的能量储备和结构物质,也是除蛋白质和核酸以外的重要生命物质 [2] [3] ,功能涉及多细胞生命体的生长发育、成熟衰老及免疫感染等多个生理和病理过程 [4] 。大量的药理学实验表明,糖类化合物具有增强和调节机体免疫、抗病毒、抗肿瘤、抗辐射、抗衰老、抗氧化等作用 [5] [6] ,现已成为营养保健和功能性食品的重要来源。
多糖种类繁多,广泛存在于植物、动物、微生物(细菌和真菌)和藻类组织中。微生物多糖是多糖研究中较为详细的一类多糖,目前国内外学者从真菌(主要是担子菌纲和子囊菌纲)中已得到真菌多糖达数百种,香菇多糖、云芝多糖、灰树花多糖、裂褶多糖和槐树多糖等已经临床用于免疫、抗肿瘤治疗 [4] ;同时真菌多糖纯天然的抗氧化功能也成为科研工作者的研究热点 [7] 。
撕裂蜡孔菌(Ceriporia lacerata),属于真菌界、担子菌门、多孔菌目、蜡孔菌属的一种真菌,多孔菌如灵芝、云芝等很多属于传统中药或民间药物。撕裂蜡孔菌是近几年新发现的蜡孔菌属的一个新品种,目前对其研究的还很少,但是专家估测其有很高的利用价值,研究可扩大到生物制浆造纸、饲料蛋白、抗癌药物和环境净化等领域。
微波辅助提取技术将溶剂浸提与微波提取相结合,可使样品瞬时产生大量热能,细胞破裂,细胞内物质易渗出,缩短实验时间,提高物质提取率 [8] 。响应曲面法(Response Surface Methodology, RSM)因其合理的试验设计,经济的试验方式,快速有效地确定多因素系统最佳条件等优势被广泛应用于众多过程的优化控制 [9] 。本论文以实验室自行筛选和鉴定的一株撕裂蜡孔菌(Ceriporia lacerata)菌丝体为原料,以水为提取溶剂,采用单因素试验对微波提取菌丝体多糖进行研究,并运用响应曲面法对影响多糖提取的几个因素进行了分析,优化其提取工艺;同时对菌丝体多糖的抗氧化性能进行分析,为撕裂蜡孔菌的有效开发利用提供理论依据。
2. 材料与方法
2.1. 试验菌株和主要仪器
撕裂蜡孔菌(Ceriporia lacerata):由江苏科技大学生物技术学院食品生物技术实验室自行从桑枝上分离和鉴定(NCBI登录号为:KP677607)。
主要仪器:Beckman ALLEGRA 64R高速冷冻离心机,DHZ-052D双层恒温摇床,UV9600紫外可见分光光度计,SW-CJ-1F型超净工作台,MCR-3微波化学反应器,日本三洋SANYO高压蒸气灭菌器。
2.2. 菌株发酵与菌丝体收集
将撕裂蜡孔菌接种在灭菌PD培养基中(去皮马铃薯200 g,葡萄糖20 g,水1000 mL,pH自然),28℃培养箱(120 r/min)中震荡培养8 d。四层纱布过滤,将收集的菌丝体在不高于50℃烘箱中烘干,研磨后过80目筛,粉末收集备用。
2.3. 单因素及响应曲面优化试验设计
选取对菌丝体多糖提取有显著影响的料液比(mg/mL,1:10、1:20、1:30、1:40、1:50和1:60)、微波时间(s,20、30、40、50和60)、微波强度(W,160、320、480、640和800)、浸提时间(min,20、30、40、50和60)和浸提温度(℃,15、25、35、45和55)为考察因素,以多糖得率(%)为评价指标,进行单因素试验。在单因素试验结果的基础上,应用Design Expert 7.0软件进行试验设计,响应曲面法优化菌丝体多糖的提取工艺。
2.4. 多糖得率的测定
多糖含量的测定采用硫酸–苯酚法 [10] 。将多糖提取液离心(5000 r/min,10 min,25℃),上清液用蒸馏水稀释后进行多糖测定。取2 mL待测液,加入1 mL苯酚溶液(6%,临时配制),摇匀后,缓慢加入5 mL浓硫酸(加入时悬空,不断反复摇动试管,使反应充分),摇匀,室温静置30 min,在490 nm波长下测定吸光度值。以葡萄糖为标准品绘制标准曲线。
2.5. 菌丝体粗多糖的体外抗氧化活性
将菌丝体多糖提取液离心(5000 r/min,10 min,25℃),上清液经旋转蒸发仪浓缩,冷冻干燥。用蒸馏水配成0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL和1 mg/mL系列浓度梯度用于体外抗氧化活性的测定。
取菌丝体多糖溶液2 mL于试管中,依次加入2 mL 6 mmol/L的FeSO4溶液和2 mL 6 mmol/L的H2O2溶液,混匀后室温静置10 min。混合液中再加入2 mL 6 mmol/L的水杨酸,混匀后室温静置30 min。510 nm波长处吸光值记为A1,双蒸水代替水杨酸时吸光值记为A2,以双蒸水代替多糖溶液时吸光值记为A0 [11] 。羟基自由基清除率按照公式E/% = [1 − (A1 − A2)/A0] × 100%计算。
取菌丝体多糖溶液5 mL于试管中,加入由50 mmol/L磷酸缓冲液(pH 7.4)配制的10 mmol/L H2O2溶液5 mL,缓慢摇匀,10 min后记下在230 nm处时的吸光度值,记为A1。A0为不加样品液的H2O2溶液吸光度值,A2为不加H2O2溶液的样品液吸光值。过氧化氢的清除率按照公式E/% = [A0 − (A1 − A2)]/A0 × 100%计算 [12] 。
取菌丝体多糖溶液1 mL,加入2.5 mL磷酸缓冲液(pH 6.6)和2.5 mL 1%铁氰化钾溶液,混匀后50℃恒温水浴20 min,再加入2.5 mL 10%三氯乙酸,4000 r/min离心10 min。取上清液2 mL加入2.5 mL蒸馏水,再加入0.5 mL 0.1% FeCl3,充分反应后于700 nm处测定其吸光度。吸光值越高,还原性越强 [13] 。
吸取1:25卵黄悬液0.4 mL,加入菌丝体多糖溶液0.8 mL,再加入25 mmol/L的FeSO4溶液0.4 mL,用pH7.4的磷酸缓冲液补充至4 mL,37℃振荡15 min。加入20%三氯乙酸1 mL,3500 r/min离心10 min。取上清液4 mL,加入质量分数为0.8%的TBA(硫代巴比妥酸)溶液1 mL,封口,沸水浴15 min,532 nm处下测定吸光度值。不加样品管的吸光度为A0,样品加磷酸缓冲液的吸光度为A1。待测液对卵黄脂质过氧化的抑制率(%) = [(A0 − A1)/A0] × 100% [14] 。
1:25卵黄悬液的配制:新鲜鸡蛋去鸡蛋清,蛋黄用pH 7.4的0.1 mol/L磷酸盐缓冲溶液配成1:1悬液,磁力搅拌10 min。取1 mL该混合液于25 mL容量瓶中,pH 7.4磷酸盐缓冲液定容至25 mL,4℃冷藏备用。
采用邻苯三酚自氧化法测定菌丝体多糖对超氧阴离子自由基的清除能力 [15] 。取0.05 mol/L Tris-HCl缓冲液4.5 mL(pH 8.2),25℃水浴中预热20 min后再加入l mL菌丝体多糖溶液和0.4 mL邻苯三酚溶液(25 mmol/L),混合均匀后置于25℃水浴中反应4 min,加入1 mL 8 mol/L HCl终止反应,在299 nm处测定吸光度A1,在空白对照组中以相同体积的蒸馏水代替溶液样品,吸光度记为A0。超氧离子自由基清除率按照公式E/% = (A0 − A1)/A0 × 100%计算。
2.6. 数据处理
每一试验均重复三次,所示数据为三次结果的平均值。
3. 结果与分析
3.1. 单因素试验
固定料液比1:20,微波强度400 W,浸提温度45℃,浸提时间30 min,微波时间对菌丝体多糖的提取有一定的影响(图1(a))。在试验微波时间范围内多糖得率呈现先升后降趋势,在微波时间30 s时,多糖得率最大可达2.11%。由于微波加热升温极其迅速,处理时间过短,多糖溶解不充分;处理时间过长,多糖会受热分解,因此选用30 s作为最佳的微波时间。
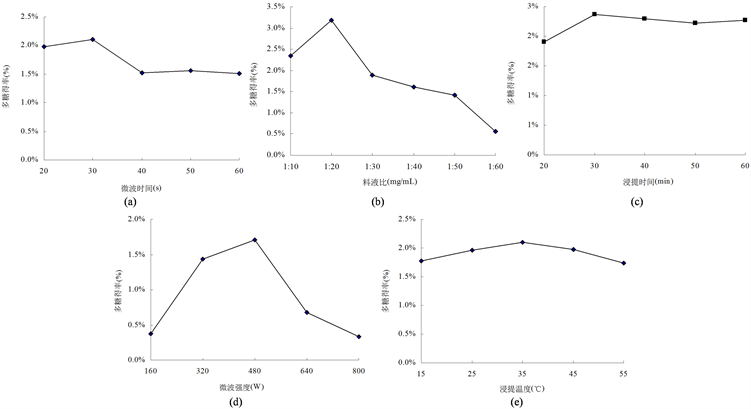
Figure 1. Effects of different factors on the polysaccharide yield
图1. 单因素对多糖得率的影响
3.1.2. 料液比对菌丝体多糖提取的影响
固定微波强度400 W,浸提温度45℃,浸提时间30 min,微波时间30 s,料液比对菌丝体多糖提取的影响如图1(b)所示。随着料液比的增大,菌丝体多糖得率逐渐提高,当料液比在1:20时,多糖得率达到最大,为3.18%。料液比较低时,多糖溶解不充分;当料液比增大后,多糖虽能充分溶胀,但由于溶液体积的增加,微波对菌丝体的作用效果下降,多糖得率随之降低。确定1:20为最佳料液比。
固定微波强度400 W,浸提温度45℃,微波时间30 s,料液比1:20,浸提时间对菌丝体多糖提取的影响如图1(c)所示。在试验浸提时间范围内,多糖得率呈现先上升后下降的总体趋势,在浸提时间为30 min时,多糖得率达到最大值,为2.37%。多糖的浸出过程与时间密切相关,时间过短,多糖溶解不充分;时间过长,会引起产物结构的变化进而使提取率降低 [16] 。确定30 min为最佳浸提时间。
固定浸提温度45℃,微波时间30 s,料液比1:20,浸提时间30 min,微波强度对菌丝体多糖的提取有一定的影响(图1(d))。在试验微波强度范围内,随着微波强度的增大,多糖得率也随之迅速增大,在强度为480 W时多糖得率达到最大值;但当微波强度进一步提高时,多糖得率又急剧下降。微波强度过大,溶液中分子震荡加剧,温度急剧升高,多糖部分分解从而造成多糖的损失。选用480 W为最佳微波强度。
固定微波时间30 s,料液比1:20,浸提时间30 min,微波强度480 W,浸提温度对菌丝体多糖提取的影响如图1(e)所示。在试验设定的浸提温度范围内,随着浸提温度的升高,多糖得率逐渐增加;当浸提温度高于35℃时,多糖的得率又随温度的升高而下降。伴随温度的升高,原料溶胀度增大,传质强化,从而使多糖溶出率增加;但由于多糖是活性物质,温度过高易破坏其结构 [16] ,从而使多糖得率下降。选用35℃为最佳浸提温度。
3.2. 响应曲面法优化菌丝体多糖提取工艺
在单因素试验基础上,采用中心组合试验Box-Behnken设计方案,微波时间(s)、料液比(mg/mL)、浸提时间(min)、微波强度(W)和浸提温度(℃),分别用A、B、C、D和E表示,并以+1、0和−1分别代表变量的水平,响应值Y为菌丝体多糖得率(%),试验自变量因素及水平编码详见表1,试验设计方案及结果见表2。
表2共46个试验点,其中41个为析因点,5个为零点。析因点为自变量取值在A、B、C、D和E所构成的顶点,零点为区域的中心点,其中零点试验重复5次,用以估算试验误差。
利用Design-Expert 7.0软件对表2中的试验数据进行多元回归拟合,得到菌丝体多糖得率(Y)对微波时间(A)、料液比(B)、浸提时间(C)、微波强度(D)和浸提温度(E)的二次多项回归模型为:
对模型方程进行显著性检验(表3),模型的F = 1.94,p > 0.05,表明回归模型不显著;矢拟项F = 83.04,p < 0.0001,极显著。由于回归系数R2 = 0.998,所以实际值与预测值具有高度相关性,这表示模型和实验值拟合良好,具有99.8%数据拟合,试验方法的可信度较高,此模型能够对撕裂蜡孔菌多糖的提取率进行准确的预测与分析。模型一次项A、B、C、D和E对Y影响不显著;二次项A2、B2、D2和E2对Y影响显著,C2不具显著性;交互项对Y均不具显著性影响,因此各个具体试验因子对Y值的影响不是简单的线性关系。
根据一次项F值,试验5个因素对菌丝体多糖提取的影响程度大小依次是浸提时间(C) > 微波强度(D) > 料液比(B) > 浸提温度(E) > 微波时间(A)。
图2为各因素交互作用的曲面图,表示某一因素取零水平时,其余两因素对菌丝体多糖提取的影响。从响应面分析图上可看出最佳参数以及各参数之间的相互作用。等高线可直观反映两变量交互作用的显著程度,圆形表示两因素交互作用不明显,而曲率半径较大的椭圆表示两因素交互作用显著,且曲率半径越大,交互作用越显著 [17] 。
通过Design expert 7.0软件分析得到撕裂蜡孔菌菌丝体多糖的最优提取条件为:微波时间32.27 s、料液比1:24.17、浸提时间36.56 min、微波功率480.49 W、浸提温度37.89℃。为了操作方便,修正最佳提取条件为微波时间30 s、微波功率480 W、液料比1:20、浸提时间30 min、浸提温度35℃。测得撕裂蜡孔菌多糖提取率为6.437%,与理论预测值6.523%基本一致。表明所得模型可以较好的预测撕裂蜡孔菌多糖的提取情况。
3.3. 菌丝体多糖体外抗氧化活性
羟自由基是活性氧中毒性最强的氧自由基,可造成有机体中生物大分子物质的氧化性损伤,使细胞坏死。在试验浓度范围内,菌丝体多糖对羟自由基有一定的清除作用,清除效果与多糖浓度呈正相关。当浓度为1 mg/mL时,清除率可达60.74%;但与同浓度抗氧化剂Vc相比,清除率较低(图3(a))。
菌丝体多糖对过氧化氢也表现出一定的清除能力(图3(b)),且清除能力随浓度的增加而增加,当多糖浓度为1 mg/mL时,清除率达44.46%,为0.2 mg/mL浓度时的4.16倍,但明显低于Vc的清除能力。
多糖的还原能力与其抗氧化性之间存在相关性,多糖通过自身的还原能力给出电子而清除自由基。还原力越强,抗氧化性越强 [18] 。菌丝体多糖还原力随浓度的升高而增强,但远远低于同浓度Vc的还原能力(图3(c))。
菌丝体多糖对蛋黄脂质过氧化表现出较高的抑制效果(图3(d)),显著高于同浓度Vc。当多糖浓度为1 mg/mL时,抑制率可达82.23%,比Vc增加了29.70%。
Table 1. Independent variables and levels in Box-Behnken
表1. Box-Behnken设计的因素及水平编码
Table 2. Design matrix and responses values of polysaccharide yield in mycelium
表2. 试验设计方案及菌丝体多糖得率测定值
Table 3. Variance analysis of the regression mode
表3. 回归模型方差分析
注:**表示差异极显著(P < 0.01),*表示差异显著(P < 0.05)。**significant at 0.01 level,*significant at 0.05 leve1。
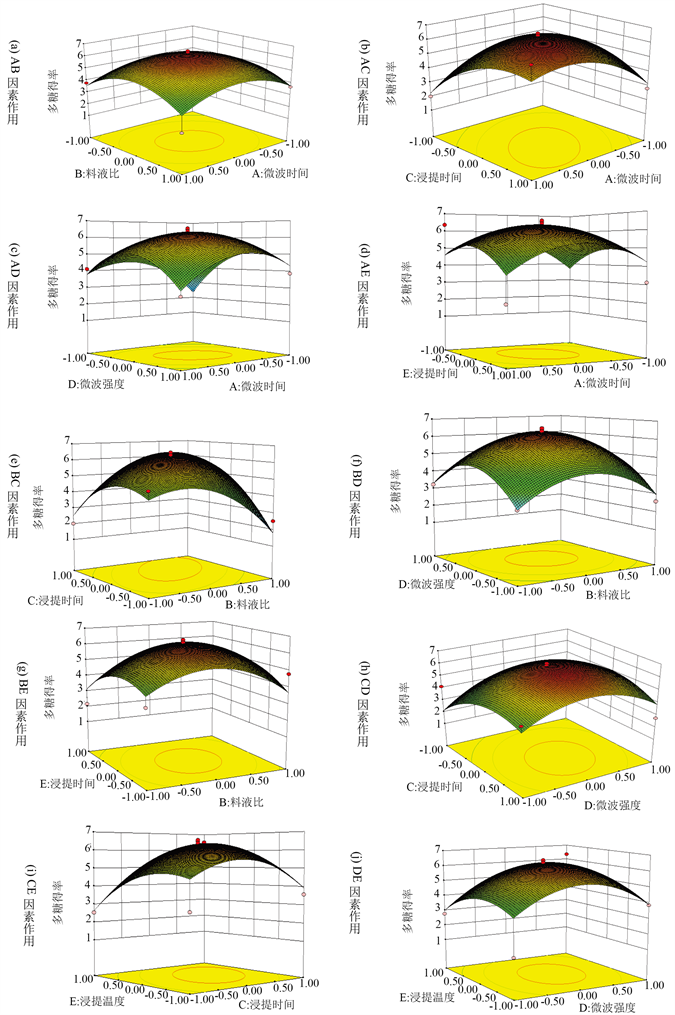
Figure 2. Response surface of the polysaccharide yield
图2. 多糖得率的响应曲面
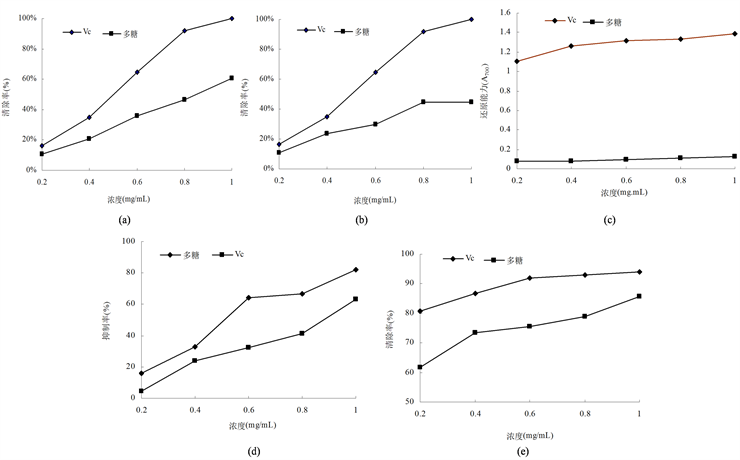
Figure 3. Antioxidant activities of polysaccharide from mycelium
图3. 菌丝体多糖的抗氧化活性
超氧阴离子( )是弱的氧化剂,其能在有机体内通过歧化等反应产生羟自由基、过氧化物、单线态氧等,对细胞膜和DNA造成损害 [19] [20] 。由图3(e)可知,菌丝体多糖对超氧阴离子自由基的抑制作用较为明显,随糖浓度的增加而增强。当糖浓度为1 mg/mL时,抑制率可达85.65%,仅比同浓度的Vc低8.84%。
4. 结论
本实验应用响应曲面法对撕裂蜡孔菌菌丝体多糖提取的工艺条件进行优化,对真菌资源的综合利用具有较好的现实意义。优化后最佳水提取多糖的工艺条件为:微波时间32.27 s、料液比1:24.17、浸提时间36.56 min、微波功率480.49 W、浸提温度37.89℃。根据实际操作情况,修正最佳提取工艺条件为:微波时间30 s、微波功率480 W、液料比1:20、浸提时间30 min、浸提温度35℃。在此修正条件下菌丝体多糖实际得率为6.437%,比理论预测值6.523%低0.086%,表明所得模型可以较好的预测撕裂蜡孔菌多糖的提取情况。
撕裂蜡孔菌菌丝体多糖表现出一定的抗氧化能力,且抗氧化效果与浓度表现出良好的相关性。多糖对羟自由基和过氧化氢的清除作用较好,抗脂质过氧化能力和清除超氧阴离子自由基能力最强,但还原能力比较弱。
综上所述,撕裂蜡孔菌多糖具有较强的抗氧化能力,在开发具有清除自由基、抗脂质过氧化、延缓机体衰老的天然抗氧化剂用品方面具有较好的前景。
基金项目
江苏科技大学本科创新计划。
文章引用
姚 婷,孙 雪,许瑞程,褚衍亮,王 娜. 响应曲面法优化撕裂蜡孔菌多糖的微波辅助提取工艺及抗氧化活性研究
Study on Response Surface Methodology as an Approach for Optimization of Microwave-Assisted Extraction and Antioxidant Activities of Polysaccharides from Ceriporia lacerate[J]. 微生物前沿, 2018, 07(01): 1-11. https://doi.org/10.12677/AMB.2018.71001
参考文献
- 1. 翁梁, 温鲁. 药用真菌多糖研究进展[J]. 食品科学, 2008, 29(12): 748-751.
- 2. 赵国华, 陈宗道, 李志孝, 等. 活性多糖的研究进展[J]. 食品与发酵工业, 2001, 27(7): 45-48.
- 3. 刘锐. 多糖类物质的研究进展[J]. 安徽农业科学, 2005, 33(9): 1722-1725.
- 4. 魏传晚, 曾和平, 王晓娟, 等. 多糖及其研究进展简述[J]. 广东化工, 2004(1): 36-40, 11.
- 5. 申利红, 王建森, 李雅, 等. 植物多糖的研究及应用进展[J]. 中国农学通报, 2011, 27(2): 349-352.
- 6. 何余堂, 潘孝明. 植物多糖的结构与活性研究进展[J]. 食品科学, 2010, 31(17): 493-496.
- 7. 阿燕. 真菌多糖抗氧化活性的研究进展[J]. 微生物学杂志, 2012, 32(4): 83-86.
- 8. 聂金媛, 吴成岩, 吴世容, 等. 微波辅助提取茯苓中茯苓多糖的研究[J]. 中草药, 2004, 35(12): 1346-1348.
- 9. Li, Q. and Fu, C. (2005) Application of Response Surface Methodology for Extraction Optimization of Germinant Pumpkin Seeds Protein. Food Chemistry, 92, 701-706. https://doi.org/10.1016/j.foodchem.2004.08.042
- 10. 赵美峰, 魏超妮, 剡建华. 硫酸–苯酚法测定黑果枸杞中多糖的含量[J]. 中医药学信息, 2015, 32(2): 58-60.
- 11. 祝子坪, 李娜. 桑黄菌多糖体外抗氧化作用[J]. 食品科学, 2011, 32(19): 92-95.
- 12. 武忠伟, 许桂芳, 曹蓬勃, 等. 虫草与富硒虫草多糖的体外抗氧化活性[J]. 食品科学, 2011, 32(9): 76-78.
- 13. 储维维, 张烨, 段晓梅, 等. 大理野生蕨菜总黄酮的提取及抗氧化活性研究[J]. 食品研究与开发, 2016, 37(2): 52-57.
- 14. 吴冬青, 安红钢, 徐新建, 等. 甘肃临泽小枣多糖提取及抗氧化性[J]. 光谱实验室, 2011, 28(3): 1066-1070.
- 15. 程超, 李伟.几种植物水溶性多糖的体外抗氧化作用[J]. 食品工业科技, 2006, 27(9): 63-65.
- 16. 王鸿, 邓泽元, 刘蓉, 等. 响应曲面法优化山蕗菜根多糖的提取工艺[J]. 食品科学, 2010, 31(2): 46-50.
- 17. 徐卫东, 王佩香, 欧阳臻, 等. 响应曲面法优化桑枝多糖提取工艺[J]. 中国药房, 2011, 22(43): 4063-4067.
- 18. 盛伟, 方晓阳, 吴萍. 白灵菇、杏鲍菇、阿魏菇多糖体外抗氧化活性研究[J]. 食品工业科技, 2008, 29(5): 103-105, 109.
- 19. Macdonald, J., Galley, H.F. and Webster, N.R. (2003) Oxidative Stress and Gene Expression in Sepsis. British Journal of Anaesthesia, 90, 221-232. https://doi.org/10.1093/bja/aeg034
- 20. 汪艳群. 五味子多糖的分离、结构鉴定及免疫活性研究[D]: [博士学位论文]. 辽宁: 沈阳农业大学, 2012.
