Advances in Microbiology
Vol.
09
No.
01
(
2020
), Article ID:
34572
,
9
pages
10.12677/AMB.2020.91001
Protective Effect of Exopolysaccharide from Pseudomonas rhodesiae PYQ4 against UVC Radiation Induced Damage on HaCaT Cells
Yiqing Wang1, Jixiang Huang2, Wenwen Zhou1*
1College of Biosystems Engineering and Food Science, Zhejiang Key Laboratory for Agro-Food Processing, National-Local Joint Engineering Laboratory of Intelligent Food Technology and Equipment, Zhejiang University, Hangzhou Zhejiang
2HeZe (High-tech Zone) BioUnique Biotechnology Co. Ltd, Heze Shandong

Received: Feb. 25th, 2020; accepted: Mar. 11th, 2020; published: Mar. 18th, 2020

ABSTRACT
A strain PYQ4 with high production of exopolysaccharide (EPS) was isolated from soil and identified by molecular biology techniques. The protective effect and its mechanism of the EPS produced by PYQ4 against UVC radiation on HaCaT cells were evaluated. The results showed that the strain PYQ4 was identified as Pseudomonas rhodesiae. After cultured for 48 h, the yield of EPS reached 2.50 g/L. The EPS was non-cytotoxic to HaCaT cells in the concentration range of 100 - 1000 µg/mL. After UVC irradiation, the treatment with EPS increased the survival rate of HaCaT cells, decreased the intracellular reactive oxygen species (ROS) content, and mitigated the collapse of mitochondrial membrane potential (MMP). The differences were all statistically significant (p <0.05), indicating that the EPS has a significant protective effect against oxidative damage caused by UVC radiation on HaCaT cells.
Keywords:Pseudomonas rhodesiae, Exopolysaccharide, UVC, Cell Damage, Biological Activity

罗氏假单胞菌PYQ4胞外多糖对UVC辐照HaCaT细胞损伤的保护作用
汪旖清1,黄继翔2,周文文1*
1浙江大学生物系统工程与食品科学学院,浙江省农产品加工技术研究重点实验室,智能食品加工技术与装备国家地方联合工程实验室,浙江 杭州
2菏泽高新区优科生物科技有限公司,山东 菏泽

收稿日期:2020年2月25日;录用日期:2020年3月11日;发布日期:2020年3月18日

摘 要
从土壤中分离筛选一株高产胞外多糖的菌株PYQ4,运用分子生物学技术对其进行鉴定,并探究其胞外多糖(EPS)对短波紫外线(UVC)引起人永生化角质细胞(HaCaT)损伤的保护作用和保护机制。结果表明,筛选并分离得到的菌株PYQ4为罗氏假单胞菌(Pseudomonas rhodesiae)。菌株PYQ4发酵48 h后多糖产量可达2.50 g/L,其所产EPS在100~1000 µg/mL的浓度范围内对HaCaT细胞均无细胞毒性。在UVC辐照后,EPS的加入使得HaCaT细胞存活率上升,细胞内活性氧(ROS)含量下降同时减轻线粒体膜电位(MMP)的降低,差异均具有统计学意义(p < 0.05),说明该EPS对UVC辐射HaCaT细胞引起的氧化损伤有显著保护作用。
关键词 :罗氏假单胞菌,胞外多糖,UVC,细胞损伤,生物活性

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
按照波长的不同,紫外线可以分为三种类型:长波紫外线(UVA, 320~400 nm),中波紫外线(UVB, 280~320 nm)和短波紫外线(UVC, 190~280 nm) [1]。其中UVA和UVB的穿透力较强可以抵达地球表面,而绝大部分的UVC被臭氧层吸收,但UVC是三者中破坏力最高的类型,可以对人体皮肤组织和细胞产生巨大伤害,诱发细胞癌变。近年来,得益于其独特的灭菌功能,UVC越来越广泛地应用于工业生产和日常生活,而相关人员暴露于UVC下的风险也越来越大。
研究表明,紫外线辐射对生物体有多种生理影响,过度暴露于紫外线可以诱导细胞产生过量的活性氧(ROS),破坏其自身的抗氧化防御系统,引起脂质过氧化和DNA损伤,影响相关的信号传导途径,破坏细胞结构或功能,并导致光老化、炎症、免疫抑制甚至恶性肿瘤的产生 [2]。因此,寻找合适的方法来降低UV引起的损害十分有必要。一些植物和大型真菌的提取物由于其良好的抗氧化活性已被研究者们关注并应用于这方面。在众多降低UV引起的损害作用的物质中,多糖由于其良好的抗氧化活性而成为近年来的研究热点之一。目前,研究主要聚焦在植物多糖和大型真菌多糖上 [3] [4],对细菌多糖在这方面的生物活性作用报道较少。
细菌胞外多糖是细菌产生的一类大分子聚合物,在许多重要生命过程中起关键作用 [5]。在体外和体内研究中,细菌胞外多糖均表现出广泛的生物活性,如持水、抗氧化、免疫调节以及抗肿瘤等 [6] [7] [8] [9],在食品和医学等领域受到越来越多的关注。相比于植物多糖或真菌多糖,细菌多糖具有生产周期短、可大量发酵提取、品质稳定等优势,具有良好的应用前景。
本研究从土壤中筛选了一株高产胞外多糖的罗氏假单胞菌菌株PYQ4,并运用HaCaT细胞模型评估了PYQ4所产胞外多糖对UVC辐射所致细胞损伤的保护作用,为未来保健食品、护肤品的开发提供了理论基础,具有广阔的应用前景。
2. 材料与方法
2.1. 材料与设备
2.1.1. 材料与试剂
筛选培养基:蔗糖20.0 g,胰蛋白胨10.0 g,酵母浸粉5.0 g,磷酸氢二钠3.0 g,琼脂20.0 g,蒸馏水1 L,115℃灭菌25 min。
发酵培养基:蔗糖50.0 g,胰蛋白胨5.0 g,酵母浸粉1.0 g,磷酸氢二钠3.0 g,蒸馏水1 L,115℃灭菌25 min。
人永生化角质形成细胞(HaCaT)购自中国典型培养物保藏中心。细菌基因组DNA提取试剂盒购自宝日医生物工程有限公司。2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)、罗丹明123 (Rh123)荧光探针购自上海碧云天生物技术有限公司。噻唑蓝(MTT)购自Sigma-Aldrich。使用的其他试剂均为分析纯。
2.1.2. 仪器与设备
SW-CJ-1FD净化工作台,苏州净化设备有限公司;LRH-250生化培养箱,上海一恒科技有限公司;A3K15冷冻离心机,德国sigma公司;FreeZone冷冻干燥机,美国Labconco公司;Spark 10M多功能酶标仪,瑞士Tecan公司;HF90 CO2培养箱,上海力申仪器有限公司;石英紫外灯管,北京精英特种灯泡厂;Nikon ECLIPSE Ti倒置显微镜,日本尼康公司。
2.2. 试验方法
2.2.1. 产胞外多糖菌株的筛选与鉴定
从山东菏泽的公园、湖滨等地收集土壤样本,每个样本中取10 g加至90 mL无菌生理盐水中,混合均匀后梯度稀释,取合适稀释度的稀释液100 µL涂布于筛选平板上,30℃培养48 h。观察并记录菌落特征。选取粘稠,有拉丝的单菌落至筛选平板上进行划线纯化并保存,将该菌株命名为PYQ4。
根据宝日医生物细菌基因组DNA提取试剂盒步骤提取该菌株的总DNA,以通用引物27F和1492R扩增该菌的16S rDNA基因,回收扩增产物后进行测序,通过测定16S rDNA的序列来进行菌种鉴定。使用BLAST将PCR产物的测序结果与NCBI GenBank中的基因序列进行比较。
2.2.2. 胞外多糖的制备
胞外多糖提取方法参考已有文献并稍作修改 [10]。将分离菌株以2 %的接种量接种至发酵培养基中,在30℃,转速为150 rpm的摇床中振荡培养48小时。所得发酵液于冷冻离心机中4℃、4000 × g下离心15 min除去菌体,所得上清液在60℃的旋转蒸发仪中浓缩。随后用Sevag法去除蛋白质5次。取上清液与三倍体积的无水乙醇混合,并在4℃下沉淀过夜。将沉淀物重新溶解在去离子水中,透析(截留量3500 Da) 2天后冷冻干燥,获得EPS。
采用Bradford法 [11] 和苯酚–硫酸法 [12] 测定EPS中总蛋白和碳水化合物的含量,分别以牛血清白蛋白和D-葡萄糖为标准。
2.2.3. HaCaT细胞培养
HaCaT细胞在含有100 μg/mL青霉素,100 U/mL链霉素和10% (v/v) FBS的DMEM高糖培养,并置于37℃,5% CO2条件下的培养箱中。当细胞融合度达到80%后,弃去培养基,将细胞用含0.02% EDTA的胰蛋白酶消化并接种到不同规格的孔板中以待后续实验,具体规格取决于检测指标。
2.2.4. 胞外多糖对HaCaT细胞的毒性试验
采用MTT法测定EPS对HaCaT细胞存活率的影响。将细胞以5000个/孔的密度接种至96孔板中,培养24 h后加入含不同浓度EPS (100,200,300,600,1000 µg/mL)的新鲜培养基。孵育24 h后移去培养基,PBS清洗后每孔加入0.5 mg/mL的MTT,避光孵育4 h后移去上清液,每孔加入150 µL的DMSO,充分溶解生成的甲臜后在570 nm下检测吸光度。
2.2.5. UVC损伤模型的建立与分组
参考现有文献报道 [13],采用8 mJ/cm2剂量的UVC用于实验。细胞培养24 h后,用PBS洗涤并暴露于8 mJ/cm2 UVC下,然后与含有不同浓度EPS (100,200,300,600,1000 µg/mL)的新鲜培养基一起孵育24小时。对照组不经UVC和EPS处理,UVC模型组只用UVC处理。
2.2.6. 胞外多糖对UVC引起HaCaT细胞损伤的影响
将细胞以5000个/孔的密度接种至96孔板中,培养24 h后将细胞用PBS洗涤并暴露于UVC,然后与一系列浓度的EPS共孵育24小时,同时实验采用5.68 mmol/L的Vc作为阳性对照 [14]。随后,采用MTT法测定EPS对UVC引起的HaCaT细胞损伤的影响。
2.2.7. 胞外多糖对HaCaT细胞内ROS水平的影响
使用DCFH-DA荧光探针表征细胞内ROS的含量 [15]。将HaCaT细胞以4 × 104个/孔的密度接种到24孔板中。处理后,将HaCaT细胞与10 μM DCFH-DA在37℃,5% CO2下孵育30分钟,之后用PBS洗涤。加入无酚红培养基后,立即用荧光显微镜观察细胞。使用Image-Pro Plus 6.0软件对荧光强度进行定量。
2.2.8. 胞外多糖对HaCaT细胞线粒体膜电位的影响
使用Rh123荧光探针表征细胞线粒体膜电位(MMP) [16]。将HaCaT细胞以4 × 104个/孔的密度接种到24孔板中,经上述处理后,将HaCaT细胞与2 μM Rh123在37℃,5% CO2条件下孵育30分钟,PBS清洗后用荧光显微镜观察。使用Image-Pro Plus 6.0软件对荧光强度进行定量。
2.2.9. 统计分析
实验数据均使用平均值±标准差来表示,对所有数据采用SPSS 23.0软件进行单因素方差分析(ANOVA),进一步使用Duncan检验对每组之间的差异进行分析。p < 0.05表示差异具有统计学意义。
3. 结果与分析
3.1. 菌株的筛选鉴定与胞外多糖的制备
通过大量筛选和不断纯化,从土壤中筛选出一株高产胞外多糖的菌株PYQ4。菌株PYQ4的菌落形态及菌体形态如图1所示。由图1(A)可知,在筛选培养基上菌株PYQ4单菌落呈圆形凸起,微黄色不透明且湿润粘稠。图1(B)革兰氏染色结果可知PYQ4为杆状革兰氏阴性菌。
由图2可知,将该菌株的16S rDNA序列与GenBank中相关种属的序列进行比对后发现,PYQ4与罗氏假单胞菌(Pseudomonas rhodesiae)同源性最高,将该菌株鉴定为Pseudomonas rhodesiae PYQ4,并保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC No. 16674 [17]。
通过苯酚-硫酸法测定,菌株PYQ4在30℃,150 rpm,48 h的条件下可发酵得胞外多糖2.50 ± 0.13 g/L,显著高于多种乳酸菌胞外多糖的产量 [10] [18] [19]。不仅如此,与其他假单胞菌的产量相比也处于较高水平,刘凤等 [20] 报道的海洋假单胞菌pf-6发酵产量为1.22 g/L,范秋苹 [21] 优化依氏交替假单胞菌HZ (Pesudoalteromonas issachenkonii HZ)发酵条件后,其发酵产量才达到2.603 ± 0.022 g/L,比优化前提高114.95%。对所获胞外多糖的成分进一步分析发现,菌株PYQ4发酵所得胞外多糖中糖含量为94.35% ± 2.20%,蛋白质含量为2.47% ± 0.26%,说明所获胞外多糖纯度较高。

Figure 1. Colony morphology (A) and cell morphology (B) of strain PYQ4 on the solid screening medium
图1. 菌株PYQ4的菌落形态(A)及菌体形态(B)

Figure 2. Phylogenetic tree of strain PYQ4
图2. 菌株PYQ4的系统发育树
3.2. 罗氏假单胞菌PYQ4胞外多糖对HaCaT细胞存活率的影响
罗氏假单胞菌PYQ4胞外多糖对HaCaT细胞的毒性实验结果如图3所示。与浓度为100,200,300,600,1000 µg/mL的EPS共孵育24 h后,HaCaT细胞存活率在101.82%~106.25%之间,与对照组相比无显著性差异。实验结果表明上述浓度的EPS不会对HaCaT细胞造成损伤,可以用于后续实验和进一步产品开发。
3.3. 罗氏假单胞菌PYQ4胞外多糖对UVC引起HaCaT细胞损伤的影响
罗氏假单胞菌PYQ4胞外多糖对UVC引起HaCaT细胞毒性的保护存活效果如图4所示。经UV辐射处理,HaCaT细胞存活率大幅下降,仅为对照组的69.06 ± 3.76%,说明UVC具有显著的细胞毒性。而EPS的加入使得HaCaT细胞的存活率较UV模型组显著上升。此外,对于不同浓度的EPS处理组来说,浓度越高对细胞的保护效应越强,最高浓度的EPS处理组(1000 µg/mL)细胞存活率为84.63 ± 2.70%,与Vc阳性对照组(87.60 ± 4.41%)相当无显著性差异。该实验结果说明,针对UVC引起的细胞损伤,该EPS有显著的保护效应,且具有剂量依赖性。适当浓度EPS对UVC损伤的修复效果可与Vc相当,性质稳定,潜在应用价值高。

Figure 3. Cytotoxicity assay of EPS on HaCaT cells
图3. EPS对HaCaT细胞的细胞毒性评估

Figure 4. Effect of EPS on UVC-induced damage in HaCaT cells (a, b, c, and d represent significant differences)
图4. EPS对UVC引起的HaCaT细胞损伤的影响(不同标记字母a, b, c, d统计学结果显示差异显著)
3.4. 罗氏假单胞菌PYQ4胞外多糖对HaCaT细胞内ROS水平的影响
上述实验结果已经证明罗氏假单胞菌PYQ4所产胞外多糖能有效修复UVC引起的细胞损伤,在接下来的实验中对这种细胞保护作用的机制进行了进一步的探究。正常机体内过氧化物质与抗氧化物质处于平衡状态 [22],已有研究表明紫外线辐射会引起细胞内大量ROS的产生,而过量的ROS对脂质、蛋白质和DNA均有严重不利影响 [23]。考虑到这一现象,本研究使用DCFH-DA探针评估HaCaT细胞内ROS水平。
根据图5所示,UVC造模处理组的细胞荧光强度达到对照组的3.87倍。EPS以剂量依赖性的方式显著降低了UV诱导的细胞内ROS的产生。在100、200、300、600、1000 µg/mL EPS的存在下,HaCaT细胞内ROS的荧光强度分别下降至295.21 ± 43.88%、263.33 ± 43.65%、226.39 ± 20.35%、179.06 ± 13.66%、171.78 ± 30.04%,表明菌株PYQ4所产EPS能够有效清除因紫外线诱导而产生的过量ROS从而保护细胞,这与Lee等人的报道具有一致性 [24]。
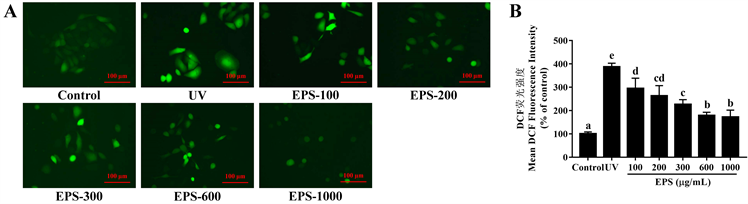
Figure 5. Effects of EPS on UVC-induced excessive ROS in HaCaT cells (a, b, c, and d represent significant differences)
图5. EPS对UVC引起的HaCaT细胞内过量ROS的影响(不同标记字母a, b, c, d统计学结果显示差异显著)
3.5. 罗氏假单胞菌PYQ4胞外多糖对HaCaT细胞线粒体膜电位的影响
作为一种重要的细胞器,线粒体为细胞提供生存所需的能量,于此同时,伴随着呼吸链中电子的泄漏,ROS在线粒体内快速产生并影响其代谢 [25]。现有研究表明 [26],紫外辐射会导致线粒体功能障碍,从而引发一系列不良反应。鉴于罗氏假单胞菌PYQ4所产胞外多糖能够有效清除过量ROS的实验结果,我们猜测EPS也可能通过减轻线粒体功能障碍发挥其保护作用。本研究中使用Rh123探针来表征线粒体膜电位。
图6中的数据表明,与对照组相比,UVC模型组的荧光强度下降至78.24 ± 2.42%,而在EPS存在的情况下,MMP的损失明显受到剂量依赖性的抑制,尤其是当EPS浓度600 μg/mL和1000 μg/mL时,HaCaT细胞的荧光强度分别可以达到101.19 ± 2.96%和102.87 ± 2.56%。根据以上实验结果可知,UVC辐照会导致细胞MMP的大幅崩解,从而导致线粒体功能障碍,而罗氏假单胞菌PYQ4所产EPS能够显著缓解这种不利影响,从而在一定程度上恢复细胞的正常生物活性。

Figure 6. Effects of EPS on UVC-induced mitochondrial dysfunction in HaCaT cells (a, b, c, and d represent signi-ficant differences)
图5. EPS对UVC引起的HaCaT细胞内线粒体功能紊乱的影响(不同标记字母a, b, c, d统计学结果显示差异显著)
4. 结论
本研究从土壤中筛选出1株高产胞外多糖的菌株PYQ4,经分子生物学鉴定,该菌株被鉴定为罗氏假单胞菌(Pseudomonas rhodesiae)。通过HaCaT细胞模型,本研究初步证实了罗氏假单胞菌PYQ4所产胞外多糖可通过显著清除过量ROS的产生、抑制线粒体膜电位的崩解,从而有效缓解UVC引起的细胞毒性损伤的能力,且这种保护作用呈剂量依赖性方式。上述研究成果展示了EPS发挥修复作用的部分机制,为开发基于菌株PYQ4所产胞外多糖的UV防护剂提供了理论基础,进一步拓展了微生物多糖在食品和化妆品领域的应用前景。
文章引用
汪旖清,黄继翔,周文文. 罗氏假单胞菌PYQ4胞外多糖对UVC辐照HaCaT细胞损伤的保护作用
Protective Effect of Exopolysaccharide from Pseudomonas rhodesiae PYQ4 against UVC Radiation Induced Damage on HaCaT Cells[J]. 微生物前沿, 2020, 09(01): 1-9. https://doi.org/10.12677/AMB.2020.91001
参考文献
- 1. Takasawa, R., Nakamura, H., Mori, T., et al. (2005) Differential Apoptotic Pathways in Human Keratinocyte HaCaT Cells Exposed to UVB and UVC. Apoptosis, 10, 1121-1130. https://doi.org/10.1007/s10495-005-0901-8
- 2. Pacholczyk, M., Czernicki, J. and Ferenc, T. (2016) The Effect of Solar Ultraviolet Radiation (UVR) on Induction of Skin Cancers. Medycyna Pracy, 67, 255-266. https://doi.org/10.13075/mp.5893.00342
- 3. 李振洁, 彭丽倩, 高爱莉, 等. 枸杞多糖对紫外线致人皮肤成纤维细胞脂质损伤的防御作用[J]. 中国激光医学杂志, 2017(3): 17-22.
- 4. Wen, L., Gao, Q., Ma, C., Ge, Y., Yo, L., et al. (2016) Effect of Polysaccharides from Tremella fuciformis on UV-Induced Photoaging. Journal of Functional Foods, 20, 400-410. https://doi.org/10.1016/j.jff.2015.11.014
- 5. 赵霞, 王若愚. 细菌胞外多糖生物活性的研究进展[J]. 微生物学免疫学进展, 2016, 44(3): 73-77.
- 6. Banik, R.M., Kanari, B. and Upadhyay, S.N. (2000) Exopolysaccharide of the Gellan Family: Prospects and Potential. World Journal of Microbiology & Biotechnology, 16, 407-414. https://doi.org/10.1023/A:1008951706621
- 7. Ye, S., Liu, F., Wang, J., et al. (2012) Antioxidant Ac-tivities of an Exopolysaccharide Isolated and Purified from Marine Pseudomonas PF-6. Carbohydrate Polymers, 87, 764-770. https://doi.org/10.1016/j.carbpol.2011.08.057
- 8. Makino, S., Ikegami, S., Kano, H., et al. (2006) Immunomodulatory Effects of Polysaccharides Produced by Lactobacillus delbrueckii ssp. bulgaricus OLL1073R-1. Journal of Dairy Science, 89, 2873-2881. https://doi.org/10.3168/jds.S0022-0302(06)72560-7
- 9. Umezawa, H., Okami, Y., Kurasawa, S., et al. (1983) Marinactan, Antitumor Polysaccharide Produced by Marine Bacteria. The Journal of Antibiotics, 36, 471-475. https://doi.org/10.7164/antibiotics.36.471
- 10. 黄承敏, 肖茜, 王蓉蓉, 等. 一株高产胞外多糖乳酸菌的分离鉴定及其产胞外多糖的研究[J]. 中国酿造, 2019, 38(1): 87-90.
- 11. 王文平, 郭祀远, 李琳, 等. 考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J]. 食品研究与开发, 2008, 29(1): 115-117.
- 12. 茆广华, 吴向阳, 仰榴青, 等. 苯酚-硫酸法测定银杏外种皮多糖的含量[J]. 食品科技, 2008, 33(6): 197-199.
- 13. Wang, H., Liu, J., Pang, D., et al. (2019) Mechanisms Underlying the Protective Effects of Blueberry Extract against Ultraviolet Radiation in a Skin Cell Co-Culture System. Journal of Functional Foods, 52, 603-610. https://doi.org/10.1016/j.jff.2018.11.037
- 14. 韩志武, 王美芝, 王龙源, 等. 玫瑰花露抑制紫外线诱导HaCaT细胞凋亡的研究[J]. 中国药房, 2013(7): 592-595.
- 15. Herranz-López, M., Fernández-Arroyo, S., Pérez-Sanchez, A., et al. (2012) Synergism of Plant-Derived Polyphenols in Adipogenesis: Perspectives and Implications. Phytomedicine International Journal of Phytotherapy & Phytopharmacology, 19, 253-261. https://doi.org/10.1016/j.phymed.2011.12.001
- 16. 朱启星, 马泰, 沈彤, 等. 银杏叶提取物对三氯乙烯所致的角质形成细胞线粒体膜电位变化的影响[J]. 中国工业医学杂志, 2007, 20(2): 72-75.
- 17. 周文文, 汪旖清. 一种高产胞外多糖的罗氏假单胞菌PYQ4及其多糖制备方法和应用[P]. 中国专利, 201811481048.3. 2019-03-19.
- 18. 刘丽波, 孙迪, 谷春涛, 等. 高产EPS乳酸菌株的筛选及在农家干酪中的应用[J]. 食品工业科技, 2013(11): 95-99.
- 19. 胡盼盼, 宋微, 单毓娟, 等. 影响乳酸菌胞外多糖产量的因素[J]. 食品科技, 2014(9): 31-37.
- 20. 刘凤, 叶淑红, 王际辉, 等. 海洋假单胞菌pf-6胞外多糖吸湿保湿和抗氧化性研究[J]. 食品工业科技, 2011(11): 68-71.
- 21. 范秋苹. 一株依氏交替假单胞菌HZ胞外多糖的研究[D]: [硕士学位论文]. 济南: 齐鲁工业大学, 2016.
- 22. 陈晓昱, 马文宇. 沙棘水提物对UVC辐射HaCaT细胞损伤的保护作用及其机制[J]. 山东医药, 2017(13): 48-50.
- 23. Ichihashi, M., Ueda, M., Budiyanto, A., et al. (2003) UV-Induced Skin Damage. Toxicology, 189, 21-39. https://doi.org/10.1016/S0300-483X(03)00150-1
- 24. Lee, B.C., Bae, J.T., Pyo, H.B., et al. (2003) Biological Activities of the Polysaccharides Produced from Submerged Culture of the Edible Basidiomycete Grifola frondosa. Enzyme and Microbial Technology, 32, 574-581. https://doi.org/10.1016/S0141-0229(03)00026-7
- 25. 肖海滨, 李平, 张雯, 等. 有机分子荧光探针成像检测线粒体内ROS的研究进展[J]. 中国科学: 化学, 2017(8): 67-84.
- 26. Farrukh, M.R., Nissar, U.A., Kaiser, P.J., et al. (2015) Glycyrrhizic Acid (GA) Inhibits Reactive Oxygen Species Mediated Photodamage by Blocking ER Stress and MAPK Pathway in UV-B Irradiated Human Skin Fibroblasts. Journal of Photochemistry and Photobiology B: Biology, 148, 351-357. https://doi.org/10.1016/j.jphotobiol.2015.05.003
NOTES
*通讯作者。