Biophysics
Vol.2 No.02(2014), Article ID:13735,7 pages
DOI:10.12677/BIPHY.2014.22002
Mechanical Analyses of Stents with Different Structures under Compressing State
College of Life Science and Bioengineering, Beijing University of Technology, Beijing
Email: *qak@bjut.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: May 8th, 2014; revised: May 20th, 2014; accepted: May 28th, 2014
ABSTRACT
In order to provide scientific guidance of design and development of stents and interventional treatment, the crimping properties and the flexibilities under crimping of the stents with different structures of connecting ribs were studied in this paper. The models of three different structures of connecting ribs were built by commercial software. L-stent, V-stent and S-stent were defined according to different link structures. Finite element analysis was carried out to analyze the crimping properties of three kinds of stents, and the flexibility under crimping was further researched. In the course of the crimping, the resilient rates of L-stent, V-stent and S-stent were respectively 2.67%, 6.00% and 11.30%, and axial elongations were respectively 1.74%, 1.57% and 2.61%. Under the crimping, the peak stress of L-stent had the minimum distribution compared to the others. Three stents displacements of the center of the end face were respectively 0.135 mm, 0.578 mm and 0.675 mm. In conclusion, L-stent had the best performance of crimping as it’s the minimum resilient rate after crimping; V-stent was suitable for transport in the vessels because it's the minimum axial elongation. S-stent had the best flexibility which was easier to reach tortuous vessels.
Keywords:Stent, Three-Dimensional Modeling, Finite Element Analysis, Biomechanics

压握状态下不同结构支架的力学分析
任庆帅,李秋池,乔爱科*
北京工业大学生命科学与生物工程学院,北京
Email: *qak@bjut.edu.cn
收稿日期:2014年5月8日;修回日期:2014年5月20日;录用日期:2014年5月28日

摘 要
研究不同连接筋结构的血管支架的压握性能及支架在压握状态下的柔顺性性能,为支架的设计、开发及介入治疗提供科学的指导。利用Pro/E三维软件构建三种不同链接筋的支架模型。根据支架连接筋的结构分别称为L-支架、V-支架和S-支架。应用ABAQUS软件模拟3种不同链接筋支架的压握和弯曲过程,并进一步分析3种支架的压握性能和柔顺性。在支架压握过程中,L-支架、V-支架和S-支架的弹性回弹率分别为2.67%、6.00%和11.30%,轴向伸长率分别是1.74%、1.57%和2.61%。3种支架在压握状态下的弯曲过程中,L-支架上的应力峰值最小,3种支架端面中心点的位移分别为0.135 mm、0.578 mm和0.675 mm。结论为:L-支架压握后的回弹率最小,压握效果最好;V-支架的轴向伸长率最小,方便在血管中的运输;S-支架在压握状态下的柔顺性最好,较易送达迂曲的血管。
关键词
血管支架,三维建模,有限元分析,生物力学

1. 引言
支架植入术是在经皮穿刺腔内冠状动脉形成术(Percutaneous Transluminal Angioplasty, PTCA)的基础上,通过球囊导管将金属支架送到病变处,并使其扩张后对血管起支撑作用[1] 。临床手术中,需将支架压握于球囊上或压缩入导管中进行输送[2] 。当支架通过导丝被送达狭窄处后,施加压力使球囊膨胀撑开支架或支架依靠自身恢复弹力张开最终撑开血管,最后抽出导丝,使支架留置与血管中。
在支架出现的早期,人们主要关心支架的支撑性能[3] 。Ormiston[4] 实验测量了13种常见支架在三种状态(单独的未膨胀支架、爬附在球囊上的未膨胀支架、单独的膨胀后支架)的刚度。Rieu[5] 等人研究了17种常见支架的支撑刚度。但是随后的动物实验和临床结果逐渐让人们意识到了支架柔顺性的重要性。周承倜[6] 等将实验数据与纵向柔度理论相对比,研究了与柔顺性伴随发生的弯折屈曲现象。Mori[7] 等人采用实验和数值模拟的方法研究了膨胀后的支架在纯弯曲状态下的柔顺性,其中涉及到4种不同设计的支架以及在二维平面上简化了的局部模型。Petrini[8] 等人利用有限元法在纯弯条件下模拟了两种支架膨胀前后的柔度,研究了结构内的自接触(Self-Contact)现象对柔顺性的影响。Wu[9] 等人对于两种膨胀后支架,分别计算了弹性与塑性阶段的抗弯刚度。Fontaine等人在猪的腹部血管植入了硬支架和柔支架进行对比[10] ;结果发现虽然硬支架的支撑性能更好,但是却引起了更厚的内膜增生,因此后期管腔的丢失比柔支架严重。李宁等人通过对冠脉支架纵向柔顺性数值模拟[11] 及冠脉支架纵向柔顺性优化模型[12] 的研究得出只有连接筋构件的几何形状与设计尺寸是决定支架弯曲性能的主要因素。
目前对于支架柔顺性的研究仅着眼于支架在膨胀状态下的柔顺性研究。然而,支架材质大多为金属,在压握过程中会发生塑性变形。由于金属材质在再结晶温度以下发生塑性变形时其强度和硬度均会升高,故支架压握过程可能会影响支架的后续变形行为[13] 。所以在压握状态下,支架的柔顺性将会受到影响。而支架压握于球囊之上后,支架的柔顺性决定着支架运输过程中的安全性和可行性,最终影响治疗的效果。所以本研究将利用有限元方法模拟具有不同连接筋结构的支架压握的完整变形过程,并评价不同连接筋结构支架的压握性能。在此基础上进一步对支架在压握状态下的柔顺性进行有限元模拟研究,评价不同连接筋在压握状态下的柔顺性,以便对支架的设计与临床应用提供科学合理的依据。
2. 方法
支架的花型主要是指支架中支撑筋(亦称主筋)和连接筋(亦称桥筋)的形式[14] 。利用计算机辅助设计软件Pro/ENGINEER Wildfire 5.0构建了3种血管支架。三种支架的主筋均采用波浪形主筋,支撑筋采用3种形式,分别为L型、V型、S型,具体结构可由图1所示。相应地,3种支架分别命名为L-支架、V-支架和S-支架。3种支架除连接筋形式不同外,其他尺寸均相同,具体参数为:支架扩张前,长度为11.5 × 10−3 m,外径为2.10 × 10−3 m,支架筋宽度为0.14 × 10−3 m,厚度为0.12 × 10−3 m,支撑筋间距为1 × 10−3 m。
根据参考文献[15] 设置材料参数,其中支架材料为304不锈钢,赋予其双线性弹塑性材料属性。具体数值如表1所示。
根据划分网格的基本原则[16] ,在ABAQUS/Standard软件中,分别将3种支架进行网格划分。支架有限元模型全部采用八节点六面体减缩积分单元(C3D8R)进行网格离散。此外,为保证计算精度,支架在厚度方向的网格划分至少为两层。网格划分后支架单元与节点数量详见表2所示。
本文利用有限元分析软件ABAQUS/Standard进行数值模拟。在第一个分析步内对L-支架、V-支架和S-支架施加相同的径向向内的位移,第二个分析步内对3种支架维持所有约束,在第三个分析步内撤去径向位移约束,支架将发生自由反弹。最终可以获得支架在压握状态下的应力分布和支架压握反弹后的
 (a) (b) (c)
(a) (b) (c)
Figure 1. Geometrical models of stent: (a) L-stent; (b) V-stent; (c) S-stent
图1. 支架的几何模型:(a) L-支架;(b) V-支架;(c) S-支架
表1. 支架材料属性[13]
形变程度。在此基础上,对支架在压握状态下的柔性进行有限元分析。将压握后支架的一端设置为固定边界的条件约束,确保支架在施加弯矩的时候不会产生刚性位移。选择支架另一端横截面的中心为参考点,在该参考点上施加一个垂直于中心轴的集中力。集中力的优点在于将集中力施加在某一点上(几何的点,节点),所产生的力的效果相当于均匀分布在支架的端面。此时,再将参考点与作用面上的节点进行耦合约束,而不需要直接施加在节点上(如图2所示)。
3. 结果分析
3.1. 支架压握性能分析
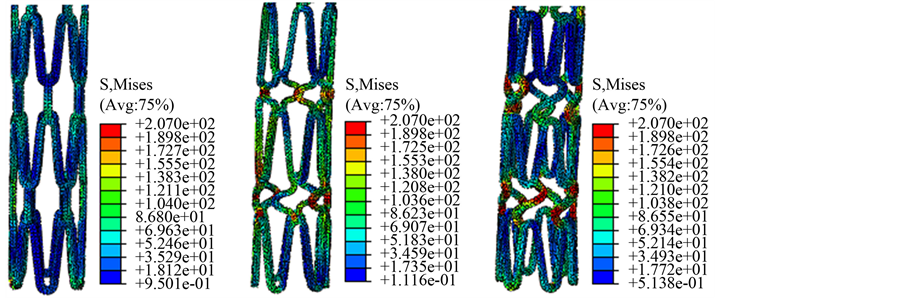
在支架周围施加均匀的径向位移,大小为向内0.3 × 10−3 m。位移引起L-支架、V-支架和S-支架的应力峰值均为207 MPa,应力最小值分别为6.642 MPa、9.324 MPa和11.24 MPa。如图3所示,分别表示L-支架、V-支架、S-支架连接筋结构上的应力分布。
如图4所示,表示3种不同结构支架压握后的径向位移对比。当撤销支架的径向位移约束后,支架产生自由的反弹,造成同一支架上各个节点的最终位移也不同。
给支架施加的径向向内位移为0.3 × 10−3 m,支架压握过程的压缩率为:0.3/1.05 = 28.6%。L-支架、V-支架和S-支架的弹性回复率分别为2.67%、6.00%和11.30%,如表3所示。
表2. 支架单元与节点数

Figure 2. Boundary conditions of the bending simulation of stent. Left end: fixed; Right end: concentrated force
图2. 支架弯曲模拟的边界条件。左端固定约束,右端中心受集中力作用
 (a)
(a) (b)
(b) (c)
(c)
Figure 3. Contours of the Von Mises stress generated in the links of stent: (a) L-stent; (b) V-stent; (c) S-stent
图3. 支架连接筋产生的Von Mises应力云图:(a) L-支架;(b) V-支架;(c) S-支架
支架在压握过程中,将会出现支架的轴向伸长。根据表4所示为不同支架的轴向伸长率。轴向伸长率将影响支架最终输送时的实际尺寸,对支架植入过程的安全性和有效性有重要的作用。
3.2. 支架的柔顺性分析结果
支架一端固定、另一端施加大小为0.09 N的横向集中力,引起三种支架的内部产生应力。三种支架的应力峰值均为207 MPa,且应力峰值主要集中在给支架施加约束的一端;V-支架和S-支架各个支架丝部分的应力明显大于L-支架,如图5所示。
如图6所示,S-支架、V-支架和L-支架在施加集中力的一端的中心点位移分别0.675 mm、0.578 mm和0.135 mm,S-支架发生的位移最大。
4. 讨论
已有的支架扩张研究中,考虑支架的应力分布、径向回弹率与轴向伸缩率来讨论支架的支撑性能[17] 。本文研究同样采用了这三个指标来讨论支架的压握性能。
支架在发生弯曲时,支架的大应变区主要集中在支架的连接筋处,在连接的受拉区域伸长,受压区域缩短,最终形成了支架的弯曲,连接筋构件的几何形状与设计尺寸是决定支架弯曲性能的主要因素。在本次研究中考虑了三种不同连接筋结构的支架,其中,既包括了直线结构与曲线结构的连接筋,又包括了对称型与非对称型结构的连接筋,充分讨论不同连接筋结构对支架柔顺性的影响。支架在压握过程中,不仅会改变支架的外形结构,其强度与硬度均会发生改变,特别是发生在连接筋处的这些改变,对
 (a)
(a) (b)
(b) (c)
(c)
Figure 4. Change of the stents’ outside diameter: (a) L-stent; (b) V-stent; (c) S-stent
图4. 支架外径变化:(a) L-支架;(b) V-支架;(c) S-支架
表3. 支架外径变化
表4. 支架的轴向伸长
 (a) (b) (c)
(a) (b) (c)
Figure 5. Contours of the Von Mises stress generated in stent (lower end was fixed). (a) L-stent; (b) V-stent; (c) S-stent
图5. 支架上产生的Von Mises应力云图(下端为固定端)。(a) L-支架;(b) V-支架;(c) S-支架

Figure 6. Nodal displacement in stent (left end is fixed): (a) L-stent; (b) Vstent; (c) S-stent
图6. 支架上的节点位移(左端为固定端):(a) L-支架;(b) V-支架;(c) S-支架
支架的柔顺性产生很大的影响,这说明研究支架在压握状态下的柔顺性十分重要。
在早前研究支架柔性的方法中[18] [19] ,多采用三点约束的方法进行支架柔顺性的研究,例如三点弯曲法、端部扭转法。本文中所采用的两点约束的方法,虽然比于前两种方法,真实性略差一些,但具有简单、直观、易操作等优势。另外,由于支架植入使病变血管扩张而引起血管内皮的损伤,血管弹性纤维层的破坏进而延伸到动脉外膜,血管的损伤导致血管平滑肌细胞向损伤部位迁移增殖以及血栓的形成。从而引起血管支架内的再狭窄(In-stent restenosis) [20] 。而对于迂曲血管处的支架植入,支架对血管产生抻直效应,支架良好的柔顺性将降低对血管内壁的损伤,减轻支架内再狭窄的发生。
此次研究三种支架压握性能的数值模拟的结果中,支架的轴向伸长率均小于5%,且三种支架轴向伸长的差距较小。这主要是因为此次建模的三种支架不能实现将外径压缩至1 mm内;当外径压缩小于1 mm时,模拟计算就不能得到相应的结果。究其原因,可能是因为支架结构使得压缩到1 mm时支架网丝及连接筋之间可能发生碰撞干涉。为了模拟结果更加精确和模拟效果更加明显,在以后的研究过程中还需要对支架的参数和结构进行不断的优化。
本文研究主要是对具有不同连接筋的血管支架在压握状态后的柔顺性进行简单分析,因此有限元模拟过程主要针对支架的柔性,并未对支架的顺应性进行数值分析。对于支架顺应性的研究,Rieu等人提出了一种支架顺应性评价方法[7] 。作为为参考,在今后的研究中,支架顺应性的研究将会着重考虑。
本文所设计的3种支架结构具有不同的结构力学和血流动力学特性[21] -[26] 。因此对血管的支撑力、由此产生的血管壁应力应变和支架应力应变都不同;对支架介入治疗之后血管内的血流动力学影响也不同。这些都会影响到支架的输送性能、特别是支架送达像脑血管等迂曲而复杂的血管部位的便利性能,也会影响到术后疗效。
5. 结论
本文建立了L-支架、V-支架、S-支架3种具有不同连接筋结构的支架模型,对3种支架的压握性能进行有限元数值模拟研究,进而模拟研究3种支架在压握状态下的柔顺性,讨论不同连接筋结构对支架的压握性能与柔顺性的影响,为支架的设计与临床的选用提供可靠的科学依据。
在相同的压握条件下,3种支架的应力分布比较均匀,分布在连接筋部位的应力较小;L-支架的弹性回复率最小,相比于另外两种支架其压握效果最好;V-支架发生轴向伸长的程度最小,使得支架压握于运输支架的球囊上时与球囊发生相对位移的几率小,同时较短的支架更有利于在血管中的运输,有利于临床手术的进行。在支架压握数值模拟结果的基础上,进行支架压握后的柔顺性数值模拟分析的结论为:L-支架的应力峰值远低于V-支架和S-支架的应力峰值,支架发生破裂的可能性最小;L-支架的节点位移的最大值远小于V-支架和S-支架的节点位移最大值,柔性在三种支架中最差。所以,波浪形或弯曲的连接筋结构的支架柔顺性比平直的连接筋结构支架的柔顺性要好。
项目基金
国家自然科学基金项目(81171107)。
参考文献 (References)
- [1] 王跃轩, 易红, 倪中华, 顾兴中 (2005) 医用血管支架生物力学性能分析方法研究. 东南大学学报, 2, 216-221.
- [2] 吴卫 (2007) 人体血管支架有限元分析与结构拓扑优化. 大连理工大学, 大连.
- [3] Sawada, S., Saito, S., Kotani, K., et al. (1991) Study of the physical properties of expandable metallic stents. Radiation Medicine, 9, 213-216.
- [4] Ormiston, J.A., Dixon, S.R., Webster, M., et al. (2000) Stent longitudinal flexibility: A comparison of 13 stent designs before and after balloon expansion. Catheterization and Cardiovascular Interventions, 50, 120-124.
- [5] Rieu, R., Barragan, P., Garitey, V., et al. (2003) Assessment of the trackability, flexibility, and conformability of coronary stents: A comparative analysis. Catheterization and Cardiovascular Interventions, 59, 496-503.
- [6] 周承倜, 董何彦 (2008) 冠状动脉支架力学性能的理论和实验研究. 应用力学学报, 4, 26-31.
- [7] Mori, K. and Saito, T. (2005) Effects of stent structure on stent flexibility measurements. Annals of Biomedical Engineering, 33, 733-742.
- [8] Petrini, L., Migliavacca, F., Auricchio, F., et al. (2004) Numerical investigation of the intravascular coronary stent flexibility. Journal of Biomechanics, 37, 495-501.
- [9] Wu, W., Yang, D.Z., Qi, M., et al. (2007) An FEA method to study flexibility of expanded coronary stents. Journal of Materials Processing Technology, 184, 447-450.
- [10] Fontaine, A.B., Spigos, D.G., Eaton, G., et al. (1994) Stent-induced intimal hyperplasia: are there fundamental differences between flexible and rigid stent designs. Journal of Vascular and Interventional Radiology, 5, 739-744.
- [11] 李宁, 张洪武 (2011) 冠脉支架纵向柔顺性数值模拟. 计算机力学学报, 6, 309-314.
- [12] 李宁, 张洪武 (2011) 冠脉支架纵向柔顺性优化模型. 计算机力学学报, 6, 315-319.
- [13] 王明, 马全超, 张文光, 罗云 (2012) 压握过程对球囊扩张支架性能的影响. 上海交通大学学报, 4, 646-650.
- [14] 李田昌, 胡大一 (2000) 冠状动脉内支架进展. 中国医疗器械信息, 6, 6-13.
- [15] 李红霞, 张艺浩, 王希诚 (2012) 基于有限元模拟的支架扩张、血流动力学及支架疲劳分析. 医用生物力学, 27, 40-47.
- [16] 朱秀娟 (2009) 有限元分析网格划分的关键. 机械工程与自动化, 152, 185-186.
- [17] 王晓, 冯海全, 王文雯, 张瑞敏, 陈彦龙 (2013) 球囊扩张式冠脉支架生物力学性能研究. 中国生物医学工程学报, 32, 203-210.
- [18] Ormiston, J.A., Dixon, S.R., Webster, M.W.I., et al. (2000) Stent longitudinal flexibility: A comparison of 13 stent designs before and after balloon expansion. Catheterization and Cardiovascular Interbentions, 50, 120-124.
- [19] Petrinia, L., Migliavaccab, F., Ferdinando, A., et al. (2004) Numerical investigation of the intravascular coronary stent flexibility. Journal of Biomechanics, 37, 495-501.
- [20] Kornowski, R., Hong, M.K., Tio, F.O., et al. (1998) In-stent restenosis: Contributions of inflammatory response and arterial injury to neointimal hyperplasia. Journal of the American College of Cardiology, 31, 224-230.
- [21] 张站柱, 乔爱科 (2012) 支架内再狭窄的生物力学研究进展. 医用生物力学, 27, 698-702.
- [22] 张站柱, 乔爱科, 付文宇 (2013) 不同连接筋结构的支架治疗椎动脉狭窄的力学分析. 医用生物力学, 28, 44-49.
- [23] 张站柱, 乔爱科, 付文宇 (2013) 不同连接筋结构的支架治疗椎动脉狭窄的血流动力学数值模拟. 医用生物力学, 28, 148-153.
- [24] Qiao, A. and Zhang, Z. (2013) Solid and fluid simulations of vertebral artery stenosis treated with stents with different shapes of link. Proceedings of the ASME, Vol. 1A, V01AT20A003.
- [25] Qiao, A. and Zhang, Z. (2014) Solid and fluid simulations of vertebral artery stenosis treated with stents with different shapes of link. Applied Mechanics and Materials, 553, 338-343.

NOTES
*通讯作者。
