Biophysics
Vol.03 No.02(2015), Article ID:15839,8
pages
10.12677/BIPHY.2015.32005
Effects of Carotenoids on 3T3-L1 Preadipocyte Viability and Differentiation
Runcao Gao1, Ba Ngoc Nguyen2, Pin Lv1, Wenen Zhao1
1School of Chemical Engineering and Energy, Zhengzhou University, Zhengzhou Henan
2College of Food Industry, Danang
Email: zhaowenen@zzu.edu.cn
Received: Jul. 24th, 2015; accepted: Aug. 8th, 2015; published: Aug. 11th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The aim of the study was to assess the suppressive effects of bixin, β-carotene and lycopene on the differentiation of 3T3-L1 preadipocytes. The viability of 3T3-L1 cells were tested by MTT and their differentiation was evaluated by Oil red O staining method. The expression levels of peroxisome proliferator-activated receptor gamma (PPARγ) were measured by West blotting. The results showed that bixin, β-carotene and lycopene significantly reduced the viability and suppressed the differentiation of 3T3-L1 preadipocytes, respectively. β-Carotene had stronger suppressive effects than bixin and lycopene on adipocyte differentiation in 3T3-L1 cells. Bixin, β-carotene and lycopene down-regulated PPARγ expression. These results suggest that bixin, β-carotene and lycopene inhibit the adipocyte differentiation of 3T3-L1 cells through down-regulation of PPARγ.
Keywords:Carotenoids, 3T3-L1 Preadipocytes, Differentiation, PPARγ
类胡萝卜素对前脂肪细胞3T3-L1增殖和分化的影响
高润草1,阮宝玉2,吕品1,赵文恩1
1郑州大学化工与能源学院,河南 郑州
2岘港食品工业学院,岘港
Email: zhaowenen@zzu.edu.cn
收稿日期:2015年7月24日;录用日期:2015年8月8日;发布日期:2015年8月11日

摘 要
本文通过评估胭脂树橙、β-胡萝卜素和番茄红素对3T3-L1前脂肪细胞活力和分化的影响,探究其可能作用机制。以四甲基偶氮唑盐(MTT)法检测细胞活力,用油红O染色和染色比色法分析脂肪细胞的分化程度,West blotting检测过氧化物酶体增殖物激活受体gamma (PPARγ)的表达水平。结果表明,胭脂树橙、β-胡萝卜素和番茄红素明显降低3T3-L1细胞活力,抑制其分化,下调PPARγ的表达水平。β-胡萝卜素比胭脂树橙和番茄红素表现出更强的抑制作用。结果提示胭脂树橙、β-胡萝卜素和番茄红素经由PPARγ下调抑制3T3-L1细胞分化。
关键词 :类胡萝卜素,3T3-L1前脂肪细胞,分化,PPARγ

1. 引言
当今世界脂肪组织过度积累引起的肥胖已成为人类面对的最主要健康问题之一,已引起广泛的重视[1] 。脂肪组织的量是由管控脂肪细胞数目和大小的过程决定的,增殖和分化导致脂肪细胞数目增加,甘油三酯的不断贮存导致脂肪细胞扩大。脂肪细胞的分化是个复杂的过程,涉及许多转录因子,作为一种配体依赖性转录因子,过氧化物酶体增殖物激活受体gamma (PPARg)是脂肪形成的关键调节者,其缺少则脂肪细胞分化过程不能进行,它控制着脂类和糖代谢酶基因的表达 [2] 。脂肪细胞在体内的能量平衡上发挥重要作用,它将过剩的能量贮存作甘油三酯,通过脂肪酸来释放能量以响应营养需求信号或饥饿。脂肪细胞还分泌激素和脂肪因子,后两者调节着胰岛素敏感性、能量平衡与血压。脂肪细胞中甘油三酯的过多积累会导致肥胖,干扰脂肪因子分泌,增加多种疾病危险,包括II型糖尿病、高血压和高血脂 [3] 。当今运用天然产物安全有效地控制脂肪细胞的分化以减少脂肪细胞的数目,达到预防肥胖及减肥目的的做法受到越来越多的关注。
类胡萝卜素是广泛存在于水果和蔬菜中的一类具营养功能的脂溶性色素,也是较强的生物抗氧化剂,对人体健康有多种有益功效。已经报道饮食β-胡萝卜素主要通过其代谢中间产物(视黄醇、视黄醛和视黄酸)降低身体肥胖,缩减脂肪细胞的大小,β-胡萝卜素抑制3T3-L1细胞分化为脂肪细胞,降低PPARg活性 [4] - [7] 。b-隐黄质和岩藻黄质也有同样的效应 [8] - [10] 。番茄红素可对抗高脂饮食引起的脂肪肝,下调大鼠肾和肾上腺中PPARg的表达 [11] ,其代谢中间产物阿朴-10’-番茄红素酸抑制ob/ob小鼠的脂肪肝发展 [12] 。但在另一评估13种类胡萝卜素(包括b-隐黄质和叶黄素)对3T3-L1脂肪细胞分化研究中发现,只有新黄质表现出抑制细胞分化下调PPARg表达的作用 [13] 。但是,胭脂树橙激活分化后的3T3-L1脂肪细胞PPARg表达 [14] ,辣椒色素(主要为辣椒红素和辣椒玉红素两种类胡萝卜素)促进3T3-L1脂肪细胞分化,上调脂联素mRNA表达与分泌 [15] ,在牛白色脂肪组织上研究指出,β-胡萝卜素和叶黄素诱导前脂肪细胞分化,促进牛脂肪生成,可用于牛增肥 [16] 。看来目前对类胡萝卜素影响脂肪细胞分化及抗肥胖作用(包括对PPARg活性影响)尚无定论,研究结果和结论也不一致,甚至截然不同。
为了较全面评估类胡萝卜素对脂肪细胞分化的影响及其作用机制。试验用3T3-L1前脂肪细胞株,分析胭脂树橙、b-胡萝卜素和番茄红素对之增殖和分化及牵涉PPARg表达的影响。
2. 材料与方法
高糖DMEM培养液、胎牛血清(FBS)、0.25%胰酶-EDTA、油红O、细胞裂解液、胰岛素和地塞米松均购自北京索莱宝生物科技有限公司;β-胡萝卜素、胭脂树橙、噻唑蓝(MTT)和3-异丁基-1-甲基黄嘌呤(IBMX)均为美国Sigma公司产品;番茄红素购自成都彼斯特生物科技有限公司;兔抗PPARγ (H-100)抗体为美国Santa Cruz公司产品;Real Band Protein Marker、脱脂奶粉、兔抗b-actin和羊抗兔IgG为上海生工生物工程有限公司产品;其它试剂均为进口或国产分析纯。二氧化碳恒温培养箱购自上海一恒公司;BIOTEKELX808酶标仪购自美国伯腾仪器有限公司北京代表处;OLYMPUSCKX41倒置显微镜购自上海赖氏电子科技有限公司;TS-1型脱色摇床购自江苏省海门其林医用仪器公司;电泳仪和垂直电泳槽、转膜槽购自北京六一仪器厂。小鼠前脂肪细胞3T3-L1购自北京协和细胞资源中心。
2.1. 细胞活力检测
参考本组采用的细胞活力检测法稍做修改 [17] ,收集生长至对数期状态良好的细胞,以每孔5000个细胞接种至96孔板,次日待细胞贴壁后,分别用不同浓度的类胡萝卜素处理细胞,以不含药物的DMSO为对照组,每个浓度设6孔平行;培养3 d后,每孔加入适量MTT工作液,使其终浓度为0.5 mg/mL,继续培养2 h;小心吸除孔内液体,每孔加入100 μL DMSO,轻轻振荡混匀,使紫色结晶充分溶解;用酶标仪在490 nm处测定吸光值(A490),细胞存活率 = 处理组A490 − 对照组A490/对照组A490 × 100%。在培养液中添加药物时,控制DMSO浓度 ≤ 1% (v/v)。
2.2. 细胞分化检测的油红o染色法
参考文献 [18] 3T3-L1脂肪细胞分化检测法,收集状态良好的细胞,以每孔15,000个细胞接种至96孔板,在37℃,5% CO2培养箱中培养,待细胞生长至完全融合(细胞量达到孔面积的80%)后2 d (设为第0 d)开始诱导分化,将培养液换成含0.5 mmol/L IBMX、1 μmol/L DEX和10 μg/mL Insulin的脂肪细胞培养液(含10% FBS);48 h后(即诱导分化2 d),换以仅含有5 μg/mL Insulin的脂肪细胞培养液,同时加不同浓度的类胡萝卜素处理细胞,直至实验结束。取出培养板,小心移除孔内液体,用PBS清洗细胞两次,室温加入10%的甲醛磷酸盐缓冲液,每孔20 μL,固定30 min。之后移除固定液,PBS清洗一次,再用60%的异丙醇清洗细胞一次,晾干。最后加入油红O工作液,每孔20 μL,避光染色120 min。染色后,用PBS清洗,直到上层清液没有颜色。最后,每孔加入100 μL异丙醇溶解油红O染料,振荡摇匀10 min,于酶标仪510 nm处测定各孔光密度值(OD)值。以上实验各重复3次。
2.3. PPARg蛋白表达水平检测
参考本组采用的蛋白表达水平检测法稍做修改 [15] ,用细胞裂解液裂解细胞,提取细胞总蛋白,通过BCA法测定蛋白在570 nm处吸光值(A570),用标准浓度蛋白与其A570作标准曲线,计算样品蛋白浓度。配制体积分数为0.1的SDS-聚丙烯酰胺凝胶,在SDS-聚丙烯酰胺凝胶中进行电泳。之后将蛋白转移到NC膜,然后放入封闭缓冲液中,室温摇床孵育1 h。一抗4℃孵育过夜,二抗室温摇床孵育2 h,用TBST清洗3次。用ECL化学发光液对膜进行显色处理,感光胶片显影,X光片上条带强度用NH Image软件分析。
2.4. 数据分析
计算各组重复实验的平均值和标准差,并采用one-way ANOVA进行比较。处理组与对照组比较:*P < 0.05,差异显著;**P < 0.01,差异极显著。
3. 结果
3.1. 类胡萝卜素对前脂肪细胞3T3-L1活力的影响
从图1可看到,40 μM类胡萝卜素处理后存活的3T3-L1前脂肪细胞数目都大幅度减少,其中尤以β-胡萝卜素处理的极为显著,经处理后留存下来的细胞已极其少。图2结果显示,1.25、2.5、5、10、20、40 μM的类胡萝卜素分别处理3T3-L1细胞,培养72 h后,胭脂树橙、β-胡萝卜素和番茄红素对3T3-L1前脂肪细胞活力的降低作用与其浓度呈现剂量-效应关系,类胡萝卜素浓度越大作用越强。在10 μM胭脂树橙处理下细胞活力降低与对照组相比有显著差异,在5 μM番茄红素和β-胡萝卜素处理下细胞活力降低与对照组相比有显著差异。当浓度为40 μM时,胭脂树橙、番茄红素和β-胡萝卜素处理组细胞活力分别降至对照组的33.4%、17.8%和31.4%。结果表明这三种类胡萝卜素都可显著降低3T3-L1前脂肪细胞的活力(胭脂树橙:P10 = 0.0295 < 0.05,P20 = 0.0080 < 0.01,P40 = 0.0003 < 0.01;番茄红素:P5 = 0.0123 < 0.05,P10 = 0.0015 < 0.01,P20 = 0.0030 < 0.01,P40 = 0.0005 < 0.01;β-胡萝卜素:P5 = 0.0395 < 0.05,P10 = 0.0003 < 0.01,P20 = 0.0024 < 0.01,P40 = 0.0002 < 0.01)。
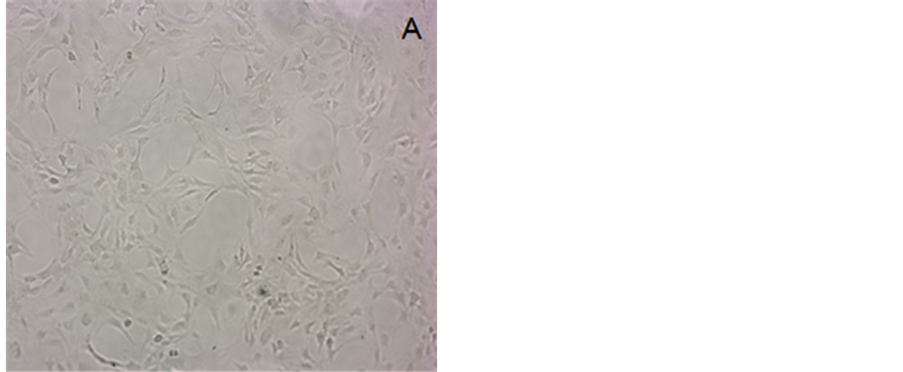
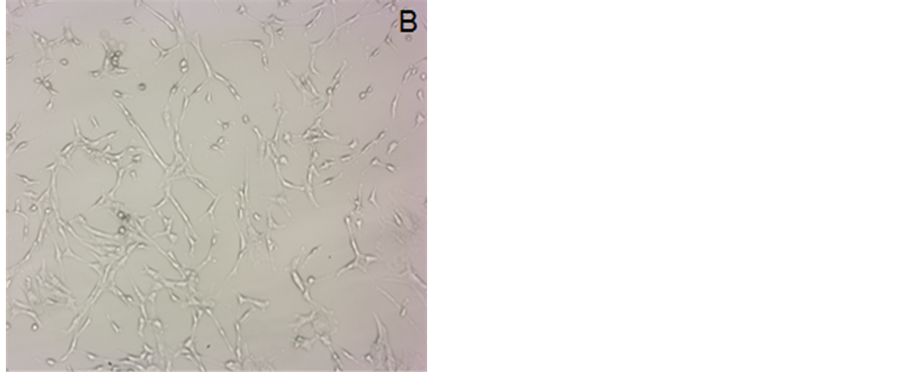


Figure 1. 3T3-L1 cells treated for 72 h by 40 μM carotenoids (40×): (A) Control; (B) Bixin; (C) Lycopene; (D) β-carotene
图1. 40 μM类胡萝卜素处理72 h后的3T3-L1细胞(40×):(A) 对照;(B) 胭脂树橙;(C) 番茄红素;(D) β-胡萝卜素
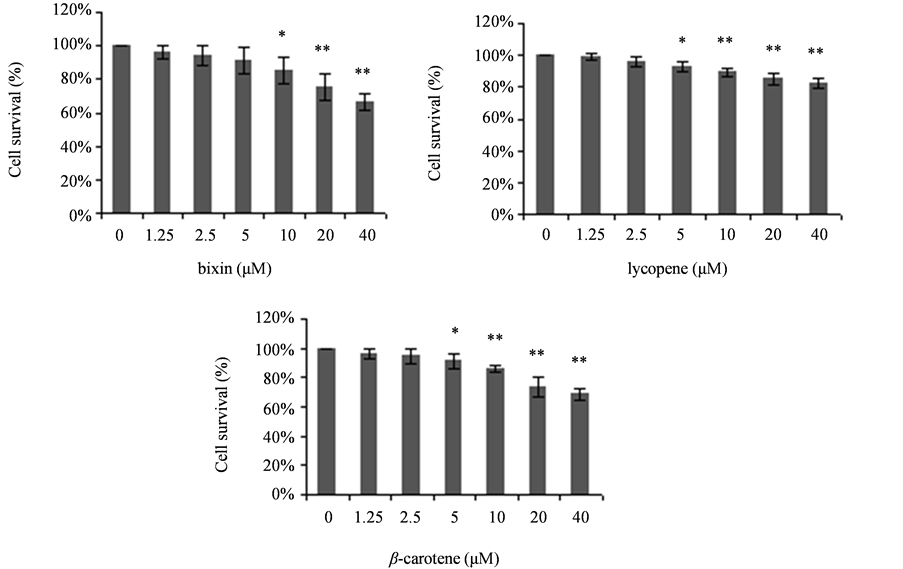
Figure 2. Carotenoids on 3T3-L1 cell viability. The viability of 3T3-L1 cells treated with carotenoids for 72 h was measured by MTT assay. Data are presented as the means ± S.D., n = 3, *P < 0.05 and **P < 0.01 versus control group
图2. 类胡萝卜素对3T3-L1细胞活力的影响。用类胡萝卜素处理72 h后3T3-L1细胞的活力用MTT法检测。数据表示为平均值±标准差,重复3次,*P < 0.05和**P < 0.01分别表示与对照组相比差异的显著程度
3.2. 类胡萝卜素对前脂肪细胞3T3-L1分化的影响
用诱导剂诱导前脂肪细胞3T3-L1分化至8 d后,未加类胡萝卜素的对照组脂肪细胞分化率较高,油红O染色后可看到细胞分泌脂肪颗粒较多(图3)。而经过类胡萝卜素处理的细胞分化率明显降低,油红O染色后能看到40 μM类胡萝卜素处理6 d的细胞(诱导剂处理了8 d)分泌脂肪颗粒少而稀疏,以胭脂树橙和β-胡萝卜素的极为明显。用浓度分别为5、10、20、40 μM类胡萝卜素处理诱导2 d的细胞,继续诱导分化至8 d后用油红O染色,然后测定OD值,以定量检测细胞内脂肪含量,判断脂肪细胞分化程度。结果如图4,可以看出胭脂树橙、番茄红素和β-胡萝卜素对3T3-L1前脂肪细胞的分化都有一定的抑制作用。在本试验浓度范围内未发现胭脂树橙和番茄红素对3T3-L1脂肪细胞分化的抑制作用与浓度有较大关联,10 μM胭脂树橙处理时细胞分化受抑制程度与对照组相比有显著差异,20 μM和40 μM处理时分化受抑制与对照组相比有极显著差异。20 μM和40 μM番茄红素处理组细胞分化受抑制程度与对照组相比有极显著差异。β-胡萝卜素对3T3-L1脂肪细胞分化的抑制作用表现出与浓度呈现剂量效应关系,10 μM处理时细胞分化率降低与对照组相比已有显著差异,20 μM和40 μM处理时差异达极显著程度。
3.3. 类胡萝卜素对3T3-L1细胞中PPARγ表达的影响
蛋白质水平检测结果显示(图5),3T3-L1前脂肪细胞分化过程中加入类胡萝卜素干预,其PPARγ蛋白表达水平明显被下调,与类胡萝卜素抑制细胞分化的情形很相似,除胭脂树橙处理浓度变化与PPARγ蛋白表达水平降低之间没有相关性外,高浓度的另两种类胡萝卜素处理组的蛋白表达水平都低于低浓度处理组,β-胡萝卜素还明显呈现出浓度依赖的方式下调PPARγ蛋白表达。
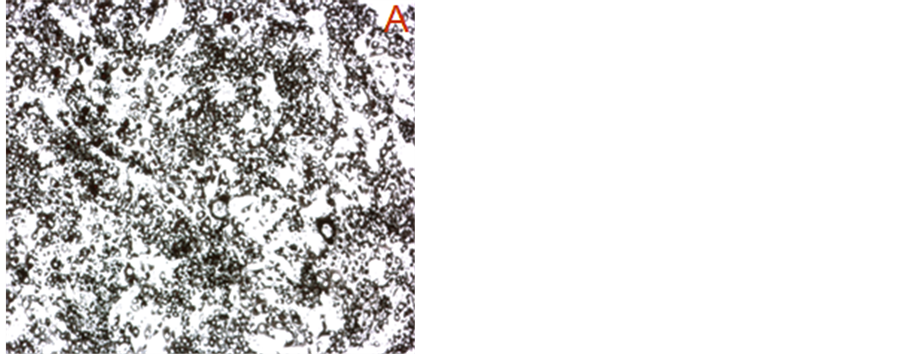
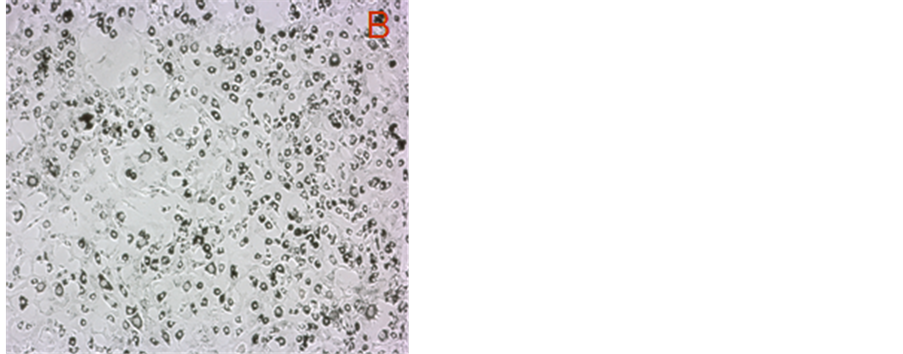
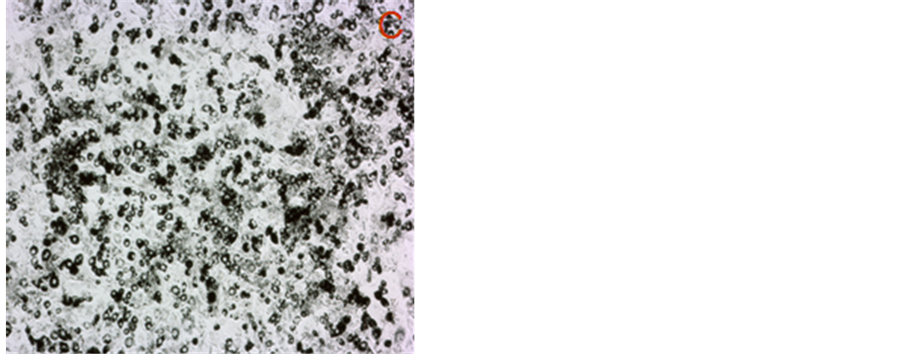

Figure 3. Oil red O attaining of 3T3-L1 cells treated for 6 d by 40 μM carotenoids (40×): (A) Control; (B) Bixin; (C) Lycopene; (D) β-carotene
图3. 40 μM类胡萝卜素处理6 d的3T3-L1脂肪细胞油红染色图(40×):(A) 对照;(B) 胭脂树橙处理;(C) 番茄红素处理;(D) β-胡萝卜素处理
4. 讨论
肥胖是由于机体能量摄入与消耗之间的不平衡,体现为脂肪细胞数量增加和体积增大 [2] ,抑制前脂肪细胞的增殖和分化为成熟脂肪细胞成为抗肥胖的一个重要手段。本试验结果表明,胭脂树橙、β-胡萝卜素和番茄红素能降低3T3-L1前脂肪细胞的活力,抑制其分化,下调PPARg的表达,这与文献报道的β-胡萝卜素、b-隐黄质、岩藻黄质以及新黄质在3T3-L1细胞上的研究结果一致 [7] - [10] [13] ,但与胭脂树橙和辣椒色素的结果不同 [14] [15] 。番茄红素作为近年广受关注的类胡萝卜素,尽管已表明可抑制脂肪肝发展,还未见其影响前脂肪细胞系分化相关报道,本结果有助于全面认识番茄红素的抑制脂肪积累抗肥胖功能。
如前所述,前脂肪细胞分化为成熟脂肪细胞是个复杂的过程,是由精细的转录因子网络调控的,不同时间进程阶段细胞表现不同 [19] 。在视黄酸抑制3T3-L1前脂肪细胞分化为脂肪细胞研究中发现,当PPARg已经表达后加入视黄酸则抑制3T3-L1细胞分化,并引起细胞中PPARg蛋白损失。分化诱导后72到96 h,视黄酸便失去抑制细胞分化作用 [20] 。研究岩藻黄质对3T3-L1前脂肪细胞三个分化阶段期间脂肪生成影响观察到,在分化的早期阶段(0~2 d)用岩藻黄质则促进3T3-L1脂肪细胞分化,增加甘油三酯积累与PPARg蛋白表达,在分化的中期(2~4 d)和后期阶段(4~7 d)岩藻黄质降低PPARg表达,提示岩藻黄质
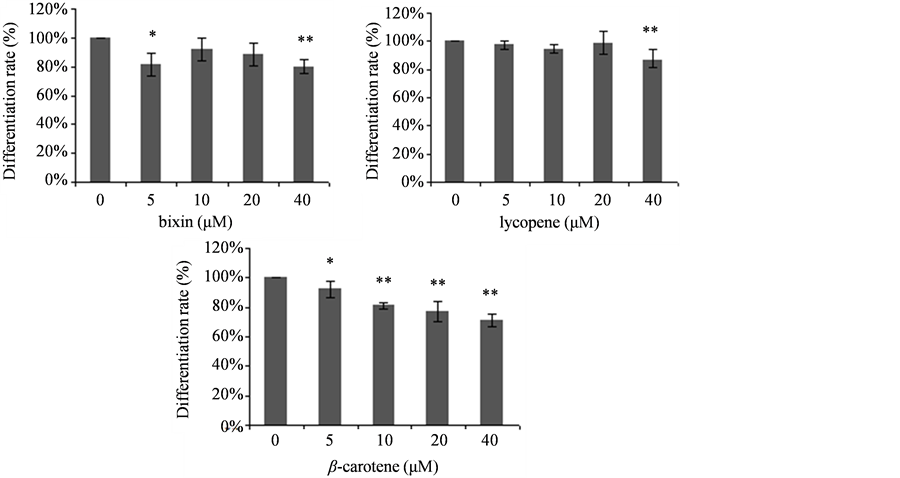
Figure 4. Effects of carotenoids on the differentiation of 3T3-L1 cells. 3T3-L1 cells treated by differentiation inducer for 2 d and then another 6 d after carotenoid addition. Data are presented as percent of control and the bars are the means ± S.D. values for three independent experiments. *P < 0.05 and **P < 0.01 versus control groups
图4. 类胡萝卜素对3T3-L1细胞分化的影响。3T3-L1 细胞用分化诱导剂处理2天后加类胡萝卜素再处理培养6天。数据为对照组的百分率,柱形图的数值为3次独立试验的平均值 ± 标准差,*P < 0.05和**P < 0.01分别表示与对照组相比差异的显著程度

Figure 5. Carotenoids down-regulate PPARγ protein expression levels in 3T3-L1 cells. 3T3-L1 cells treated by differentiation inducer for 2 d and then another 6 d after carotenoid addition. The expression levels of samples were normalized to the corresponding levels of β-actin. Data are presented as percent of control and the bars are the means ± S.D. values for three independent experiments. *P < 0.05 and **P < 0.01 versus control groups
图5. 类胡萝卜素下调3T3-L1细胞中PPARγ蛋白表达水平。3T3-L1细胞用分化诱导剂处理2天后加类胡萝卜素再处理培养6天,用相应的β-actin水平将样品的表达水平标准化,数据为对照组的百分率,柱形图的数值为3次独立试验的平均值±标准差,*P < 0.05和**P < 0.01分别表示与对照组相比差异的显著程度
在3T3-L1细胞不同分化阶段施加的不同效应 [21] 。以上研究结果有助于理解当下在研究类胡萝卜素对3T3-L1前脂肪细胞分化及PPARg蛋白表达影响上得到不一致甚至相反的结果,即在3T3-L1前脂肪细胞到脂肪细胞不同分化阶段施用类胡萝卜素,会得到截然不同抑制脂肪积累抗肥胖效果。例如,已报道胭脂树橙是作为PPARg激活剂起作用的,可增强分化了的3T3-L1脂肪细胞中PPARg靶基因的表达 [14] 。
PPARg是一种配体依赖性转录因子,参与脂类生物合成、葡萄糖代谢、炎症反应、动脉粥样硬化,还调控细胞增殖与分化 [22] 。PPARg在3T3-L1成纤维细胞分化早期阶段发挥重要作用,其表达增强足以诱导成纤维细胞的脂肪细胞分化,缺PPARg下没有发现促进脂肪生成的因子,绝大部分的脂肪生成前因子至少部分地是通过激活PPARg表达或活力来发挥功能的。若激活PPARg,则会促进3T3-L1细胞活力并分化为成熟脂肪细胞,只有下调PPARg表达才能降低细胞活力抑制其分化。有研究表明,PPARγ基因缺失小鼠在高脂饮食情况下不会发生肥胖,表明PPARγ表达量的降低能防止高脂饮食引起的脂肪细胞过度肥大 [23] 。本试验结果,连同其他多数同类研究报道也都证明这个观点,表明类胡萝卜素是经由下调PPARg来对3T3-L1施加影响的。
类胡萝卜素的抗肥胖作用已在多种细胞类型和动物上得到确认,例如番茄红素可对抗高脂饮食引起的大鼠脂肪肝 [11] [12] 。给肥胖大鼠补充虾青素可使内脏脂肪细胞减小,降低血液游离脂肪酸浓度 [24] 。长期给饲虾青素可明显缓解高脂饲料喂饲引起的小鼠体重增加,降低脂肪组织的脂水平 [25] 。对β-胡萝卜素和叶黄素在牛白色脂肪组织中诱导前脂肪细胞分化,促进脂肪生成的原因可能在于细胞类型不同,因为虾青素促进神经干细胞脂肪生成,使PPARg过表达 [26] ,同时也表明调控体内脂肪生成和积累系统的复杂性。
类视黄素(视黄醇、视黄醛和视黄酸)抑制脂肪细胞分化的抗肥胖作用已得到较广泛认同 [27] ,β-胡萝卜素降低3T3-L1细胞活力抑制其分化的能力强于胭脂树橙和番茄红素,且其作用效应强弱呈现浓度依赖方式,都可能与其易生成类视黄素有关,最不易转化为类视黄素的番茄红素对细胞的作用就较弱,这需要在今后的成分检测试验中给以确认。
文章引用
高润草,阮宝玉,吕 品,赵文恩, (2015) 类胡萝卜素对前脂肪细胞3T3-L1增殖和分化的影响
Effects of Carotenoids on 3T3-L1 Preadipocyte Viability and Differentiation. 生物物理学,02,49-57. doi: 10.12677/BIPHY.2015.32005
参考文献 (References)
- 1. Wu, Y. (2002) Obesity: An epidemic must be paid attention to. Chinese Journal of Epidemiology, 23, 3-4.
- 2. Rosen, E.D. and MacDougald, O.A. (2006) Adipocyte differentiation from the inside out. Nature Reviews Molecular Cell Biology, 7, 885-896. http://dx.doi.org/10.1038/nrm2066
- 3. Mueller, E. (2014) Understanding the variegation of fat: Novel regulators of adipocyte differentiation and fat tissue biology. Biochimica et Biophysica Acta, 1842, 352-357.
- 4. Lobo, G.P., Amengua, J., Li, H.N.M., Golczak, M., Bonet, M.L., Palczewski, K. and von Lintig, J. (2010)β,β-Caro- tene decreases peroxisome proliferator receptor gamma activity and reduces lipid storage capacity of adipocytes in a β,β-carotene oxygenase 1-dependent manner. Journal of Biological Chemistry, 285, 27891-27899. http://dx.doi.org/10.1074/jbc.M110.132571
- 5. Amengual, J., Gouranton, E., van Helden, Y.G.J., et al. (2011) Beta-Carotene reduces body adiposity of mice via BCMO1. PLoS ONE, 6, e20644. http://dx.doi.org/10.1371/journal.pone.0020644
- 6. Harari, A., Harats, D., Marko, D., et al. (2008) A 9-cis β-Carotene-enriched diet inhibits atherogenesis and fatty liver formation in LDL receptor knockout mice. Journal of Nutrition, 138, 1923-1930.
- 7. Kawada, T., Kamei, Y., Fujita, A., Hida, Y., Takahashi, N., Sugimoto, E. and Fushiki, T. (2000) Carotenoids and retinoids as suppressors on adipocyte differentiation via nuclear receptors. Biofactors, 13, 103-109. http://dx.doi.org/10.1002/biof.5520130117
- 8. Shirakura, Y., Takayanagi, K., Mukai, K., Tanabe, H. and Inoue, M. (2011)β-Cryptoxanthin suppresses the adipogenesis of 3T3-L1 cells via RAR activation. Journal of Nutritional Science and Vitaminology, 57, 426-431. http://dx.doi.org/10.3177/jnsv.57.426
- 9. Maeda, H., Hosokawa, M., Sashima, T., Takahashi, N., Kawada, T. and Miyashita, K. (2006) Fucoxanthin and its metabolite, fucoxanthinol, suppress adipocyte differentiation in 3T3-L1 cells. International Journal of Molecular Medicine, 18, 147-152.
- 10. Yim, M.J., Hosokawa, M., Mizushina, Y., Yoshida, H., Saito, Y. and Miyashita, K. (2011) Suppressive effects of amarouciaxanthin A on 3T3-L1 adipocyte differentiation through down-regulation of PPARγ and C/EBPα mRNA expression. Journal of Agricultural and Food Chemistry, 59, 1646-1652. http://dx.doi.org/10.1021/jf103290f
- 11. Zaripheh, S., Nara, T.Y., Nakamura, M.T. and Erdman Jr., J.W. (2006) Dietary lycopene downregulates carotenoid 15,15’-monooxygenase and PPAR-γ in selected rat tissues. Journal of Nutrition, 136, 932-938.
- 12. Chung, J., Koo, K., Lian, F., Hu, K.Q., Ernst, H. and Wang, X.D. (2012) Apo-10’-lycopenoic acid, a lycopene metabolite, increases sirtuin 1 mRNA and protein levels and decreases hepatic fat accumulation in ob/ob mice. Journal of Nutrition, 142, 405-410. http://dx.doi.org/10.3945/jn.111.150052
- 13. Okada, T., Nakai, M., Maeda, H., Hosokawa, M., Sashima, T. and Miyashita, K. (2008) Suppressive effect of neoxanthin on the differentiation of 3T3-L1 adipose cells. Journal of Oleo Science, 57, 345-351. http://dx.doi.org/10.5650/jos.57.345
- 14. Takahashi, N., Goto, T., Taimatsu, A., Egawa, K., Katoh, S., Kusudo, T., Sakamoto, T., Ohyane, C., Lee, J.Y., Kim, Y.I., Uemura, T., Hirai, S. and Kawada, T. (2009) Bixin regulates mRNA expression involved in adipogenesis and enhances insulin sensitivity in 3T3-L1 adipocytes through PPARγ activation. Biochemical and Biophysical Research Communications, 390, 1372-1376. http://dx.doi.org/10.1016/j.bbrc.2009.10.162
- 15. Maeda, H., Saito, S., Nakamura, N. and Maoka, T. (2013) Paprika pigments attenuate obesity-induced inflammation in 3T3-L1 adipocytes. PPAR Research, 2013, Article ID: 763758.
- 16. García-Rojas, P., Antaramian, A., Gonzalez-Davalos, L., Villarroya, F., Shimada, A., Varela-Echavarría, A. and Mora, O. (2010) Induction of peroxisomal proliferator-activated receptor γ and peroxisomal proliferator-activated receptor γ coactivator 1 by unsaturated fatty acids, retinoic acid, and carotenoids in preadipocytes obtained from bovine white adipose tissue. Journal of Animal Science, 88, 1801-1808. http://dx.doi.org/10.2527/jas.2009-2579
- 17. Zhang, X., Zhao, W., Hu, L., Zhao, L. and Huang, J. (2011) Carotenoids inhibit proliferation and regulate expression of peroxisome proliferators-activated receptor gamma (PPARγ) in K562 cancer cells. Archives of Biochemistry and Biophysics, 512, 96-106. http://dx.doi.org/10.1016/j.abb.2011.05.004
- 18. Zebisch, K., Voigt, V., Wabitsch, M. and Brandsch, M. (2012) Protocol for effective differentiation of 3T3-L1 cells to adipocytes. Analytical Biochemistry, 425, 88-90. http://dx.doi.org/10.1016/j.ab.2012.03.005
- 19. Gregoire, F.M. (2001) Adipocyte differentiation: From fibroblast to endocrine cell. Experimental Biology and Medicine, 226, 997-1002.
- 20. Xue, J.C., Schwarz, E.J., Chawla, A. and Lazar, M.A. (1996) Distinct stages in adipogenesis revealed by retinoid inhibition of differentiation after induction of PPARγ. Molecular and Cellular Biology, 16, 1567-1575.
- 21. Kang, S.I., Ko, H.C., Shin, H.S., Kim, H.M., Hong, Y.S., Lee, N.H. and Kim, S.J. (2011) Fucoxanthin exerts differing effects on 3T3-L1 cells according to differentiation stage and inhibits glucose uptake in mature adipocytes. Biochemical and Biophysical Research Communications, 409, 769-774. http://dx.doi.org/10.1016/j.bbrc.2011.05.086
- 22. Semple, R.K., Chatterjee, V.K. and O’Rahilly, S. (2006) PPAR gamma and human metabolic disease. Journal of Clinical Investigation, 116, 581-589. http://dx.doi.org/10.1172/JCI28003
- 23. Kadowaki, T., Hara, K., Kubota, N., Tobe, K., Terauchi, Y. and Yamauchi, T. (2002) The role of PPARγ in high-fat diet-induced obesity and insulin resistance. Journal of Diabetes and Its Complications, 16, 41-45. http://dx.doi.org/10.1016/S1056-8727(01)00206-9
- 24. Kimura, M., Iida, M., Yamauchi, H., Suzuki, M., Shibasaki, T., Saito, Y. and Saito, H. (2014) Astaxanthin supplementation effects on adipocyte size and lipid profile in OLETF rats with hyperphagia and visceral fat accumulation. Journal of Functional Foods, 11, 114-120. http://dx.doi.org/10.1016/j.jff.2014.08.001
- 25. Arunkumar, E., Bhuvaneswari, S. and Anuradha, C.V. (2012) An intervention study in obese mice with astaxanthin, a marine carotenoid—Effects on insulin signaling and pro-inflammatory cytokines. Food & Function, 3, 120-126. http://dx.doi.org/10.1039/C1FO10161G
- 26. Kim, J.H., Nam, S.-W., Kim, B.W., Kim, W.-J. and Choi, Y.H. (2010) Astaxanthin improves the proliferative capacity as well as the osteogenic and adipogenic differentiation potential in neural stem cells. Food and Chemical Toxicology, 48, 1741-1745. http://dx.doi.org/10.1016/j.fct.2010.04.002
- 27. Frey, S.K. and Vogel, S. (2011) Vitamin A metabolism and adipose tissue biology. Nutrients, 3, 27-39. http://dx.doi.org/10.3390/nu3010027