Biophysics
Vol.
07
No.
03
(
2019
), Article ID:
31688
,
7
pages
10.12677/BIPHY.2019.73033
Study on the Photoconversion Effect of DAPI under Fluorescent Double Labeling Condition by Confocal Microscopy
Weicheng Yao, Jiayu Liu, Mengdi Zhu, Kaishun Hu, Yongqiang Wang*
Guangdong Provincial Key Laboratory of Malignant Tumor Epigenetics and Gene Regulation, Medical Research Center, Sun Yat-sen Memorial Hospital, Sun Yat-sen University, Guangzhou Guangdong
Received: Jun. 19th, 2019; accepted: Aug. 6th, 2019; published: Aug. 13th, 2019

ABSTRACT
As an important fluorescent dye, DAPI is widely used in nuclear labeling experiments. Recently, it has been reported that DAPI will produce light conversion effect due to exposure to UV. After light conversion, DAPI can be excited by blue light and emit green fluorescence signal, thus affecting the fluorescence experimental observation. In this paper, the nuclear dye DAPI and green fluorescence were labeled in the same cells, and it was observed that the light conversion efficiency of DAPI was significantly reduced, indicating that the green fluorescence of cytoplasm had an inhibitory effect on the light conversion effect of cell nucleus DAPI. In this study, the light conversion effect of DAPI was observed and analyzed through Laser Scanning Confocal Microscope, providing foundation for the multi-labeled fluorescence experimental observations that DAPI participated in the same time.
Keywords:DAPI, Photoconversion, Ultraviolet Light, Laser Scanning Confocal Microscope
应用激光共聚焦显微技术研究荧光双标记条件下的DAPI光转化效应
姚伟城,刘嘉煜,朱梦迪,胡开顺,王永强*
中山大学孙逸仙纪念医院医学研究中心,广东省恶性肿瘤表观遗传与基因调控重点实验室,广东 广州
收稿日期:2019年6月19日;录用日期:2019年8月6日;发布日期:2019年8月13日

摘 要
DAPI作为重要的荧光染料,在细胞核标记实验中被广泛使用。近期有报道指出,DAPI会因紫外光照射而发生光转化效应,光转化后的DAPI可被蓝色光激发而发出绿色荧光信号,进而影响荧光观察。本文通过对细胞核DAPI染色的同时进行细胞质绿色荧光标记,观察到DAPI光转化效率显著下降,说明胞质的绿色荧光对胞核DAPI光转化效应产生抑制。该研究通过激光共聚焦显微手段,对DAPI光转化效应进行观察和分析,为多标记荧光实验观察提供一定依据。
关键词 :DAPI,光转化,紫外光,激光共聚焦显微术

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
DAPI于1971年在Otto Dann的实验室第一次合成,当时作为药物用于治疗锥虫病。后来有研究人员发现DAPI与DNA有较强的结合能力,并逐步发展成为生命科学领域广泛使用的DNA染料,应用于荧光显微观察、流式细胞术等实验 [1] [2] 。前人的研究显示DAPI主要结合在富含A-T序列的DNA片段区域 [3] ,可被紫外光(UV)激发,在430~470 nm波段产生最大发射,基于这样的荧光特征,DAPI成为细胞荧光多标记实验中重要的荧光染料之一。近期的研究表明,DAPI的激发信号和荧光发射信号并非稳定的,在UV处理下DAPI会发生光转化效应,转化后可由蓝光激发并产生绿色荧光发射信号 [4] [5] [6] 。因此,在使用DAPI与其他荧光染料结合的实验中,对荧光检测、捕获图像或解释图像时,需避免假阳性的结果。
本文以乳腺肿瘤细胞为实验材料,对细胞进行DAPI和绿色荧光蛋白双标记,在标准卤素灯紫外光照射处理下,通过激光共聚焦显微技术,研究细胞荧光双标记实验观察中DAPI光转化效应的变化。通过对固定视野下的细胞,不同位置逐步给光处理的方式,本文观察到DAPI的荧光转化效应逐步产生的过程。在UV照射处理早期,对细胞核蓝色荧光发射以及绿色荧光发射分别进行检测分析,发现绿色荧光发射量与蓝色荧光发射量变化成负相关。进一步的分析发现,在DAPI单标记样本中细胞核定位的荧光量总处于相对稳定水平,而双标记样本中细胞核定位的荧光总量呈明显下降趋势,说明双标记可能引起DAPI荧光转化率下降,但是转化率下降的机制仍不清楚。本文基于UV处理早期的数据研究,对DAPI荧光转移信号进行检测和分析,为DAPI参与的多标记荧光观察研究提供初步的实验依据。
2. 实验方法和材料
2.1. 试剂
DMEM培养基、胎牛血清、胰酶购于美国Gibco公司;DAPI购于中国北京leagene公司;4%多聚甲醛、triton-X100、Tween、荧光二抗购于Thermo Fisher Scientific公司;Vimentin一抗购于美国CST公司;DIG标记的oligo探针由苏州泓迅生物公司设计合成,序列为:DIG-GAACCAGGCGACATGGCACATG C-DIG;抗DIG荧光二抗购于Roche公司;抗荧光淬灭封片液购于碧云天生物科技。
2.2. 细胞培养
乳腺癌MCF-7细胞系源于美国模式培养物集存库,使用10%胎牛血清及DMEM Medium培养。将细胞按1 × 105个接种于共聚焦皿中,细胞密度30%~50%,接种后8小时用4%多聚甲醛固定15分钟,备用。
2.3. 探针原位杂交
固定后的细胞用0.5% triton X-100通透,75%酒精变性,−20℃酒精梯度脱水,预杂交后加入双端标有DIG标记的oligo探针于杂交炉中与circRNA原位杂交过夜。杂交结束后冲洗细胞,0.5% BSA封闭,然后加入抗DIG的荧光二抗(494/523 nm)孵育过夜。PBS清洗多余的二抗后,细胞用1 μM的DAPI染色,10分钟后用PBS漂洗细胞三次,吸尽清洗液后滴加抗荧光淬灭封片剂。染色后的细胞用于共聚焦显微镜观察或者4℃保存备用。
2.4. 免疫荧光染色
免疫荧光染色,将细胞固定后使用PBST(1X PBS + 0.1% Triton X-100)漂洗3次,每次5分钟,动作轻柔,漂洗后完全去除漂洗液,用1% BSA封闭10分钟。加一抗(抗Vimentin抗体,用1% BSA稀释至1:100)孵育,4℃过夜。回收一抗,用PBST (1X PBS + 0.1% Tween)漂洗3次,每次5分钟,漂洗结束后完全去除漂洗液,孵育荧光二抗(抗Rabbit,488 nm;用1% BSA 1:200稀释),室温1小时。孵育完成后回收二抗,用PBST(1X PBS + 0.1% Tween)漂洗3次,每次5分钟,漂洗结束后完全去除漂洗液。用0.5 ug/ml DAPI染核,室温孵育5分钟,孵育完成后PBST (1X PBS + 0.1% Tween)漂洗3次,每次5分钟,漂洗结束后完全去除漂洗液。加入抗荧光淬灭剂防止荧光淬灭,放入湿盒中4℃避光保存。
2.5. 荧光成像
使用激光共聚焦显微镜(LCSM 800,Zeiss,Germany)记录图像。实验用波长405 nm和488 nm激光对样本进行激发,分别对波长范围的荧光进行收集。405 nm激光器和488 nm激光器输出能量设置分别为0.25 mW和0.65 mW。图像处理使用ZEN (blue edition) 软件。使用Lumen Dynamicsx-Cite® exacte荧光光源发出的紫外光进行光转化刺激,采用360/40 nm发射滤光片。
3. 结果
3.1. 紫外光处理条件下DAPI发生光转化效应
本文首先使用DAPI标记乳腺肿瘤细胞核,然后在标准卤素灯紫外光处理下观察细胞核的相关荧光信号变化。实验过程使用激光共聚焦显微镜观察,用405 nm和488 nm激光激发标记了DAPI的细胞核,对预期的蓝色荧光发射(410~530 nm)和绿色荧光发射(498~600 nm)信号进行分别检测。实验结果显示未经卤素灯紫外光处理之前,仅能检测到蓝色荧光信号,没有绿色荧光信号的产生(图1A)。在标准卤素灯紫外光处理局部细胞核之后,处理区域细胞核产生了显著地绿色荧光信号(图1B),进一步扩大到全视野处理,在所有细胞核都检测到了强的绿色荧光信号(图1C),并且该绿色荧光与细胞核是共定位的。未经DAPI标记的乳腺肿瘤细胞却没有以上现象的产生(本文未列出该数据),说明绿色荧光的发生是源于DAPI的性状变化,产生可被488 nm激光激发发出绿色的荧光信号。图1实验显示,绿色荧光信号逐步产生与标准卤素灯紫外光的逐步处理直接相关,表明紫外光处理条件是导致DAPI发生光转化效应的直接原因。
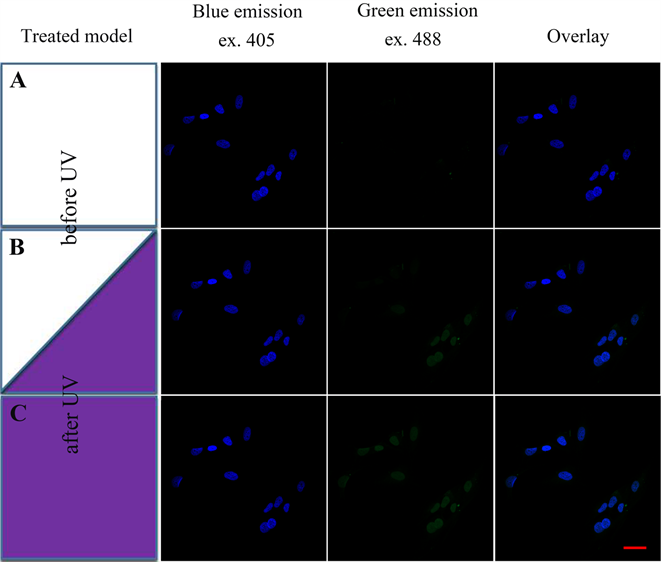
Figure 1. UV-Induced Changes of Spectral Characteristics of DAPI. (A) Fluorescence imaging of blue and green channels before UV irradiation; (B) Fluorescence imaging of blue and green channels when UV irradiation of half of the cells in the field; (C) Fluorescence imaging when all the cells under UV treatment. (scale bars = 20 μm)
图1. 紫外光照射处理引起了DAPI光转化效应。(A) 未经紫外光照射处理之前的蓝色、绿色通道的荧光成像;(B) 对视野内一半的细胞进行紫外光照射处理,检测蓝色和绿色通道的荧光信号;(C) 对全视野内细胞进行紫外光照射处理,并检测相关荧光信号。(标尺 = 20 μm)
3.2. 紫外光处理条件下DAPI光转化的定量分析
分析DAPI光转化效应与标准卤素灯紫外光照射时长之间的关系,有利于在实验过程中控制不利条件的影响,所以本文进一步记录标准卤素灯紫外光处理下相关荧光信号变化,并做了荧光数据统计和分析。结果显示,在标准卤素灯处理早期,随着紫外光照射时间的加长,细胞核定位绿色荧光信号逐步增强(图2A)。对细胞核蓝色荧光和绿色荧光强度统计,结果显示随着标准卤素灯处理时间的加长会引起DAPI荧光信号逐渐趋于减弱,而绿色荧光强度则有显著提升(图2B),在前者的报道中也有类似现象。进一步统计细胞核定位蓝色荧光信号和绿色荧光信号的荧光总值,发现在标准卤素灯紫外光处理早期细胞核定位的荧光总值处于稳定水平(图2C),表明细胞核定位蓝色荧光量值的减少被绿色荧光量产值高效补充。图2实验说明,准卤素灯紫外光照射初期,DAPI光转化效率处于比较高的水平。
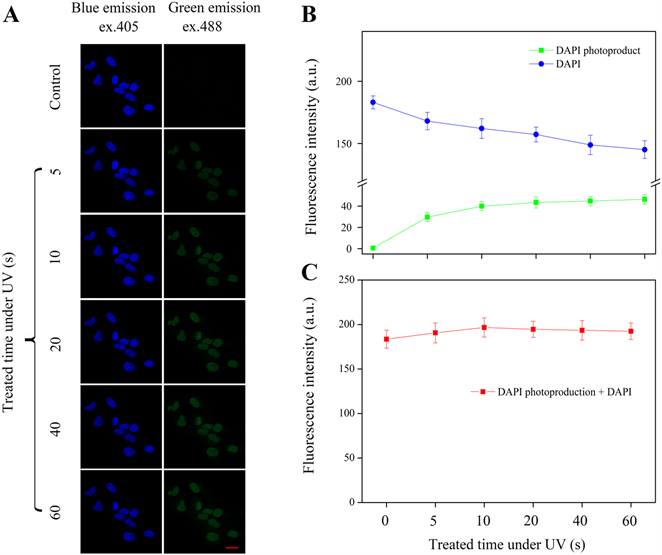
Figure 2. Detection and statistical analysis of DAPI light conversion effect under UV light irradiation treatment. (A) Detection the fluorescence signal of nuclear localization by laser confocal microscopy (scale = 10 μm); (B) Statistics of blue fluorescence and green fluorescence in A; (C) Statistics on the total fluorescence intensity of nuclear localization. Error bars are ± SD values for three replicates
图2. 紫外光照射处理下DAPI光转化效应的检测与统计分析。(A) 通过激光共聚焦显微镜观察细胞核定位的荧光信号;(B) 对A图中蓝色荧光和绿色荧光进行统计;(C) 对细胞核定位的总荧光强度进行统计。(标尺 = 10 μm)
3.3 细胞质荧光双标记会影响DAPI的光转化效率
DAPI作为重要的多标记荧光染料之一,在细胞荧光观察、流式细胞术等实验中广泛使用。为进一步研究DAPI光转化效应在多标记荧光观察实验中的影响,本文在乳腺肿瘤细胞原位杂交和免疫荧光实验中,记录标准卤素灯紫外光处理下细胞核和细胞质荧光信号的变化情况。实验结果显示,DAPI因标准卤素灯紫外光的照射处理发生光转化效应,细胞核绿色荧光信号不断增强,相反细胞质绿色荧光信号逐步减弱(图3A、图3B、图3C)。紫外光处理早期,对circRNA和波形蛋白分别的单标记荧光实验结果显示,细胞质荧光信号逐步减弱(本文实验未显示)。随后的荧光信号统计表明,细胞核定位的荧光总值却是趋于不断下降,在标准卤素灯紫外光处理一分钟时已降低至原有总值的50%左右(图3D)。为确认该现象的可重复性,本文实验重复了三次,得到了相同的实验趋势。图3实验现象表明,细胞质绿色荧光的标记,间接引起DAPI光转化效率降低,并且DAPI荧光转化现象对细胞质荧光观察并无明显影响。
4. 讨论
本文尝试分析细胞荧光双标记实验中DAPI光转化效应的变化情况,为细胞多荧光标记实验观察以
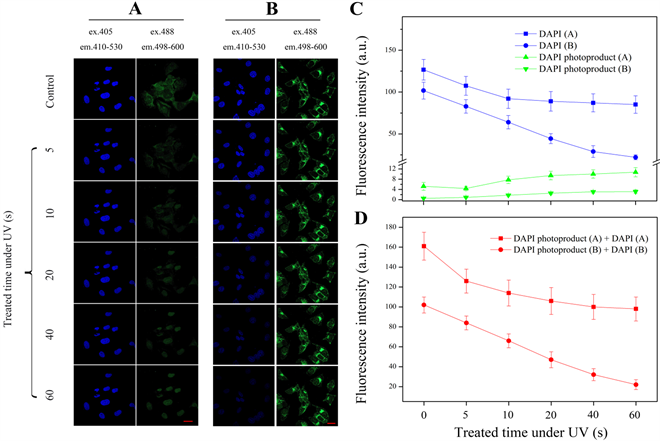
Figure 3. Detection and statistical analysis of light conversion effects in DAPI-assisted double labeling experiments under UV irradiation. (A) Detection the DAPI fluorescence signal conversion under the conditions of in situ hybridization of circRNA by confocal microscopy (scale = 10 μm); (B) Detecting the DAPI fluorescence conversion signal under the condition of cytoplasmic vimentin green fluorescent labeling (scale = 10 μm); (C) Statistics of blue fluorescence and green fluorescence in graphs A and B; (D) Statistics of total fluorescence intensity of nuclear localization. Error bars are ± SD values for three replicates
图3. 紫外光照射处理下,DAPI参与的双标记实验中光转化效应的检测与统计分析。(A) 通过激光共聚焦显微镜观察细胞circRNA原位杂交实验条件下的DAPI荧光信号转化;(B) 对细胞质波形蛋白绿色荧光标记条件下DAPI荧光转化信号检测;(C) 对A、B图中蓝色荧光和绿色荧光进行统计;(D) 对细胞核定位的总荧光强度进行统计。(标尺 = 10 μm)
及分析提供基础依据。
最近的报道显示,紫外光照射可以引起DAPI和Hoechst 33258发生光转化现象,可由蓝光激发并产生绿色荧光发射信号 [4] [5] [6] [7] 。本文通过对固定视野下的细胞,不同位置逐步给光处理的方式,观察到了DAPI的荧光转化效应逐步实现的过程(图1)。同时,本文实验显示,在紫外光照射初期(0~60 s),细胞核定位的荧光产值总量处于相对稳定的水平,也就是说DAPI蓝色荧光发射的减弱,与DAPI光转化产生的绿色荧光发射总荧光量值处于相对稳定水平(图2),说明DAPI光转化效应较为显著。自从发现DAPI荧光转化现象以来,就有研究人员指出其在荧光多标记实验观察中需要引起注意 [5] ,本文对此进行初步的实验分析。分别在细胞原位杂交和免疫荧光实验中,通过标准卤素灯紫外光的照射处理,对DAPI光转化效应进行观察、记录和分析。实验结果显示DAPI光转化效率会因细胞质荧光的标记而下降,DAPI光转化现象并未对细胞质荧光产生影响(图3),所以DAPI作为多标记实验染料是可行的。为了避免DAPI荧光转化效应对实验观察的影响,日常实验操作中最好避开使用卤素灯紫外光通道寻找视野,而改用白光或者红、绿、蓝通道。本文的研究显示,DAPI光转化受外部荧光干扰而降低转化率,出现更多的荧光淬灭现象,但相关机制有待进一步的研究。
基金项目
国家自然科学基金(81772821)资助。
文章引用
姚伟城,刘嘉煜,朱梦迪,胡开顺,王永强. 应用激光共聚焦显微技术研究荧光双标记条件下的DAPI光转化效应
Study on the Photoconversion Effect of DAPI under Fluo-rescent Double Labeling Condition by Confocal Microscopy[J]. 生物物理学, 2019, 07(03): 27-33. https://doi.org/10.12677/BIPHY.2019.73033
参考文献
- 1. Kapuscinski, J. (1995) DAPI: A DNA-Specific Fluorescent Probe. Biotechnic & Histochemistry, 70, 220-233. https://doi.org/10.3109/10520299509108199
- 2. Dann, O., Bergen, G., Demant, E. and Volz, G. (1971) Trypanocide Diamidine des 2-Phenyl-benzofurans, 2-Phenyl-indens und 2-Phenyl-indols. Justus Liebigs Annalen der Chemie, 749, 68-89. https://doi.org/10.1002/jlac.19717490110
- 3. Zeman, L.J. and Lusena, C.V. (1975) Preferential Digestion of (A + T)-Rich Stretches of Yeast Mitochondrial DNA in Isolated Mitochondria. European Journal of Biochemistry, 57, 561-567. https://doi.org/10.1111/j.1432-1033.1975.tb02331.x
- 4. Zurek-Biesiada, D., Kedracka-Krok, S. and Dobrucki, J.W. (2013) UV-Activated Conversion of Hoechst 33258, DAPI, and Vybrant DyeCycle Fluorescent Dyes into Blue-Excited, Green-Emitting Protonated Forms. Cytometry Part A, 83A, 441-451. https://doi.org/10.1002/cyto.a.22260
- 5. Karg, T.J. and Golic, K.G. (2018) Photoconversion of DAPI and Hoechst Dyes to Green and Red-Emitting Forms after Exposure to UV Excitation. Chromosoma, 127, 235-245. https://doi.org/10.1007/s00412-017-0654-5
- 6. Piterburg, M., Panet, H. and Weiss, A. (2012) Photoconversion of DAPI Following UV or Violet Excitation Can Cause DAPI to Fluoresce with Blue or Cyan Excitation. Journal of Microscopy, 246, 89-95. https://doi.org/10.1111/j.1365-2818.2011.03591.x
- 7. Żurek-Biesiada, D., Waligórski, P. and Dobrucki, J.W. (2014) UV-Induced Spectral Shift and Protonation of DNA Fluorescent Dye Hoechst 33258. Journal of Fluorescence, 24, 1791-1801. https://doi.org/10.1007/s10895-014-1468-y