Biophysics
Vol.
08
No.
02
(
2020
), Article ID:
36898
,
9
pages
10.12677/BIPHY.2020.82002
Multifunction of LncRNA RMRP RNA
Hong Fu, Haoyu Zhao, Tailin Guo*
School of Medicine, Southwest Jiaotong University, Chengdu Sichuan

Received: Jul. 10th, 2020; accepted: Jul. 29th, 2020; published: Aug. 5th, 2020

ABSTRACT
RMRP RNA is an LncRNA which is multifunctional. It forms nucleic acid endonuclease RNase MRP with other proteins and produces 2 miRNAs and a siRNA. What’s more, RMRP RNA combines with transcription factor to regulate gene expression and acts as a miRNA sponge. This is how RMRP RNA regulates gene expression in different ways. RMRP RNA is widely involved in different life processes, and abnormally expressed RMRP RNA is also involved in the development of cancer and various diseases. Some mutations of RMRP RNA can cause dwarfism. Starting from the different functions of RMRP RNA, this review expounds the relationship between RMRP RNA and life process and various diseases, and also explores the molecular mechanism of RMRP RNA in it, so as to provide a reference for the follow-up research of RMRP RNA.
Keywords:RMRP RNA, RNase MRP, Multifunction, miRNA Sponge, siRNA

长链非编码RNA RMRP RNA功能的多样性
付洪,赵浩宇,郭泰林*
西南交通大学医学院,四川 成都

收稿日期:2020年7月10日;录用日期:2020年7月29日;发布日期:2020年8月5日

摘 要
RMRP RNA是一个长链非编码RNA,它具有多种功能,包括和其它蛋白形成核酸内切酶RNase MRP,产生2种miRNA,作为miRNA海绵,和转录因子结合调控基因表达以及产生1种siRNA,从不同层面调控基因表达。RMRP RNA广泛参与不同的生命过程,异常表达的RMRP RNA也参与癌症和各种疾病的发生。它自身某些位点的突变也会造成侏儒症。该综述从RMRP RNA不同的功能入手,阐述其与生命过程和各种疾病间的关系,同时也探寻RMRP RNA在其中的分子机制,为研究RMRP RNA后续的研究提供一个参考。
关键词 :RMRP RNA,RNase MRP,多功能,miRNA海绵,siRNA

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
长链非编码RNA (LncRNA)通常是指长度超过200 bp且不具有编码蛋白质功能的RNA。总体上而言编码LncRNA的基因数量要远远超过编码蛋白质的基因,自从LncRNA被发现以来,发现新的LncRNA的速度要远远超过被鉴定的LncRNA的速度 [1]。LncRNA有多种功能,从各个层面去调控各种生命过程 [2]。RMRP RNA (RNA component of mitochondrial RNA processing endoribonuclease)是一个多功能,参与多种生命过程,与多种疾病和癌症相关的一个LncRNA。人源的RMRP RNA长275 bp,目前已知RMRP RNA有5种功能。首先是RMRP RNA和其它蛋白亚基组成一个核酸内切酶RNase MRP,该核酸内切酶的已知底物有CLB2 mRNA [3],Viperin mRNA [4] 和Pre-rRNA [5],这是RMRP RNA最为人所知的一个功能。RMRP RNA第二个功能是它可以产生至少2种microRNA (miRNA),分别是RMRP-S1和RMRP-S2,它们拥有大量的底物,RMRP RNA可以通过miRNA广泛调控生命过程 [6]。第三种功能是RMRP RNA可以作为miRNA sponge,从而抑制miRNA的功能,比如miR-206 [7] 和miR-675都是其底物 [8]。第四个功能是在RNA helicase DEAD-boxprotein5 (DDX5)的介导下和转录因子RORγ结合,改变RORγ的特异性,调控基因表达 [9]。最后一个已知的功能是RMRP RNA,可以和端粒逆转录酶TERT相互结合,TERT发挥RNA-dependent RNA polymerase (RdRP)活性,再经过Dicer酶切加工,产生一个内源性的siRNA,该siRNA的作用靶点是RMRP RNA本身,此外还有其它一些靶基因 [10]。RMRP RNA在所有的组织或者细胞里面都有表达,某些位点的突变会造成Cartilage-Hair Hypoplasia (CHH),即软骨毛发发育不良 [11] [12]。这些突变也更加容易使患者倾向于患一些癌症,且通常伴随有t细胞免疫受损、贫血和支气管受损等。在许多种癌细胞中,RMRP RNA都是大量异常表达,且会促进癌细胞的增殖、迁移和转移 [13],这表明RMRP RNA在癌症发生中扮演重要的作用。该文章主要介绍详细RMRP RNA的五种功能,通过对这几种功能分析讨论RMRP RNA在CHH,t细胞免疫受损,不同癌细胞的增殖、迁移和转移,心肌相关疾病和其它生命过程中发挥的作用。
2. RMRP RNA的5种功能
2.1. RMRP RNA和其它蛋白亚基组成的RNase MRP及其功能
RNase MRP复合物由RMRP RNA和其它蛋白亚基组成,至少包括7个蛋白Rpp20、Rpp40、Rpp38、Rpp30、Rpp25、hPop5和hPop1,还有三个额外的与RNase MRP的蛋白亚基相关的蛋白Rpp14、Rpp21和Rpp29。RNase MRP主要定位在细胞核内。它的结构在真核生物之间比较保守。目前已知能够被RNase MRP内切的RNA有Clb2 mRNA、Viperin mRNA和pre-rRNAb (图1)。Clb2是一个细胞周期蛋白,在细胞周期中的S期结合并激活CDK1,促进细胞增殖。因此RNase MRP复合物可以通过Clb2调节细胞增殖 [14]。RNase MRP对Clb2 mRNA的切割位点在5’UTR,内切后由Xrn1 5’到3’端核酸外切酶降解,而不是由外泌体降解 [3]。Viperin是一个抗病毒蛋白 [15],在少量的I型或II型干扰素或者病毒感染的情况下,能被大量诱导表达 [16]。在哺乳动物或者低级脊椎动物中,Viperin蛋白的结构高度保守。它被切割的位点在CDS区 [4]。其功能有阻止甲型流感病毒从感染细胞的质膜上释放,干扰丙型肝炎病毒和人类巨细胞病毒的复制。过表达的Viperin可导致结晶性内质网并减少细胞蛋白的分泌。Viperin敲除的小鼠表现出Th2反应受损和t细胞受体介导的NF-κB和AP-1活化。因此RMRP RNA突变导致的t细胞发育受损可能与Viperin蛋白有关。RNase MRP复合物的另一个已知底物是rRNA的前体,与前2种底物不同的是RNase MRP对rRNA前体的内切是促进rRNA的成熟。RNase MRP切割rRNA前体的位点在internal transcribed spacer 1 (ITS1) [5]。尽管RNase MRP在真核生物中比较保守,但是在不同的物种里面其底物也稍有区别。对于底物Viperin mRNA和Pre-rRNA,在人源和鼠源中的RNase MRP都可以作用于这两个底物。对于Clb2,酵母和鼠源的RNase MRP可以作用于它 [3] [17],但在人源细胞里面,当RNase MRP的相关亚基被敲除时,Clb2 mRNA量却没有变化 [4]。这意味着在不同物种里面RNase MRP的底物识别特异性存在差异。
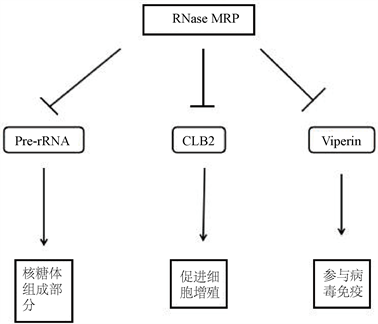
Figure 1. Substrats of RNase MRP and functions of substrates [3] [4] [5]
图1. RNase MRP的底物及其底物的功能 [3] [4] [5]
2.2. 来源于 RMRP RNA的2个miRNA
有的LncRNA可以通过产生的miRNA发挥作用。比如来源于LncRNAH19的miR-675可以促进MSC向成骨分化 [18]。RMRP RNA可以产生至少2种miRNA,它们分别是RMRP-S1和RMRP-S2 (图2)。RMRP-S1位于RMRP RNA的5’起始端,其长度为19到20 bp,其5’端一部分从RMRP RNA第一位碱基开始,另一部分从RMRP RNA第二位碱基开始。和RMRP-S1不同的是,RMRP-S2的5’端全部起源于RMRP RNA的140 bp处,全长19 bp。RMRP-S1和RMRP-S2在不同细胞,相同细胞的不同阶段或者在不同条件下表达量不一样。在BMSC里面同样也有表达。将RMRP-S1或RMRPS-2的模拟物转入Hek293细胞系,再用高通量检测所有基因的变化情况。RMRP-S1模拟物转入后表达量发生变化的基因总共有35个,其中表达下调的基因有29个,上调的基因有6个。RMRP-S2模拟物转入后表达量变化的基因总共901个,其中表达下调的有680个,上调的有221个。总的来说,在所有下调的基因中超过90%基因的mRNA3’端含有能和RMRP-S1或者RMRP-S2种子区(从miRNA5’端第二位碱基算起的后面6到8个碱基,在miRNA发挥作用时和靶序列互补)互补的序列。这意味着绝大部分被下调的RNA都是和RMRP-S1或RMRP-S2直接作用 [6]。
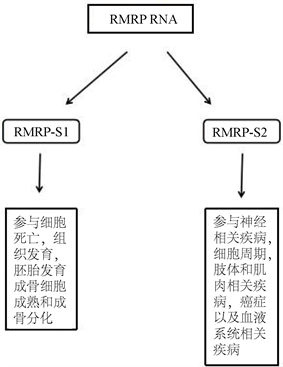
Figure 2. Functions of 2 miRNAs derived from RMRP RNA [6]
图2. 来源于RMRP RNA的2个miRNA及其功能 [6]
通过将这些能够被RMRP-S1或者RMRP-S2调控的基因分类,我们可以了解RMRP RNA通过RMRP-S1和RMRP-S2调控细胞的哪些功能。从表1中可以看到RMRP-S1的底物与细胞死亡相关的基因最多,共有9个。与胚胎发育相关的底物有3个,参与组织发育的有4个,与组织发育和功能相关的有6个。剩于少数底物与成骨细胞成熟、肢体发育和成骨分化相关。RMRP-S2的底物与神经病学相关的有96个,与骨骼和肌肉疾病相关的有97个,参与癌症发生的有78个,与细胞增殖相关的有46个。剩下的与血液疾病、血液系统的发展和功能、血压相关(表1)。从RMRP-S1和RMRP-S2的底物我们可知RMRP RNA仅仅是通过来源于它本身的miRNA就可以广泛的参与调控各种生命过程和有关疾病。这说明该LncRNA在生命过程中的重要作用。
2.3. RMRP RNA作为miRNA Sponge调控细胞发育
miRNA海绵(Sponge)是指含有某个miRNA高亲和结合位点的RNA,存在这个高亲和结合位点的RNA和miRNA的其它底物竞争性结合miRNA,减轻miRNA其它底物受到的抑制,miRNA和该RNA结合位点结合后会导致该RNA和miRNA的数量降低。RMRP RNA可以作为miRNA的Sponge,通过负调控其它miRNA调控生命过程。目前已知RMRP RNA可以作为多种miRNA的海绵,包括miR-206、miR-214-5p、miR-1-5p、miR-675和miR-613 (图3)。
miR-206高度保守,在人源和鼠源中其序列是一样的,它全长22 bp,和RMRP RNA有12个碱基配对,其中和miR-206的种子区全部配对。该miRNA的底物有很多,超过1000个。它是一个可以抑制癌症的miRNA。在成神经细胞瘤的发育过程中,RMRP RNA高表达,当它被抑制时,可以使成神经细胞瘤的增殖,迁移和转移受到抑制。RMRP RNA促进成神经细胞瘤的发育是通过作为miR-206海绵发挥作
Table 1. Substrats of RMRP-S1 and RMRP-S2 involved in different life process and disease [6]
表1. RMRP-S1和RMRP-S2的底物参与不同生命过程和疾病发生 [6]

Figure 3. miRNAs supressed by RMRP RNA and its functions [8] [19] [20] [21] [22]
图3. 被RMRP RNA抑制的miRNA和相应miRNA的功能 [8] [19] [20] [21] [22]
用。Tachykinin-1 receptor (TARC1)是miR-206的一个底物,RMRP RNA的大量表达使TARC1免于受miR-206的抑制。过量表达的TARC1通过激活extracellular signal-regulated kinases1/2 (ERK1/2)信号通路可以恢复因RMRP RNA敲除而造成的神经细胞瘤受损。相反,敲除TARC1或ERK1/2则会使RMRP RNA介导的促成神经细胞瘤增殖受到抑制 [13]。同样在胃癌细胞里面,RMRP RNA高表达,甚至可以作为胃癌的标志物,RMRP RNA通过作为miR-206海绵间接促进miR-206的底物CDK2,从而促进胃癌细胞的增殖 [7]。miR-206除了可以抑制癌细胞的功能以外还可以在成骨分化中发挥作用,在成骨分化过程中miR-206表达降低,过表达的miR-206会抑制成骨分化。Connexin 43 (Cx43)是miR-206的一个底物,当miR-206过表达时,同时使Cx43也大量表达,同样会促进成骨分化,这说明miR-206通过抑制Cx43抑制成骨分化 [19]。RMRP RNA本身也可以促进成骨分化,这不禁使人联想RMRP RNA促进成骨分化是否也是通过作为miR-206海绵实现的。
miR-675-5p在许多人类癌细胞里面都被异常调控,它在乳头状甲状腺癌(PTC)组织和细胞里的表达和相应正常细胞相比降低。在乳头状甲状腺癌里面异常高表达的miR-675能抑制该癌细胞的增殖、迁移,在体内会抑制这种癌组织的生长。和在其它癌细胞里面一样,RMRP RNA可以促进乳头状甲状腺癌的增殖、转移和迁移,其机制是作为miR-675的海绵,抑制miR-675,通过miR-675间接调控miR-675的一个底物Mitogen-activated protein kinase 1 (MAPK1),从而促进乳头状甲状腺癌的增殖、转移和迁移 [8]。
RMRP RNA除了促进癌细胞的发育外,也通过作为miRNA sponge参与许多其它疾病的发生或者参与其它功能。比如在心肌纤维化过程中RMRP RNA表达上升,被抑制的RMRP RNA能抑制心肌成纤维细胞增殖、分化和胶原蛋白的积累。miR-613介导RMRP RNA对心肌纤维化激活的促进作用。RMRP RNA通过作为miR-613的竞争性内源性RNA促进心肌成纤维细胞的活化 [20]。在脂质体诱导心肌功能紊乱时,RMRP RNA能够防止线粒体功能障碍和心肌细胞凋亡,其机制是通过抑制miR-1-5p对热休克蛋白HSP70 protein 4 (HSPA4)转录后的调控功能实现的。在脂质体诱导的心肌功能紊乱时,使HSPA4大量表达可以让心肌功能紊乱得到一定恢复 [21]。在低氧诱导损伤时,RMRP RNA大量表达。RMRP RNA被敲除可以显著减轻缺氧诱导的细胞损伤,增强细胞活力、迁移和侵袭能力,减少细胞凋亡和LDH的释放。而RMRP的过表达加重了缺氧诱导的损伤。RMRP RNA作为miR-214-5p的内源性海绵,其表达受RMRP RNA负调控。过表达miR-214-5p可进一步增强RMRP敲低对缺氧损伤的影响,而沉默miR-214-5p则可显著减弱RMRP敲低对缺氧损伤的影响。而p53被证实为miR-214-5p的直接靶点 [22]。
总之,RMRP RNA作为miRNA sponge,负调控能与之高亲和性结合的miRNA,仅仅是通过这一个功能便能广泛的参与各种生理过程。包括不同癌细胞的增殖、迁移和转移,心肌纤维化和缺氧诱导的损伤。这些都进一步证明了LncRNA RMRP RNA对于各种生理疾病和正常生理生化过程的重要性。
2.4. DDX5介导RMRP RNA与RORγ相互作用特异性调控基因表达
helper 17 (Th17)细胞是CD4+淋巴细胞,帮助保护粘膜上皮屏障免受细菌和真菌感染,对多种自身免疫性疾病中也非常重要。Th17细胞分化成熟过程由转录因子RORγ决定,RORγ是一种甾醇配体调节的核受体,它将细胞因子调控的转录网络的活性集中在关键基因组目标位点的上,包括编码标志Th17的细胞因子的基因(IL-17A,IL-17F、IL-22),也包括IL-23R、IL-1R1、CCR6。像其他核受体,RORγ和它的亚基相互作用,然后招募辅助转录因子于需要调控的靶基因位点(图4)。这里的其它亚基就包括DDX5和RMRP RNA。前面提到RMRP RNA本身能和蛋白亚基Rpp20、Rpp40和Rpp38等蛋白亚基结合,作为结构组成部分形成内切核酸酶RNase MRP,在这里也一样,在RNA解旋酶DDX5的介导下RMRP RNA和RORγ结合,作为DDX5和RORγ形成的复合物的结构组成部分,促进该复合物形成和调控其功能,从而调控基因转录。RORγ在不和DDX5和RMRP RNA相互作用下也拥有调控基因表达的功能,RORγ和DDX4和RMRP RNA结合后会改变其能识别的靶基因位点,在Th17细胞里特异性调控能促进该细胞发育的基因表达 [9]。
RMRP RNA突变的确可以造成免疫相关的疾病,包括t细胞免疫受损和其它的自身免疫相关疾病。前面已经讨论过RMRP RNA通过RNase MRP的一个底物Viperin可能与免疫相关,这里RMRP RNA又通过和DDX5和RORγ形成复合物,促进免疫相关基因表达使Th17细胞正常发育。其中有一个RMRP RNA对应于CHH的突变位点,可以使该LncRNA不能正常促进DDX5和RORγ的相互作用,进一步减少相关基因表达,最后使Th17细胞发育受损。这个功能是RMRP RNA已经证明了与人体免疫正相关。
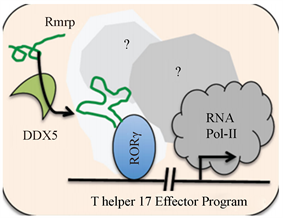
Figure 4. The model of RMRP RNA interacting with DDX5 and RORγ [9]
图4. RMRP RNA和DDX5,RORγ的作用模式 [9]
2.5. 来源于RMRP RNA的siRNA
siRNAs和miRNAs在结构和功能上有许多相似之处,但这两者在生物体内产生途径却不一样。在miRNA前体中,miRNA特有的茎环碱基对从基因组DNA转录而来。Drosha和Dicer酶依次对茎环结构进行处理,最终生成成熟的miRNA单链。相反,双链siRNA前体的模板序列并不存在于基因组DNA中。双链siRNAs由依赖RNA的RNA聚合酶(RdRP)合成,它产生与单链模板RNA互补的RNA链。然后,双链RdRP产物以依赖Dicer酶切途径或不依赖Dicer酶切途径的方式加工成成熟的siRNA。通常多种多样的RdRP在植物和线虫里面都存在,在哺乳动物里面尚未找到相似的RdRP。这里人源的端粒酶逆转录酶TERT充当了一个RdRP的角色,和RMRP RNA结合对其进行逆转录合成一段siRNA前体。最终成熟的siRNA双链产物又可以反过来作用于RMRP RNA本身,形成一个负调控网络(图5)。该siRNA位于RMRP RNA的22到43位碱基。目前已知的能够促进RMRP RNA表达的有BMP-2、YAP和β-catenin,这个负调控通路丰富了RMRP RNA的调控方式 [10]。
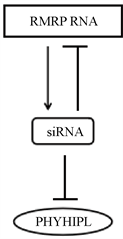
Figure 5. The function of siRNA derived from RMRP RNA [10] [23]
图5. 来源于RMRP RNA的siRNA的功能 [10] [23]
来源于RMRP RNA的siRNA除了能负调控RMRP RNA以外,还可以通过脱靶效应负调控phytanoyl-CoA hydroxylase-interacting protein-like gene (PHYHIPL) (图5)。在PHYHIPL mRNA的3’UTR区域存在这三处和该siRNA的种子区完全结合的碱基。当这三处被克隆到荧光报告基因的3’UTR区,单个位点突变或者抑制这个siRNA都可以使荧光增加,这意味着这是一个类似于miRNA作用机制的siRNA。这也是首次证实了RdRP活性产生的内源性siRNA的脱靶效应。这增加了RMRP RNA调控信号通路参与生命过程的手段 [23]。
3. 结语
RMRP RNA的五种功能中有4种是从mRNA或者说RNA水平直接或者间接调控基因。包括和其它蛋白亚基形成RNA内切酶、产生miRNA和siRNA,以及作为miRNA sponge负调控miRNA。剩下的1种则是通过和转录因子RORγ和DDX5结合从转录水平上调控基因表达。RMRP RNA在所有的组织或细胞都有表达,通过这5种不同的功能,它可以调控至少上千的基因。和它的多功能相对的是它广泛参与各种生命过程,包括成骨发育,免疫系统发育,心肌细胞成熟等。还参与各种疾病发生,包括CHH、癌细胞的增殖、迁移和转移,心肌细胞的纤维化和免疫缺陷等疾病。即使知道RMRP RNA有如此多的功能以及他在生命过程和疾病发生中的重要作用,RMRP RNA与之相关的具体分子机制却很少被证明。目前已知RMRP RNA通过部分通过负调控miR-206、miR-675和miR-613等参与癌症发生、心肌纤维化等疾病;通过RORγ和DDX5结合调控相关基因表达促进Th17细胞发育。对于其它疾病如CHH及其伴随的贫血和支气管受损和许多不同癌症发生都缺乏相应的分子机制进行解释。现如今发现新的LncRNA的速度远远高于其功能被鉴定的速度。因此仍然需要大量的基础研究,才能更好的揭示RMRP RNA的多功能性广泛参与生命过程和各种疾病发生的复杂的分子机制。
文章引用
付洪,赵浩宇,郭泰林. 长链非编码RNA RMRP RNA功能的多样性
Multifunction of LncRNA RMRP RNA[J]. 生物物理学, 2020, 08(02): 19-27. https://doi.org/10.12677/BIPHY.2020.82002
参考文献
- 1. Quinn, J.J. and Chang, H.Y. (2016) Unique Features of Long Non-Coding RNA Biogenesis and Function. Nature Re-views Genetics, 17, 47-62. https://doi.org/10.1038/nrg.2015.10
- 2. Wang, K.C. and Chang, H.Y. (2011) Molecu-lar Mechanisms of Long Noncoding RNAs. Molecular Cell, 43, 904-914. https://doi.org/10.1016/j.molcel.2011.08.018
- 3. Gill, T., et al. (2004) RNase MRP Cleaves the CLB2 mRNA to Promote Cell Cycle Progression: Novel Method of mRNA Degradation. Molecular and Cellular Biology, 24, 945-953. https://doi.org/10.1128/MCB.24.3.945-953.2004
- 4. Mattijssen, S., et al. (2011) Viperin mRNA Is a Novel Tar-get for the Human RNase MRP/RNase P Endoribonuclease. Cellular and Molecular Life Sciences, 68, 2469-2480. https://doi.org/10.1007/s00018-010-0568-3
- 5. Goldfarb, K.C. and Cech, T.R. (2017) Targeted CRISPR Disrup-tion Reveals a Role for RNase MRP RNA in Human Preribosomal RNA Processing. Genes & Development, 31, 59-71. https://doi.org/10.1101/gad.286963.116
- 6. Rogler, L.E., et al. (2014) Small RNAs Derived from lncRNA RNase MRP Have Gene-Silencing Activity Relevant to Human Cartilage-Hair Hypoplasia. Human Molecular Genetics, 23, 368-382. https://doi.org/10.1093/hmg/ddt427
- 7. Shao, Y.F., Li, Q.E., Sun, W.L., Ye, G.L., Zhang, X.J., Yang, Y.B., et al. (2016) LncRNA-RMRP Promotes Carcinogenesis by Acting as a miR-206 Sponge and Is Used as a Novel Biomarker for Gastric Cancer. Oncotarget, 7, 37812-37824. https://doi.org/10.18632/oncotarget.9336
- 8. Wang, J., Xiao, T. and Zhao, M. (2019) MicroRNA-675 Directly Targets MAPK1 to Suppress the Oncogenicity of Papillary Thyroid Cancer and Is Sponged by Long Non-Coding RNA RMRP. OncoTargets and Therapy, 12, 7307-7321. https://doi.org/10.2147/OTT.S213371
- 9. Huang, W., et al. (2015) DDX5 and Its Associated lncRNA Rmrp Modulate TH17 Cell Effector Functions. Nature, 528, 517-522. https://doi.org/10.1038/nature16193
- 10. Maida, Y., et al. (2009) An RNA-Dependent RNA Polymerase Formed by TERT and the RMRP RNA. Nature, 461, 230-235. https://doi.org/10.1038/nature08283
- 11. Hermanns, P., et al. (2005) Consequences of Mutations in the Non-Coding RMRP RNA in Cartilage-Hair Hypoplasia. Human Molecular Genetics, 14, 3723-3740. https://doi.org/10.1093/hmg/ddi403
- 12. Hermanns, P., et al. (2006) RMRP Mutations in Cartilage-Hair Hypo-plasia. American Journal of Medical Genetics Part A, 140, 2121-2130. https://doi.org/10.1002/ajmg.a.31331
- 13. Feng, W., et al. (2017) Up-Regulation of the Long Non-Coding RNA RMRP Contributes to Glioma Progression and Promotes Glioma Cell Proliferation and Invasion. Archives of Medical Science, 13, 1315-1321. https://doi.org/10.5114/aoms.2017.66747
- 14. Viji Mythily Draviam, S.O., Lowe, M., Pardi, R. and Pines, J. (2001) The Localization of Human Cyclins B1 and B2 Determines CDK1 Substrate Specificity and Neither Enzyme Re-quires MEK to Disassemble the Golgi Apparatus. The Journal of Cell Biology, 152, 945-958. https://doi.org/10.1083/jcb.152.5.945
- 15. Teng, T.S., et al. (2012) Viperin Restricts Chikungunya Virus Replica-tion and Pathology. Journal of Clinical Investigation, 122, 4447-4460. https://doi.org/10.1172/JCI63120
- 16. Karwan, R. (1993) RNase MRP/RNase P: A Structure-Function Relation Conserved in Evolution. FEBS Letters, 319, 1-4. https://doi.org/10.1016/0014-5793(93)80025-P
- 17. Steinbusch, M.M.F., et al. (2017) Expression of RMRP RNA Is Regulated in Chondrocyte Hypertrophy and Determines Chondro-genic Differentiation. Scientific Reports, 7, Article No. 6440. https://doi.org/10.1038/s41598-017-06809-5
- 18. Huang, Y., et al. (2015) Long Noncoding RNA H19 Promotes Osteoblast Differentiation via TGF-beta1/Smad3/HDAC Signaling Pathway by Deriving miR-675. Stem Cells, 33, 3481-3492. https://doi.org/10.1002/stem.2225
- 19. Inose, H., et al. (2009) A microRNA Regulatory Mechanism of Osteoblast Differentiation. Proceedings of the National Academy of Sciences of the United States of America, 106, 20794-20799. https://doi.org/10.1073/pnas.0909311106
- 20. Zhang, S.Y., et al. (2019) Upregulation of lncRNA RMRP Promotes the Activation of Cardiac Fibroblasts by Regulating miR613. Molecular Medicine Reports, 20, 3849-3857. https://doi.org/10.3892/mmr.2019.10634
- 21. Han, Y., et al. (2020) lncRNA RMRP Prevents Mito-chondrial Dysfunction and Cardiomyocyte Apoptosis via the miR-1-5p/hsp70 Axis in LPS-Induced Sepsis Mice. In-flammation, 43, 605-618. https://doi.org/10.1007/s10753-019-01141-8
- 22. Teng, Y., et al. (2020) LncRNA RMRP Accelerates Hypox-ia-Induced Injury by Targeting miR-214-5p in H9c2 Cells. Journal of Pharmacological Sciences, 142, 69-78. https://doi.org/10.1016/j.jphs.2019.07.014
- 23. Maida, Y., et al. (2013) Off-Target Effect of Endogenous siRNA Derived from RMRP in Human Cells. International Journal of Molecular Sciences, 14, 9305-9318. https://doi.org/10.3390/ijms14059305
NOTES
*通讯作者。
