Biophysics
Vol.
09
No.
04
(
2021
), Article ID:
45728
,
7
pages
10.12677/BIPHY.2021.94008
富含脂肪酶菌种的筛选与鉴定
李乔惠1,王冰鹤2,李成龙3,杨森4,王悦琦4,周欢5,李海玲4,高秀峰4*
1南京农业大学信息管理学院,江苏 南京
2沈阳科技学院,辽宁 沈阳
3南京农业大学工学院,江苏 南京
4四川大学华西基础医学与法医学院,四川 成都
5四川大学华西临床医学院,四川 成都
收稿日期:2021年9月6日;录用日期:2021年10月8日;发布日期:2021年10月14日

摘要
脂肪酶是生物柴油生产的关键酶,为了降低生物柴油的研发成本,本研究从餐厅油脂污染处和自然环境中筛选得到了含脂肪酶菌;然后对其进行了紫外以及高温诱变。对诱变后的脂肪分解菌利用罗丹明B固体培养基对其活性进行了鉴定;利用p-NP法测定了活性;筛选得到了相对活性最高的脂肪分解菌,最后,通过16 s测序鉴定了富含脂肪酶菌的菌种或菌属,为进一步生物柴油的开发提供了实验基础。
关键词
脂肪分解菌,脂肪酶,诱变,菌株筛选,p-NP法

Screening and Identification of Lipase-Rich Strains
Qiaohui Li1, Binghe Wang2, Chenglong Li3, Sen Yang4, Yueqi Wang4, Huan Zhou5, Hailing Li4, Xiufeng Gao4*
1College of Information Management, Nanjing Agricultural University, Nanjing Jiangsu
2Shenyang Institute of Science and Technology, Shenyang Liaoning
3College of Engineering, Nanjing Agricultural University, Nanjing Jiangsu
4West China School of Basic Medical Sciences & Forensic Medicine, Sichuan University, Chengdu Sichuan
5West China School of Medicine, Sichuan University, Chengdu Sichuan
Received: Sep. 6th, 2021; accepted: Oct. 8th, 2021; published: Oct. 14th, 2021

ABSTRACT
Lipase is the key enzyme in biodiesel production. In order to reduce the development cost of biodiesel, lipase-rich strains were screened from the restaurant grease contamination and natural environment, and then the lipase-rich strains were mutagenized by UV and high temperature. The activity of the mutated lipolytic bacteria was identified by using Rhodamine B solid medium, and determined by P-NP method. Finally, the species or genus of lipase-rich strains were identified by 16 S sequencing, which provided an experimental basis for the further development of biodiesel.
Keywords:Lipolytic Bacteria, Lipase, Induced Mutation, Strain Screening, p-NP Method

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
柴油作为能源物质,在各行各业具有广泛的需求。随着石油不断的开采,自然资源逐渐消耗,为了扩大柴油的来源,利用秸秆、地沟油等生物质作为生物柴油的原料已得到广泛的关注,这些原料来源广、制作工艺简单,污染小、成本低,并且可实现废物的重新利用。而生物柴油的制备需要将这些不同的原料通过生物或生物酶降解,生成醇类和脂肪酸,最后在脂肪酶的作用下发生酯化反应生成脂肪酸甲酯或脂肪酸乙酯(即生物柴油) [1] [2]。在脂肪的降解生成脂肪酸以及最后的脂肪酸与醇类发生酯化反应中,脂肪酶起到关键的作用 [3] [4]。目前常用的脂肪酶主要依赖国外进口,为降低生物柴油的研发成本,富含脂肪酶菌的研究成为研究热点 [5] [6] [7] [8]。本研究拟从环境中筛选富含脂肪酶的细菌,为生物柴油的研发提供关键原料。
2. 材料与方法
2.1. 材料
甘油三酯,K2HPO4,KH2PO4,酵母膏,蛋白胨,葡萄糖,罗丹明B均购至本泽试剂公司,对硝基苯酚(p-nitrophenol, p-NP)和4-硝基苯基棕榈酸酯(4-nitrophenyl palmitate, p-NPP)购自百灵威科技有限公司,均为分析纯级。
2.2. 仪器
UV-1800PC紫外可见分光亮度计为上海美谱达仪器有限公司产品;SZX-3水浴振荡器,YX-280B型高压蒸汽灭菌器为江阴滨江医疗设备厂生产;J2-21高速冷冻离心机为美国贝克曼(Beckman)公司产品。
2.3. 方法
2.3.1. 溶液配制
1) 样品菌富集培养基制备:取酵母膏0.5 g,蛋白胨1 g,葡萄糖2 g,蒸馏水100 mL,混匀,分装4个三角烧杯内,高压灭菌备用。
2) 液体选择培养基制备:取K2HPO4 0.15 g;KH2PO4 0.05 g;MgSO4 0.05 g;1 g/L FeSO4 0.1 mL;甘油三酯1.5 g,蒸馏水100 mL,加热混匀,分装2个三角烧杯内,每个20 mL,高压灭菌。固体选择培养基是在液体培养基中加入1.5 g/100mL琼脂粉。
3) 脂肪分解菌富集培养基:酵母膏0.2 g/L,氯化钠0.5 g/L,磷酸氢二钠3.5 g/L,磷酸二氢钾1.5 g/L,七水硫酸镁0.5 g/L,橄榄油10 mL,用蒸馏水定容至1000 mL,121℃灭菌20 min。
4) 脂肪分解菌发酵培养基:葡萄糖5.0 g/L,蛋白胨2 g/L,尿素6.0 g/L,三水磷酸氢二钾1.0 g/L,硫酸铵1 g/L,七水硫酸镁0.5 g/L,三丁酸甘油酯10.0 mL,用蒸馏水定容至1000 mL,115℃灭菌15 min。
2.3.2. 样品采集
在餐厅油脂污染处取样约10 g,加入0.9%生理盐水40 mL,25℃,悬浮5 h。在富集培养基中接种液体样品1 mL,37℃,220 r/min,震荡培养直到浑浊。取0.1 mL富集后的菌液,接种到脂肪分解菌选择培养基中初筛,37℃,220 r/min,震荡培养直至浑浊。取液体选择培养基菌液10 mL接种到固体选择培养基中。37℃,培养直到出现透明圈。在无菌条件下,挑取固体选择培养基的菌落,接种到液体选择培养基中进行复筛,37℃,220 r/min,震荡培养直到浑浊,该菌为0号菌。
2.3.3. 诱变菌株
1) 诱变:取0号菌1 mL加入1 mL液体选择培养基,放入培养皿中,暴露在20 W紫外灯下,每隔10 min取样接种于固体培养基中,共取6次,避光37℃,培养直到出现菌落。
2) 高温诱变培养:将固体培养基先置于37℃培养两天,再在80℃环境下培养1 h,培养直到出现明显单菌落。
3) 诱变菌扩大培养:挑取固体培养基中60 min和50 min范围内紫外高温诱变的单菌落,分别接种于10管液体富集培养基中,1管为空白对照组(未接菌),于37℃,220 r/min,震荡培养直到浑浊。
4) 诱变菌固体培养基筛选
第3、6、9、10管中出现浑浊,于是将这四管的菌分别接种到固体培养基上,诱变前的0号菌作为空白。发现3号菌无菌落产生,6、9、10号有菌落生成,可用于后续研究。
2.3.4. 自然菌选择
实验室内发现空白选择培养基上有菌落形成,周围有透明圈,具有分解脂肪能力,故将其命为11号菌。
2.3.5. 菌种鉴定
将0,6,9,10和11号菌送测序公司16 s测序,进行菌种鉴定。
2.3.6. 细菌生长曲线绘制
1) 诱变菌活化:取0、6、9、10、11号固体培养基中产生透明圈最大的菌落作为最终筛选得到的菌种,分别将其接种到富集培养基进行培养活化。
2) 富含脂肪酶菌生长曲线绘制:配制200 mL选择培养基5瓶,分别接种0、6、9、10、11号菌各0.5 mL。每隔一定时间取各菌液3 mL,在600 nm处测定菌液的吸光度,绘制备选菌生长曲线。
2.3.7. 固体培养基的脂肪酶活性鉴定
按照参考文献 [3] 的方法在选择培养基中加入0.5 g/L罗丹明B,制作固体选择培养基。分别将5种菌接种,37℃培养。5种菌均有透明圈产生。说明备选菌均有脂肪酶产出。
2.3.8. 酶活力测定
按照参考文献 [9] 的方法脂肪酶活性测定。将p-NP溶于Tris-HCl缓冲溶液(0.05 mol/L、pH 8.0),配成1 mg/mL的标准贮液。稀释成10 mg/mL的标准工作液。按照表1配制p-NP标准液,绘制标准曲线。
Table 1. Preparation method of p-NP standard solution
表1. p-NP标准溶液配制方法
将0.05 mol/L Tris-HCl缓冲液(pH 8.0) 2.1 mL、200 mL p-NP (7.5 mmol/L,溶剂为甲醇)和100 mL酶样加入EP管中。40℃水浴中反应10 min后置于冰水浴中,加入100 mL乙醇终止反应。405 nm测定吸光度。对照对硝基苯酚标准曲线计算浓度,按公式(1)计算酶活性:
(1)
式中:X,脂肪酶活性,U·mL−1;c,对硝基苯酚浓度,mmol·mL−1;V,反应液总体积,mL; ,酶液的用量,mL;t,作用时间,min。
3. 实验结果与讨论
3.1. 细菌诱变
取0号菌暴露在20 W紫外灯下,每隔10 min取样接种于固体培养基中,共取6次,培养40 h长出菌落,结果见图1。
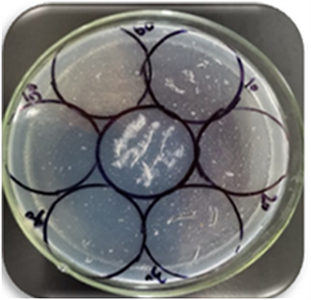
Figure 1. Induced mutation results
图1. 诱变结果
3.2. 诱变菌固体培养基筛选结果
取诱变50~60 min后的菌落分别在10管液体富集培养基经培养后3、6、9、10管中出现浑浊,将这四管的菌和诱变前的0号菌液接种到固体培养基上,结果如图2所示。3号菌无菌落产生,0、6、9、10号有菌落生成。
3.3. 菌种测序鉴定结果
0,6,9,10和11号菌16 s测序结果均为Burkholderia contaminans (或同属)。
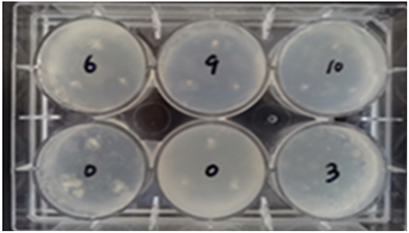
Figure 2. Screening results of mutagenic bacteria soli medium
图2. 诱变菌固定培养基筛选结果
3.4. 富含脂肪酶菌生长曲线绘制
各菌的菌生长曲线见图3。各菌的0~50 h为延滞期,50~70 h为指数生长期,70 h后为延滞期和衰退期。0号菌和11号菌生长速率最快,但速度下降较快,可能是由于营养不足导致,进一步通过活性考察确定哪一个菌更好。
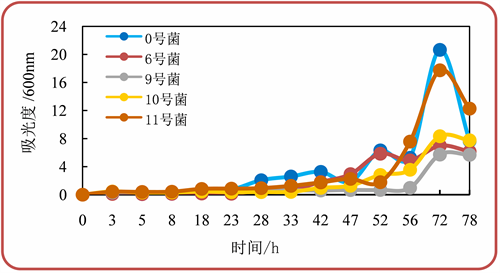
Figure 3. Growth curve of various screening bacteria
图3. 各种筛选菌的生长曲线
3.5. 固体培养基的脂肪酶活性鉴定结果
分别将各菌接种于0.5 g/L罗丹明B固体选择培养基,37℃培养,结果如图4所示。5种菌均有荧光圈产生,具有脂肪酶产生。6号菌和10号菌酶活性较好。

Figure 4. Indentification results of lipase activity in rhodamine B medium
图4. 罗丹明B培养基上的脂肪酶活性鉴定结果
3.6. 酶活性测定结果
1) p-NP标准曲线制作:
p-NP标准曲线见图5。y = 0.0818x − 0.0261,r2 = 0.9893。通过此直线方程可进一步测定酶活性。
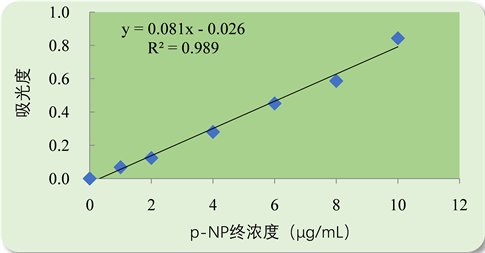
Figure 5. Calibration curve of p-NP
图5. p-NP标准曲线
2) 各筛选菌酶活性测定结果:
各菌的吸光度及p-NP浓度和脂肪酶活性结果如表2所示。
Table 2. Lipase activity of screening bacterias (n = 3)
表2. 筛选菌的脂肪酶活性(n = 3)
根据表2测定的结果得到的酶活性见图6。结果显示10号菌脂肪酶活性最高。
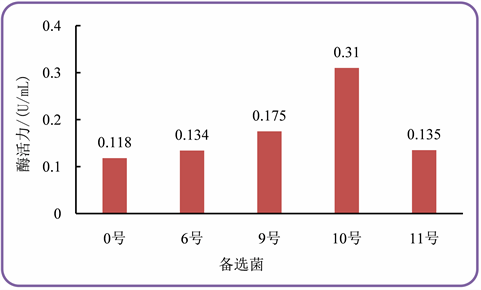
Figure 6. Lipasen activity of screening bacteria
图6. 筛选菌的脂肪酶活性
4. 结论
结合上述产酶菌生长曲线和酶活性测定结果可得出,10号菌的酶活力和生长速率在三种诱变菌中最高。选取10号作为目的菌用于后续研究。
致谢
感谢四川大学华西基础医学与法医学院的生物化学与分子生物研究室,在新冠疫情期间为我提供了良好的研究条件,并且在国家大学生创新研究中给予了耐心的指导。
文章引用
李乔惠,王冰鹤,李成龙,杨 森,王悦琦,周欢,李海玲,高秀峰. 富含脂肪酶菌种的筛选与鉴定
Screening and Identification of Lipase-Rich Strains[J]. 生物物理学, 2021, 09(04): 65-71. https://doi.org/10.12677/BIPHY.2021.94008
参考文献
- 1. 贺秋红, 巩志金, 颜梅. 产脂肪酶菌株的筛选、鉴定及发酵培养基优化[J]. 中国酿造, 2019, 38(10): 84-88.
- 2. 万洁, 李维, 杜镇. 脂肪酶产生菌的筛选及其脱墨的初步研究[J]. 四川师范大学学报(自然科学版), 2005, 28(6): 733-736.
- 3. 刘延波, 邢星月, 赵志军, 刘宁, 潘春梅, 孙西玉. 高产脂肪酶菌株的筛选鉴定及产酶条件优化[J]. 中国酿造, 2019, 38(17): 54-59.
- 4. 陈贵元, 刘林波, 桑鹏, 杨力权. 高温酸性脂肪酶产生菌Acinetobacter sp. Lip-55的筛选、鉴定及其酶学性质研究[J]. 食品与发酵工业, 2019, 24(45): 52-57.
- 5. 谢清, 王瑶, 陈尚武, 李平兰. 高产脂肪酶菌株的筛选鉴定[J]. 中国农业大学学报, 2018, 23(5): 86-92.
- 6. 张传丽, 孙会刚, 崔珏, 陈学红, 高兆建, 唐兆成, 李同祥. 高产脂肪酶菌株的筛选及其酶学性质分析[J]. 食品科技, 2019, 44(11): 29-35.
- 7. 王兴吉, 贾仁洁, 王克芬, 刘文龙. 低温脂肪酶菌株的诱变筛选及酶学特性研究[J]. 安徽农业科学, 2019, 47(1): 1-3.
- 8. 黄阳天, 陆育彪, 黄益帖, 孟繁龙, 徐凯文, 李鹏. 产电海洋脂肪酶生产菌的分离筛选鉴定及培养条件研究[J]. 生物技术通报, 2020, 36(12): 91-97.
- 9. 王欢, 何腊平, 周换景, 张义明, 李翠芹, 陶菡. 脂肪酶活力测定方法及其在筛选产脂肪酶微生物中的应用[J]. 生物技术通报, 2013(1): 203-208. https://doi.org/10.13560/j.cnki.biotech.bull.1985.2013.01.025
NOTES
*通讯作者。
