Advances in Marine Sciences
Vol.
06
No.
03
(
2019
), Article ID:
31896
,
7
pages
10.12677/AMS.2019.63011
Isolation and Identification of Rhizosphere Fungi from Aegiceras corniculatum
Shilin Wang*, Yuelian Liu#, Haipeng Zhang
Agricultural College of Guangdong Ocean University, Zhanjiang Guangdong

Received: Aug. 7th, 2019; accepted: Aug. 20th, 2019; published: Aug. 27th, 2019

ABSTRACT
In this study, the fungi in rhizosphere mud of Aegiceras corniculatum were isolated and identified in order to understand the fungi composition and structure. The samples were sampled in spring, summer and winter respectively. The samples were isolated, counted and purified by plate method. The taxonomic status of the purified strains was identified at the generic level by the morphological characteristics. The results showed that 54 strains of fungi were isolated from the samples of three periods which belonging to 5 genera: Aspergillus, Acremonium, Penicillium, Engyodontium and Cladosporium respectively. Statistical results showed that the number of fungi isolated from rhizosphere mud of A. corniculatum was the highest in spring with 22 strains, 20 in summer and 12 in winter. The first dominant genus of fungi in the rhizosphere mud of A. corniculatum is Aspergillus, with isolation frequency accounting for 53.7% of the total isolation strains; the second dominant genus is Cladosporium and Penicillium, with isolation frequency of 16.7%; the third dominant genus is Acremonium, with isolation frequency of 14.8%; and the fourth dominant genus is Cladosporium with isolation frequency of 5.6%. Understanding the population structure of marine mud fungi in the rhizosphere of A. corniculatum in different periods is of great significance for the protection of A. corniculatum.
Keywords:Marine Fungi, Aegiceras corniculatum, Identification
桐花树根际真菌的分离和鉴定
王诗霖*,刘月廉#,张海鹏
广东海洋大学农学院,广东 湛江

收稿日期:2019年8月7日;录用日期:2019年8月20日;发布日期:2019年8月27日

摘 要
本研究对桐花树根际海泥的真菌进行分离和鉴定,以期了解该区系的真菌组成结构。通过春季、夏季和冬季不同时期的采样,采用了涂布平皿法,对样品进行分离计数及纯化,并通过对纯化菌株的形态学特征来鉴定其在属水平上的分类学地位。研究结果表明,3个时期的样品分离共获得54株真菌菌株,分属于5个属。分别为曲霉属Aspergillus、枝顶孢霉属Acremonium、青霉属Penicillium、侧齿霉属Engyodontium和枝孢霉属Cladosporium。统计结果显示,桐花树根际海泥的真菌以春季样品分离的菌株数最多,有22株,其次是夏季有20株,最少的是冬季只有12株。桐花树根际海泥的真菌第一优势属为曲霉属,分离频率占总分离菌株数的53.7%;第二优势属为枝顶孢霉属和青霉属,分离频率均为16.7%;第三优势属为侧齿霉属,分离频率为14.8%,第四优势属为枝孢霉属,分离频率为5.6%。了解桐花树根际海泥真菌的种群结构,掌握其不同时期的变化规律,对桐花树的保护有重要意义。
关键词 :海洋真菌,桐花树,鉴定

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
红树林生态系统是一个具有巨大潜在力的生物资源库,是世界上典型的海陆两栖生态系统,具有净化水质、防风消浪、固岸护堤、促淤保滩、丰富物种多样性等生态价值,具有极大的生态意义、药用价值和经济价值 [1]。桐花树(Aegiceras Corniculatum (L.) Blanco)为紫金牛科蜡烛果属真红树植物,是一种灌木或乔木,广泛分布于海南、福建、广东、广西、浙江、香港、澳门等地,生态作用最重要的关键物种,在近海生态安全与可持续发展方面起着重要的保障作用 [2]。桐花树因其特殊的生长环境,其化学成分和生理活性方面都具有很多特殊性。有研究显示,桐花树叶片中含有17种氨基酸,其中7种为人体必需氨基酸,还含有15种微量元素、8种挥发油化合物、10种脂肪酸,使其具有较多的药理活性 [3]。桐花树湿地系统主要通过物理作用、化学作用及生物作用对各种污染物加以吸收、积累而起到净化作用,尤其对降低重金属污染有非常重要的意义。从红树林植物桐花树等6种植物中分离到35株具有抗细菌活性的内生真菌,这无疑对桐花树林病害防治具有重要理论与现实意义 [4]。
近年来,由于人类对红树林资源的认识不足,把大量的红树林资源改造利用,使得红树林生态系统的平衡受到一定程度的破坏,红树林的病害和虫害也日益严重,已成为威胁红树林生存的主要因素之一 [5]。在红树林植物群落中,有着丰富而独特的真菌资源,它们参与有机物质的分解和无机营养物的再生,能降解海洋环境中的污染物和促进海洋自净,在海洋生态系统中起着重要作用。由于生态系统的改变,红树林真菌的生态功能也发生了变化,一些非致病性真菌对红树发生了侵染性,导致了病害的发生 [6]。因此,很有必要对红树区系的真菌组成结构进行研究,为桐花树真菌性病害的发生及早做出判断。
2. 材料和方法
2.1. 采样
采样地为广东省湛江市高桥红树林保护区(109˚45'23.64E, 21˚34'09.91N)。分别设置春(3月份)、夏(7月)、冬(11月) 3次采样,用铲子采集根际(根部0~1 cm范围内)土壤样品,装入密封采样袋中,带回实验室,置于4℃的冰箱内保藏待用。
2.2. 真菌分离
2.2.1. 培养基
孟加拉红培养基(Rose Bengal Agar):蛋白胨5 g,葡萄糖10 g,磷酸二氢钾1 g,硫酸镁(MgSO4∙7H2O) 0.5 g,琼脂20 g,1/3000孟加拉红溶液100 mL,蒸馏水1000 mL,氯霉素0.1 g。
制作过程:上述各成分加入蒸馏水中溶解后,再加孟加拉红溶液。加入培养基中,分装后,121℃灭菌20 min。倾注平板前,另用少量乙醇溶解氯霉素加入培养基中。
PDA培养基:琼脂20 g、葡萄糖20 g、马铃薯200 g、蒸馏水1000 mL。
制作过程:将马铃薯去皮,然后称取200 g切成小块,放入锅中,加海水1000 mL,加热煮沸,持续20 min,煮至马铃薯熟而不烂。趁热用两层纱布在量杯上过滤,取滤液,补充海水至1000 mL。将滤液倒入锅中加热,并加入葡萄糖,一边搅拌一边加琼脂粉,待琼脂粉20 g完全溶解后,将煮好的培养基分装入锥形瓶中,塞上塞子,瓶口用报纸紧紧包住,放入高压蒸汽灭菌锅中灭菌30 min。
2.2.2. 分离
采用稀释涂布法对样品进行分离。称取土壤样品1 g加入到pH为8.46的99 mL土壤样品中,充分混匀后将制成10−2、10−3和10−4土壤稀释液。分别吸取各稀释液100 μL,放入孟加拉红培养基(Rose Bengal Agar)平板中,涂布,盖好,用保鲜膜封口,然后置于28℃恒温培养箱培养5~7天。记录菌落数,并对单菌落用PDA进行分离纯化。
2.3. 菌株的鉴定
将纯化菌株接入PDA培养基中,28℃培养3~5天,肉眼观察菌株菌落特征、用尼康显微DS-Ri2进行产孢结构以及分生孢子等形态特征的观察及拍照,并进行分析。参考《真菌鉴定手册》 [7] 和《半知菌分属图册》 [8] 进行归属鉴定。
3. 结果与分析
3.1. 不同时期分离真菌菌落数
试验结果表明,从桐花树根际土壤样品中3次采样分离纯化共得到了54株真菌,并分别编号。其中以春季分离得到的菌落数最多有22株,其次是夏季有20株,最少的是冬季有12株。土壤样品的稀释度为10−2可以获得较高的菌落数,10−4的基本分不到菌(见表1)。
Table 1. Number and strain number of fungal colonies in rhizosphere soil of A. corniculatum at different periods
表1. 不同时期桐花树根际土壤真菌菌落数及菌株编号
经过分析,分离的54株真菌中,有28株为曲霉属Aspergillus,第一优势菌株,占了此次实验所分离得到的总菌株数的53.7%;18株菌株为枝顶孢霉属Acremonium,是第二优势菌群,占所分离到总菌株数的16.7%;8株菌株为青霉属Penicillium,占所分离得到的总菌株数的14.8%;还有3株菌株为枝孢霉属Cladosporium,占所分离得到的总菌株数的5.6% (见表2)。
表2. 桐花树根际土壤真菌种群结构
3.2. 菌株的形态鉴定
3.2.1. 曲霉属Aspergillus
PDA培养基培养,3~4天长满整个培养基,菌落呈绒状、絮状或者毡状,黑色,菌丝有横隔,分生孢子梗不分枝,其顶端膨大成圆形、椭圆形或者棍棒状。在顶囊表面呈辐射状长满一层小梗,瓶状。瓶状小梗顶端产生成串的球形分生孢子。分生孢子梗生长在足细胞上(见图1)。

Figure 1. Strain A5.2 colony and morphology of aspergillus. (a) Colony; (b) Conidiophore and conidia; (c) Basal part; Bar = 10 μm
图1. 菌株A5.2曲霉的菌落形态以及显微形态。(a) 菌落形态;(b) 分生孢子和分生孢子梗;(c) 足细胞;标尺 = 10 μm
3.2.2. 枝顶孢霉Acremonium
PDA培养基培养,一个星期长满整个培养基,菌落平铺于培养基表面,白色絮状,4天后表面粉末状明显,之后菌丝逐渐平粘于培养基表面。分生孢子梗无色,光滑,基部宽,1~2个隔膜,向顶渐尖,孢子大小为15.7 μm,在菌丝顶端着生一团孢子,在菌丝的分枝处或非枝条顶端没有孢子簇(见图2)。
3.2.3. 青霉属Penicillium
PDA培养基培养,3天长满整个培养皿,菌落呈绒状、絮状、绳状、束状等不同的形态,青绿色,成熟后菌落表面呈粉末状。青霉的菌丝体产生长而直的分生孢子梗,上半部分产生对称或者不对称的扫帚状分枝,着生几轮小梗,小梗顶端着生成串的球形至卵形的绿色分生孢子(见图3)。
3.2.4. 侧齿霉属Engyodontium
PDA培养基培养,15天长满整个培养基,菌落多为洁白色,绒状、棉絮状。成熟后的菌落有些表面带有小滴液珠,孢子为圆形、镰刀形等,孢子梗既有对生、又有轮生,还有是在单边生长,每一小梗都是顶端才着生孢子(见图4)。

Figure 2. Strain A1.4 colony and morphology of acremonium. (a) Colony; (b) Conidiophore and conidia; Bar = 10 μm
图2. 菌株A1.4枝顶孢霉的菌落形态以及显微形态。(a) 菌落形态;(b) 分生孢子和分生孢子梗;标尺= 10 μm

Figure 3. Strain B2.1 colony and morphology of penicillium. (a) Colony; (b) Conidiophore and conidia; Bar = 10 μm
图3. 菌株B2.1青霉的菌落形态以及显微形态。(a) 菌落形态;(b) 分生孢子和分生孢子梗;标尺 = 10 μm
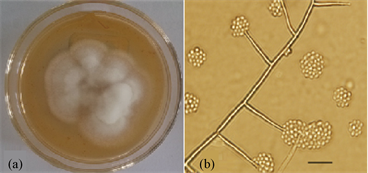
Figure 4. Strain A1.2 colony and morphology of engyodontium. (a) Colony; (b) Conidiophore and conidia; Bar = 10 μm
图4. 菌株A1.2侧齿霉的菌落形态以及显微形态。(a) 菌落形态;(b) 分生孢子和分生孢子梗;标尺 = 10 μm
3.2.5. 枝孢霉属Cladosporium
PDA培养基培养,10天左右长满整个培养基,枝孢霉菌落的颜色呈橄榄绿黑色,培养基由橙色变成黑色,质地较硬,菌落呈绒状、絮状等。分生孢子梗簇生,都是连在一起像一条链那样生长,暗褐色,不进行分枝或者偶分枝,有隔膜,平滑,基部细胞稍稍膨大。分生孢子链生,头球形、卵球形,无隔膜,平滑或具刺,浅褐色(见图5)。

Figure 5. Strain C4.1 colony and morphology of cladosporium. (a) Colony; (b) Conidiophore and conidia; Bar = 10 μm
图5. 菌株C4.1 枝孢霉的菌落形态以及显微形态。(a) 菌落形态;(b) 分生孢子和分生孢子梗;标尺 = 10 μm
4. 结论与讨论
4.1. 结论
研究结果表明,桐花树根际海泥的真菌种类存在多样性,不同时期的样品分离获得的菌株数不一样。分离获得的54株真菌菌株,分属于曲霉属Aspergillus、枝顶孢霉属Acremonium、青霉属Penicillium、侧齿霉属Engyodontium、青霉属Penicillium和枝孢霉属Cladosporium。其中曲霉属为第一优势属。统计结果显示,桐花树根际海泥的真菌以春季样品分离的菌株数最多,其次是夏季,最少的是冬季。
4.2. 讨论
据报道,我国南海海域的丝状真菌有曲霉、青霉、枝顶孢霉、枝孢霉等 [9],本研究结果与之相一致。别外,有报道样品来自广东湛江湾的海水真菌多样性Shannon指数达2.75,物种优势度变化范围为30.90%~0.02%。枝孢属的优势度最高,为湛江湾优势种群,其次是青霉属、侧齿霉属、曲霉属、枝顶孢属等 [10]。这与本研究结果曲霉属为第一优势属不一致,可能是枝孢属更适合在水体生存,而曲霉属对水体底层的海泥有更强的适应性。本研究结果显示,春季分离的菌株数最多,说明海洋微生物与陆地微生物有共同的季节感应性,春季温度回升,生理活性增强,生长繁殖速度加快,因而数量增多明显;冬季温度降低,生理活性减缓,生长繁殖受到抑制,因而数量减少。
据报道,曲霉和青霉为陆地及海洋常见菌,一般营腐生生活,极少引致植物病害;而枝孢霉为陆地植物的常见致病菌 [11],也是红树植物的条件致病菌 [12]。因此,了解桐花树根际海泥真菌的种群结构,掌握其不同时期的变化规律,对桐花树的保护有重要意义。
基金项目
广东省科技厅基金项目,海洋酸化对红树内生真菌多样性及致病性的影响(2016A030313746)及广东海洋大学大学生创新创业训练计划项目(CQ201810566073)。
文章引用
王诗霖,刘月廉,张海鹏. 桐花树根际真菌的分离和鉴定
Isolation and Identification of Rhizosphere Fungi from Aegiceras corniculatum[J]. 海洋科学前沿, 2019, 06(03): 99-105. https://doi.org/10.12677/AMS.2019.63011
参考文献
- 1. Ashournejad, Q., Amiraslani, F., Moghadam, M.K. and Toomanian, A. (2019) Assessing the Changes of Mangrove Ecosystem Services Value in the Pars Special Economic Energy Zone. Ocean and Coastal Management, 179, Article ID: 104838. https://doi.org/10.1016/j.ocecoaman.2019.104838
- 2. 李超, 吴志华, 陈粤超, 尚秀华. 红树林植物桐花树基质育苗效果的初步研究[J]. 桉树科技, 2018, 35(2): 31-36.
- 3. 宋文东, 王浩, 肖文发. 红树植物桐花树叶中氨基酸和微量元素的分析[J]. 食品研究与开发, 2008, 29(7): 106-108.
- 4. 邓祖军, 曹理想, 谭红铭, 等. 红树林内生真菌抗细菌和抗真菌活性的初步研究[J]. 广东药学院学报, 2007, 23(5): 563-567, 571.
- 5. 于凌云, 林绅辉, 焦学尧, 沈小雪, 李瑞利. 粤港澳大湾区红树林湿地面临的生态问题与保护对策[J]. 北京大学学报(自然科学版), 2019(4): 1-9.
- 6. 刘月廉. 海水酸化对桐花树内生真菌多样性的影响[C]//中国菌物学会. 中国菌物学会2016年学术年会论文摘要集. 福州: 福建农林大学出版社, 2016: 1.
- 7. 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 1-493.
- 8. 喻璋, 张猛. 半知菌分属图册[M]. 北京: 科学出版社, 2009: 1-222.
- 9. Zhang, X.-Y. and Zhang, Y. (2013) Diverse Deep-Sea Fungi from the South China Sea and Their Antimi-crobial Activity. Current Microbiology, 67, 525-530. https://doi.org/10.1007/s00284-013-0394-6
- 10. 刘月廉, 张瑜斌, 胡汉桥, 王季槐. 广东湛江湾可培养丝状真菌分布状况的初步调查[J]. 菌物学报, 2013, 32(4): 633-642.
- 11. 刘晓妹, 杨永利, 杨石有, 张贺, 朱朝华, 蒲金基. 杧果露水斑病病原菌枝状枝孢霉的巢氏PCR检测方法的建立[J]. 果树学报, 2019, 36(1): 111-118.
- 12. Liu, Y.L., Li, Y., Lin, Q.L. and Zhang, Y.B. (2017) As-sessment of the Pathogenicity of Marine Cladosporium spp. towards Mangroves. Forest Pathology, 47, 1-5. https://doi.org/10.1111/efp.12322
NOTES
*第一作者。
#通讯作者。
