Immunology Studies
Vol.05 No.01(2017), Article ID:21739,9
pages
10.12677/IS.2017.51001
Nuclear Factor Erythroid 2-Related Factor 2 Deficiency (Nrf2-/-) Enhances the Cigarette Smoke Extract-Induced Immuno-Stimulus Response of in Mice
—Nrf2 Deficiency Affects the Immuno-Stimulus Response of Mice
Xiaoxie Xu, Yanchao Ding, Zhaofeng Huang
Institute of Human Virology, Zhongshan School of Medicine, Sun Yat-sen University, Guangzhou Guangdong
Received: Jul. 26th, 2017; accepted: Aug. 10th, 2017; published: Aug. 18th, 2017

ABSTRACT
Objective: To investigate the variation of spleen lymphocyte subsets percentages and abdominal macrophage inflammatory factor of the cigarette smoke extract-induced Nrf2-/- mice, and to discuss the role of Nrf2-/- in cigarette smoke extract-induced immuno-stimulus response of mice. Methods: 36 female C57BL/6 WT and Nrf2-/- mice were randomly divided into 2 groups, respectively. Two groups of WT and Nrf2-/- mice drank pure water containing DMSO dissolved cigarette smoke extract for 4 months continuously; the other two groups’ mice drank pure water containing the same amount of DMSO for four months. Spleens were harvested for taking pictures and necrosis scores; the single cell suspension of spleen tissue was prepared for splenocyte counting and the variation of spleen lymphocyte subsets was analyzed with flow cytometry. Meanwhile, the abdominal macrophages were harvested for the detecting of the related inflammatory factor. Results: Nrf2-/- prompted the spleen swelling with necrosis and lowered the number of splenocytes of cigarette smoke extract-induced mice; Nrf2-/- increased the percents of immune regulation related spleen total T cells and CD8 T cells and reduced the B cells; Nrf2-/- reduced the CD4 and CD8 TCM or TEM cells and increased the TE cells; Nrf2-/- enhanced the majority of inflammatory cytokines, colony stimulating factors and chemokines expression in abdominal macrophage of cigarette smoke extract-induced mice. Conclusion: Nrf2-/- enhances the cigarette smoke extract-induced natural immune and regulating immune response in mice.
Keywords:Cigarette Smoke Extract, Nrf2-/-, Spleen Lymphocyte Subsets, Macrophage Cytokines
Nrf2基因缺陷增强烟雾浓缩物对小鼠的免疫刺激反应
—Nrf2基因缺陷影响着小鼠的免疫应激反应
徐小解,丁燕超,黄朝峰
中山大学中山医学院人类病毒学研究所,广东 广州
收稿日期:2017年7月26日;录用日期:2017年8月10日;发布日期:2017年8月18日

摘 要
目的:分析烟雾浓缩物刺激下的Nrf2基因缺陷的小鼠脾脏淋巴细胞亚群百分比和腹腔巨噬细胞炎症因子变化,初步探讨Nrf2基因缺陷对烟雾浓缩物刺激下小鼠免疫反应的影响。方法:36只雌性C57BL/6 WT和Nrf2-/-小鼠随机分别分为两组;其中两组WT和Nrf2-/-小鼠连续饮用含DMSO溶解烟雾浓缩物的纯净水4个月;另两组小鼠饮用含等比DMSO的纯净水4个月。取小鼠脾脏,拍照,坏死评分;制备单细胞悬液,进行计数;采用流式细胞术分析脾脏淋巴细胞各亚群的变化。同时提取小鼠腹腔巨噬细胞,检测分析相关细胞因子的表达。结果:Nrf2基因缺陷促使了烟雾浓缩物刺激下小鼠脾脏肿大,并伴有坏死,降低了其脾脏总细胞数;增高了烟雾浓缩物刺激下小鼠调节免疫相关的脾脏T淋巴细胞和CD8淋巴细胞的百分比,同时能够降低B淋巴细胞;降低了CD4和CD8中央型记忆T细胞(TCM)或效应性记忆T细胞(TEM)的百分比,增加了效应T细胞(TE);增强了多数炎症性细胞因子、集落刺激因子和趋化因子在小鼠腹腔巨噬细胞中的表达。结论:Nrf2缺陷增强了烟雾浓缩物激活的小鼠天然免疫和适应性免疫的应答。
关键词 :香烟烟雾浓缩物,Nrf2-/-,脾细胞亚型,巨噬细胞因子

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在全球范围内,每年大约有600万人因烟草使用致死;并已有预测,按照当前使用烟草的趋势,从2030年起,至少有800万人因烟草致死。但是值得注意的是,大约85%的死亡是因暴露于二手烟 [1] 。吸烟能够产生多达6000种化学物质,除尼古丁外,还包括多环芳香烃、烟草糖蛋白和一些金属性物质等,其中许多能够引起细胞毒性、致突变或致癌,并且大多数是存在于香烟烟雾中。对于任何一个因吸烟而死亡的人来说,至少有三十个人受其影响罹患因吸烟而引起的疾病 [2] 。吸烟者拥有比正常人高2~4倍患冠心病和中风的几率,大约25倍患肺癌的几率。除了这些常见的疾病,吸烟也能引起肺炎、哮喘、类风湿性关节炎、视力低下、动脉硬化、生育能力低下以及增加的流行病患病几率等症状。大多数疾病是由吸烟产生的活性氧(ROS) [3] 、尼古丁 [4] [5] 和炎症反应 [6] 而诱导的。抽烟以多种方式影响着机体的免疫系统,许多系统性的慢性疾病是因持续性暴露于香烟烟雾化学物中间接引起的,从而导致机体因对抗由烟雾化学物引起的氧化应激和其它而产生炎症性的反应 [6] 。
核因子E2相关因子2(Nrf2)属于CNC亮氨酸拉链转录激活因子家族,广泛高度表达于机体的消化道、肺和皮肤等持续暴露于外环境中的器官以及肾脏、肝脏等代谢和解毒器官中。Nrf2/ARE信号通路,正常生理状态下,Nrf2通过与其抑制剂Keap1结合隐藏在细胞质中;在外界刺激作用条件下,Nrf2脱离Keap1进入细胞核,与抗氧化应激元件(ARE)结合,从而诱导一些抗氧化基因和解毒基因的表达,如血红素(HO-1)、超氧化物歧化酶(SOD)、NAD(P)H:醌氧化还原酶(NQO1)、谷氨酰半胱氨酸连接修饰酶(GCLM)和催化亚基(GCLC),以合成谷胱甘肽(GSH) [7] [8] 。大量研究表明Nrf2参与多种疾病的发生,是迄今为止发现的最为重要的内源性抗氧化应激通路,能够诱导编码一系列抗氧化剂,保护蛋白促进细胞内氧化还原环境的调节,与抗氧化反应、抗应激、抗炎反应及细胞保护作用等有关 [9] 。Nrf2作为ARE的激活因子,是外源性有毒物质和氧化应激的感受器,能够调控细胞对抗外来有毒物质和氧化应激的损伤 [10] 。
过往研究表明,抽烟对人群的影响和个体的遗传背景有密切关系,其中Nrf2基因多态和抽烟可以协同影响人类的疾病发生 [11] [12] 。为了进一步阐明环境和遗传的协同机制,本研究拟利用烟雾浓缩物和Nrf2基因缺陷小鼠,观察外源性过氧化物刺激协调抗氧化信号通路的缺陷对小鼠的天然免疫和适应性免疫应答的影响,确定二者的协同作用,为抽烟等外源氧化物影响不同遗传背景的人群免疫反应提供实验依据。
2. 材料与方法
2.1. 实验动物及分组
8~10周龄雌性SPF级C57BL/6小鼠36只,其中18只C57BL/6 Nrf2-/-小鼠是从美国缅因州巴尔港杰克逊实验室购买,此小鼠来源于129 × B6 F1背景,然后通过与C57B6/J种系杂交超过6代获得;18只野生型(WT)C57BL/6小鼠由广东省医学实验动物中心提供,动物合格证号:SCXK(粤)2003-0002。按随机数字表法将两种小鼠分别分为两组,共4组:WT、WT(+)、Nrf2-/-和Nrf2-/-(+),每组9只。所有的小鼠在中山大学实验动物中心SPF级饲养,WT(+)和Nrf2-/-(+)两组小鼠饮用含有由DMSO溶解的香烟烟雾的纯净水4个月,终浓度为2 mg/ml;WT和Nrf2-/-两组小鼠饮用含等比DMSO的纯净水4个月。
2.2. 伦理学
本实验动物处置方法符合动物伦理学标准。
2.3. 烟草烟雾浓缩物(Cigarette Smoke Extract, CSE)的制备
硬双喜牌香烟1条和二甲基亚砜(DMSO)溶液1瓶。制备流程如下图1所示:每次取2只香烟插入过滤嘴连接的玻璃滴管外端,玻璃滴管低端浸到含DMSO的抽滤瓶中液面下,抽滤瓶另一端连接中和装置,以中和制备过程中产生的多余的烟雾,点燃香烟后利用开关调节负压抽吸速率,使烟雾能够缓慢通过DMSO溶液并让其充分溶解。重复多次操作,制备足量的CSE。待1条香烟烟雾经1瓶DMSO溶解后,测量香烟烟雾浓缩物的浓度。造模时使用浓度为2 mg/ml烟雾浓缩物的纯净水饲养小鼠。
2.4. 组织病理形态学观察及淋巴细胞亚群分析
2.4.1. 脾脏观察
小鼠饲养至6个月大时,取脾脏,观察脾脏形态变化并拍照;对脾脏坏死进行评分,评分标准:0,

Figure 1. The device for cigarette smoke extract preparation
图1. 烟草烟雾浓缩物的制备装置
无坏死;1) 轻微坏死(<1/8个脾脏);2) 中度坏死(≥1/8个脾脏,<1/4个脾脏);3) 严重坏死(≥1/4个脾脏)。
2.4.2. 细胞计数
取脾组织制备单细胞悬液,用磷酸盐缓冲液(PBS)定容至50 mL后进行细胞计数。
2.4.3. 脾脏淋巴细胞亚群流式检测分析
制备适当浓度脾单细胞悬液,采用抗小鼠藻红蛋白(PE)标记TCRβ+、异硫氰酸荧光素(FITC)标记B220+、(PE-cy7)标记CD4+、藻青蛋白(APC)标记CD8+、(PE-cy5)标记CD44+和(PE-CF594)标记的CD62L+的抗体对细胞进行直接染色,应用流式细胞仪获取细胞,Flowjo7.6软件处理数据,分析TCRβ+(T细胞)、B220+(B细胞)、TCRβ+CD4+(CD4 T细胞)、TCRβ+CD8+(CD8 T细胞)、CD44-CD62L-(TE效应T细胞)、CD44+CD62L-(TEM效应记忆T细胞)、CD44+CD62L+(TCM中央型记忆T细胞)、CD44-CD62L+(TN初始T细胞)在不同组实验小鼠脾脏中的变化。这些抗体购自美国eBioscience和BD公司。
2.5. 腹腔巨噬细胞的提取和激活培养及其细胞因子相对mRNA水平的检测
2.5.1. 小鼠腹腔巨噬细胞的提取和激活培养
无双抗RPMI1640培养基腹腔冲洗巨噬细胞,离心,弃上清。先用RPMI1640完全培养基于24孔板上37˚C CO2培养箱中培养细胞,细胞贴壁4 h;然后用含5 mg/ml细菌脂多糖(LPS)的RPMI1640完全培养基于37˚C CO2培养箱中激活培养48 h。
2.5.2. 细胞因子相对mRNA水平的检测
巨噬细胞激活培养48 h时,收取细胞,每个样本加入1 ml购自美国Invitrogen™的TRIzol提取总的RNA。先用购自日本的PrimeScript™ RT试剂盒将总的RNA逆转为cDNA,然后用购自中国北京Takara公司的SYBR Green Master Mix以cDNA为模板,在细胞因子引物下检测相应细胞因子相对mRNA的水平。
2.6. 统计学分析
所有数据以均数±标准差(x ± s)表示,采Graphpad Prism5统计软件进行分析和作图,组间差异采用t检验进行比较,P < 0.05认为有统计学意义。
3. 结果
3.1. 脾脏坏死评分及细胞计数(图2)
小鼠6月大时,WT和Nrf2-/-两组小鼠脾脏无明显差别;Nrf2-/-(+)和WT(+)两组小鼠脾脏相对其它两

Figure 2. The pictures of mice spleen necrosis (a), the scores of spleen necrosis (b) and the comparison of spleen cell numbers (c). Annotation: The picture A represented the randomly selected mice spleen in one experiment; the scoring criteria of picture B have showed in materials and methods section. *p < 0.05; **p < 0.01; ***p < 0.001
图2. 4组小鼠脾脏坏死实图(a)、脾脏坏死评分(b)和脾脏细胞数(c)的比较。注:(a)图为一次实验中随机选取的小鼠脾脏;(b)图的评分标准在材料与方法中的展示。*p < 0.05; **p < 0.01; ***p < 0.001
组略微增大,Nrf2-/-(+)组增大较为明显(a)。Nrf2-/-(+)和WT(+)两组小鼠脾脏均有明显坏死,但Nrf2-/-(+)组小鼠脾脏坏死评分显著高于其它三组组小鼠(b)。由于Nrf2-/-(+)组小鼠脾脏坏死较为显著,即使脾脏明显增大,其细胞数相对于Nrf2-/-小鼠组显著降低(c)。
3.2. Nrf2基因缺陷对烟雾浓缩物激活的小鼠调节免疫的影响(图3)
小鼠6月大时,取其脾脏细胞进行染荧光抗体流式检测分析(a)。Nrf2-/-(+)组小鼠脾脏T淋巴细胞和CD8+ T细胞的百分比显著高于Nrf2-/-组小鼠,相对于WT(+)小鼠略微增高,但无显著性差异;Nrf2-/-(+)组小鼠脾脏CD4+ T细胞相对于其它三组均无明显变化;Nrf2-/-(+)组小鼠脾脏B淋巴细胞百分比相对于Nrf2-/-组小鼠也有所下降(b)。
3.3. Nrf2基因缺陷影响着烟雾浓缩物刺激的小鼠脾脏CD4和CD8 T细胞亚群的变化(图4)
CD4和CD8初始T细胞在四组小鼠中无明显变化(a)和(b)。Nrf2-/-(+)小鼠组CD4+ T细胞来源的中央型记忆T细胞和效应记忆T细胞的百分比相对于Nrf2-/-小鼠组略微下降(A);Nrf2-/-(+)小鼠组CD8+ T细胞来源的中央型记忆T细胞百分比相对于Nrf2-/-小鼠组显著性降低(b);与此同时,Nrf2-/-(+)组小鼠脾脏CD4和CD8效应T细胞百分比显著高于Nrf2-/-组(a)和(b)。
3.4. Nrf2基因缺陷对烟雾浓缩物激活的小鼠初始免疫的调控作用(图5)
应用Q-PCR技术检测细胞因子在巨噬细胞中的表达。促炎症性细胞因子IL-1β相对mRNA的水平在Nrf2-/-(+)组小鼠巨噬细胞明显高于其它三组;肿瘤坏死因子α(TNFα)的表达也明显升高(a)。粒细胞集落刺激因子(G-CSF)和粒细胞/巨噬细胞集落刺激因子(GM-CSF)在Nrf2-/-(+)组小鼠巨噬细胞中的表达水平明显升高;趋化因子MIP-1α、MIP-1β和RANTES在Nrf2-/-(+)组小鼠巨噬细胞中的表达水平也明显升高(b)。
4. 讨论
转录调节因子NF-E2相关因子2(Nrf2)是细胞氧化应激反应的关键因子,其介导的抗氧化反应是一种主要的细胞防御机制;Nrf2基因的缺失或激活障碍,可使氧化应激源对细胞的毒性加重,从而导致细胞功能障碍、凋亡甚至死亡 [13] 。香烟烟雾中含有大量的氧化剂、自由基和有机物基团,它既影响机体的体液免疫,也影响细胞介导的免疫 [6] 。本研究使用香烟烟雾浓缩物饲养Nrf2基因缺失和野生型小鼠4个月,发现小鼠的脾脏均有明显坏死,但Nrf2基因缺失小鼠经香烟烟雾浓缩物刺激后脾脏坏死程度显著性增加(图2(a)和图2(b)),用含等比DMSO的纯净水饲养的对照组部分小鼠的脾脏也有轻微坏死,可能是由溶
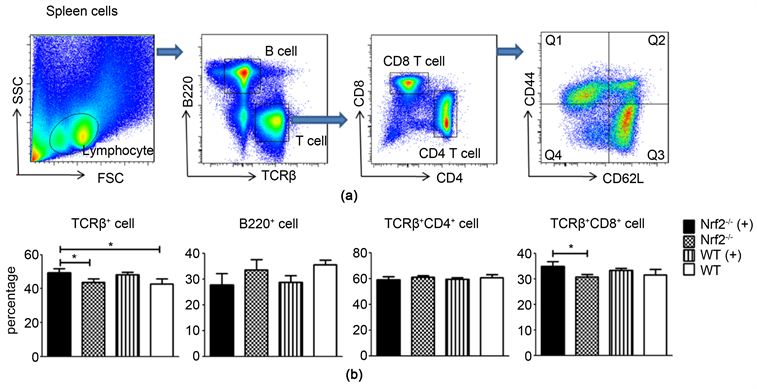
Figure 3. The representative FACS pictures of splenic lymphocytes (a) and the statistic analysis comparison of the percent of spleen T cells, B cells, CD4+ and CD8+ T cells in four groups mice (b). Annotation: The picture A represented the FACS scatter plot. The Q1 represented effector memory T cell (TEM); the Q2 represented centre memory T cell (TCM); the Q3 represented naïve T cell (TN); the Q4 represented effector T cell (TE). *p < 0.05
图3. 小鼠脾脏淋巴细胞流式图(a)以及淋巴T、B、CD4和CD8细胞在4组小鼠中的脾脏平均细胞百分比的比较(b)。注:A图为脾脏细胞亚群流式散点图。其中Q1代表效应记忆T细胞(CD44+CD62L-, TEM);Q2代表中心记忆T细胞(CD44+CD62L+, TCM);Q3代表初始T细胞(CD44−CD62L+, TN);Q4代表中效应T细胞(CD44−CD62L-, TE)。*p < 0.05
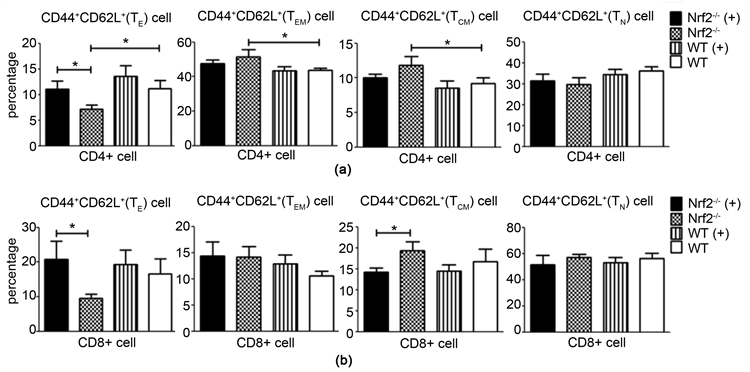
Figure 4. The comparison of mice spleen CD4+ (a) and CD8+ (b) T lymphocyte subsets. Annotation: The A represented the effector T cell (TE), effector memory T cell (TEM), centre memory T cell (TCM) and naïve T cell (TN) in CD4 T cells. The B represented the effector T cell (TE), effector memory T cell (TEM), centre memory T cell (TCM) and naïve T cell (TN) in CD8 T cells. *p < 0.05
图4. 小鼠脾脏CD4+ (a)和CD8+ (b) T细胞亚群的比较。注:A为CD4+ T细胞来源的效应T细胞、效应记忆T细胞、中央型记忆T细胞和初始T细胞;B为CD8+ T细胞来源的效应T细胞、效应记忆T细胞、中心记忆T细胞和初始T细胞。*p < 0.05
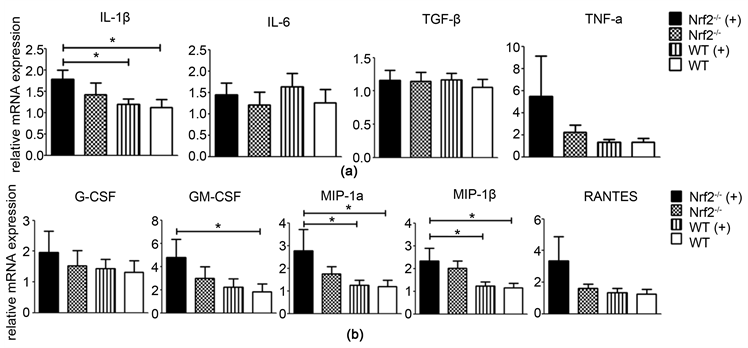
Figure 5. Represented the relative mRNA expression detection of cytokines in LPS-induced abdominal macrophage by RT-PCR. *p < 0.05
图5. 实时荧光定量PCR测定细胞因子相对mRNA在LPS激活小鼠腹腔巨噬细胞中的表达。*p < 0.05
剂DMSO引起的。同时由于Nrf2基因缺失小鼠经香烟烟雾浓缩液刺激后脾脏坏死较为明显,所以其脾脏总细胞数明显降低(图2(c))。这些结果说明外源性过氧化物刺激协调抗氧化信号通路基因的缺陷可增加小鼠机体的细胞毒性,导致小鼠脾脏淋巴细胞的凋亡和坏死。
当机体受到应激源刺激,就会形成适应性免疫应答,从而导致抗原特异性T和B细胞的克隆性扩增及向效应细胞的分化。扩增的T细胞能够分化为细胞毒性T细胞、多种辅助性T细胞和调节性T细胞,在适应性免疫反应中发挥重要作用,不仅参与体液免疫而且参与细胞免疫的调节 [14] 。已有研究表明短期诱导刺激可诱导CD8+ T细胞多次分裂,并可形成效应和记忆细胞功能 [15] 。在本文研究中,我们对小鼠的脾脏淋巴细胞亚群进行流式分析,发现Nrf2基因缺失小鼠经香烟烟雾浓缩物刺激后,其脾脏T淋巴细胞和CD8淋巴细胞的百分比相对于对照组Nrf2基因缺失小鼠显著性升高,B淋巴细胞和CD4淋巴细胞的百分比无显著性变化(图3(b))。这些数据表明,环境因素香烟烟雾浓缩物与遗传因素Nrf2基因的缺失能够协同调控着小鼠的适应性免疫应答。
免疫记忆是机体免疫应答的主要特征之一,当机体被抗原刺激时,初始细胞将活化、克隆扩增、分化成为效应细胞以清除抗原,少数效应细胞分化为记忆细胞,多数死亡 [16] ;当机体再次受到同一抗原刺激,记忆性细胞能够快速增殖分化及转变为效应细胞作用于抗原 [17] 。记忆性T细胞除了是机体防御的关键免疫调控细胞之外,它们还是机体免疫应答反应中细胞因子和细胞毒性的主要来源 [18] 。在本研究中,我们对小鼠脾脏CD4和CD8记忆性细胞亚群进行了分析,结果表明香烟烟雾浓缩物刺激的Nrf2基因缺失小鼠的脾脏CD8 TCM细胞百分比相对于对照组Nrf2基因缺失小鼠显著性降低,CD8 TE细胞相应显著性增加(图4(b));CD4 TE细胞也明显增加(图4(a))。这些数据表明,Nrf2基因缺失和香烟烟雾浓缩物刺激能够协同诱发小鼠的记忆性免疫调节。
巨噬细胞是机体最初抵御应激源的细胞防御机制,它在固有免疫和适应性免疫反应中均具有重要的作用;巨噬细胞可间接或直接地参与各种免疫反应过程 [19] 。已有研究表明,在体外,细菌脂多糖(LPS)刺激活化的巨噬细胞可产生炎性细胞因子如TNF和IL-6,并在Th1反应中成为诱导性及效应性细胞,从而有效清除病原体 [20] 。在维持机体内环境稳态免疫反应中,巨噬细胞炎性蛋白趋化因子MIP-1α和MIP-1β能够募集中性粒细胞、单核细胞和效应T细胞向应激源转移,从而快速清除病原体。在本研究中,我们用细菌脂多糖(LPS)对小鼠腹腔巨噬细胞进行体外刺激培养,发现Nrf2基因缺失明显增加经香烟烟雾浓缩物刺激的小鼠腹腔巨噬细胞相关因子IL-1β、GM-CSF、MIP-1α和MIP-1β相对mRAN水平(图5)。因此,Nrf2基因缺失和香烟烟雾浓缩物刺激能够协同诱发小鼠的天然免疫调节。
综上所述,在Nrf2基因缺失小鼠中,烟雾浓缩物的刺激导致的天然免疫和适应性免疫应答发生明显改变,小鼠的天然免疫巨噬细胞因子的表达明显上调,脾脏淋巴T细胞、CD8 T细胞和效应T细胞的形成都有显著变化。这些结果表明抗氧化基因缺陷小鼠更容易被外源氧化应激刺激物激活,具有更高的炎症因子水平,是外源氧化物对小鼠毒理影响的作用机制。
基金资助
广东省科技计划(2015A030302016和2016A050503023)。
文章引用
徐小解,丁燕超,黄朝峰. Nrf2基因缺陷增强烟雾浓缩物对小鼠的免疫刺激反应—Nrf2基因缺陷影响着小鼠的免疫应激反应
Nuclear Factor Erythroid 2-Related Factor 2 Deficiency (Nrf2-/-) Enhances the Cigarette Smoke Extract-Induced Immuno-Stimulus Response of in Mice—Nrf2 Deficiency Affects the Immuno-Stimulus Response of Mice[J]. 免疫学研究, 2017, 05(01): 1-9. http://dx.doi.org/10.12677/IS.2017.51001
参考文献 (References)
- 1. Prasad, S., Sajja, R.K., Kaisar, M.A., et al. (2017) Role of Nrf2 and Protective Effects of Metformin against Tobacco Smoke-Induced Cerebrovascular Toxicity. Redox Biology, 12, 58-69. https://doi.org/10.1016/j.redox.2017.02.007
- 2. Office, N.C.F.C and Health, O.S.A. (2014) The Health Consequences of Smoking-50 Years of Progress: A Report of the Surgeon General. Centers for Disease Control and Prevention (US), Atlanta.
- 3. Panda, K., Chattopadhyay, R., Ghosh, M.K., et al. (1999) Vitamin C Prevents Cigarette Smoke Induced Oxidative Da- mage of Proteins and Increased Proteolysis. Free Radical Biology and Medicine, 27, 1064-1079. https://doi.org/10.1016/S0891-5849(99)00154-9
- 4. Heeschen, C., Weis, M. and Cooke, J.P. (2003) Nicotine Promotes Arteriogenesis. Journal of the American College of Cardiology, 41, 489-496. https://doi.org/10.1016/S0735-1097(02)02818-8
- 5. Paulson, J.R., Yang, T., Selvaraj, P.K., et al. (2010) Nicotine Exacerbates Brain Edema during in Vitro and in Vivo Focal Ischemic Conditions. Journal of Pharmacology and Experimental Therapeutics, 332, 371-379. https://doi.org/10.1124/jpet.109.157776
- 6. Arnson, Y., Shoenfeld, Y. and Amital, H. (2010) Effects of Tobacco Smoke on Immunity, Inflammation and Autoimmunity. Journal of Autoimmunity, 34, J258-J265. https://doi.org/10.1016/j.jaut.2009.12.003
- 7. Kensler, T.W., Wakabayashi, N. and Biswal, S. (2007) Cell Survival Responses to Environmental Stresses via the Keap1-Nrf2-ARE Pathway. Annual Review of Pharmacology and Toxicology, 47, 89-116. https://doi.org/10.1146/annurev.pharmtox.46.120604.141046
- 8. Malhotra, D., Portales-Casamar, E., Singh, A., et al. (2010) Global Mapping of Binding Sites for Nrf2 Identifies Novel Targets in Cell Survival Response through ChIP-Seq Profiling and Network Analysis. Nucleic Acids Research, 38, 5718-5734. https://doi.org/10.1093/nar/gkq212
- 9. Kumar, H., Kim, I.S., More, S.V., et al. (2014) Natural Product-Derived Pharmacological Modulators of Nrf2/ARE Pathway for Chronic Diseases. Natural Product Reports, 31, 109-139. https://doi.org/10.1039/C3NP70065H
- 10. Wang, N., Ma, H., Qi, X., et al. (2015) The Research Progress of Nrf2-ARE Signaling Pathways in the Protection of Body Oxidative Stress Injury. Medical & Pharmaceutical Journal of Chinese People’s Liberation Army, 12, 21-27.
- 11. Yu, B., Chen, J., Liu, D., et al. (2013) Cigarette Smoking Is Associated with Human Semen Quality in Synergy with Functional NRF2 Polymorphisms. Biology of Reproduction, 89, 5. https://doi.org/10.1095/biolreprod.113.109389
- 12. Wang, X., Chorley, B.N., Pittman, G.S., et al. (2010) Genetic Variation and Antioxidant Response Gene Expression in the Bronchial Airway Epithelium of Smokers at Risk for Lung Cancer. PLoS ONE, 5, e11934. https://doi.org/10.1371/journal.pone.0011934
- 13. Ying, Y. (2012) The Role of Transcription Factor Nrf2 in Cigarette Smoke-Induced the Expression of MUC5AC Mucoprotein. Zhejiang University, Hangzhou.
- 14. Liu, Y., Tai, G. and Li, Q. (2015) The Formation of Memory CD4+ T Cells and Its Influencing Factors. Chinese Journal of Cellular and Molecular Immunology, 9, 1267-1269.
- 15. Liu, J. and Wu, C. (2010) The Formation of Memory T Cells, Maintain and Function. Life Science, 6, 506-514.
- 16. Li, W. (2004) The Generation of Memory T Cells and Maintaining. Foreign Medical Sciences (Section of Immunology Foreign Medical Sciences), 6, 335-339.
- 17. Cieri, N., Camisa, B., Cocchiarella, F., et al. (2013) IL-7 and IL-15 Instruct the Generation of Human Memory Stem T Cells from Naive Precursors. Blood, 121, 573-584. https://doi.org/10.1182/blood-2012-05-431718
- 18. Zhang, Y., Ohkuri, T., Wakita, D., et al. (2008) Sialyl Lewisx Anti-gen-Expressing Human CD4+ T and CD8+ T Cells as Initial Immune Responders in Memory Phenotype Subsets. Journal of Leukocyte Biology, 84, 730-735. https://doi.org/10.1189/jlb.0907599
- 19. Li, D., Ren, Y. and Fan, H. (2011) The Classification of Macrophages and the Difference of Regulating Function. Life Science, 3, 249-254.
- 20. Fleetwood, A.J., Lawrence, T., Hamilton, J.A., et al. (2007) Granulocyte-Macrophage Colony-Stimulating Factor (CSF) and Macrophage CSF-Dependent Macrophage Phenotypes Display Differences in Cytokine Profiles and Transcription Factor Activities: Implications for CSF Blockade in Inflammation. Journal of Immunology, 178, 5245-5252. https://doi.org/10.4049/jimmunol.178.8.5245