Hans Journal of Medicinal Chemistry
Vol.2 No.04(2014), Article ID:14344,6 pages
DOI:10.12677/HJMCe.2014.24007
The New Idea in the Synthesis of Lipid-Regulator Fibrates
College of Pharmacology, Inner Mongolia Medical University, Hohhot
Email: *juzi572413@163.com
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Sep. 20th, 2014; revised: Oct. 22nd, 2014; accepted: Oct. 30th, 2014
The lipid-regulating agent fibrate plays an important role in lowering the blood lipid. It can significantly reduce the level of total cholesterol, triglyceride and high-density lipoprotein in blood, and it has less side-effect than the mostly used Statins. In this review, we mainly show the mechanism and advantages of the fibrates, as well as the introduction of the disease high-blood-lipid or the lipid-regulating agents. We summary the synthesis and pharmacological activities in the past 5 years at home and abroad, including the better routes of its synthesis, changing the construction to get the double-receptor agonist, improving the oil-water partition coefficient and the binding rate in vivo. So we can get the new idea for the further study.
Keywords:Hyperlipidemia, Fibrates, Synthesis Progress, Activity Evaluation

夏 莹,额尔敦,乌 恩*
内蒙古医科大学药学院,呼和浩特
Email: *juzi572413@163.com
收稿日期:2014年9月20日;修回日期:2014年10月22日;录用日期:2014年10月30日

贝特类药物在调血脂领域具有举足轻重的位置,它在降低甘油三酯,高密度脂蛋白,总胆固醇方面具有显著疗效,与临床上应用较多的他汀类药物相比,贝特类药物的不良反应较轻。本综述在对高脂血症和调血脂药物进行介绍的基础上,主要阐述了贝特类调血脂药物的作用机制,说明其优势,对近5年国内外贝特类药物的合成方向及药理活性进行综述,包括全合成的路线优化,结构改造制备双受体激动剂,改善油水分配系数,贝特类药物与具有调血脂活性的天然产物结合等,以期为贝特类的进一步研究提供方向。
高血脂,贝特类,合成进展,活性评价

高脂血症是世界十大高危疾病之一,严重影响人们的生活质量。随着我国人民生活水平的不断提高,高脂血症已呈高发病趋势。这些年来各种调血脂药物层出不穷,但毒副作用和不良反应却限制了其使用。因此研制高效低毒的新型药物迫在眉睫。本文对临床上使用效果较好,应用较多的贝特类药物的合成进行综述,并对其活性进行探讨,为进一步合成高效低毒的调血脂药物做基础。
临床上常用的调血脂药物主要有西药和中药两类,产生作用的机制主要有以下几个方面:阻止吸收,抑制合成,促进转化,加速分解。
其中常用的西药降血脂药物有以下几类:他汀类药物、贝特类药物、烟酸类药物、胆酸螯合剂、胆固醇吸收抑制剂、其它。
目前有三十多种中药被用于高脂血症的治疗当中,已报道的中药降脂活性成分包括:蛋白质类、黄酮类、皂苷类、活性多糖、不饱和脂肪酸、酚类、生物碱类、蒽醌类、萜类等[1] -[3] 。
例如山楂叶总黄酮的降血脂实验研究表明,它能明显降低血脂,减轻动物肝脏内各类脂质沉积,同时还具有良好的抗氧化作用,能显著地保护肝脏组织的生理功能,对由高脂饮食引起的高血脂和脂肪肝具有明显的防治作用[4] 。山药皂苷对高胆固醇血症鼠也具有降脂和抗氧化作用,饲喂含0.5%的山药皂苷6 w后,可以显著降低血清和肝脏的TC,并提高HDL-C水平,对H2O2氧化应激引起的淋巴细胞DNA损伤的抵抗作用也有所增强[5] 。
3.1. 作用机制
贝特类药物亦称苯氧芳酸类药物,通过激活过氧化物酶增殖体活化受体α(peroxisome proliferator activated receptor-alpha, PPAR-α),刺激脂蛋白脂酶(lipoproteinlipase, LPL)、载脂蛋白AI(apolipoprotein AI, apoAI)、载脂蛋白AⅡ(apoAⅡ)、载脂蛋白A V (apoA V)基因的表达,增强LPL活性,去除血浆中富含甘油三酯(Triglyceride, TG)的脂蛋白,从而降低TG和升高高密度脂蛋白(high density lipoprotein, HDL-C)水平,促进胆固醇的逆向转运,并使LDL亚型由小而密颗粒向大而疏颗粒转变[6] 。贝特类药物能降低血浆TG水平30%~50%,降低LDL-C水平15%~20%,显著增加HDL-C水平5%~15%。贝特类药物治疗也能促进脂肪酸的β-氧化,减少游离脂肪酸合成TG。此外,贝特通过降低乙酰辅酶A羧化酶和脂肪酸合成酶的活性从而抑制脂肪酸的从头合成,进而减少脂肪酸向TG的生成。PPAR-α的激活也增加高密度脂蛋白中的主要蛋白质apoA I、apoA II合成。Kiyanagi等[7] 报道贝特类药物还能降低胆固醇酯转运蛋白(cholesteryl ester transfer protein, CETP)的活性,以及减低CETP介导的脂质从HDL-C转运到LDL的能力,因而使血浆HDL-C水平增加。
已知LDL颗粒亚型与致动脉粥样硬化程度有关,较大而疏的LDL具有更强的致动脉粥样硬化作用,主要由于低密度脂蛋白亚型经血浆LDL受体途径的清除较慢,颗粒小,更易进入动脉壁内,更易被氧化有关;而较大的LDL颗粒具有较高与细胞LDL受体结合的能力,也不易被氧化。代谢综合征人群的血脂异常特点是具有较高的TG,低HDL-C,尽管血清LDL-C水平无明显增高,但LDL颗粒较小,因此这类人群致动脉硬化的LDL颗粒实际上却相对增加。血脂所致的心血管风险,更多地认为是由LDL颗粒或载脂蛋白B(apo B)水平引起,而不是血浆LDL-C [8] 。贝特类药物能使LDL颗粒亚型分布正常,即减少低密度脂蛋白亚型颗粒数量和升高HDL。
3.2. 作用和优势
贝特类药物除了具有调脂作用外,还具有抗炎、降低纤维蛋白原、改善内皮功能、改善胰岛素敏感性等调脂以外的抗动脉粥样硬化作用[9] 。贝特类药物作为PPAR-α配体,能激活主要分布在肝脏、骨骼肌、心肌中的PPAR-α受体,后者在延缓动脉粥样硬化进展中起重要作用[10] 。贝特激活PPARα能调节抗炎反应,通过对转录因子NFκB的抑制作用,减少多种促炎因子(包括白细胞介素-6、各种前列腺素)的产生以及急性期蛋白(纤维蛋白原、C反应蛋白)的产生。苯扎贝特能减少氧化应激和纤维蛋白原水平高达20%,还有明显的抗血小板作用[11] ,环丙贝特和非诺贝特也被证实对高胆固醇血症人群有抗血小板聚集作用。Jeanpierre等发现苯扎贝特通过激活PPAR-α增加内皮细胞生长,增强患者的内皮功能,下调组织因子的表达进而减轻斑块的致血栓性,从而增强斑块的稳定性[12] 。Tenenbaum等发现苯扎贝特激活PPAR特别是直接激活PPAR-γ,增强胰岛素敏感性,对冠心病患者为期2年的随访证实苯扎贝特能明显延缓胰岛素抵抗[13] 。贝特类降脂药物,降甘油三酯作用明显,对高甘油三酯血症及以甘油三酯增高为主的混合性高脂血症非常有效。合成过程相对简单,并且致横纹肌溶解的副作用报道较他汀类少。
近年来贝特类调血脂药物的研究方向主要集中在以下几方面:
4.1. 贝特类全合成的路线优化
通过合成路线的优化,简化操作过程,改变不易控制的环节,使其更适合于工业生产。
例如国内做的苯扎贝特的合成路线优化[14] 。苯扎贝特的合成包括酰化和缩合两步,主要有两种方法[15] [16] ,这两种方法的缩合反应都是在无水条件下进行的,丙酮作为溶剂和反应物。由于丙酮易溶于水,因此反应结束后需蒸出以回收,剩余物再加水酸化得目标产物;另外固体氢氧化钠必须粉碎以增加其在丙酮中的溶解度,不但增加了劳动强度和腐蚀性,而且在粉碎过程中极易吸湿,又不可避免地带入少量水分,同时反应中的大量丙酮在回收时必须经精馏脱水方可循环使用,生产周期长,操作成本高。改进后的方法采用甲苯代替丙酮,并将氢氧化钠溶于水中,通过加入相转移催化剂TEBA,实现两相之间的反应,反应结束后甲苯通过萃取分层即可与产物分离,大大缩短了溶剂回收的时间,并且由于反应可以在有水条件下进行,因此回收的甲苯中少量的水分不会影响溶剂的再次使用,避免了精馏脱水。所得产品质量稳定,缩合总收率达73%。通过更换溶剂和使用相转移催化剂克服了上述缺点,操作方便安全,生产周期短,降低了操作成本,产品收率高,更有利于工业化生产。
4.2. 贝特类结构改造制备双受体激动剂
2012年来自印度药物研究所的Sashidhara KV等人设计并合成了基于非诺贝特的酰胺类化合物,发现化合物13(如图1)能显著降低血浆总胆固醇,磷脂和甘油三酯。另外能提高脂蛋白酯酶的活性和潜在的清除自由基能力,这个基于非诺贝特药效团合成的化合物有助于识别调血脂的新药物[17] 。
2012年Kumar M等人合成了一系列基于吲哚的非诺贝特药作为潜在的调血脂和抗肥胖药物,经过药理活性初步筛选,发现其中两个化合物3f,3l(如图2)具有显著地降血脂活性,另外发现在不改变正常饮食行为的条件下,这两种药物能诱导体重下降。组织学检查发现,和非诺贝特比较小鼠肝脏的脂肪变性减少。还有附加效应,卵磷脂胆固醇酰基转移酶的水平提高[18] 。
2012年Mokale SN,Shete MT等科学家合成了一系列基于嘧啶的苯氧乙酸衍生物,进行药理活性筛选,部分化合物具有降糖和降脂双重活性,部分化合物只有降脂活性或者降糖活性。R位有取代基时,活性降低或者无活性;R′位有取代基时,有活性或者活性增强。在所有化合物中,其中4b、4c、4h、4f(如图3)具有积极的降血脂作用[19] [20] 。
4.3. 贝特类结构修饰改善其油水分配系数
2011年Bandgar BP, Sarangdhar RJ, Khan F, Mookkan J, Shetty P, Singh G共同合成了非诺贝特酸酯的

Figure 1. The structure of compound 13
图1. 化合物13的结构
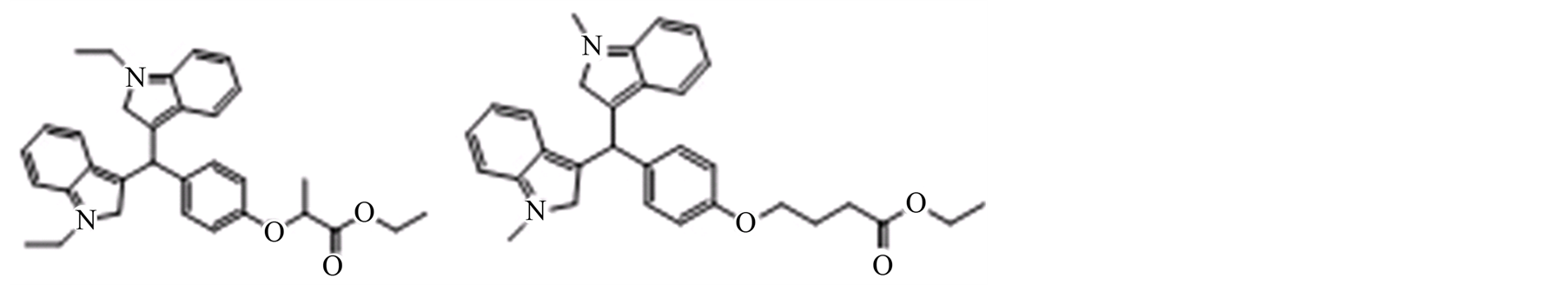
Figure 2. The structure of compound 3f and 3l
图2. 化合物3f和3l的结构

Figure 3. The structure of compound 4b, 4c, 4h and 4f
图3. 化合物4b, 4c, 4h和4f的结构
前药并对其进行生物活性的评价。非诺贝特酸酯前药的亲脂性和非诺贝特相似,前药1c和1d(如图4)表现出显著地降血脂活性,在口服给药50 mg/kg/d,连续用药8天后,小鼠血浆中甘油三酯降低47% [21] 。
2012年Bandgar BP, Sarangdhar RJ又和Fruthous K, Mookkan J, Chaudhary S等,合成了苯扎贝特的酯类前药并用瑞士白鼠对其进行生物活性的评价,和苯扎贝特做对照,其中化合物7口服给药50 mg/kg/d,连续用药8 d后,小鼠血浆甘油三酯水平下降了30%,显示出优越的降脂活性。另外前药2、3、5、6、7(如图5)和苯扎贝特比较,亲脂性更强[22] 。化合物7以及其它化合物的结构如下图所示,其余化合物均与7的结构类似,只是成酯的尾部不同。可见次甲二氧基的酯类尾部能增强这一类化合物的降脂活性。
2012年Nemoto H, Kamiya M等把三种水溶性的贝特类药物(苯扎贝特、非诺贝特、氯贝特)与甘油基三聚物共轭成水溶性更强的药物,非诺贝特与甘油三聚物共轭体系(fenofibrate-BGL003)的水溶性是原始非诺贝特的几千倍,其降脂效果却和非诺贝特一样强。口服给药4 h后,血浆中非诺贝特酸的浓度是使用原始非诺贝特的5倍[23] 。
4.4. 贝特类与天然化合物结合
来自中国北京药理和毒理学研究所的几位科学家设计合成了30多个基于黄酮类,白藜芦醇等天然骨架的苯氧乙酸(贝特)衍生物,大部分化合物具有较高的生物活性。药理活性研究结果显示:以白藜芦醇(芪类)为骨架的非诺贝特衍生物的活性高于以黄酮类为骨架的非诺贝特衍生物。其中一个白藜芦醇衍生物的降脂活性远远超过了非诺贝特,在同等条件下其降低甘油三酯48.5%,降低总胆固醇44.2%,然而非诺贝特的效果仅仅才有38.2%和30.8%。在黄酮类衍生物中,基于查尔酮衍生物的降脂活性要高于基于异黄酮的衍生物,而且部分化合物还具有降糖降脂双重活性[24] 。由于天然产物的作用持续,毒副作用小,各种天然产物中的活性成分的研究越来越受到重视[25] -[27] 。

Figure 4. Prodrugs of fenofibrate
图4. 非诺贝特的前药
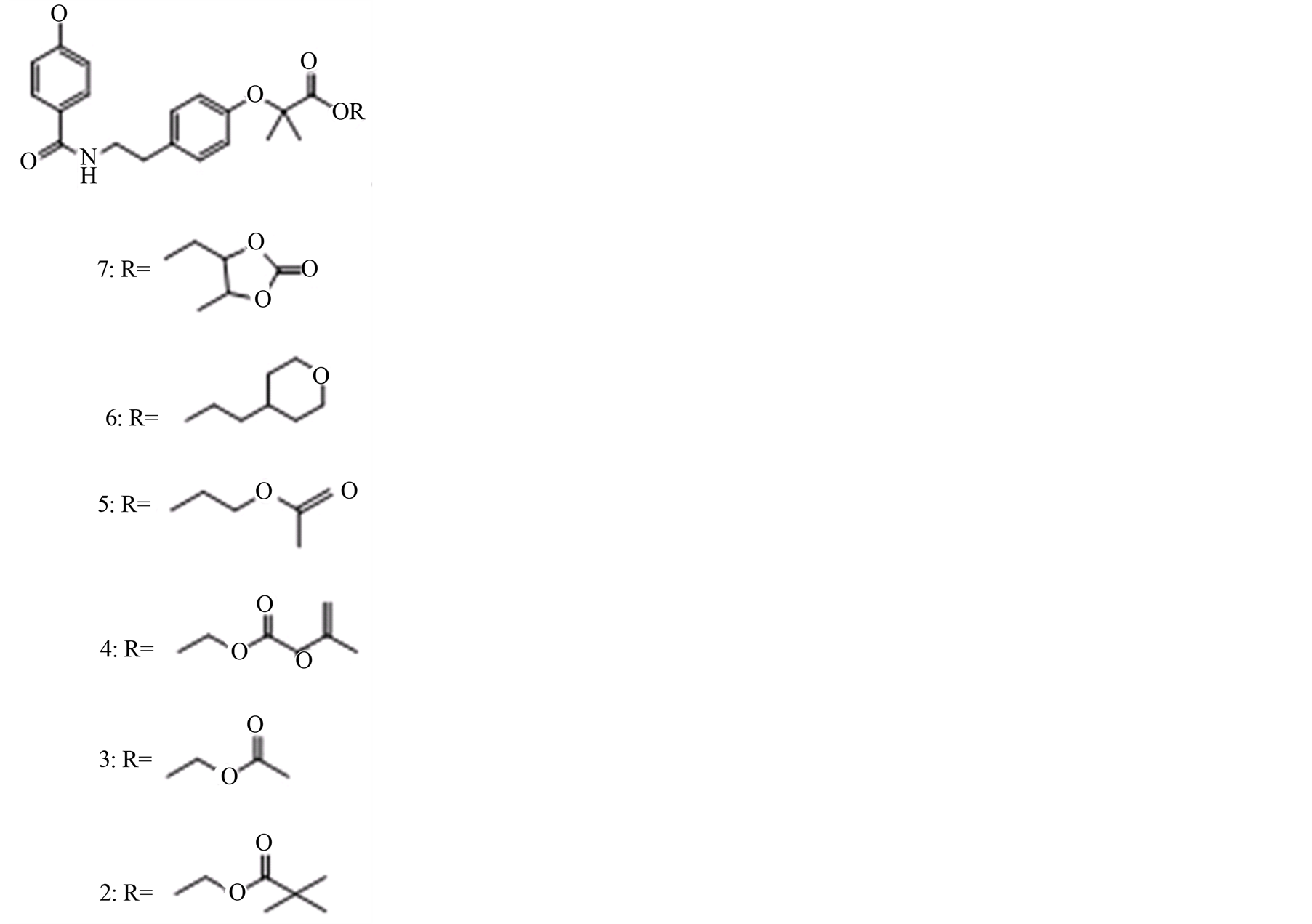
Figure 5. Prodrugs of bezafibrate
图5. 苯扎贝特的前药
综上所述,西药降血脂疗效显著但毒副作用较大,如果对其进行结构改造,并有效利用天然产物中调血脂活性成分,使二者有机的融合,从而合成高效、低毒的新型调血脂药物是我们今后研究的方向。使用现代科技手段,探索发现与西药具有相同机制的天然药物,替换毒性强的基团,从而达到保持原有疗效,低毒,进而增强疗效的目的。
感谢乌恩老师和额尔敦老师给予的宝贵意见!
- [1] 黄焕莉, 黄守坚 (2010) 调血脂药的合理应用. 新医学, 10, 687-690.
- [2] 孙吉叶, 蔡旭东等 (2012) 治疗高脂血症的新药研究进展. 现代药物与临床, 5, 435-441.
- [3] 宁娜, 韩建军 (2013) 中药降血脂活性成分研究进展. 亚太传统医药, 2, 76-80.
- [4] 叶希韵, 徐敏华, 李晓峰等 (2009) 山楂叶总黄酮降血脂防治鹌鹑脂肪肝形成的实验研究. 复旦学报(医学版), 2, 142-148.
- [5] Son, I.S. and Kim, J.H. (2007)·Antioxidative and hypolipidemic effects of diosgenin, a steroidal of yam (Dioscorea spp.), on high-cholesterol fed rats. Bioscience, Biotechnology, and Biochemistry, 71, 3063-3071.
- [6] 龚海荣, 李向平, 梁思宇 (2011) 贝特类调脂药物研究进展. 中南药学, 7, 539-542.
- [7] Kiyanagi, T., Miyazaki, T., Kume, A., et al. (2006) Decrease in CETP activity by fenofibrate may increase LDL particle size measuredby HPLC method in patients with coronary artery disease. Atherosclerosis, 3, 559.
- [8] Rizzo, M. and Berneis, K. (2007) The clinical significance of the size of low-density-lipoproteins and the modulation of subclasses by fibrates. Current Medical Research and Opinion, 23, 1103-1111.
- [9] 郭丹杰, 徐成斌 (2008) 贝特类调脂药物在降脂领域的地位及认识. 临床药物治疗杂志, 2, l-3.
- [10] van Bilsen, M. and van Nieuwenhoven, F.A. (2010) PPARs as therapeutic targets in cardiovascular disease. Expert Opinion on Therapeutic Targets, 14, 1029-1045.
- [11] Undas, A. and Celińiska-Löwenhoff, M. (2007) Antiplatelet effects of micronized fenofibrate in subjects with dyslipidemia. Polskie Archiwum Medycyny Wewnętrznej, 117, 235-240.
- [12] Jeanpierre, E., Le Tourneau, T., Zawadzki, C., Van Belle, E., Mouquet, F., Susen, S., et al. (2009) Beneficial effects of fenofibrate on plaque thrombogenicity and plaque stability in atherosclerotic rabbits. Cardiovascular Pathology, 18, 140-147.
- [13] Tenenbaum, A., Fisman, E.Z., Boyko, V., Benderly, M., Tanne, D., Haim, M., et al. (2006) Attenuation of progression of insulin resistance in patients with coronary artery disease by bezafibrate. JAMA Internal Medicine, 166, 737-741.
- [14] 吴洁, 固旭, 李东, 丁爱忠, 戴晓阳 (2010) 降脂药苯扎贝特合成工艺改进. 中国新药杂志, 4, 311-312.
- [15] Peter, B. (1983) Process for the preparation of α-[4-(4-chlorobenzoylamin-oethyl)-phenoxy]-isobutyric acid. US Patent: 4370495.
- [16] BOEHRINGER MANNHEIM GMBH (1973) Phenoxyalkylcarbonsaured-erivate and verfahrenzur herstellung derselben. DE, 2149070.
- [17] Sashidhara, K.V., Palnati, G.R., Dodda, R.P., Sonkar, R., Khanna, A.K. and Bhatia, G. (2012) Discovery of amide based fibrates as possible antidyslipidemic and antioxidant agents. European Journal of Medicinal Chemistry, 57, 302- 310.
- [18] Sashidhara, K.V., Kumar, M., Sonkar, R., Singh, B.S., Khanna, A.K. and Bhatia, G. (2012) Indole-based fibrates as potential hypolipidemic and antiobesity agents. Journal of Medicinal Chemistry, 55, 2769-2779.
- [19] Mokale, S.N., Elgire, R.D., Sakle, N.S. and Shinde, D.B. (2012) Microwave-assisted synthesis, hypolipidemic and hypoglycemic activity of some nove l2-(4-(2-amino-6-(4-substitutedphenyl)-pyrimidin-4-yl)-phenoxy)-2-methylpropanoicacid derivatives. Archiv der Pharmazie, 345, 22-27.
- [20] Mokale, S.N., Shete, M.T., Shaikh, S.I. and Shinde, D.B. (2012) Synthesis and hypolipidemic activity of novel 2-(4-(2-amino-6-(4-substitutedphenyl) pyrimidin-4-yl)-2-substituted phenoxy) acetic acid derivatives. Chemical Biology & Drug Design, 79, 548-552.
- [21] Bandgar, B.P., Sarangdhar, R.J., Khan, F., Mookkan, J., Shetty, P. and Singh, G. (2011) Synthesis and biological evaluation of orally active hypolipidemic agents. Journal of Medicinal Chemistry, 54, 5915-5926.
- [22] Bandgar, B.P., Sarangdhar, R.J., Fruthous, K., Mookkan, J., Chaudhary, S., Chavan, H.V., et al. (2012) Synthesis and biological evaluation of ester prodrugs of Benzafibrate as orally active hypolipidemic agents. European Journal of Medicinal Chemistry, 57, 217-224.
- [23] Nemoto, H., Kamiya, M., Nakamoto, A., Matsushita, T., Matsumura, K., Hattori, H., et al. (2012) Synthesis of highly water-soluble fibrate derivatives via BGLation. Bioorganic & Medicinal Chemistry Letters, 22, 6425-6428.
- [24] Li, W., Jia, H.Y., He, X.H., Shi, W.G. and Zhong, B.H. (2012) Novel phenoxyalkylcarboxylic acid derivatives as hypolipidaemic agents. Journal of Enzyme Inhibition and Medicinal Chemistry, 27, 311-318.
- [25] Verma, A.K., Singh, H., Satyanarayana, M., Srivastava, S.P., Tiwari, P., Singh, A.B., et al. (2012) Flavone-based novel antidiabetic and antidyslipidemic agent. Journal of Medicinal Chemistry, 55, 4551-4567.
- [26] Wang, B., Tang, C., Han, Y., Guo, R.Z., Qian, H. and Huang, W.L. (2012) Synthesis and preliminary antihyperlipidemic activities evaluation of andrographolide derivatives. Medicinal Chemistry, 8, 293-298.

*通讯作者。