Studies in Synthetic Chemistry
Vol.06 No.01(2018), Article ID:23682,7
pages
10.12677/SSC.2018.61001
Design and Synthesis of Proline Hydroxylase Domain Inhibitor
Sifan Liu1, Yu Zhang2, Yang Yang3, Huan Liang2, Wenxiang Hu4*, Shuxin Li1*
*通讯作者。
1Institute of Radiation Medicine, Academy of Military Medical Sciences, Academy of Military Science PLA, Beijing
2Department of Postgraduate, Jiangxi University of Traditional Chinese Medicine, Nanchang Jiangxi
3College of Pharmacy, Guangdong Pharmaceutical University, Guangzhou Guangdong
4Jingdong Xianghu Microwave Chemistry Union Laboratory, Beijing Excalibur Space Military Academy of Medical Sciences, Beijing

Received: Jan. 7th, 2018; accepted: Jan. 29th, 2018; published: Feb. 6th, 2018

ABSTRACT
Aim: To design and synthesize new proline hydroxylase domain inhibitors. Methods: JTZ-951 is concerned as lead compound. Via Ullmann reaction, triazopyrazole compounds which can compete with endogenous 2-ketoglutarate molecules thereby inhibiting activity of proline hydroxylase are synthesized. Studies on methods of key synthetic steps are also rendered in this paper by means of control variable. Results and conclusion: 5 Target compounds were synthesized. Their structure was identified by 1H NMR, MS and elemental analysis. The literature method is greatly improved, and the synthetic route of these compounds is obtained.
Keywords:Proline Hydroxylase Domain, Proline Hydroxylase Domain Inhibitor, Triazolopyridine Compounds
三氮唑并吡啶类脯氨酸羟化酶抑制剂的 设计合成研究
刘思凡1,张宇2,杨洋3,梁欢2,胡文祥4*,李庶心1*
1军事科学院军事医学研究院辐射医学研究所,北京
2江西中医药大学研究生部,江西 南昌
3广东药科大学药学院,广东 广州
4北京神剑天军医学科学院京东祥鹄微波化学联合实验室,北京
收稿日期:2018年1月7日;录用日期:2018年1月29日;发布日期:2018年2月6日

摘 要
目的:设计并合成新的三氮唑并吡啶类脯氨酸羟化酶抑制剂。方法:以JTZ-951为先导化合物,借助乌尔曼反应等方法合成三氮唑并吡啶类化合物。该类化合物的作用机理为与内源2-酮戊二酸分子形成竞争,从而抑制脯氨酸羟化酶的活性。通过控制变量的方法对关键合成步骤进行了方法学研究。结果与结论:合成了5个化合物均未见文献报道,其结构经核磁共振氢谱、质谱、元素分析鉴定。并在参考文献合成方法的基础上,对文献方法进行较大改进,建立了这类化合物的合成路线。
关键词 :脯氨酸羟化酶,脯氨酸羟化酶抑制剂,三氮唑并吡啶类化合物

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
低氧诱导因子(hypoxia-inducible factor, HIF)是细胞中根据氧含量高低做出生物应答的关键性转录因子 [1] 。常氧条件下HIF的脯氨酸残基Pro402与Pro564易被脯氨酸羟化酶(proline hydroxylase domain, PHD)羟基化后经泛素途径降解。PHD是Fe2+、α-酮戊二酸依赖的双加氧酶,低氧条件下PHD的活性被抑制,HIF得以稳定表达 [2] 。HIF调控的下游因子有促红细胞生成蛋白(erythropoietin, EPO)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等 [3] [4] [5] ,故HIF的稳定表达有促进红细胞与血管生成的作用。本文中设计合成的化合物有抑制PHD的活性的作用,在临床上对于贫血、炎症性低氧、高原反应、辐射损伤等病症的治疗具有重大意义。α-酮戊二酸是PHD催化反应的必须协同分子,C(1)羧基氧与其α位的酮羰基氧和连接有HIF羟化位点的Fe2+发生螯合作用,C(5)羧基与PHD的Arg383残基通过盐桥相连 [6] (见图1)。本文中设计合成的三氮唑并吡啶类化合物可与体内的2-酮戊二酸分子形成竞争,从而抑制脯氨酸羟化酶的活性。设计合成的目标化合物以日本烟草公司的三氮唑并吡啶类PHD抑制剂JTZ-951为先导化合物(见图2),其抑制PHD的IC50值为100 nm/L,在Hep3B细胞中的EC50值4.9 µm/L [7] 。该化合物保留了α-酮戊二酸末端与PHD结构域结合的羧基基团,并在分子中引入了杂环替代α-酮戊二酸的酮羧基团,以求在保留对亚铁离子的螯合能力的同时增强相对于其他羟化酶的选择性。本实验期望通过对目标基团的改构,增加邻近杂原子对数目,达到功能基团多样化并改善分子疏水性与透膜能力的目的,以图获取具有更加优越的活性与药代动力学性质的目标化合物。
2. 实验部分
2.1. 仪器与试剂
熔点采用天津分析仪器厂RY-1熔点测定仪测定(温度未校正);1H-NMR谱采用日本电子株氏会社

Figure 1. Structure of 2-ketoglutaric acid and its mechanism
图1. 2-酮戊二酸结构及其作用机理
图2. 先导化合物JTZ-951 (左)与目标化合物I1~I5结构通式
JNM-ECA-400超导核磁共振仪(DMSO-d6为溶剂,TMS为内标)测定;质谱采用Agilent 1100四级杆液相色谱质谱联用仪。柱色谱用硅胶(100~200目,154~71 μm)为国药集团化学试剂有限公司生产;TLC用硅胶GF254板为青岛裕民源硅胶试剂厂生产。
2.2. 合成方法
以中间体1(合成参照文献方法 [7] [8] )为起始原料经5步得到目标化合物,其合成路线见图3,目标化合物I1~I5的实验与光谱数据见表1。
2.2.1. 中间体2a~2e合成通法,以7-苄氧基-5-(2,4-二氯苯氧基)-[1,2,4]三唑并[1,5-a] 吡啶-8-甲酸叔丁酯为例
在50 mL三口瓶中,加入1.00 g 7-苄氧基-5-碘-[1,2,4]三唑并[1,5-a]吡啶-8-甲酸叔丁酯,依次加入0.75 g碳酸钾,0.13 g氧化亚铜,0.07 g吡啶-2-甲酸,0.45 g 2,4-二氯苯酚,继而加入5 mL乙腈混合。加热体系至50˚C搅拌8 h。向体系中加入10 mL乙酸乙酯,不溶物过滤除去,滤液在减压下浓缩,残余物通过硅胶柱层析分离,所用洗脱剂为石油醚/乙酸乙酯(30/1~8/1),得淡灰白色固体0.81 g,产率87.5%,mp 135˚C~137˚C。
2.2.2. 中间体3a~3e合成通法,以7-苄氧基-5-(2,4-二氯苯氧基)-[1,2,4]三唑并[1,5-a]吡啶-8-羧酸为例
在50 mL三口瓶中,加入0.81 g 7-苄氧基-5-(2,4-二氯苯氧基)-[1,2,4]三唑并[1,5-a]吡啶-8-甲酸叔丁酯,滴加四氢呋喃/60%三氟乙酸= 1/1(体积比)混合液体4 mL,搅拌5 h。向体系中加入10 mL四氢呋喃后,加入20 mL冰水混合物。水相以二氯甲烷萃取三次,合并有机相,以饱和氯化钠溶液洗涤一次,加入无水硫酸钠干燥后过滤,滤液在减压下浓缩,得米白色固体0.53 g,产率76.1%,mp 166˚C~168˚C。
2.2.3. 中间体4a~4e合成通法,以2-(7-苄氧基-5-(2,4-二氯苯氧基)-[1,2,4]三唑并[1,5-a]吡啶-8-甲酰氨基) 乙酸乙酯为例
在50 mL三口瓶中加入0.53 g 7-苄氧基-5-(2,4-二氯苯氧基)-[1,2,4]三唑并[1,5-a]吡啶-8-羧酸,加入0.61 g甘氨酸乙酯盐酸盐,滴加2 mL N,N-二甲基甲酰胺溶解。向溶液中滴加0.89 g三乙胺与1.40 g HOBT,

Figure 3. Synthesis routine of target compounds I1~I5
图3. 目标化合物I1~I5的合成路线
Table 1. Experiment and spectral data of target compound I1~I5
表1. 目标化合物I1~I5实验与光谱数据
室温下搅拌3 h。向体系中加入10 mL水,水相以乙酸乙酯萃取三次,合并后的有机相以饱和氯化钠溶液洗涤一次,加入无水硫酸钠干燥后过滤,滤液在减压下浓缩,所得残留物通过硅胶柱层析提纯,所用洗脱剂比例为二氯甲烷/甲醇(300/1~100/1),得黄褐色固体0.56 g,产率85.4%,mp 139˚C~141˚C。
2.2.4. 中间体5a~5e合成通法,以2-(7-羟基-5-(2,4-二氯苯氧基)- [1,2,4]三唑并[1,5-a]吡啶-8-甲酰氨基) 乙酸乙酯为例
在50 mL三口瓶中,加入0.56 g 2-(7-苄氧基-5-(2,4-二氯苯氧基)-[1,2,4]三唑并[1,5-a]吡啶-8-甲酰氨基)乙酸乙酯,滴加3 mL三氟乙酸溶解,将体系加热至60˚C搅拌2 h。向体系中加入水10 mL,水相以二氯甲烷萃取三次,合并后得有机相用饱和氯化钠溶液洗涤一次,加入无水硫酸钠干燥后过滤,滤液在减压下浓缩,得褐色固体0.31 g,产率69.4%,mp 158˚C~160˚C。
2.2.5. 目标化合物I1~I5合成通法,以2-(7-羟基-5-(2,4-二氯苯氧基)-[1,2,4]三唑并[1,5-a]吡啶-8-甲酰氨基) 乙酸为例
在50 mL三口瓶中加入0.31 g 2-(7-羟基-5-(2,4-二氯苯氧基)-[1,2,4]三唑并[1,5-a]吡啶-8-甲酰氨基)乙酸乙酯,滴加1.5 mL四氢呋喃溶解,滴加2 mol/L氢氧化钠水溶液2 mL,室温搅拌3 h。将体系置于减压下浓缩,向将残余液体中滴加2 mol/L盐酸至pH < 5。析出的白色固体通过过滤分离,以乙醇打浆后过滤,得纯白色固体0.19 g,产率66.4%,mp 241˚C~242˚C。
3. 结果与讨论
3.1. 7-苄氧基-5-(2,4-二氯苯氧基)-[1,2,4]三唑并[1,5-a]吡啶-8-甲酸叔丁酯(2a)的合成中反应物当 量的的方法学考察
参照文献方法 [8] ,以三乙烯二胺、三乙胺为催化剂,相关反应式见图4。
原料(1)~(4)的摩尔比例为1:1:1.3:0.15,反应温度为25˚C,反应时间5 h,实际操作过程中发现原料基本未参与反应,后采用另一文献方法 [9] [10] 并在该方法基础上进行了改进(按原文献方法只有较少原料参与了反应),将文献方法中的催化剂铜粉改为氧化亚铜粉末,并加入了配体吡啶-2-甲酸,于80˚C下反应2 h,薄层板显示反应较完全,反应式见图5。
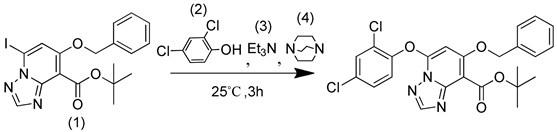
Figure 4. Reaction formula in literature method
图4. 文献方法反应式

Figure 5. The reaction of the improved method
图5. 改良方法反应式
该反应在最初采用的原料物质量比例(1):(2):(3):(4):(5) = 1:1.5:0.1:1:0.25下产率为45.6%,无法达到一个理想的转化率,故此对不同当量的Cu2O与K2CO3进行了一系列的试验,并且每个当量都进行了一次平行试验,求两次平行试验产率的平均值,得出平均产率结果见表2。
由上表可知当氧化亚铜的当量在0.3附近,碳酸钾的当量在1.0附近时,该反应达到了最大平均产率86.6%,单次反应最高产率为87.5%。未转化的反应物应及时通过柱层析分离并去除,以免影响下一步水解反应的产物纯度。
3.2. 中间体3a~3e合成中,叔丁基酯水解的方法学考察
按照文献方法 [11] ,以氢氧化钠作为催化剂在80˚C下进行叔丁基酯的水解,产物经1H-NMR鉴定后,断定为脱苄基产物,叔丁基并未脱去,证明不适合在该条件下进行脱苄反应。通过进一步查阅文献,发现叔丁基酯的水解不同于乙酯与甲酯的水解,需要在酸性条件下进行 [12] 。实验过程中初步选定的酸为盐酸,乙酸,三氟乙酸。为了测定最佳的水解酸性条件,进行了下列一系列浓度梯度试验,各个浓度进行一次平行试验,求两个平行实验产率的平均值,得出了一系列平均产率数据,见表3。
Table 2. The yield of the reaction at different reactant equivalents
表2. 不同反应物当量下的反应产率
Table 3. The yield of the reaction under different acid and solvent
表3. 不同酸与溶剂条件下反应的产率
当所用溶剂为60%三氟乙酸:四氢呋喃= 1:1时达到了最大平均产率75.0%,单次反应最高产率为76.1%。
4. 结论
本文得出的结论如下:1) 合成了5个三氮唑并吡啶类化合物,其结构均经过1H-NMR、MS鉴定。2) 本路线最适合的乌尔曼成醚反应的催化剂为Cu2O与吡啶-2-甲酸搭配,且当氧化亚铜的加入当量为0.3,碳酸钾的加入当量为1.0时,所得最大平均产率为86.6%,单次反应最高产率为87.5%。3) 叔丁基的水解反应需要在酸性条件下进行,最适宜的酸性条件为V60%三氟乙酸:V四氢呋喃= 1:1时,达到了最大平均产率75.0%,单次反应最高产率为76.1%。
基金项目
国家自然科学基金项目(No. 30973616)。
文章引用
刘思凡,张 宇,杨 洋,梁 欢,胡文祥,李庶心. 三氮唑并吡啶类脯氨酸羟化酶抑制剂的设计合成研究
Design and Synthesis of Proline Hydroxylase Domain Inhibitor[J]. 合成化学研究, 2018, 06(01): 1-7. http://dx.doi.org/10.12677/SSC.2018.61001
参考文献 (References)
- 1. Hellwig Burgel, T., Stiehl, D.P., Wagner, A.E., et al. (2005) Review: Hypoxia-Inducible Factor-1(HIF-1): A Novel Transcription Factor in Immune Reactions. Journal of Interferon and Cytokine Research, 25, 297-310. https://doi.org/10.1089/jir.2005.25.297
- 2. Paolo, S., Maria, G.D. and Angelo, G.G. (1998) Nitrolysis of Carboxylic T-Butyl and 1-Adamanty Esters. Tetrahedron Letters, 87, 9255-9258.
- 3. Tian, Y.M., Mole, D.R., Ratcliffe, P.J., et al. (2006) Characterization of Different Isoforms of the HIF Prolyl Hydroxylase PHD1 Generated by Alternative Initiation. Biochemical Journal, 397, 179-186. https://doi.org/10.1042/BJ20051996
- 4. Wang, X.J. and Si, L.B. (2013) Advances on Hypoxia Induciblefactor-1. Chinese Medical Journal, 126, 3567-3571.
- 5. Nallamshetty, S., Chan, S.Y. and Loscalzo, J. (2013) Hypoxia: Amaster Regulator of microRNA Biogenesis and Activity. Free Radical Biology & Medicine, 64, 20-30. https://doi.org/10.1016/j.freeradbiomed.2013.05.022
- 6. Mace, T.A., Collins, A.L., Wojcik, S.E., et al. (2013) Hypoxia Induces the Overexpression of Microrna-21 in Pancreatic Cancer Cells. Journal of Surgical Research, 184, 855-860. https://doi.org/10.1016/j.jss.2013.04.061
- 7. Rabinowitz, M.H. (2013) Inhibition of Hypoxia-Inducible Factor Prolyl Hydroxylase Domain Oxygen Sensors: Tricking the Body into Mounting Orchestrated Survival and Repair Responses. Journal of Medicinal Chemistry, 56, 9369- 9402. https://doi.org/10.1021/jm400386j
- 8. Mitani, I., Ogoshi, Y., Matsui, T., et al. (2011) Triazolopyridine Compound, and Action thereof as Prolyl Hydroxylase Inhibitors and Erytheropoietin Production Inducer. WO, 2011007856.
- 9. 沈阳三生制药股份有限公司. 被芳氧基取代的5-羟基-1,7-萘啶化合物其制备方法及制药用途[P]. 中国专利, 06146490 A, 2016.
- 10. Cristau, HJ, Pascal, P.C., Samy, H., et al. (2004) A General and Mild Ullmann-Type Synthesis of Diaryl Ethers. Organic Letters, 6, 913-916. https://doi.org/10.1021/ol036290g
- 11. Dangelo, N.D., Peterson, J.J., Booker, S.K., et al. (2006) Effect of Microwave Heating on Ullmann-Type Heterocycle-Aryl Ether Synthesis Using Chloro-Heterocycles. Tetrahedron Letters, 47, 5045-5048. https://doi.org/10.1016/j.tetlet.2006.05.103
- 12. Filali, E., Lloyd-Jones, G.C. and Sale, D.A. (2009) Cleavage of Tert-Butyl Benzoates with NaH in DMF: Comments on the Mechanism Anda Simple and Safe Alternative Procedure. Synlett, 10, 205-208.
