Advances in Analytical Chemistry
Vol.
13
No.
04
(
2023
), Article ID:
75086
,
18
pages
10.12677/AAC.2023.134052
过渡金属基电催化材料的研究进展
陈俊伊,汤艳峰*
南通大学化学化工学院,江苏 南通
收稿日期:2023年7月21日;录用日期:2023年11月6日;发布日期:2023年11月10日

摘要
电化学水分解是一项很有前景的可持续制氢技术,电催化剂对于加速缓慢的析氢和析氧反应(HER 和 OER)至关重要。过渡金属基电催化剂因其资源丰富、成本低以及与贵金属相当的催化性能而引起了极大的兴趣。在这些研究中,镍、钴、铁基材料具有独特的优势,如丰富的活性位点、高活性表面积和快速的电子传输。本文介绍了过渡金属基复合材料在电解水领域的研究进展。
关键词
过渡金属,析氢反应,析氧反应,高活性,高稳定性

Research Progress of Transition Metal-Based Electrocatalytic Materials
Junyi Chen, Yanfeng Tang*
College of Chemistry and Chemical Engineering, Nantong University, Nantong Jiangsu
Received: Jul. 21st, 2023; accepted: Nov. 6th, 2023; published: Nov. 10th, 2023

ABSTRACT
Electrochemical water decomposition is a promising technology for sustainable hydrogen production, and electrocatalysts are very important to accelerate the slow hydrogen evolution and oxygen evolution reaction (HER and OER). Transition metal-based electrocatalysts have attracted great interest because of their abundant resources, low cost, and catalytic performance comparable to precious metals. In these studies, nickel, cobalt, and iron-based materials have demonstrated distinctive advantages, such as abundant active sites, high surface area activity, and rapid electron transfer. This paper presents the research progress of transition metal-based composite materials in the field of electrolysis of water.
Keywords:Transition Metal, HER, OER, High Activity, High Stability

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
自从伏打电池发明以来,科学界已经研究了一个多世纪从水中产生能量的想法。多年来,人们发明了不同的方法来分解水分子并产生氢气(H2),这最终被称为“未来的燃料”。电催化分解水显然是首选技术,其次是热分解和光催化分解水。在这些技术中,光催化分解水似乎是最可持续的技术,但基于光催化系统的工业技术仍然是一个遥远的梦想,主要是因为它们固有的低太阳能到氢气(STH)的转换效率 [1] [2] [3] 。在这种情况下,电催化分解水的重要性成倍增加,因为它可以与间歇性可再生能源(太阳能、风能、潮汐能)相结合,并为我们的能源需求提供可行的解决方案 [4] 。尽管电催化分水技术是一项普遍的技术,但由于存在几个瓶颈,还没有实现全球规模的电催化水分解,但这与转换效率无关,就像光催化一样。
电化学分解水过程涉及两个半反应:阴极的析氢反应(HER)和阳极的析氧反应(OER),这两个反应涉及多个电荷和质子转移步骤,导致整个水电解过程缓慢 [5] 。电催化剂用于提高这些半反应的速率,并促进水的电解过程。因此,迫切需要为HER和OER设计高效、长寿命的催化剂。
Pt基催化剂和Ru或Ir的氧化物分别是HER和OER的最佳选择电催化剂 [5] [6] 。然而,高昂的成本和较低的丰度大大限制了它们的商业应用。在过去的几十年里,研究人员试图以两种方式提高电催化剂的性价比:(1) 通过最小化电催化剂中的贵金属负载;(2) 开发非贵金属的电催化剂 [7] 。通过设计不同的结构特征,将电催化剂中的贵金属含量降至最低 [8] [9] [10] 。近年来,最吸引人的研究领域与非贵金属电催化剂的开发有关。与元素周期表中的其他元素相比,过渡金属(特别是第一行)的自然丰度较高。因此,人们在低成本和稳定的过渡金属(TM)基材料的开发上付出了大量努力,以提高其电化学活性 [11] [12] [13] 。其中一些催化剂为HER和OER提供了极其优异的性能,甚至可以与贵金属基催化剂相媲美。作为贵金属基电催化剂的可行替代品,过渡金属基电催化剂显示出巨大的应用前景 [14] [15] [16] 。
2. 电解水反应及其机理概述
2.1. 电解水反应机理
通过电流将水分解成氢和氧的过程称为电化学水分解。像其他电化学反应一样,水分解过程也可以细分为两个半电池反应。还原反应即HER发生在阴极,而OER即氧化反应,发生在阳极 [17] 。H2O分解为H2和O2在不同pH的溶液中机理不同,在酸性环境下虽然性能较好,但是催化剂因为容易中毒而寿命较少,中性环境下虽然稳定性较好,但是溶液离子较少性能较差,所以我们一般采用碱性环境研究催化剂的性能,可以表示如下:
阴极:
阳极:
无论在何种电解质介质中,催化剂都必须具有某些特性,使其适合催化HER和OER。
2.2. 析氢反应机理
在碱性和酸性介质中,电化学HER过程有不同的反应机理。在碱性和酸性介质中,第一步都是Volmer反应,即电化学吸附。当电子通过外部电路到达电极表面(M)时,溶液中的质子可以被捕获并吸附到电极表面,形成吸附的氢(Hads)。在酸性介质中,吸附的质子是存在于溶液中的H+。然而,Hads是通过在碱性溶液中吸附的水分子释放出OH−而形成的。第二步包括Heyrovsky反应和Tafel反应,即H2的生成。在Hads覆盖率较低的情况下,Hads将结合一个来自外电路的电子和一个存在于溶液中的质子形成H2,这就是Heyrovsky反应。如果第一步(Volmer反应)进行得很快,催化剂表面有更多的Hads,两个相邻的Hads原子将结合生成H2分子,这就是Tafel反应。反应过程显示在下面的基本步骤中。
在碱性或中性介质中:
Volmer步骤
Tafel步骤
Heyrovsky步骤
在酸性介质中:
Volmer步骤
Tafel步骤
Heyrovsky步骤
任何一种材料要成为好的HER催化剂,都应具备如下基本特征:a) 具有最佳电子密度的大量活性位点,从而与吸附的氢原子形成中等的键合强度(Sabatier原理) [18] ,进而不阻碍吸附或脱附过程,b) 界面以及与底层电极材料之间的低电荷转移阻力,c) 在电解质介质中的稳定性。氢吸附的吉布斯自由能变化(ΔGH*)反映了H*吸附和H2脱附行为,是预测HER催化剂催化活性的重要参数。ΔGH*接近于零,表明氢原子不仅容易吸附在催化剂表面,而且可以脱附释放出H2分子。一般来说吸附氢原子吉布斯自由能不应该太高或太低,越接近于零则催化性能越好。从图中可知,贵金属催化剂的析氢性能最好。比如Pt的氢吸附吉布斯自由能接近于0。对于过渡金属而言,当吉布斯自由能小于零时,催化剂与氢的结合能更大,但是结合能过大不利于氢气的脱附,进而可能会使催化活性位点中毒;当吉布斯自由能大于零时,催化剂与氢的结合力变弱,从而需要更大的能量来驱动反应,也会影响整体的催化效率。
基于这些参数,可以方便地解释各种电催化剂性能背后的基本原理。例如,Pt极高的HER性能主要归因于其最佳的氢键强度,因为它位于火山图的顶端(图1) [19] [20] 。而对于贵金属,通过减小颗粒尺寸、以多孔结构来增加表面积、与过渡金属结合以增加贵金属原子的分散、设计核壳结构使贵金属原子暴露在壳层上等方法,在提高HER性能方面取得了显著进展。而根据ΔGH*的火山图,Fe−、Co−和Ni基电催化剂是代替Pt催化剂的最有前途的HER催化剂。同样,属于硫化物(TMSs)家族的电催化剂如MoS2,由于MoS2平面的Mo边缘有高活性的硫原子而表现出HER活性(图2) [21] [22] 。对于磷化物(Ni,Co和Mo基),较高的HER活性归因于“系综效应”(也称为“配体效应”) [23] [24] ,其中带正电荷的金属中心(Mδ+)充当氢化物受体,而带负电荷的磷中心(Pδ−)充当质子受体,从而促进了HER的活性。对于氮化物,带负电荷的氮原子插入到TMs中会使金属晶格扩展,金属的d带变宽,从而增加了d带的收缩和费米能级附近的态密度(DOS)。DOS的重新分布有利于改变TMNs的电子结构,使其类似于贵金属如Pt和Pd的电子结构,以促进HER的活性。而对于非贵金属,构造特定的形貌以暴露大量的表面活性位点,与导电体相结合,加速电子和离子的传输,从而减少动力学反应障碍,与碳以外的其他材料偶联形成异质结构或异质界面,协同促进HER动力学,掺杂异质原子,调整电子构型,优化催化剂表面的氢吸附/解吸热力学。对于过渡金属催化剂是通过非金属元素掺杂来调整电子结构,提高g-C3N4和石墨烯的HER活性。

Figure 1. The volcanic curves of HER on different metals indicate the relationship between observed exchange current density and hydrogen bond adsorption strength (ΔGH*) [19]
图1. HER在不同金属上的火山曲线图,表明观察到的交换电流密度与氢键吸附强度(ΔGH*)之间的关系 [19]

Figure 2. Model of MoS2 nanoribbons, with the exposed Mo edge on the right side covered by sulfur monomers [22]
图2. MoS2纳米条带的模型,其右侧暴露的Mo边缘被硫单体覆盖 [22]
2.3. 析氧反应机理
与HER相比,OER涉及的四电子过程需要更高的过电势来加速复杂而缓慢的反应。在酸性和碱性条件下,许多研究人员提出了几种可能的OER反应机理。大多数反应机理包括相同的中间体MOH和MO,其中M代表催化活性中心。在不同的介质中,主要的区别取决于O2的形成 [25] [26] [27] 。在碱性溶液中,O2是通过羟基的氧化形成的,而在酸性溶液中,O2的形成是水分子的氧化。反应过程显示在下面的基本步骤中。
在碱性和中性介质中 [28] :
在酸性介质中:
如图3(a)所示,首先,OH−在碱性介质中被吸附在活性位M的表面,变成M-OH并失去e−。M-OH与OH‒反应生成另一种含氧中间体(M-O)。M-O产生O2有两条路径:1) O2直接由M-O产生,并且活性位再次暴露(绿色路径)。2) M-O与OH−结合并失去e−生成M–OOH,然后M-OOH与OH结合并分解成O2 [31] 。
结果表明,吉布斯自由反应能(ΔG)的变化等于两连续中间体的化学吸附能之差。为了最大限度地减少电极过电位,整个反应必须是放热的(即ΔG必须是负的)。如图3(b)所示,在该过程中,每个反应都需要克服一定的吉布斯自由能 [32] ,由ΔG3可知,第三步(OOH*的形成)显示出最大的能量差,这被认为对真实催化剂的性能不利 [29] 。事实上,在标准条件下水电解所需的理论电压为1.23 V。然而,考虑到前面所述的吉布斯自由能和电阻,实际电解水所需的电压肯定高于1.23 V (理论电压)。实际电压与理论电压之差被称为过电位 [30] 。
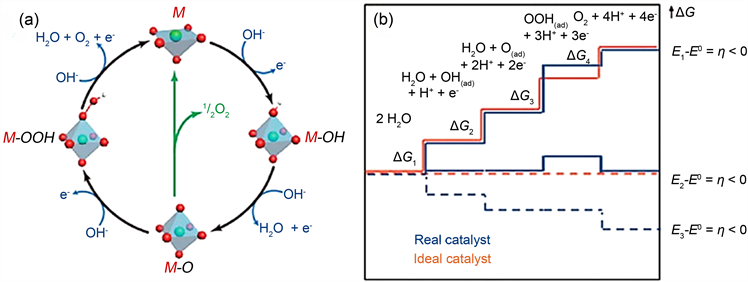
Figure 3. (a) Schematic diagram of alkaline OER mechanism, where M represents metal [31] ; (b) Gibbs free energy diagram and reaction coordination diagram of OER [32]
图3. (a) 碱性OER机理的示意图,M代表金属 [31] ;(b) OER的吉布斯自由能图与反应配位的关系图 [32]
图4中有不同催化剂的火山图。Sabatier原理是火山图的基础。它表明了快速反应的可能性,即中间体结合到催化剂的活性位点上既不太强也不太脆弱 [33] 。从图中可以看出,在火山图的峰值,存在具有最小理论超电势的贵金属(例如,IrO2、RuO2)。从火山图中的数据可以观察到,第一行过渡金属化合物,如镍、钴和铁基材料,也是适用OER催化剂的高效选择。它具有多价氧化态(M2+/3+/4+;M = 金属原子的活性中心),这有助于它们具有突出的OER活性。钴基催化剂相应的催化活性中心是M4+物种,而铁基和镍基催化剂的活性中心是M3+物种。此外,氧的组成、形态和表面结合能也会影响OER性能。

Figure 4. Volcanic maps of different binary oxides, all values measured at room temperature at pH = 14 [33]
图4. 不同二元氧化物的火山图,所有值都是在室温下,当pH = 14时测量的 [33]
3. 催化剂的电化学性能评价标准
3.1. 质量负载
增加催化剂的量可以提高活性位点的数量,从而提高催化性能。一些报告,特别是涉及多孔基底使用了1 mg cm−2 [34] 或超过10 mg cm−2 [35] 的催化剂负载量,这意味着过电位要低得多(OER < 200 mV)。然而,如此高的催化剂负载量并没有什么用处,因为当扩大规模时,它们不能提供具有成本效益的解决方案。商用水电解槽采用低至0.25 mg cm−2 [36] 的催化剂负载量,因此报告的数据必须对应较低的负载量,通常在0.1~0.5 mg cm−2的范围内。
3.2. 过电位
过电位(η)是评价催化剂电化学活性最重要的参数。为了加速HER和OER,与可逆电势相比,必须施加比可逆电位更高的电位(定义为过电位)来克服固有的反应势垒和阻力。因此,HER和OER的过电位方程可以描述为:ηHER = EHER−0 V,ηOER = EOER−1.23 V,0 V和1.23 V分别是HER和OER的可逆电位。η10是电流密度为10 mA cm−2下的过电位,它是比较不同电催化剂活性的基准。对于高负载量的材料,常用η50和η100来描述HER和OER的活性。
3.3. Tafel斜率
Tafel斜率描述了过电位(η)和电流密度(j)之间的关系,由Tafel方程给出:
(1-21)
在上式中,b代表塔菲尔斜率。对HER来说,Tafel斜率可以预测电化学过程的内在机制,较低的Tafel斜率可以反映电催化界面上更快的电荷转移。然而,OER涉及四个电子转移和许多中间步骤,比HER更复杂,Tafel斜率很难准确地预测这一机制。除了Tafel斜率之外,还可以从η = 0时的Tafel方程得到交换电流密度(j0),这也可以反映电催化剂用于水分解的动力学行为。
3.4. 转换频率(TOF)
转换频率定义为每单位时间在每个催化活性位点上转化为所需产物的反应物的数量,它可以反映每个催化位点的电化学反应速率。TOF可以通过下式计算: 式中,j为特定过电位处的电流密度,A为工作电极的表面积,α指转移到所需分子的电子数(αH2 = 2,αO2 = 4),F为法拉第常数(96,485 C mol−1),n是活性物质的摩尔数。
3.5. 稳定性
材料的稳定性是衡量其实际应用潜力的关键因素。有两种评价电催化剂稳定性的技术:连续循环伏安法(CV)和计时电位法或计时电流法。第一种方法是通过比较多次CV循环前后的线性扫描伏安法(LSV)曲线来进行的。计时电位法或计时电流法可以反映催化剂在恒定的电流密度或电位下是否能够长期保持活性。
4. 催化剂的性能优化策略
4.1. 异质结构的构筑
异质结构形成是一种广泛采用的提高电催化剂效率和稳定性的策略。两种或多种过渡金属基材料之间的杂化协同增强了它们各自的催化活性 [37] [38] [39] [40] [41] 。通过将一种对HER有活性的材料和另一种对OER有活性的材料结合起来,实现了对整体水分解的双功能活性 [40] [41] 。当材料与碳质材料形成异质结构时,其活性位点的数量和操作稳定性都会增加 [42] [43] 。
将电催化剂与含碳材料杂化是提高电催化剂活性和稳定性的一种常见策略 [42] 。例如,Liu等人 [43] 利用N和S共掺杂的rGO作为衬底,在其上垂直生长Co9S8纳米片,异质结中掺杂的rGO有助于获得更多的活性位,并促进电荷传输过程。结果表明异质结构对OER具有较高的活性,对HER具有中等活性。Jiao等人 [44] 以ZIF-67/rGO复合材料为原料,通过热解和磷化工艺制备了层状CoP/rGO异质结构,所衍生的CoP是多孔的,为催化提供了丰富的活性位点。由于CoP和rGO之间的成功耦合,异质结构表现了优异的导电性和稳定性。因此,异质结构在整体水分解方面表现出优异的双功能电催化活性。
4.2. 形态调控
形态调控是在各个方面提高电催化剂效率的有效策略。现在已经有人开始对电催化剂的形态进行调节,以克服由于电极上形成气泡而导致的电位下降,随着电催化剂表面粗糙度和亲水性的增加,这一问题变得容易解决了 [45] 。调节电催化剂的形态可以调节电催化活性位点的数量和电荷转移效率 [46] 。一种材料的不同晶面表现出不同的电催化活性,而形态调节有助于暴露出特别需要的晶面 [47] [48] ,同样纳米尺寸的形貌可以增加材料的体积与表面积之比,进而增强其电催化活性 [49] 。
在水电解过程中,电极上产生的气泡是一个严重的问题,尤其是在过电位较高的情况下,会导致显著的电压下降。Ahn等人 [45] 发现形貌调控技术可用于增强Ni催化剂的亲水性,他们通过改变电沉积参数调节了Ni催化剂的形态(图5(a)~(d)),材料的亲水性和OER活性都随着表面粗糙度的增加而增加(图5(e))。与其他形态相比,具有层次化针状形态的Ni催化剂的氧气泡脱离过程最快。因此,在具有分层形态的Ni催化剂中,OER催化活性的衰减速度是最低的。Silva等人 [50] 发现表面粗糙度对NiO的OER催化活性也有积极的影响。一维(1D)NiO中空纳米纤维(NiO-NFBs)的表面粗糙度更高,与三维(3D)纳米颗粒(NiO-NPTs)相比,表现出更好的活性。催化剂的电催化活性可以通过在一定限度内增加其表面粗糙度来增强,因为表面粗糙度的增加提高了材料的表面积和润湿性。然而,在某一极限之后,这将暴露材料的不同晶面,这些晶面可能具有催化活性,也可能不具有催化活性。因此,更大程度地提高表面粗糙度会导致疏水性,这将对其催化活性产生不利影响 [51] 。随着表面粗糙度的增加,电催化活性增强的可能性适用于大多数电催化剂,因为这些催化剂本质上是亲水的 [52] 。然而,对于不同的电催化剂,上述调节范围会有所不同。电催化活性通常随着晶粒尺寸的减小而增加,然而,较高的表面能导致纳米粒子在电化学反应过程中发生团聚,这反过来降低了NiO-NPTs的催化活性。另一方面,具有中空结构的NiO-NFBs具有更高的电化学活性表面积(ECSA),这有利于质量和垂直电荷的传输。

Figure 5. Scanning electron microscope (SEM) images of Ni catalysts with different morphologies [45] : (a) Flat, (b) Smooth, (c) Cauliflower like and (d) Needle like; (e) Surface tension of water droplets on different nickel catalysts relative to corresponding contact angles (see illustration)
图5. 不同形貌Ni催化剂的扫描电子显微镜(SEM)图像 [45] :(a) 扁平,(b) 光滑,(c) 花椰菜状和(d) 针状;(e) 水滴在不同镍催化剂上相对于相应接触角的表面张力(见插图)
4.3. 元素掺杂
元素掺杂可以有效地调节材料的内在电子结构,从而影响其基底的吸附能力和电催化活性 [53] 。在材料中掺杂外来元素会产生晶格缺陷,这也可以显著调节其电催化活性。除此之外,缺陷的引入增加了电催化剂中可用的电催化活性中心的数量 [54] 。非金属掺杂剂可以增强电催化剂的导电性,其电负性起着重要作用 [55] [56] 。三维过渡金属掺杂剂可以显著提高组成金属在电催化剂中的氧化态,从而促进OER催化活性 [57] 。然而,双元素而不是单元素的掺杂为调节电催化剂的活性提供了巨大的空间,所以应该非常谨慎地选择掺杂剂 [58] [59] [60] [61] 。
不同种类的金属原子可以用作掺杂剂来提高非贵金属电催化剂的效率。Dong等人 [62] 通过溶剂热反应和退火制备出了具有晶界缺陷的二维Fe掺杂NiO纳米片。Fe掺杂剂调节了NiO中Ni的电子态,边界缺陷促进了传质过程。掺杂剂浓度的变化可以调节NiO的OER催化活性,其中NiFe0.1O的催化活性最好。操作技术有助于理解电催化剂活性增强背后的确切原因。Qiu等人 [57] 采用化学浴沉积法制备了在NF上掺杂Fe的NiO,与未掺杂的NiO相比,其显示出优异的双功能电催化活性。电催化剂中Fe和Ni的存在协同促进了催化活性氢氧化物相的形成过程。此外,Fe掺杂使NiO的功函数减小,从而提高了其催化活性。拉曼光谱表明,掺Fe的NiO在OER过程中转化为含γ-NiOOH的Ni4+,相反,未掺杂的NiO被转化成含有β-NiOOH的Ni3+。Fe掺杂提高了NiO的电荷传输效率,这有助于其实现优异的双功能活性。
4.4. 缺陷工程
上一节的讨论表明,任何材料掺杂异质元素掺杂都可能引起缺陷。这些缺陷位点增加了催化活性位点的数量,并促进了传质过程。在没有杂原子掺杂的情况下,也可以在材料的晶格中产生缺陷。很少有物理化学方法,如离子辐射、紫外线臭氧处理、碱蚀刻等被用于在非贵金属的电催化剂中引入和设计缺陷 [63] [64] [65] 。因此,缺陷工程可被视为提高非贵金属电催化剂电催化活性的主要策略之一。
Zhao等人 [66] 采用原位水热法在NF上生长了由两个单层组成的δ-MnO2纳米片(NS-MnO2)。物化分析证实了NS-MnO2中存在氧空位,这产生了配位不饱和的Mn3+位点。NS-MnO2提供了大量的电催化活性位点,并具有优异的导电性。密度泛函理论(DFT)计算表明,氧空位促进了H2O的吸附过程,配位不饱和的Mn3+位使δ-MnO2具有半金属性质。因此,NS-MnO2对HER和OER都表现出优异的双功能催化活性。Su等人 [67] 采用水热法在酸处理的炭黑上制备了富缺陷的Co3O4纳米结构。Co3O4纳米结构中的缺陷密度可以通过简单地改变水热反应的时间来调节。反应3 h后得到的Co3O4立方体(Co3O4-3h)的氧缺陷密度和Co2+/Co3+比值最高。Co3O4-3h中氧空位的相对密度为8.5原子%。在所有合成的纳米结构中,Co3O4-3h表现出优异的OER催化活性。水热反应会导致电催化剂中的缺陷,这种缺陷可以通过增加反应时间来增加,但缺陷的百分比不能相应地调节。从金属氧化物中除去像O这样的电负性元素会增加较低氧化态的金属含量,金属价态的这种变化会使电子密度向金属氧化物的EF方向移动,使其导电性增加。
4.5. 其他策略
除了上述讨论的主要策略之外,最近还采用了一些新技术来提高非贵金属电催化剂的活性。值得一提的策略是:(1) 电化学活化,(2) 表面功能化和(3) 单原子锚定 [68] [69] [70] [71] [72] 。尽管最近的研究很少采用这些新的策略,但研究者们仍需要进行大量实验才能确定其可行性。
5. 非贵金属电解水催化剂的最新进展
5.1. 过渡金属硼化物
作为一类金属间无机物,过渡金属硼化物(TMBs)具有特殊的化学和物理性质,包括高导电性、高硬度以及在酸性和碱性介质中良好的耐腐蚀性。最近,随着电化学水分解研究兴趣的增加,TMBs开始获得更多的关注,并对HER和OER显示出可调的催化活性。TMBs的催化活性受金属和硼之间的电子转移影响,电子转移调节电子结构并改变表面性质,从而调节催化过程中涉及的反应能垒。迄今为止,人们已经开发了多种策略来优化TMBs的催化活性,例如组分调节(包括硼含量和金属种类/含量)、结晶度调节和纳米结构构建。
在已报道的硼化物中,贵金属基硼化物表现出优异的HER催化性能,甚至超过了Pt/C,例如Pd2B、PdB、RuB、ReB、RuB2和OSB2 [73] [74] 。然而,TMBs的催化活性有限。研究人员已经开发了一些有效的策略来提高非贵金属基TMBs固有的HER催化活性,如结晶度工程、组分调控、纳米结构控制、界面构建等。例如,Zeng等人 [75] 通过化学镀法合成了平均直径约为80 nm的非晶态Ni-B纳米颗粒(图6(a),图6(b))。X射线光电子能谱(XPS)分析表明,Ni/B为2.7:1,电子从B向Ni转移。在1 M HClO4电解液中,合成的Ni-B具有较低的η20,为123 mV。Xu等人 [76] 构建了具有大量晶态–非晶态相边界的Ni-ZIF/Ni-B超薄纳米片阵列。HER过程的DFT计算结果表明,与Ni-ZIF和Ni-B相比,Ni-ZIF/Ni-B催化剂具有更优的ΔGH*,接近于零。得益于结构上的优势,Ni-ZIF/Ni-B对HER的η10仅为67 mV。
最近,TMBs也被报道为OER的有效催化剂。众所周知,与过渡金属硫化物(TMSs)和过渡金属磷化物(TMPs)类似,TMBs也是一类容易氧化的化合物,因此其组成和电子结构在OER过程中会发生变化。例如,Guo等人 [77] 以非晶态的硼粉作为硼源,通过高温处理对一系列金属箔(镍、钴、铁、镍铁合金和SUS 304钢)进行了硼化处理(图7(a))。对硼化金属箔的电化学OER性能进行了评估,并与1 M KOH中相应金属相的性能进行了比较。如图7(b)所示,所有硼化单金属箔的OER性能均优于金属箔,并且硼化的镍箔催化活性最好。这些结果证明硼化是提高金属OER催化活性的有效方法。

Figure 6. (a) SEM images and (b) TEM images of amorphous Ni-B; The illustration shows the corresponding SAED pattern [75]
图6. (a) 非晶态Ni-B的SEM图像和(b) TEM图像;插图显示了相应的SAED图案 [75]
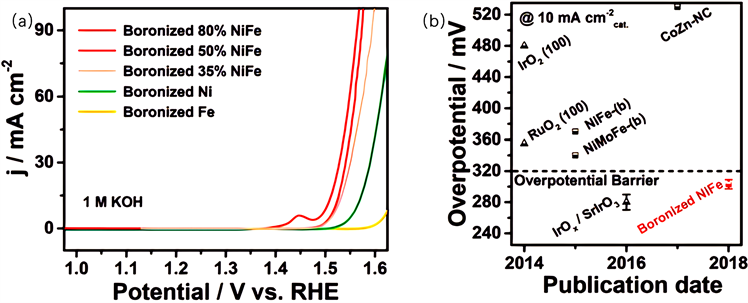
Figure 7. (a) LSV curves in 1 M KOH solution with a scan rate of 1 mV s−1 for various boronized metal sheets including Ni, Fe and NiFe alloys. (b) Comparison of intrinsic catalytic activities towards the OER between the boronized 80% NiFe sheets and some representative oxygen evolution electrocatalysts reported recently. Triangles and squares represent the overpotentials at 10 mA cmcatalyst−2 current density, which are normalized to the catalyst’s AFM scan area and electrochemical active surface area, respectively [77]
图7. (a) 在1 M KOH溶液中扫描速率为1 mV s−1的各种渗硼金属板(包括Ni、Fe和NiFe合金)的LSV曲线。(b) 硼化80% NiFe片材与最近报道的几种有代表性的析氧电催化剂对OER的本征催化活性比较。三角形和正方形分别表示10 mA cmcatalyst−2电流密度下的过电位,它们分别归一化为催化剂的AFM扫描面积和电化学活性表面积 [77]
5.2. 过渡金属磷化物
由于金属和磷化物的协同作用,TMPs正越来越多地通过各种技术开发出来,实现了高效率的水电解,这些材料中的大多数涉及基于铁基、钴基和镍基磷化物,并且它们的合金形式已被证明可以通过改变组成有效地提高电解性能。在OER的情况下,众所周知,当M2+与OH*中间体的相互作用减弱时,过渡金属氧化物(TMOs)能够提高性能 [28] 。这主要归因于金属d带和配位氧p带(3d-2p)之间的斥力增强。然而,TMPs作为OER催化剂并不是很有前途,由于位于金属原子附近的电负性P原子阻碍了反应中间体OH*的配位,从而阻碍了OER [78] 。取而代之的是,TMPs已经被用作预催化剂,在阳极条件下形成具有OER活性的金属–氧/羟基物种。相比之下,TMPs已被证明是用于HER的良好催化剂。带负电荷的P原子和带正电荷的金属原子分别作为质子和阴离子的受体。因此,两者都影响在碱性/酸性条件下协同促进HER的整体效应。此外,发现在适当范围内增加P原子含量对增强HER活性更有效。此后,人们对P作为HER的催化剂的作用进行了大量的研究。最近,Shin等人 [79] 设计了一种合成工艺,在保持晶体结构的同时获得了不同Fe-Ni组成的FexNi2-xP纳米催化剂。这项工作证明了TMPs的合金化效应,不包括结构效应,在各种FexNi2-xP纳米催化剂中(图8(a)),Fe0.5Ni1.5P纳米催化剂需要的η50为163 mV,Tafel斜率为65 mV dec−1。XPS分析表明,在FexNi2-xP的P原子中,Fe0.5Ni1.5P中的P原子表现出最缺电子的特征(图8(b))。通过EXAFS分析发现,Fe0.5Ni1.5P中高度有序的M-M (Ni-M,Fe-M)键和无序的Ni-P键导致P的电负性降低,从而显著改善了HER动力学(图8(c))。因此,P的最佳电子分布对于提高HER性能具有重要意义 [80] 。然而,目前开发的TMP电催化剂的HER性能还没有达到工业水平,人们正在努力设计新的催化剂模型来进一步提高HER性能。
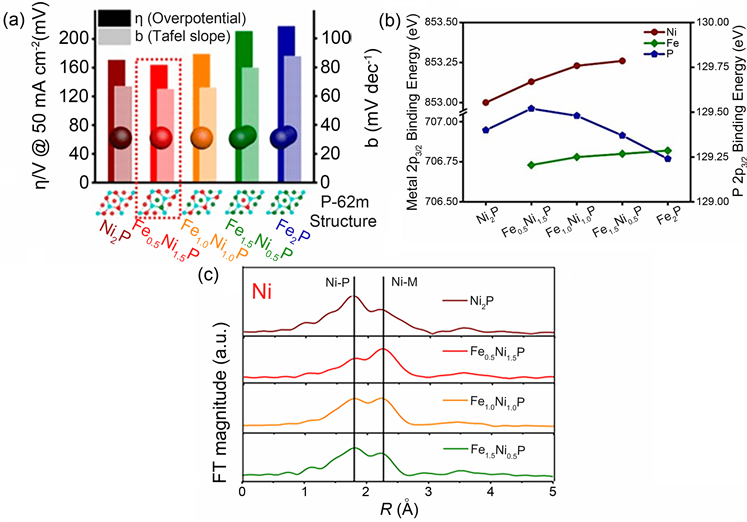
Figure 8. (a) Ni2P (grape wine color), Fe0.5Ni1.5P (red), Fe1.0Ni1.0P (orange), Fe1.5Ni0.5P (green), and Fe2P (blue) nanocatalysts at j = 50 mA cm−2 a rectangular diagram of b and η; (b) XANES spectrum of FexNi2-xP nano catalyst: Binding energy of Ni 2p, Fe 2p and P 2p in FexNi2-xP nano catalyst; (c) Fourier Transform of Ni K Edge and Fe K Edge EXAFS Spectra in FexNi2-xP Nanocatalysts [79]
图8. (a) Ni2P (葡萄酒色),Fe0.5Ni1.5P (红色),Fe1.0Ni1.0P (橙色),Fe1.5Ni0.5P (绿色)和Fe2P (蓝色)纳米催化剂在j = 50 mA cm−2时b和η的矩形图;(b) FexNi2-xP纳米催化剂的XANES光谱:FexNi2-xP纳米催化剂中Ni 2p,Fe 2p和P 2p的结合能;(c) FexNi2-xP纳米催化剂中Ni K边和Fe K边EXAFS光谱的傅里叶变换 [79]
5.3. 过渡金属硫化物
由于其独特的物理和化学性质,TMSs已被广泛开发为潜在的电解水催化剂(如图9(a),图9(b)) [78] [81] [82] 。与TMOs相比,TMSs通常具有较高的电导率,这是由于其价带和导带之间的带隙很小。更令人印象深刻的是,二维层状MS2 (M = Mo,W)具有丰富的暴露着的活性位点和适中的氢原子吸附能,使得HER具有显著的电催化性能。另一类TMSs,即非层状MxSy (M = Fe,Ni,Co等),由于它们具有高电导率、快速电荷转移动力学和低成本,也成为经济友好的HER催化剂。通过形貌控制、杂原子掺杂、相控制、缺陷工程和复合工程等方法可以提高这些催化剂的催化性能。
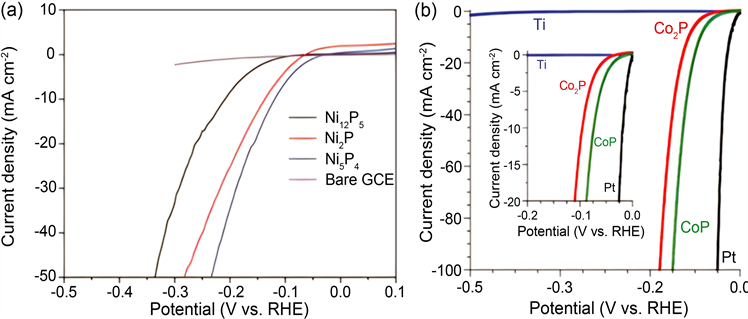
Figure 9. (a) LSV curves of bare GCE, Ni12P5, Ni2P, and Ni5P4 NCs in 0.5 m H2SO4. (b) Polarization data (plots of current density vs potential) in 0.5 m H2SO4 for Co2P/Ti and CoP/Ti electrodes [78]
图9. (a) 裸GCE、Ni12P5、Ni2P和Ni5P4 NCs在0.5 m H2SO4中的LSV曲线。(b) Co2P/Ti和CoP/Ti电极在0.5 m H2SO4中的极化数据(电流密度与电位的关系图) [78]
与HER的电催化机理相比,OER表现出不同的机理,因此提高催化性能的策略也不同。与金属氧化物相比,TMSs的热力学稳定性较低,这表明TMSs在OER的强氧化条件下很容易被氧化成相应的金属氧化物 [83] 。因此,TMSs在形成氧化物/氢氧化物表面时充当预催化剂,是实际的催化活性中心。
5.4. 过渡金属碳化物
过渡金属碳化物(TMCs)的HER性能仍然受到其表面强Hads的限制。优化TMCs的电子性质以调节Hads能量是进一步提高其HER活性的关键。因此,目前对TMCs的研究主要集中在设计具有异质结构的MC基材料(如与过渡金属化合物杂化) [84] 。TMCs也因其在高电位下具有高化学稳定性而被认为是很有前途的OER催化剂,然而,与可接受的HER活性相比,TMCs的OER活性较差,这严重限制了它们的实际应用。这主要归因于OER中间体在催化剂表面上的强吸附,导致反应中间体和产物的脱离过程缓慢。
最近,许多研究利用金属有机骨架(MOFs)作为前驱体来制备各种金属–氧化物–碳复合材料 [85] [86] [87] 。例如,Chaikittisilp等人 [86] 使用Co基MOF (沸石咪唑骨架-9 (ZIF-9))为前驱体,通过简单的碳化过程制备了纳米多孔碳–钴–氧化物杂化材料(图10)。在该过程中,金属Co纳米颗粒在惰性气氛中碳化后嵌入到纳米多孔碳网中;然后在空气中的碳化过程中Co纳米颗粒转化为Co氧化物。此外,Xiao等人 [88] 报道了一种基于电化学后处理(ECPT)的金属Co纳米球包覆超薄碳层(Co@C)的新型Co基OER电催化剂。所制备的样品具有以下三个特征:第一,原位生成的超薄碳层作为良好的导电网络,有利于电子传输,增强了OER活性;第二,金属Co核是支撑和分散Co氧化物纳米颗粒的良好的导电载体;第三,纳米尺寸的Co氧化物和超薄碳层之间的协同效应可能有助于提高OER性能。
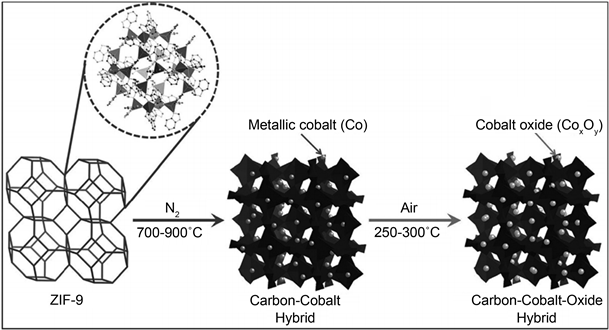
Figure 10. Schematic diagram of ZIF-9 forming carbon cobalt oxide Hybrid material after two-step heat treatment [86]
图10. ZIF-9经过两步热处理形成碳–钴–氧化物杂化材料的示意图 [86]
5.5. 过渡金属氧化物
基于第一排3D金属(Mn、Fe、Co和Ni)的TMOs由于具有高碱性稳定性、氧空位的灵活性和独特的电子分布,已被用作成熟碱性电解槽的阳极催化剂 [5] [28] 。TMOs在碱性介质中的高本征活性和稳定性使得它们甚至可以应用于技术先进且定义明确的阴离子交换膜水电解槽(AEMWE)系统。TMOs的高OER活性源于3D金属的d带和氧的p带的重叠 [28] 。这些能带结构之间的电子相互作用调节了每个中间物种和氧化物表面之间的结合能,并决定了OER速率。特别是O*和OH*之间的结合能差(ΔDGO-ΔGOH)被认为是氧化物表面OER活性的一个有用的描述 [28] 。成分和结构的优化使得各种晶体结构(如岩盐、尖晶石、层状氧化物和钙钛矿)具有最佳的ΔGO-ΔGOH和优异的OER性能 [28] [89] [90] [91] 。这些先进的TMO催化剂通常表现出优于PGM基催化剂的OER性能。
最近,TMOs也出现了有前途的HER催化剂 [12] 。由于TMOs可以拥有不同的晶体结构,它们的电子结构是灵活的。TMOs被认为是HER的非活性材料,但可以通过结构工程和改变电子结构来激活 [92] [93] [94] [95] 。这些策略,包括氧空位调节、相变和开发多金属成分,通过提高低电导率和优化氧化物表面的ΔGH来促进HER,从而生成具有各种不同晶体结构的HER活性TMO催化剂。
6. 总结与展望
电化学水分解是产生最纯氢气(99.99%)的相对方法之一。近年来,许多非贵金属已被报道并被证明适用于碱性介质中的HER和OER。镍、钴、铁这三种过渡金属因其优异的内在活性、稳定性和丰富的资源,在能量储存和转换方面得到了广泛的应用,尤其是在析氢反应中。研究表明,碳基材料、MOF、LDHs、PBAs等多种材料负载的镍、钴、铁基电催化剂的最新进展显示出良好的催化性能,然而,它们仍然面临催化活性不足和长期稳定性差的问题。综上所述,尽管基于镍、钴、铁基电催化剂的电解水性能研究已经取得了许多成果,但仍有许多挑战需要克服。镍、钴、铁基电催化剂的设计和制备,以及表征和理论算法的结合应用,将在未来促进非贵金属电催化剂的发展。
文章引用
陈俊伊,汤艳峰. 过渡金属基电催化材料的研究进展
Research Progress of Transition Metal-Based Electrocatalytic Materials[J]. 分析化学进展, 2023, 13(04): 482-499. https://doi.org/10.12677/AAC.2023.134052
参考文献
- 1. Chen, Z., Jaramillo, T.F., Deutsch, T.G., et al. (2010) Accelerating Materials Development for Photoelectrochemical Hydrogen Produc-tion: Standards for Methods, Definitions, and Reporting Protocols. Journal of Materials Research, 25, 3-16. https://doi.org/10.1557/JMR.2010.0020
- 2. Jacobsson, T.J. (2018) Photoelectrochemical Water Splitting: An Idea Heading to-wards Obsolescence? Energy & Environmental Science, 11, 1977-1979. https://doi.org/10.1039/C8EE00772A
- 3. Shwetharani, R., Sakar, M., Fernando, C.N., et al. (2019) Recent Advances and Strategies to Tailor the Energy Levels, Active Sites and Electron Mobility in Titania and Its Doped/Composite Analogues for Hydrogen Evolution in Sunlight. Catalysis Science & Technology, 9, 12-46. https://doi.org/10.1039/C8CY01395K
- 4. Vesborg, P.C.K. and Seger, B. (2015) Chorkendorff I Recent Development in Hydrogen Evolution Reaction Catalysts and Their Practical Implementation. The Journal of Physical Chemistry Letters, 6, 951-957. https://doi.org/10.1021/acs.jpclett.5b00306
- 5. She, Z.W., Kibsgaard, J., Dickens, C.F., et al. (2017) Combining Theory and Experiment in Electrocatalysis: Insights into Materials Design. Science, 355, eaad4998. https://doi.org/10.1126/science.aad4998
- 6. Lee, Y., Suntivich, J., May, K.J., et al. (2012) Synthesis and Activities of Rutile IrO2 and RuO2 Nanoparticles for Oxygen Evolution in Acid and Alkaline Solutions. The Journal of Physical Chemistry Letters, 3, 399-404. https://doi.org/10.1021/jz2016507
- 7. Du, X., Huang, J., Zhang, J., et al. (2019) Modulating Electronic Structures of Inorganic Nanomaterials for Efficient Electrocatalytic Water Splitting. Angewandte Chemie International Edition, 58, 4484-4502. https://doi.org/10.1002/anie.201810104
- 8. Zhu, C., Fu, S., Shi, Q., et al. (2017) Single-Atom Electrocatalysts. Angewandte Chemie International Edition, 56, 13944-13960. https://doi.org/10.1002/anie.201703864
- 9. Nong, H.N., Gan, L., Willinger, E., et al. (2014) IrOx Core-Shell Nanocatalysts for Cost- and Energy-Efficient Electrochemical Water Splitting. Chemical Science, 5, 2955-2963. https://doi.org/10.1039/C4SC01065E
- 10. Wang, J.X., Zhang, Y., Capuano, C.B., et al. (2015) Ultralow Charge-Transfer Resistance with Ultralow Pt Loading for Hydrogen Evolution and Oxidation Using Ru@Pt Core-Shell Nanocatalysts. Scientific Reports, 5, Article No. 12220. https://doi.org/10.1038/srep12220
- 11. Chen, Z., Duan, X., Wei, W., et al. (2020) Elec-trocatalysts for Acidic Oxygen Evolution Reaction: Achievements and Perspectives. Nano Energy, 78, Article ID: 105392. https://doi.org/10.1016/j.nanoen.2020.105392
- 12. Zhu, Y., Lin, Q., Zhong, Y., et al. (2020) Metal Oxide-Based Materials as an Emerging Family of Hydrogen Evolution Electrocatalysts. Energy & Environmental Science, 13, 3361-3392. https://doi.org/10.1039/D0EE02485F
- 13. Guo, X., Chen, C., Zhang, Y., et al. (2019) The Application of Transition Metal Co-baltites in Electrochemistry. Energy Storage Materials, 23, 439-465. https://doi.org/10.1016/j.ensm.2019.04.017
- 14. Wang, J., Yue, X., Yang, Y., et al. (2020) Earth-Abundant Transition-Metal-Based Bifunctional Catalysts for Overall Electrochemical Water Splitting: A Review. Journal of Alloys and Compounds, 819, Article ID: 153346. https://doi.org/10.1016/j.jallcom.2019.153346
- 15. Chen, Z., Duan, X., Wei, W., et al. (2019) Recent Advances in Transition Metal-Based Electrocatalysts for Alkaline Hydrogen Evolution. Journal of Materials Chemistry A, 7, 14971-15005. https://doi.org/10.1039/C9TA03220G
- 16. Yuan, N., Jiang, Q., Li, J., et al. (2020) A Review on Non-Noble Metal Based Elec-trocatalysis for the Oxygen Evolution Reaction. Arabian Journal of Chemistry, 13, 4294-4309. https://doi.org/10.1016/j.arabjc.2019.08.006
- 17. Zeng, K. and Zhang, D. (2010) Recent Progress in Alkaline Water Electrolysis for Hydrogen Production and Applications. Progress in Energy and Combustion Science, 36, 307-326. https://doi.org/10.1016/j.pecs.2009.11.002
- 18. Sabatier, P. (1911) Hydrogénations et déshydrogénations par catalyse. Berichte der deutschen chemischen Gesellschaft, 44, 1984-2001. https://doi.org/10.1002/cber.19110440303
- 19. Morales-Guio, C.G., Stern, L.-A. and Hu, X. (2014) Nanostructured Hydrotreating Catalysts for Electrochemical Hydrogen Evolution. Chemical Society Reviews, 43, 6555-6569. https://doi.org/10.1039/C3CS60468C
- 20. Trasatti, S. (1972) Work Function, Electronegativity, and Electrochemical Behaviour of Metals: III. Electrolytic Hydrogen Evolution in Acid Solutions. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 39, 163-184. https://doi.org/10.1016/S0022-0728(72)80485-6
- 21. Jaramillo, T.F., Jørgensen, K.P., Bonde, J., et al. (2007) Identification of Active Edge Sites for Electrochemical H2 Evolution from MoS2 Nanocatalysts. Science, 317, 100-102. https://doi.org/10.1126/science.1141483
- 22. Lazar, P. and Otyepka, M. (2017) Role of the Edge Properties in the Hydrogen Evolution Reaction on MoS2. Chemistry—A European Journal, 23, 4863-4869. https://doi.org/10.1002/chem.201605848
- 23. Xiao, P., Chen, W. and Wang, X. (2015) A Review of Phosphide-Based Materials for Electrocatalytic Hydrogen Evolution. Advanced Energy Materials, 5, Article ID: 1500985. https://doi.org/10.1002/aenm.201500985
- 24. Liu, P., Rodriguez, J.A., Asakura, T., et al. (2005) Desulfurization Reactions on Ni2P(001) and α-Mo2C(001) Surfaces: Complex Role of P and C Sites. The Journal of Physical Chemistry B, 109, 4575-4583. https://doi.org/10.1021/jp044301x
- 25. Zhao, S., Wang, Y., Dong, J., et al. (2016) Ultrathin Metal-Organic Framework Nanosheets for Electrocatalytic Oxygen Evolution. Nature Energy, 1, Article No. 16184. https://doi.org/10.1038/nenergy.2016.184
- 26. Liang, Y., Li, Y., Wang, H., et al. (2011) Co3O4 Nanocrystals on Graphene as a Synergistic Catalyst for Oxygen Reduction Reaction. Nature Materials, 10, 780-786. https://doi.org/10.1038/nmat3087
- 27. Cheng, F., Zhang, T., Zhang, Y., et al. (2013) Enhancing Electrocatalytic Oxygen Reduc-tion on MnO2 with Vacancies. Angewandte Chemie International Edition, 52, 2474-2477. https://doi.org/10.1002/anie.201208582
- 28. Suen, N.-T., Hung, S.-F., Quan, Q., et al. (2017) Electrocatalysis for the Oxygen Evolution Reaction: Recent Development and Future Perspectives. Chemical Society Reviews, 46, 337-365. https://doi.org/10.1039/C6CS00328A
- 29. Dang, S., Zhu, Q.-L. and Xu, Q. (2017) Nanomaterials Derived from Metal-Organic Frameworks. Nature Reviews Materials, 3, Article No. 17075. https://doi.org/10.1038/natrevmats.2017.75
- 30. Kötz, R., Neff, H. and Stucki, S. (1984) Anodic Iridium Oxide Films: XPS‐Studies of Oxidation State Changes and O2-Evolution. Journal of the Elec-trochemical Society, 131, 72. https://doi.org/10.1149/1.2115548
- 31. Cai, Z., Bu, X., Wang, P., et al. (2019) Recent Advances in Layered Double Hydroxide Electrocatalysts for the Oxygen Evolution Reaction. Journal of Materials Chemistry A, 7, 5069-5089. https://doi.org/10.1039/C8TA11273H
- 32. Dau, H., Limberg, C., Reier, T., et al. (2010) The Mechanism of Water Oxidation: From Electrolysis via Homogeneous to Biological Catalysis. ChemCatChem, 2, 724-761. https://doi.org/10.1002/cctc.201000126
- 33. Fabbri, E., Habereder, A., Waltar, K., et al. (2014) Developments and Perspectives of Oxide-Based Catalysts for the Oxygen Evolution Reaction. Catalysis Science & Technology, 4, 3800-3821. https://doi.org/10.1039/C4CY00669K
- 34. Nsanzimana, J.M.V., Reddu, V., Peng, Y., et al. (2018) Ultrathin Amorphous Iron-Nickel Boride Nanosheets for Highly Efficient Electrocatalytic Oxygen Production. Chemistry—A European Journal, 24, 18502-18511. https://doi.org/10.1002/chem.201802092
- 35. Liang, Y., Sun, X., Asiri, A.M., et al. (2016) Amorphous Ni-B Alloy Nanoparticle Film on Ni Foam: Rapid Alternately Dipping Deposition for Efficient Overall Water Splitting. Nanotechnology, 27, 12LT01. https://doi.org/10.1088/0957-4484/27/12/12LT01
- 36. Lewinski, K.A., Van Der Vliet, D. and Luopa, S.M. (2015) NSTF Ad-vances for PEM Electrolysis—The Effect of Alloying on Activity of NSTF Electrolyzer Catalysts and Performance of NSTF Based PEM Electrolyzers. ECS Transactions, 69, 893. https://doi.org/10.1149/06917.0893ecst
- 37. Zhu, Y.-X., Jiang, M.-Y., Liu, M., et al. (2020) An Fe-V@NiO Heterostructure Electrocatalyst towards the Oxygen Evolution Reaction. Nanoscale, 12, 3803-3811. https://doi.org/10.1039/C9NR08749D
- 38. Su, D., Zhang, X., Wu, A., et al. (2019) CoO-Mo2N Hollow Heterostructure for High-Efficiency Electrocatalytic Hydrogen Evolution Reaction. NPG Asia Materials, 11, Article No. 78. https://doi.org/10.1038/s41427-019-0177-z
- 39. Niu, Z., Qiu, C., Jiang, J., et al. (2019) Hierarchical CoP-FeP Branched Hetero-structures for Highly Efficient Electrocatalytic Water Splitting. ACS Sustainable Chemistry & Engineering, 7, 2335-2342. https://doi.org/10.1021/acssuschemeng.8b05089
- 40. Shit, S., Chhetri, S., Jang, W., et al. (2018) Cobalt Sulfide/Nickel Sulfide Heterostructure Directly Grown on Nickel Foam: An Efficient and Durable Electrocatalyst for Overall Water Splitting Application. ACS Applied Materials & Interfaces, 10, 27712-27722. https://doi.org/10.1021/acsami.8b04223
- 41. Shit, S., Chhetri, S., Bolar, S., et al. (2019) Hierarchical Cobalt Sulfide/Molybdenum Sulfide Heterostructure as Bifunctional Electrocatalyst towards Overall Water Split-ting. ChemElectroChem, 6, 430-438. https://doi.org/10.1002/celc.201801343
- 42. Ahmed, M.S., Choi, B. and Kim, Y.-B. (2018) Development of Highly Active Bi-functional Electrocatalyst Using Co3O4 on Carbon Nanotubes for Oxygen Reduction and Oxygen Evolution. Scientific Reports, 8, Arti-cle No. 2543. https://doi.org/10.1038/s41598-018-20974-1
- 43. Liu, H., Xu, C.-Y., Du, Y., et al. (2019) Ultrathin Co9S8 Nanosheets Vertically Aligned on N,S/rGO for Low Voltage Electrolytic Water in Alkaline Media. Scientific Reports, 9, Article No. 1951. https://doi.org/10.1038/s41598-018-35831-4
- 44. Jiao, L., Zhou, Y.-X. and Jiang, H.-L. (2016) Metal-Organic Frame-work-Based CoP/Reduced Graphene Oxide: High-Performance Bifunctional Electrocatalyst for Overall Water Splitting. Chemical Sci-ence, 7, 1690-1695. https://doi.org/10.1039/C5SC04425A
- 45. Ahn, S.H., Choi, I., Park, H.-Y., et al. (2013) Effect of Morphology of Electrodepos-ited Ni Catalysts on the Behavior of Bubbles Generated during the Oxygen Evolution Reaction in Alkaline Water Electrolysis. Chemical Communications, 49, 9323-9325. https://doi.org/10.1039/c3cc44891f
- 46. Lu, M., Cui, X., Song, B., et al. (2020) Studying the Effect of CuCo2S4 Morphology on the Oxygen Evolution Reaction Using a Flexible Carbon Cloth Substrate. ChemElectroChem, 7, 1080-1083. https://doi.org/10.1002/celc.201902128
- 47. Maiyalagan, T., Chemelewski, K.R. and Manthiram, A. (2014) Role of the Morphology and Surface Planes on the Catalytic Activity of Spinel LiMn1.5Ni0.5O4 for Oxygen Evolution Reaction. ACS Catalysis, 4, 421-425. https://doi.org/10.1021/cs400981d
- 48. Fang, L., Jiang, Z., Xu, H., et al. (2018) Crystal-Plane Engineering of NiCo2O4 Electro-catalysts towards Efficient Overall Water Splitting. Journal of Catalysis, 357, 238-246. https://doi.org/10.1016/j.jcat.2017.11.017
- 49. Mohamed, M.M., Salama, T.M., Hegazy, M.A., et al. (2019) Synthesis of Hex-agonal WO3 Nanocrystals with Various Morphologies and Their Enhanced Electrocatalytic Activities toward Hydrogen Evolution. In-ternational Journal of Hydrogen Energy, 44, 4724-4736. https://doi.org/10.1016/j.ijhydene.2018.12.218
- 50. Silva, V.D., Simões, T.A., Grilo, J.P.F., et al. (2020) Impact of the NiO Nanostructure Morphology on the Oxygen Evolution Reaction Catalysis. Journal of Materials Science, 55, 6648-6659. https://doi.org/10.1007/s10853-020-04481-1
- 51. Daub, C.D., Wang, J., Kudesia, S., et al. (2010) The Influence of Molecu-lar-Scale Roughness on the Surface Spreading of an Aqueous Nanodrop. Faraday Discussions, 146, 67-77. https://doi.org/10.1039/b927061m
- 52. Zhu, M., Zhang, Z., Zhang, H., et al. (2018) Hydrophilic Cobalt Sulfide Nanosheets as a Bifunctional Catalyst for Oxygen and Hydrogen Evolution in Electrolysis of Alkaline Aqueous Solution. Journal of Colloid and Inter-face Science, 509, 522-528. https://doi.org/10.1016/j.jcis.2017.09.076
- 53. Yu, F., Gao, Y., Lang, Z., et al. (2018) Electrocatalytic Performance of Ultrasmall Mo2C Affected by Different Transition Metal Dopants in Hydrogen Evolution Reaction. Nanoscale, 10, 6080-6087. https://doi.org/10.1039/C8NR00908B
- 54. Yang, W., Zeng, J., Hua, Y., et al. (2019) Defect Engineering of Cobalt Microspheres by S Doping and Electrochemical Oxidation as Efficient Bifunctional and Durable Electrocatalysts for Water Splitting at High Current Densities. Journal of Power Sources, 436, Article ID: 226887. https://doi.org/10.1016/j.jpowsour.2019.226887
- 55. Ren, X., Yang, F., Chen, R., et al. (2020) Improvement of HER Activity for MoS2: Insight into the Effect and Mechanism of Phosphorus Post-Doping. New Journal of Chemistry, 44, 1493-1499. https://doi.org/10.1039/C9NJ05229A
- 56. He, W., Han, L., Hao, Q., et al. (2019) Fluorine-Anion-Modulated Electron Structure of Nickel Sulfide Nanosheet Arrays for Alkaline Hydrogen Evolution. ACS Energy Letters, 4, 2905-2912. https://doi.org/10.1021/acsenergylett.9b02316
- 57. Qiu, Z., Ma, Y. and Edvinsson, T. (2019) In Operando Raman Investigation of Fe Doping Influence on Catalytic NiO Intermediates for Enhanced Overall Water Splitting. Nano Energy, 66, Article ID: 104118. https://doi.org/10.1016/j.nanoen.2019.104118
- 58. Qi, J., Wang, H., Lin, J., et al. (2019) Mn and S Dual-Doping of MOF-Derived Co3O4 Electrode Array Increases the Efficiency of Electrocatalytic Generation of Oxygen. Journal of Colloid and Inter-face Science, 557, 28-33. https://doi.org/10.1016/j.jcis.2019.09.009
- 59. Zhang, Y.-Y., Zhang, X., Wu, Z.-Y., et al. (2019) Fe/P Dual Doping Boosts the Activity and Durability of CoS2 Polycrystalline Nanowires for Hydrogen Evolution. Journal of Materials Chemistry A, 7, 5195-5200. https://doi.org/10.1039/C8TA12269E
- 60. Xu, B., Yang, X., Fang, Q., et al. (2020) Anion-Cation Dual Doping: An Effective Electronic Modulation Strategy of Ni2P for High-Performance Oxygen Evolution. Journal of Energy Chemistry, 48, 116-121. https://doi.org/10.1016/j.jechem.2019.12.027
- 61. Chen, J., Chen, J., Cui, H., et al. (2019) Electronic Structure and Crystalline Phase Dual Modulation via Anion-Cation Co-Doping for Boosting Oxygen Evolution with Long-Term Stability under Large Current Density. ACS Applied Materials & Interfaces, 11, 34819-34826. https://doi.org/10.1021/acsami.9b08060
- 62. Dong, Y., Yang, J., Liu, Y., et al. (2020) 2D Fe-Doped NiO Nanosheets with Grain Boundary Defects for the Advanced Oxygen Evolution Reaction. Dalton Transactions, 49, 6355-6362. https://doi.org/10.1039/C9DT04633J
- 63. Sun, C., Wang, P., Wang, H., et al. (2019) De-fect Engineering of Molybdenum Disulfide through Ion Irradiation to Boost Hydrogen Evolution Reaction Performance. Nano Re-search, 12, 1613-1618. https://doi.org/10.1007/s12274-019-2400-1
- 64. Kang, S., Koo, J.-J., Seo, H., et al. (2019) Defect-Engineered MoS2 with Ex-tended Photoluminescence Lifetime for High-Performance Hydrogen Evolution. Journal of Materials Chemistry C, 7, 10173-10178. https://doi.org/10.1039/C9TC02256B
- 65. Wang, Y., Qiao, M., Li, Y., et al. (2018) Tuning Surface Electronic Configuration of NiFe LDHs Nanosheets by Introducing Cation Vacancies (Fe or Ni) as Highly Efficient Electrocatalysts for Oxygen Evolution Reac-tion. Small, 14, Article ID: 1800136. https://doi.org/10.1002/smll.201800136
- 66. Zhao, Y., Chang, C., Teng, F., et al. (2017) Defect-Engineered Ultrathin δ-MnO2 Nanosheet Arrays as Bifunctional Electrodes for Efficient Overall Water Splitting. Advanced En-ergy Materials, 7, Article ID: 1700005. https://doi.org/10.1002/aenm.201700005
- 67. Su, Y., Liu, H., Li, C., et al. (2019) Hydrothermal-Assisted Defect Engineering in Spinel Co3O4 Nanostructures as Bifunctional Catalysts for Oxygen Electrode. Journal of Alloys and Compounds, 799, 160-168. https://doi.org/10.1016/j.jallcom.2019.05.331
- 68. Henckel, D.A., Lenz, O.M., Krishnan, K.M., et al. (2018) Improved HER Catalysis through Facile, Aqueous Electrochemical Activation of Nanoscale WSe2. Nano Letters, 18, 2329-2335. https://doi.org/10.1021/acs.nanolett.7b05213
- 69. Mcglynn, J.C., Dankwort, T., Kienle, L., et al. (2019) The Rapid Electrochemi-cal Activation of MoTe2 for the Hydrogen Evolution Reaction. Nature Communications, 10, Article No. 4916. https://doi.org/10.1038/s41467-019-12831-0
- 70. Tao, L., Huang, M., Guo, S., et al. (2019) Surface Modification of NiCo2Te4 Nanoclusters: A Highly Efficient Electrocatalyst for Overall Water-Splitting in Neutral Solution. Applied Catalysis B: Environmental, 254, 424-431. https://doi.org/10.1016/j.apcatb.2019.05.010
- 71. Sun, X., Sun, S., Gu, S., et al. (2019) High-Performance Single Atom Bifunc-tional Oxygen Catalysts Derived from ZIF-67 Superstructures. Nano Energy, 61, 245-250. https://doi.org/10.1016/j.nanoen.2019.04.076
- 72. Xu, Y., Zhang, W., Li, Y., et al. (2019) The Synergetic Effect of Ni and Fe Bi-Metal Single Atom Catalysts on Graphene for Highly Efficient Oxygen Evolution Reaction. Frontiers in Materials, 6, Article No. 271. https://doi.org/10.3389/fmats.2019.00271
- 73. Ai, X., Zou, X., Chen, H., et al. (2020) Transition-Metal-Boron Intermetallics with Strong Interatomic d-sp Orbital Hybridization for High-Performance Electrocatalysis. Angewandte Chemie International Edition, 59, 3961-3965. https://doi.org/10.1002/anie.201915663
- 74. Chen, L., Zhang, L.-R., Yao, L.-Y., et al. (2019) Metal Boride Better Than Pt: HCP Pd2B as a Superactive Hydrogen Evolution Reaction Catalyst. Energy & Environmental Science, 12, 3099-3105. https://doi.org/10.1039/C9EE01564G
- 75. Zeng, M., Wang, H., Zhao, C., et al. (2016) Nanostructured Amorphous Nickel Bo-ride for High-Efficiency Electrocatalytic Hydrogen Evolution over a Broad pH Range. ChemCatChem, 8, 708-712. https://doi.org/10.1002/cctc.201501221
- 76. Xu, H., Fei, B., Cai, G., et al. (2020) Boronization-Induced Ultrathin 2D Nanosheets with Abundant Crystalline-Amorphous Phase Boundary Supported on Nickel Foam toward Efficient Water Splitting. Advanced Energy Materials, 10, Article ID: 1902714. https://doi.org/10.1002/aenm.201902714
- 77. Guo, F., Wu, Y., Chen, H., et al. (2019) High-Performance Oxygen Evolution Electrocatalysis by Boronized Metal Sheets with Self-Functionalized Surfaces. Energy & Envi-ronmental Science, 12, 684-692. https://doi.org/10.1039/C8EE03405B
- 78. Joo, J., Kim, T., Lee, J., et al. (2019) Morphology-Controlled Metal Sulfides and Phosphides for Electrochemical Water Splitting. Advanced Materials, 31, Article ID: 1806682. https://doi.org/10.1002/adma.201806682
- 79. Shin, D., Kim, H.J., Kim, M., et al. (2020) FexNi2-xP Alloy Nanocatalysts with Electron-Deficient Phosphorus Enhancing the Hydrogen Evolution Reaction in Acidic Media. ACS Catalysis, 10, 11665-11673. https://doi.org/10.1021/acscatal.0c02301
- 80. Shi, Y. and Zhang, B. (2016) Recent Advances in Transition Metal Phosphide Na-nomaterials: Synthesis and Applications in Hydrogen Evolution Reaction. Chemical Society Reviews, 45, 1529-1541. https://doi.org/10.1039/C5CS00434A
- 81. Yan, Y., Xia, B., Xu, Z., et al. (2014) Recent Development of Molybdenum Sulfides as Advanced Electrocatalysts for Hydrogen Evolution Reaction. ACS Catalysis, 4, 1693-1705. https://doi.org/10.1021/cs500070x
- 82. Guo, Y., Park, T., Yi, J.W., et al. (2019) Nanoarchitectonics for Transi-tion-Metal-Sulfide-Based Electrocatalysts for Water Splitting. Advanced Materials, 31, Article ID: 1807134. https://doi.org/10.1002/adma.201807134
- 83. Ramanarayanan, T. and Chun, C.M. (2008) Developments in High-Temperature Corrosion and Protection of Materials. Elsevier, Cambridge, 599-638.
- 84. Kou, Z., Yu, Y., Liu, X., et al. (2020) Potential-Dependent Phase Transition and Mo-Enriched Surface Reconstruction of γ-CoOOH in a Heterostructured Co-Mo2C Precatalyst Enable Water Ox-idation. ACS Catalysis, 10, 4411-4419. https://doi.org/10.1021/acscatal.0c00340
- 85. Ma, T.Y., Dai, S., Jaroniec, M., et al. (2014) Metal-Organic Framework Derived Hybrid Co3O4-Carbon Porous Nanowire Arrays as Reversible Oxygen Evolution Electrodes. Journal of the American Chemical Socie-ty, 136, 13925-13931. https://doi.org/10.1021/ja5082553
- 86. Chaikittisilp, W., Torad, N.L., Li, C., et al. (2014) Synthesis of Nanoporous Car-bon-Cobalt-Oxide Hybrid Electrocatalysts by Thermal Conversion of Metal-Organic Frameworks. Chemistry—A European Journal, 20, 4217-4221. https://doi.org/10.1002/chem.201304404
- 87. Chaikittisilp, W., Ariga, K. and Yamauchi, Y. (2013) A New Family of Carbon Materials: Synthesis of MOF-Derived Nanoporous Carbons and Their Promising Applications. Journal of Materials Chemistry A, 1, 14-19. https://doi.org/10.1039/C2TA00278G
- 88. Xiao, Q., Zhang, Y., Guo, X., et al. (2014) A High-Performance Electrocatalyst for Oxygen Evolution Reactions Based on Electrochemical Post-Treatment of Ultrathin Carbon Layer Coated Cobalt Nanoparticles. Chem-ical Communications, 50, 13019-13022. https://doi.org/10.1039/C4CC05953K
- 89. Gorlin, Y. and Jaramillo, T.F. (2010) A Bi-functional Nonprecious Metal Catalyst for Oxygen Reduction and Water Oxidation. Journal of the American Chemical Society, 132, 13612-13614. https://doi.org/10.1021/ja104587v
- 90. Suntivich, J., May, K.J., Gasteiger, H.A., et al. (2011) A Perovskite Oxide Optimized for Oxygen Evolution Catalysis from Molecular Orbital Principles. Science, 334, 1383-1385. https://doi.org/10.1126/science.1212858
- 91. Zhang, B., Zheng, X., Voznyy, O., et al. (2016) Homogeneously Dispersed Multi-metal Oxygen-Evolving Catalysts. Science, 352, 333-337. https://doi.org/10.1126/science.aaf1525
- 92. Li, Y.H., Liu, P.F., Pan, L.F., et al. (2015) Local Atomic Structure Modulations Activate Metal Oxide as Electrocatalyst for Hydrogen Evolution in Acidic Wa-ter. Nature Communications, 6, Article No. 8064. https://doi.org/10.1038/ncomms9064
- 93. Ling, T., Yan, D.-Y., Wang, H., et al. (2017) Activating Cobalt(II) Oxide Nanorods for Efficient Electrocatalysis by Strain Engineering. Nature Communications, 8, Article No. 1509. https://doi.org/10.1038/s41467-017-01872-y
- 94. Li, Y., Yu, Z.G., Wang, L., et al. (2019) Electronic-Reconstruction-Enhanced Hydrogen Evolution Catalysis in Oxide Polymorphs. Nature Communications, 10, Article No. 3149. https://doi.org/10.1038/s41467-019-11124-w
- 95. Ling, T., Zhang, T., Ge, B., et al. (2019) Well-Dispersed Nickel- and Zinc-Tailored Electronic Structure of a Transition Metal Oxide for Highly Active Alkaline Hydrogen Evolution Reaction. Advanced Materials, 31, Article No. 1807771. https://doi.org/10.1002/adma.201807771
NOTES
*通讯作者。