International Journal of Ecology
Vol.
11
No.
02
(
2022
), Article ID:
51633
,
9
pages
10.12677/IJE.2022.112021
淡水浮游植物与浮游动物化学计量学特征 相关性研究
李子尧,吉力,黄头生*
华北电力大学,工程生态学与非线性科学研究中心,北京
收稿日期:2022年4月17日;录用日期:2022年5月18日;发布日期:2022年5月25日

摘要
本文研究了太子城河浮游植物与浮游动物C、N、P的元素含量,探讨了浮游植物与浮游动物间化学计量学特征的相关性。结果表明,浮游植物C元素含量较高,C:N:P = 156:15.41:1,说明浮游植物生长受N、P共同限制,且作为浮游动物食物质量较差。浮游动物C含量与浮游植物相近,C:N:P = 92.76:11.16:1,N、P元素含量高于浮游植物,表明浮游动物对N、P有富集作用且对P的富集程度较高。将浮游植物与浮游动物元素含量与元素比(C:P、N:P、C:N)进行相关性分析。结果表明,浮游植物与浮游动物元素比差值与浮游植物元素比呈显著正相关关系,线性拟合R2 > 0.5,两者间元素水平并不能维持相对一致,说明两者间化学计量学特征随浮游植物元素占比升高产生了不平衡性,即相关性减弱。
关键词
浮游植物,浮游动物,食物质量,化学计量学,相关性

Investing the Stoichiometric Coupling between Phytoplankton and Zooplankton in Freshwater
Ziyao Li, Li Ji, Tousheng Huang*
Research Center for Engineering Ecology and Nonlinear Science, North China Electric Power University, Beijing
Received: Apr. 17th, 2022; accepted: May 18th, 2022; published: May 25th, 2022

ABSTRACT
To study the correlation of stoichiometric characteristics between phytoplankton and zooplankton, the contents of C, N and P in phytoplankton and zooplankton in Taizicheng River were investigated. The results showed that phytoplankton had a high content of C element (C:N:P = 156:15.41:1), and the growth of phytoplankton was restricted by both N and P, and the quality of phytoplankton as food was poor. The C content of zooplankton was similar to that of phytoplankton (C:N:P = 92.76:11.16:1), and the content of N and P elements was higher than that of phytoplankton, indicating that zooplankton enriched N and P and had a higher degree of enrichment of P. The correlation analysis of phytoplankton and zooplankton element content and element ratio (C:P, N:P, C:N) was carried out. The results showed that there was a significant positive correlation between phytoplankton element ratio and phytoplankton element ratio, and the linear fitting R2 was more than 0.5. The element level between phytoplankton element ratio and phytoplankton element ratio was not consistent, indicating that the stoichiometric characteristics between phytoplankton element ratio and phytoplankton element ratio were unbalanced with the increase of phytoplankton element ratio, that is, the correlation was weakened.
Keywords:Phytoplankton, Zooplankton, Food Quality, Ecological Stoichiometry, Correlation

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着生态学研究的深入,生态学家需求更统一、更本质的生态学理论,这需要将已了解的生物个体、种群、群落和生态系统有机联系起来,探求一致性特征 [1]。然而,要将不同水平、不同类型和不同生境的生物统一研究寻找普遍性特征是一个很大的挑战 [2]。此时,结合热力学第一定律、生物进化理论和分子生物学中心法则的生态化学计量学应运而生,并逐渐形成“内稳态”和“生长速率”两个核心理论,为探索生物间的相互作用提供了新的角度和手段 [3]。生态化学计量学理论从元素的角度解释生态系统生物间的相互作用。在河流生态系统中,由于水环境差异、光照条件不同和营养盐的输入不同等,导致了浮游植物对元素的吸收产生偏移,最终进化出独特的C:N:P化学计量学特征。部分浮游植物进化出较高的C:P比值,导致浮游动物食物质量降低。食物质量变差限制了浮游动物生长发育等生理过程,影响了生态系统中的元素循环和能量流动,导致植食性生物与浮游植物两者间元素水平产生不平衡,甚至引发部分植食性生物向杂食性甚至食肉性转变。
生物间的捕食关系使其元素上产生耦联的现象在大自然中广泛存在。Persson J. [4] 发现了陆生昆虫和其食物间化学计量学关系。Vanderploeg H. A. [5] 通过对悬浮物质量与斑马纹贻贝排泄物间化学计量学关系的研究确定了食物影响捕食者化学计量学特征。Elser J. [6] 和Kyle M. [7] 研究表明浮游动物与浮游植物间P元素的不平衡性是其营养动力学的主要驱动因子,食物中P含量的变化直接影响了浮游动物的生长速率 [8],浮游动物的氮磷比也与食物中的元素含量密切相关 [9]。不仅是元素比值,其形式也受到影响,浮游动物的不饱和脂肪酸含量直接与食物不饱和脂肪酸含量相关 [10]。
浮游动物种群因食物质量的改变会影响自身在种群中的优势度,而浮游动物群落作为一个整体是否与食物化学计量特征耦合,当食物质量改变浮游动物群体又是如何响应的相关研究较少。本文通过对太子城河的浮游植物、浮游动物的化学计量学分析,探讨两者之间的化学计量学特征在变化过程中的相关性及不平衡性。
2. 研究区域概况与方法
2.1. 研究区域概况
太子城河位于冬奥会核心区张家口市崇礼区,从老虎沟向西至马丈子沟有支流汇入最终注入清水河。地处冀西北山地,北为坝上草原,河道曲折,为弯曲型河床,垂直变化大,海拔落差近500 m,区域内年均气温低于3℃水流速度快、水动力强、水体较浅,浮游生物占主要地位,鱼虾蚌等大型生物较少。太子城河发源于翠云山北侧老虎沟,流向为东西,流经众多村落和冬奥会施工现场。河道主河槽内常年有地表径流。太子城河地处中温带,其特殊的海拔高度和地理环境使其气候特征近似寒温带,为寒冷山区淡水河流。
2.2. 采样点布设与样品采集
本文依据太子城河河流特点,按照河流样点设置原则布设了13个采样点。分别在2020年5月、2020年8月、2020年11月和2021年2月四个月份采集浮游植物和浮游动物样品(浮游动物使用13号浮游生物网拖拽采集,浮游植物使用13号嵌套25号浮游生物网采集),并存放在500 ml聚乙烯采样瓶中带回实验室内处理。将1至4号样点划分为太子城河上游,1号点为老虎沟泉眼点为整条河流源头,河水较浅,河面较窄,河水较缓,受人为因素影响较小;4至6号点为太子城河干流,该区域水流较急,并且沿河岸有施工现场影响河流水质;7至9号点为太子城河下游,水流较急,部分河段有施工现场影响河流;10至12号点为太子城河支流,该区域水流较急,不受施工影响。采样的具体位置用GPS定位取得经纬度海拔数据,保证每次采样在同一位置。
2.3. 研究方法与室内处理
对于化学计量学的研究方法一般有两种,一是直接测定浮游生物生物体和有机碎屑的元素组成;二是根据水体中生源元素的浓度变化进行反推。本文选择直接测定浮游植物与浮游动物生命体化学元素组成来进行其化学计量学研究。将采集的浮游植物与浮游动物样品在体视显微镜下挑拣,与河流中的颗粒悬浮物等杂物分离,将挑出的样品分别装入样品瓶中,在冷冻干燥机中干燥并研磨得到粉末状样品,进行元素测试。其中碳(C)、氮(N)两种元素使用Elemantar: Vario EL cube型元素分析仪测定;磷(P)元素使用安捷伦7800型ICP-MS电感耦合等离子质谱仪测定。
2.4. 数据分析
测定数据使用SPSS 25.0进行平均值、标准偏差、变异系数分析及单因素方差分析,对C、N、P元素及其化学计量比(C:P、N:P、C:N)之间进行双侧Person相关性检验。浮游植物、浮游动物数据处理的结果在OriginPro 2018c软件中绘制图表。本文采用浮游植物与浮游动物元素比差值(ΔC:P、ΔN:P、ΔC:N)表示两者化学计量学的不平衡性,分析其与浮游植物化学计量学相关性,并使用CurveExpert Pro软件对两者进行线性拟合。
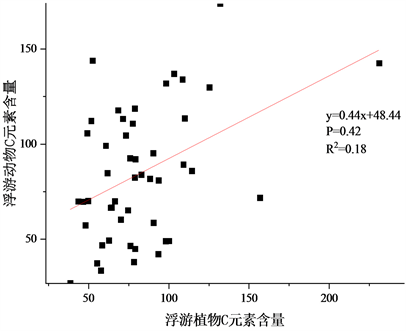


Figure 1. Correlation analysis of phytoplankton and zooplankton element content
图1. 浮游植物–浮游动物元素含量(g/kg)相关分析
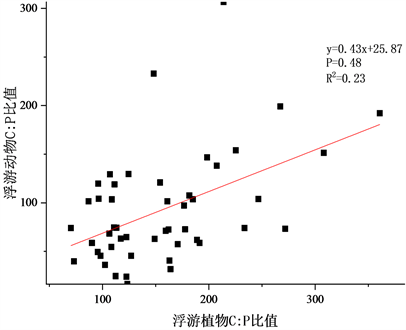
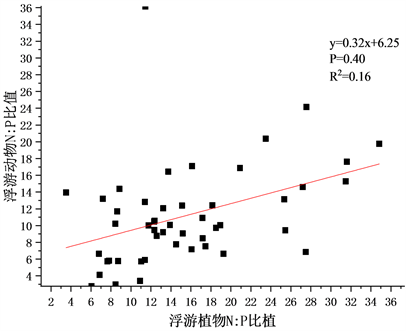
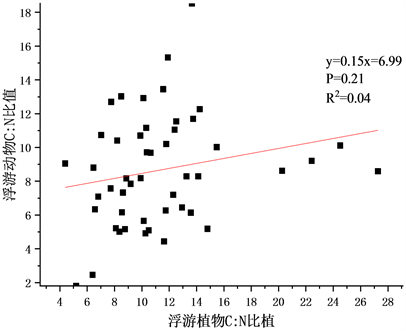
Figure 2. Correlation analysis of phytoplankton to zooplankton element ratio
图2. 浮游植物–浮游动物元素比相关分析
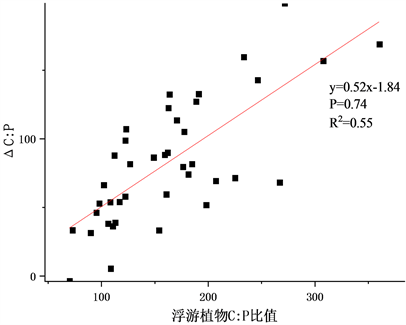

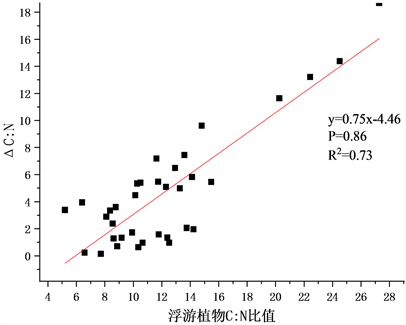
Figure 3. Correlation analysis between phytoplankton element ratio difference and phytoplankton element ratio
图3. 浮游植物–浮游动物元素比差值与浮游植物元素比相关分析
3. 结果
3.1. 浮游植物与浮游动物元素含量相关性分析
本次调查中,浮游植物–浮游动物元素含量的相关分析如图1。浮游植物C元素含量平均82.17 g/kg,变化范围约为38~232 g/kg;浮游动物C元素含量平均84.26 g/kg,变化范围为27~174 g/kg。两者在0.01级别显著正相关,相关系数为0.420;浮游植物N元素含量平均8.14 g/kg,变化范围约为2~18 g/kg;浮游动物N元素含量平均12.09 g/kg,变化范围为4~26 g/kg。两者在0.05级别显著正相关,相关系数为0.364;浮游植物P元素含量平均0.99 g/kg,变化范围约为0.50~3 g/kg;浮游动物P元素含量平均2.15 g/kg,变化范围为1.10~5.80 g/kg。两者在0.01级别显著正相关,相关系数为0.389。浮游动物作为更高营养级体内C、N、P含量一般比浮游植物更稳定,而在本次调查中浮游动物C元素波动较小,N、P元素波动较浮游植物略高,浮游植物对N、P元素的固定作用较强(对P元素更强的吸收导致N:P比值降低)。浮游植物一部分C元素使用在细胞壁上,浮游动物无此需求,对C元素的吸收比例降低。浮游动物食物来源不唯一,食物中其余悬浮物的影响可能造成了浮游动物化学计量学特征的不稳定。
3.2. 浮游植物与浮游动物C:P、N:P、C:N间相关性分析
在本次调查中,浮游植物与浮游动物元素比相关分析如图2。浮游植物化学计量摩尔比为C:N:P = 156:15.41:1 (C:N = 10.12),其中C:P变化范围为70~360,N:P为3~35,C:N为4~28;浮游动物化学计量学特征为C:N:P = 92.76:11.16:1 (C:N = 8.31),C:P变化范围为23~233,N:P为3~36,C:N为2~18。两者C:P之间在0.01级别显著正相关,相关系数为0.478,C:P之间在0.01级别显著正相关,相关系数为0.399,C:N之间相关性不显著。国际上公认的浮游生物化学计量比是由Redfield提出的C:N:P = 106:16:1 (C:N = 6.63)。而太子城河中浮游植物碳元素占比过高,当食物质量降低时(浮游植物C元素含量过高P元素含量不足),浮游动物群落优势种演替,如水蚤对P元素的需求较高,在这种情况下会被低P需求的桡足类取代,浮游动物群落生态化学计量学特征通过类似方式来适应环境变化。
3.3. 浮游植物与浮游动物间元素不平衡性分析
本次调查中大多数浮游植物元素比大于浮游动物。去除少数(10%~20%)与此规律相反的异常点后,将浮游植物与浮游动物元素比的差值与浮游植物元素比对比得到下图,以此衡量浮游植物与浮游动物间元素不平衡性。
浮游植物–浮游动物元素比差值与浮游植物元素比间相关关系如图3。将其做相关性分析得到两者C:P在0.01级别显著正相关,相关系数为0.723,N:P间在0.01级别显著正相关相关系数为0.771,C:N间在0.01级别显著相关,相关系数为0.857。将其做线性拟合得出R2分别为0.55、0.60、0.73。浮游动物体内C、N、P的元素含量相较浮游植物一般被认为更稳定的,当浮游植物元素比逐渐增大时,浮游植物和浮游动物间元素间的不平衡性也逐渐增大。整体看来,在一定范围内浮游植物–浮游动物元素比差值随浮游植物元素比增大而增大并存在线性关系,即浮游动物对自身元素有一定调节能力但无法完全保持自身元素不受环境影响。
4. 讨论
生态学家对于浮游动物是受浮游植物营养元素等资源(上行作用)或鱼类捕食作用的控制(下行作用)存在争议。太子城河无大型鱼类且虾蚌较少,食物链简单、营养级单一,浮游生物受下行作用小,适合研究浮游动物受浮游植物的上行作用,针对元素限制(养分限制)进行探索,加强对营养级、养分循环、和浮游动物生态位的理解。结果表明,太子城河浮游生物元素间,不论是含量和比值都呈现出高度正相关关系。在元素含量上,C元素含量浮游植物与浮游动物大致相同,N、P元素浮游动物都略高于浮游植物,两者间元素含量存在显著正相关关系但线性关系较差,拟合结果R2均不到0.3。仅仅研究元素含量是不足以探讨两者相关关系,对元素比的研究要比元素含量更有意义,McCarthy和Irvine [11] 的报道了浮游动物群落C:P和悬浮物C:P之间的正相关关系,Teurlincx S.和Velthuis M. [12] 发现二者之间呈抛物线关系,而Dobberfuhl D. R.和Elser J. J. [13] 的研究却发现两者并无相关性。自然选择作用使生物顺应环境条件梯度分布,同时生物也通过调整自身尽力不被环境淘汰。浮游动物一般情况下能保持自身元素含量的相对稳定,不同物种间保持着自身独特的化学计量学特征,这种特征是生物与环境双向选择,长期生长进化的结果。而在食物元素含量、元素比波动过程中,浮游动物群体通过自身调节和群落演替适应环境元素改变,但当食物化学计量学特征突变时,浮游动物无法适应导致种群优势度降低甚至灭亡 [14]。
将其进一步研究发现,浮游植物–浮游动物元素比差值与浮游植物元素比间存在一定线性相关关系,浮游植物与浮游动物间元素的不平衡性与浮游植物元素比正相关。Teurlincx [12] 发现在浮游植物C:P比不断增加过程中,比值低于270时,浮游动物C:P与浮游植物比值呈显著正相关,当浮游植物C:P继续增加时浮游动物相关性降低,直至浮游植物C:P增加至500,浮游动物C:P比基本维持在100左右不再变化,浮游动物群落结构与其自身元素可塑性共同决定了浮游动物元素比。因此,浮游植物的元素比偏离了浮游动物的需求时(C元素占比过高),意味着浮游动物对C元素的摄取过高,导致浮游动物元素同化效率降低 [15],生长发育受限,最终对群落生物量产生影响,对于这种现象Elser [16] 提出了“生长速率假说”。生长速率假说最开始的研究是针对浮游动物的营养元素与生物物质摄取(主要是C:P)和生命活动间的关系。在浮游植物P比例高时,浮游动物元素内稳态将发生改变,大量P元素分配至RNA中,蛋白质合成速率增加,提高了生长发育速度,当元素供给与生物需求完全一致时,生态系统传递效率最高。反之,P元素占比较小C元素相对过剩,在消费者体内积累,生态系统C元素的同化效率和传递效率变低导致收支不平衡,这种不平衡是驱动元素生态地球化学循环变化的重要原因之一。
5. 结论
1) 本次调查中浮游动物化学计量比为C:N:P = 92.76:11.16:1,浮游植物化学计量比C:N:P = 156.00:15.41:1。浮游动物P元素占比较高,浮游植物C元素占比过高,作为食物质量较低;
2) 浮游植物与浮游动物元素含量、化学计量比(除C:N外)均显著正相关,浮游动物化学计量学特征受食物质量影响;
3) 浮游植物–浮游动物元素比差值(ΔC:P、ΔN:P、ΔC:N)与浮游植物元素比(C:P、N:P、C:N)呈显著正相关关系,线性拟合R2分别为0.55、0.60、0.73,表明浮游植物与浮游动物间元素水平差距逐渐增大,其相关性随之降低。
基金项目
国家水体污染控制与治理科技重大专项“冬奥会核心区生态修复与水源涵养功能提升技术与示范”(2017ZX07101002)。
文章引用
李子尧,吉 力,黄头生. 淡水浮游植物与浮游动物化学计量学特征相关性研究
Investing the Stoichiometric Coupling between Phytoplankton and Zooplankton in Freshwater[J]. 世界生态学, 2022, 11(02): 163-171. https://doi.org/10.12677/IJE.2022.112021
参考文献
- 1. 陈广生, 曾德慧. 生态化学计量学: 复杂生命系统奥秘的探索[J]. 植物生态学报, 2005, 29(6): 1007-1019.
- 2. 张丽霞, 白永飞, 韩兴国. N:P化学计量学在生态学研究中的应用[J]. 植物学报, 2003, 45(9): 1009-1018.
- 3. 贺金生, 韩兴国. 生态化学计量学: 探索从个体到生态系统的统一化理论[J]. 植物生态学报, 2010, 34(1): 2-6.
- 4. Persson, J., Fink, P. and Goto, A. (2017) To Be or Not to Be What You Eat: Regulation of Stoichiometric Homeostasis among Autotrophs and Heterotrophs. Oikos, 119, 741-751. https://doi.org/10.1111/j.1600-0706.2009.18545.x
- 5. Vanderploeg, H.A., Sarnelle, O., Liebig, J.R., Morehead, N.R., Robinson, S.D., Johengen, T.H., et al. (2017) Seston Quality Drives Feeding, Stoichiometry and Excretion of Zebra Mussels. Freshwater Biology, 62, 664-680. https://doi.org/10.1111/fwb.12892
- 6. Elser, J. (2006) Biological Stoichiometry: A Chemical Bridge between Ecosystem Ecology and Evolutionary Biology. American Naturalist, 168, S25-S35. https://doi.org/10.1086/509048
- 7. Kyle, M., Acharya, K., Weider, L.J., Looper, K. and Elser, J.J. (2006) Cou-pling of Growth Rate and Body Stoichiometry in Daphnia: A Role for Maintenance Processes? Freshwater Biology, 51, 2087-2095. https://doi.org/10.1111/j.1365-2427.2006.01639.x
- 8. Hessen, D.O. (1992) Nutrient Element Limitation of Zo-oplankton Production. American Naturalist, 140, 799-814. https://doi.org/10.1086/285441
- 9. Saikia, S.K. and Nandi, S.C. (2010) C and P in Aquatic Food Chain: A Re-view on C:P Stoichiometry and PUFA Regulation. Knowledge and Management of Aquatic Ecosystems, No. 398, Article No. 3. https://doi.org/10.1051/kmae/2010024
- 10. Brett, M.T., Müller-Navarra, D.C., Ballantyne, A.P., Ravet, J.L. and Goldman, C.R. (2006) Daphnia Fatty Acid Composition Reflects That of Their Diet. Limnology and Oceanography, 51, 2428-2437. https://doi.org/10.4319/lo.2006.51.5.2428
- 11. McCarthy, V. and Irvine, K. (2010) A Test of Stoichiometry across Six Irish Lakes of Low-Moderate Nutrient Status and Contrasting Hardness. Journal of Plankton Research, 32, 15-29. https://doi.org/10.1093/plankt/fbp103
- 12. Teurlincx, S., Velthuis, M., Seroka, D., Govaert, L., van Donk, E., Van de Waal, D.B., et al. (2017) Species Sorting and Stoichiometric Plasticity Control Community C:P Ratio of First-Order Aquatic Consumers. Ecology Letters, 20, 751-760. https://doi.org/10.1111/ele.12773
- 13. Dobberfuhl, D.R. and Elser, J.J. (2000) Elemental Stoichiometry of Lower Food Web Components in Arctic and Temperate Lakes. Journal of Plankton Research, 22, 1341-1354. https://doi.org/10.1093/plankt/22.7.1341
- 14. Andersen, T., Elser, J.J. and Hessen, D.O. (2002) Stoichiometry and Population Dynamics. Ecology Letters, 72, 251-270.
- 15. Elser, J.J., Sterner, R.W., Gorokhova, E., Fagan, W., Markow, T., Cotner, J., et al. (2000) Biological Stoichiometry from Genes to Ecosystems. Ecology Letters, 3, 540-550. https://doi.org/10.1111/j.1461-0248.2000.00185.x
- 16. Elser, J.J., Dobberfuhl, D.R. and Mackay, N.A. (1996) Organism Size, Life History, and N:P Stoichiometry. Bioscience, 46, 674-684. https://doi.org/10.2307/1312897
NOTES
*通讯作者。