Open Journal of Natural Science
Vol.
10
No.
04
(
2022
), Article ID:
53460
,
8
pages
10.12677/OJNS.2022.104057
基于PDA修饰磁性纳米材料富集尿液氯霉素、甲砜霉素和氟甲砜霉素的研究
耿阳1,2,3,章志淳1,2,3,相江英3,4,胡燕3,4,詹铭3,4*,周颖1,2,3*
1复旦大学教育部公共卫生安全教育部重点实验室,上海
2复旦大学公共卫生学院营养与食品卫生暨卫生化学教研室,上海
3复旦大学浦东预防医学研究院,上海
4上海市浦东新区疾病预防控制中心理化检验科,上海
收稿日期:2022年6月8日;录用日期:2022年7月4日;发布日期:2022年7月11日

摘要
针对人体抗生素暴露问题,开发了基于Fe3O4@PDA磁性纳米材料实现对尿液中3种氯霉素类抗生素(氯霉素、甲砜霉素和氟甲砜霉素)的富集及其生物监测。采取SEM和TF-IR技术表征Fe3O4@PDA磁性纳米材料的形貌和结构功能,结果表明制备的PDA通过Fe-O-C化学键连接到磁性Fe3O4纳米颗粒表面,修饰于Fe3O4外层。磁性强度实验表明制备的Fe3O4@PDA材料在磁场中具有高的磁反应性。通过对影响因素的优化,在Fe3O4@PDA用量为20 mg,溶液pH为7,吸附时间为15 min,10 mL 5% (v/v)氨水甲醇溶液作为洗脱剂,超声洗脱时间10 min时,3种目标物的平均回收率在90%以上,且检出限和定量限分别为0.10~0.16 μg/L和0.30~0.47 μg/L。利用该方法对实际儿童尿液样本进行检测,3种物质的加标回收率为95.95%~117.64%。该方法可有效地检测出尿液中3种氯霉素类抗生素,其在实际尿液样本检测中具有较高的应用前景。
关键词
磁性纳米材料,多巴胺修饰,尿液,氯霉素,甲砜霉素,氟苯尼考

Study on Enrichment of Chloramphenicol, Thiamphenicol and Thiamphenicol in Urine Based on PDA-Modified Magnetic Nanomaterials
Yang Geng1,2,3, Zhichun Zhang1,2,3, Jiangying Xiang3,4, Yan Hu3,4, Ming Zhan3,4*, Ying Zhou1,2,3*
1Key Laboratory of Public Health Safety, Ministry of Education, Fudan University, Shanghai
2Department of Nutrition and Food Hygiene and Hygienic Chemistry, School of Public Health, Fudan University, Shanghai
3Fudan University Pudong Institute of Preventive Medicine, Shanghai
4Department of Physico-Chemical Analysis, Pudong New Area Center for Disease Control and Prevention, Shanghai
Received: Jun. 8th, 2022; accepted: Jul. 4th, 2022; published: Jul. 11th, 2022

ABSTRACT
Considering the antibiotic exposure in humans, a magnetic solid-phase extraction technology based on Fe3O4@PDA magnetic nanomaterials was developed to enrich three kinds of chloramphenicol antibiotics (chloramphenicol, thiamphenicol, and florfenicol) in urine samples for biomonitoring. Firstly, the morphology and structural properties of Fe3O4@PDA magnetic nanomaterials were characterized by SEM and TF-IR techniques, and the results showed that the prepared PDA nanoparticles was connected to the surface of magnetic Fe3O4 nanoparticles through Fe-O-C chemical bonds, and modified on the outer layer of Fe3O4. In addition, magnetic strength experiments showed that the prepared Fe3O4@PDA material has high magnetic reactivity in a magnetic field. Under the optimal conditions as follows: 20 mg of Fe3O4@PDA were added, pH of the solution was 7, the adsorption time was 15 min, 10 mL of 5% (v/v) ammonia methanol solution used as the eluent, and the ultrasonic elution time of 10 min, the average recovery rate of the target compound was above 90%. The limit of detection and quantification was in the range of 0.10~0.16 μg/L and 0.30~0.47 μg/L, respectively. When applied to detect actual urine samples, the recovery rates of the method ranged from 95.95% to 117.64% for three targeted chloramphenicols. It suggested the proposed method can effectively enrich chloramphenicol antibiotics in urine, thereby having a great potential for application in the biomonitoring of actual urine samples.
Keywords:Magnetic Nanoparticles, Polydopamine Modified, Urine, Chloramphenicol, Thiamphenicol, Florfenicol

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
抗生素残留的人群健康风险评估是公共卫生领域的热点问题。氯霉素类抗生素主要包括氯霉素(chloramphenicol, CAP)、甲砜霉素(thiamphenicol, TAP)和氟甲砜霉素(florfenicol, FFL)。它们是我国目前畜禽疾病防治的重要药物,时常在食源性动物组织甚至人群中检出 [1] [2] [3] [4] [5]。氯霉素对人体毒性较大,可引起人类再生障碍性贫血,被IARC列为Group 2A致癌物即对人类可能致癌物。甲砜霉素作为氯霉素替代物,能够抑制红细胞、白细胞和血小板生成,且免疫抑制作用比氯霉素强约6倍 [6] [7]。氟苯尼考作为甲砜霉素的替代物,动物研究发现其具有一定的免疫和胚胎毒性,如果长期暴露于氟苯尼考可能导致比氯霉素和甲砜霉素更强的健康效应 [8]。尿液生物监测是人群氯霉素类抗生素内暴露评估的有效手段 [3] [4] [5]。
尿液样本基质复杂且样本中氯霉素含量低。高效萃取尿液样本中氯霉素类抗生素是开展尿液生物监测的前提。传统的液液萃取结合固相萃取技术(solid-phase extraction, SPE)操作繁琐,且微米级粒径吸附剂的萃取效率有待进一步提高。结合纳米材料高萃取效率和磁性材料操作简便等特点的磁性固相萃取技术(magnetic solid-phase extraction, MSPE),是实现简便、高效生物监测抗生素的最具前景的样品前处理技术之一。MSPE已经被用于萃取环境介质和食物中痕量抗生素 [9] [10] [11]。MPSE技术使用流程简单,而研究和开发新的吸附剂是MSPE的核心。
磁性纳米材料(magnetic nanoparticles, MNPs)因结合了磁响应性和纳米粒子的双重特点,是作为MSPE吸附剂的首选 [12]。纳米材料的比表面积大,吸附容量高,吸附速率快,少量的吸附剂便可在短时间内从样中提取分析物 [13]。聚多巴胺(polydopamine, PDA)是多巴胺在温和的弱碱性条件下氧化聚合而成的产物,可在不同类型基体上形成具有反应活性基团的粘附膜,因此PDA是一个提高吸附剂的萃取能力的良好修饰材料。PDA膜层中邻苯二酚基团能与金属离子形成配位键,可将金属氧化物沉积在材料表面,基于此可制成磁性纳米材料,例如Fe3O4@PDA磁性纳米材料。基于PDA的磁性纳米材料已经用于环境介质中污染物的萃取 [14]。PDA还具有环境稳定性和生物相容性 [15],适合于生物材料如尿液中污染物萃取。
本研究目的是制备Fe3O4@PDA磁性纳米材料,优化MSPE技术,建立尿液中氯霉素、甲砜霉素和氟甲砜霉素等高效萃取方法,用于生物监测尿液氯霉素类抗生素。
2. 材料与方法
2.1. 仪器与试剂
超高效液相色谱——三重四极杆串联质谱仪(日本岛津公司),C18 (100 mm × 2.1 mm,1.7 μm,美国沃特斯公司);0.22 μm微孔滤膜(上海安谱科学仪器公司);KQ-100DE超声波清洗器(昆山市超声仪器公司);MIRA3场发射扫描电镜(SEM,欧洲TESCAN公司),高分辨透射电子显微镜(HRTEM,)傅立叶变换红外光谱分析仪(FTIR,美国赛默飞世尔科技公司),MPMS3磁学测量系统(美国Quantum Design公司)。
标准物质氯霉素(CAP)、甲砜霉素(TAP)、氟甲砜霉素(FF)纯度 ≥ 99% (上海安谱科学仪器公司);甲酸为液质纯,甲醇、乙腈均为色谱纯(美国Sigma-Aldrich公司);三氯化铁(FeCl3) (美国Sigma-Aldrich公司);实验用水为超纯水(美国Millipore公司)。
2.2. 标准溶液配制
称取标准物质各2.5 mg于25 mL容量瓶中,用甲醇溶解并定容,得到100 μg/mL标准储备溶液,于4℃冰箱内避光保存。使用时,用甲醇稀释至合适浓度。
2.3. 模拟尿样制备
准确称量3.8 g 氯化钾,8.5 g氯化钠,24.5 g尿素,1.03 g柠檬酸,0.34 g抗坏血酸,1.18 g磷酸钾,1.4 g肌酐,0.64 g氢氧化钠,0.47 g碳酸钠,以及0.28 mL硫酸溶于500 mL超纯水中并超声60 min [16]。
2.4. 磁性纳米材料的制备
利用溶剂热法制备Fe3O4纳米颗粒,然后与多巴胺(PDA)反应生成Fe3O4@PDA [17]。
Fe3O4纳米颗粒通过多元醇高温热解法制备,以聚乙二醇为分散剂,在高温的条件下合成。称取3.60 g乙酸钠、1.0 g聚乙二醇和0.81 g三氯化铁依次加入反应釜中,移取40 mL乙二醇,室温下磁力搅拌30 min,搅拌均匀后于200℃反应12 h,静置冷却至室温,磁铁分离得到黑色沉淀,用水、乙醇交替冲洗至近中性,真空60℃干燥24 h用于后续Fe3O4@PDA的制备。
利用溶液氧化法制备Fe3O4@PDA:称取0.32 g Fe3O4纳米粒子于烧杯中,加入160 mL三羟基氨基甲烷盐酸溶液(pH = 6),超声混匀,加入0.32 g盐酸多巴胺,室温下搅拌10 h,然后使用磁铁分离收集沉淀物,用水和乙醇交替冲洗3次至近中性,所得黑色粉末于60℃真空条件下干燥24 h。
2.5. MSPE萃取
如图1所示,称量适量Fe3O4@PDA于锥形瓶中,加入模拟尿液样本溶液10 mL,涡旋5 min,超声萃取15 min;磁铁吸附Fe3O4@PDA后去除上清液体;加入洗脱剂2 mL,涡旋5 min超声15 min;磁铁吸附Fe3O4@PDA,吸取上清液到离心管中,氮气吹干,以流动相100 μL复溶待测。

Figure 1. Schematic illustration for magnetic solid phase extraction based on Fe3O4@PDA
图1. Fe3O4@PDA磁性纳米材料MSPE示意图
2.6. 仪器条件
液相色谱条件:采用C18色谱柱(100 mm × 2.1 mm × 1.7 μm)、柱温35℃、进样体积10 μL、流动相为0.1%氨水溶液(A)和0.1%氨水甲醇溶液(B),流速0.2 mL/min,梯度洗脱程序:0~0.20 min,10%B;0.20~4.00 min,10%~100%B;4.00~5.50 min,100%B;5.50~5.70 min,100%~10%B;5.70~11.30 min,10%B,分析时间11.30分钟。
质谱条件:离子源为电喷雾离子化源(ESI),采用负离子检测模式,多反应监测(MRM)模式进行定量分析。雾化气(N2)流速为3.0 L/min,干燥气(N2)温度为400℃,干燥气流速为10.0 L/min,鞘气(N2)温度为250℃,鞘气流速为10.0 L/min,毛细管电压为4500 V,质谱采集参数见表1。
Table 1. MS parameters for determination of 3 chloramphenicols
表1. 3种氯霉素抗生素的质谱分析条件
3. 结果与讨论
3.1. 磁性纳米材料的表征
3.1.1. 电镜表征
Fe3O4和Fe3O4@PDA的扫描电镜如图2所示。采用溶剂热法制备的Fe3O4磁性纳米颗粒呈规则的球形,具有较大的比表面积(图2(a))。Fe3O4@PDA纳米颗粒呈球形,呈现团簇状,其粒径在300~500 nm之间,且相比较于Fe3O4纳米颗粒表面更加平滑(图2(b));使用透射电镜进一步分析,纳米材料微球整体着色均匀,球体表面存在粒径不等的浅色附着层,附着层厚度介于20~50 nm (图2(c))。这提示所制备的纳米材料呈现明显双层复合核-壳结构,外部浅色壳层是PDA,而呈簇状的内核是Fe3O4,表明PDA已修饰于Fe3O4外层。

Figure 2. SEM images of Fe3O4 (a) and Fe3O4@PDA (b) and TEM images of Fe3O4@PDA (c)
图2. 磁纳米颗粒Fe3O4 (a)和Fe3O4@PDA扫描电镜(b)和Fe3O4@PDA透射电镜图(c)
3.1.2. 红外光谱表征
采用傅里叶变换红外光谱(TF-IR)对Fe3O4和Fe3O4@PDA进行表征。如图3(a)所示,Fe3O4在587 cm−1和3300~3500 cm−1处出现强吸收峰,为Fe-O的特征吸收峰。在图3(b)中,Fe3O4@PDA在1294、1513、1618 cm−1处出现强峰,该峰归属于苯环上C=C伸缩振动引起的吸收峰 [14],以及在3500 cm−1~3100 cm−1处出现了由-NH2和-OH的伸缩振动引起的特征吸收峰,均提示PDA外壳已形成;此外,Fe-O键伸缩振动引起的吸收峰从587 cm−1移至585 cm−1,表明PDA壳通过Fe-O-C化学键连接到磁性Fe3O4纳米颗粒表面。
 (a) (b)
(a) (b)
Figure 3. FT-IR spectrum of Fe3O4 and Fe3O4@PDA
图3. Fe3O4和Fe3O4@PDA的FT-IR谱图
3.1.3. 磁性强度表征
300 K条件下,设定循环磁场强度为−10200~10200 Oe,通过磁性测量系统得到磁滞回线,如图4所示。该曲线没有出现磁滞,剩磁或矫顽力接近于零,说明所合成Fe3O4@PDA没有改变Fe3O4的超顺磁性;Fe3O4@PDA颗粒的饱和磁强度为54.0 emu/g,展现出强磁性。图4(b1),图4(b2)显示经磁铁吸引10 s后,Fe3O4@PDA全部被富集到磁铁周围。这提示所制备的Fe3O4@PDA材料在磁场中具有高的磁反应性,有利于从样品溶液中快速分离。
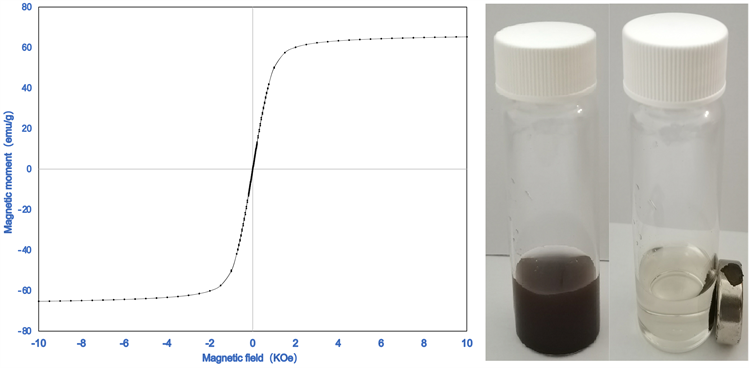 (a) (b1) (b2)
(a) (b1) (b2)
Figure 4. Magnetization curves of Fe3O4@PDA (a) and photograph of the solution of Fe3O4@PDA without (b1) and with (b2) a magnet
图4. Fe3O4@PDA的磁滞曲线(a)和Fe3O4@PDA经磁铁吸引前(b1)、后(b2)效果
3.2. MSPE萃取条件的优化
吸附和洗脱是影响MSPE的关键因素。本研究考察了吸附条件(吸附剂用量、吸附时间和样品pH值)和洗脱条件(洗脱剂、洗脱时间)对3种目标物萃取效率的影响,每组实验平行测定3次。
3.2.1. 吸附条件的选择
磁性吸附剂用量是影响萃取效应的重要因素之一。本研究考察不同Fe3O4@PDA磁性纳米颗粒用量(5~25 mg)对模拟尿样中3种氯霉素类抗生素萃取回收率的影响。实验结果表明,Fe3O4@PDA用量为5~20 mg时,目标物的回收率随着磁性吸附剂用量的增加而增加,当Fe3O4@PDA用量为20 mg时,目标物的回收率达到最大,继续增加Fe3O4@PDA用量,目标物的回收率未有明显增加,因此Fe3O4@PDA用量为20 mg。
由于氯霉素类抗生素属于弱酸性物质(pKa 9~10),样品溶液的pH值可以影响其存在状态,从而影响目标物的萃取效率。调节样品pH 3~11,实验结果显示,pH在7时目标物的萃取回收率较高。这提示可能由于氯霉素类抗生素在中性条件下多呈分子状态,有利于与PDA分子中氨基之间形成氢键作用。因此,最终选择样品溶液pH为7。
充足的吸附时间保证目标物与吸附剂充分相互作用达到吸附平衡,可以有效提升萃取效率。考察了不同吸附时间(5~25 min)对目标物的萃取效率的影响。实验结果表明,吸附时间为5~15 min时,目标物的回收率随着吸附时间的增加而增加,当吸附时间为15 min时,目标物的回收率达到最大,继续增加吸附时间,目标物的回收率未有明显增加,因此MSPE最佳吸附时间为15 min。
3.2.2. 洗脱条件的选择
选择合适的洗脱剂可以提高回收率。由于3种氯霉素抗生素为极性化合物,易溶于极性溶剂甲醇,选择甲醇溶液作为洗脱剂,以10 mL为洗脱体积,考察了甲醇、1% (v/v)甲酸甲醇溶液和5% (v/v)氨水甲醇溶液对目标物的洗脱效果,实验结果表明,当洗脱剂为5% (v/v)氨水甲醇溶液,3种目标物的平均回收率为93.29%~112.03%,洗脱效果较好。因此,选择10 mL 5% (v/v)氨水甲醇溶液作为洗脱剂。进一步考察了超声洗脱时间为1~20 min时目标物萃取回收率的变化。实验结果表明,洗脱时间为10 min时,目标物的萃取回收率达到最大,继续增加洗脱时间,萃取回收率保持稳定,因此,超声洗脱时间选择10 min。
3.3. 方法性能
在最优条件下进行MSPE-HPLC-MSMS分析。在0.1~100 μg/L范围内,选择模拟尿液配置系列浓度的混合加标溶液,平行测定3次。如表2所示,在0.5~50 μg/L范围内3种目标物呈现良好的线性关系,相关系数(R2)为0.991~0.997。以3倍和10倍信噪比(S/N)确定检出限(LOD)和定量限(LOQ)分别为0.10~0.16 μg/L和0.30~0.47 μg/L,精密度为1.45%~8.85%,说明方法具有良好的准确度和精密度。
Table 2. Analytical performance of Fe3O4@PDA based MSEP method
表2. 基于Fe3O4@PDA的MSEP方法的分析性能指标
3.4. 实际样品验证
取等分10名儿童尿液样本制成混合样本,分别加入3种氯霉素标准溶液5 μg/L和25 μg/L,利用最佳MSPE条件进行样品前处理。3种物质的加标回收率为95.95%~117.64%,相对标准偏差为1.45%~5.99%。研究结果提示所开发的MSPE方法能够简便、高效萃取尿液中3种目标物质。
4. 结论
本研究成功制备了Fe3O4@PDA磁性纳米材料作为MSPE吸附剂,建立了MSPE尿液中3种氯霉素类抗生素的方法。与现有生物监测尿液氯霉素类抗生素的SPE方法相比,该方法具有简便快速、有机溶剂用量少和样品不易损失等优点。本研究的磁性纳米吸附剂制备方法简便,分析方法适用性高,可用于灵敏的生物监测人群尿液中3种氯霉素类抗生素。
基金项目
上海市浦东新区卫生和计划生育委员会卫生计生科研项目(PW2017A-13)。
文章引用
耿 阳,章志淳,相江英,胡 燕,詹 铭,周 颖. 基于PDA修饰磁性纳米材料富集尿液氯霉素、甲砜霉素和氟甲砜霉素的研究
Study on Enrichment of Chloramphenicol, Thiamphenicol and Thiamphenicol in Urine Based on PDA-Modified Magnetic Nanomaterials[J]. 自然科学, 2022, 10(04): 469-476. https://doi.org/10.12677/OJNS.2022.104057
参考文献
- 1. Tuyet-Hanh, T.T., Sinh, D.X., Phuc, P.D., Ngan, T.T., Van Tuat, C., Grace, D., Unger, F. and Nguyen-Viet, H. (2017) Exposure Assessment of Chemical Hazards in Pork Meat, Liver, and Kidney, and Health Impact Implication in Hung Yen and Nghe An Provinces, Vietnam. International Journal of Public Health, 62, 75-82. https://doi.org/10.1007/s00038-016-0912-y
- 2. dos Santos, J.S., Botaro, B.G., Ribeiro, A.B.C., Bruzaroski, S.R., Trento, I. and Santana, E.H.W. (2016) Chloramphenicol Residues Found in Milk Processed in Northern Parana, Brazil. Journal für Verbraucherschutz und Lebensmittelsicherheit, 11, 79-81. https://doi.org/10.1007/s00003-015-0975-3
- 3. Wang, Y., Zhang, W., Mhungu, F., Zhang, Y. and Filippini, T. (2021) Probabilistic Risk Assessment of Dietary Exposure to Chloramphenicol in Guangzhou, China. International Journal of Environmental Research and Public Health, 18, Article No. 8805. https://doi.org/10.3390/ijerph18168805
- 4. Wang, H., Wang, N., Qian, J., Hu, L., Huang, P., Su, M., Yu, X., Fu, C., Jiang, F., Zhao, Q., Zhou, Y., Lin, H., He, G., Chen, Y. and Jiang, Q. (2017) Urinary Antibiotics of Pregnant Wom-en in Eastern China and Cumulative Health Risk Assessment. Environmental Science & Technology, 51, 3518-3525. https://doi.org/10.1021/acs.est.6b06474
- 5. Wang, H., Wang, N., Wang, B., Zhao, Q., Fang, H., Fu, C., Tang, C., Jiang, F., Zhou, Y., Chen, Y. and Jiang, Q. (2016) Antibiotics in Drinking Water in Shanghai and Their Contribution to Antibiotic Exposure of School Children. Environmental Science & Technology, 50, 2692-2699. https://doi.org/10.1021/acs.est.5b05749
- 6. Turton, J.A., Andrews, C.M., Havard, A.C., Robinson, S., York, M., Williams, T.C. and Gibson, F.M. (2002) Haemotoxicity of Thiamphenicol in the BALB/c Mouse and Wistar Hanover Rat. Food and Chemical Toxicology, 40, 1849- 1861. https://doi.org/10.1016/S0278-6915(02)00178-3
- 7. Fröhli, P., Graf, C. and Rhyner, K. (1984) Thiamphenicol Induced Bone Marrow Suppression as a Therapy of Myeloproliferative Diseases. Blut, 49, 457-463. https://doi.org/10.1007/BF00320488
- 8. Zhang, Y., Guo, P., Wu, Y., Wang, M., Deng, J., Su, H. and Sun, Y. (2021) Evaluation of the Acute Effects and Oxidative Stress Responses of Phenicol Antibi-otics and Suspended Particles in Daphnia magna. Environmental Toxicology and Chemistry, 40, 2463-2473. https://doi.org/10.1002/etc.5108
- 9. Khatibi, S.A., Hamidi, S. and Siahi-Shadbad, M.R. (2021) Current Trends in Sample Preparation by Solid-Phase Extraction Techniques for the Determination of Antibiotic Residues in Foodstuffs: A Review. Critical Reviews in Food Science and Nutrition, 61, 3361-3382. https://doi.org/10.1080/10408398.2020.1798349
- 10. Wang, H., Zhao, X., Xu, J., Shang, Y., Wang, H., Wang, P., He, X. and Tan, J. (2021) Determination of Quinolones in Environmental Water and Fish by Magnetic Metal Organic Frameworks Based Magnetic Solid-Phase Extraction Followed by High-Performance Liquid Chromatography-Tandem Mass Spectrometry. Journal of Chromatography A, 1651, Article ID: 462286. https://doi.org/10.1016/j.chroma.2021.462286
- 11. Pérez, R.A., Albero, B., Férriz, M. and Tadeo, J.L. (2017) Analysis of Macrolide Antibiotics in Water by Magnetic Solid-Phase Extraction and Liquid Chromatography-Tandem Mass Spectrometry. Journal of Pharmaceutical and Biomedical Analysis, 146, 79-85. https://doi.org/10.1016/j.jpba.2017.08.013
- 12. Cristea, C., Tertis, M. and Galatus, R. (2017) Magnetic Nanoparti-cles for Antibiotics Detection. Nanomaterials, 7, Article No. 119. https://doi.org/10.3390/nano7060119
- 13. Her-rero-Latorre, C., Barciela-García, J., García-Martín, S., Peña-Crecente, R.M. and Otárola-Jiménez, J. (2015) Magnetic Solid-Phase Extraction Using Carbon Nanotubes as Sorbents: A Review. Analytica Chimica Acta, 892, 10-26. https://doi.org/10.1016/j.aca.2015.07.046
- 14. Wang, Y., Wang, S., Niu, H., Ma, Y., Zeng, T., Cai, Y. and Meng, Z. (2013) Preparation of Polydopamine Coated Fe3O4 Nanoparticles and Their Application for Enrichment of Polycyclic Aromatic Hydrocarbons from Environmental Water Samples. Journal of Chromatography A, 1283, 20-26. https://doi.org/10.1016/j.chroma.2013.01.110
- 15. Lee, H., Dellatore, S.M., Miller, W.M. and Messersmith, P.B. (2007) Mussel-Inspired Surface Chemistry for Multifunctional Coatings. Science, 318, 426-430. https://doi.org/10.1126/science.1147241
- 16. Rocha, B.A., da Costa, B.R., de Albuquerque, N.C., de Oliveira, A.R., Souza, J.M., Al-Tameemi, M., Campiglia, A.D. and Barbosa Jr., F. (2016) A Fast Method for Bisphenol A and Six Analogues (S, F, Z, P, AF, AP) Determination in Urine Samples Based on Dispersive Liquid-Liquid Microextraction and Liquid Chromatography-Tandem Mass Spectrometry. Talanta, 154, 511-519. https://doi.org/10.1016/j.talanta.2016.03.098
- 17. Jeong, U., Teng, X., Wang, Y., Yang, H. and Xia, Y. (2007) Superparamagnetic Colloids: Controlled Synthesis and Niche Applications. Advanced Materials, 19, 33-60. https://doi.org/10.1002/adma.200600674
NOTES
*通讯作者。
