Hans Journal of Medicinal Chemistry
Vol.
10
No.
02
(
2022
), Article ID:
51934
,
6
pages
10.12677/HJMCe.2022.102019
HPLC测定不同产地南板蓝根中靛玉红含量
周芳丽*,张丽艳#,李军
贵州中医药大学,贵州 贵阳
收稿日期:2022年5月6日;录用日期:2022年5月23日;发布日期:2022年5月31日

摘要
目的:建立不同产地南板蓝根药材中靛玉红含量的高效液相色谱法。方法:采用Agilent ZORBAX SB-C18色谱柱(5 μm, 4.6 × 150 mm);以甲醇-0.1%磷酸水为流动相,梯度洗脱;流速为0.8 mL·min−1;柱温为35℃;检测波长为290 nm;进样量为10 μL。结果:靛玉红的进样量在0.63~12.6 μg (r = 0.9999)范围内与峰面积呈较好的线性关系;平均回收率为101.18% (RSD为2.74%);靛玉红的含量为0.040~0.151 mg·g−1。结论:建立的南板蓝根含量测定方法操作简单、具有良好的重复性和可靠性。对南板蓝根质量控制及整体性评价具有一定的指导意义。
关键词
南板蓝根,高效液相色谱,靛玉红,含量测定

Determination of Indirubin in Baphicacanthis Cusiae Rhizoma et Radix from Different Habitats by HPLC
Fangli Zhou*, Liyan Zhang#, Jun Li
Guizhou University of Traditional Chinese Medicine, Guiyang Guizhou
Received: May 6th, 2022; accepted: May 23rd, 2022; published: May 31st, 2022

ABSTRACT
Objective: To establish an HPLC method for the content of indirubin in Baphicacanthis Cusiae Rhizoma et Radix from different habitats. Methods: Agilent ZORBAX SB-C18 column (5 μm, 4.6 × 150 mm) was used. Gradient elution was performed with methanol-0.1% phosphoric acid as mobile phase. The flow rate was 0.8 mL·min−1. The column temperature was 35˚C. The detection wavelength was 290 nm. The injection volume was 10 μL. Results: The sample amount of indirubin showed a good linear relationship with the peak area in the range of 0.63~12.6 μg (r = 0.9999). The average recovery rate was 101.18% (RSD 2.74%). The content of indirubin was determined in the range of 0.040~0.151 mg·g−1. Conclusion: The established method for the determination of Baphicacanthis Cusiae Rhizoma et Radix is simple, reproducible and reliable. It has certain guiding significance for quality control and integrity evaluation of Baphicacanthis Cusiae Rhizoma et Radix.
Keywords:Baphicacanthis Cusiae Rhizoma et Radix, High Performance Liquid Chromatography, Indirubin, Content Determination

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
南板蓝根为爵床科马蓝(Baphicacanthus cusia (Nees) Bremek)的干燥根及根茎,性寒味苦,归心、胃经,具有清热解毒、凉血消斑的功效,临床用于温疫时毒,发热咽痛,温毒发斑、丹毒 [1]。广泛分布于我国的华西、西南,尤其是广西、福建,南方地区多以此入药 [2]。南板蓝根为多年生草本,根及根茎不甚发达,产量低,野生资源分散较少 [3]。南板蓝根已被广泛应用于各种复方制剂中,如复方南板蓝根冲剂、复方南板蓝根颗粒等,复方南板蓝根冲剂在抗病毒、消炎散清等方面的疗效尤为突出 [4]。在SARS、H1N1等病毒性疾病的临床治疗方面也发挥了重要的作用 [5]。南板蓝根中含有较多种类的成分,包括生物碱类、苷类、氨基酸类、多糖等化学成分 [6] [7] [8] [9]。其中靛蓝、靛玉红为南板蓝根的主要活性成分 [10]。靛玉红及其衍生物,已被鉴定为板蓝根中有效的抗病毒化合物 [11],并且靛玉红对癌肿生长和扩散程度有明显的抑制作用 [10]。目前,2020年版《中国药典》中只收录了南板蓝根的常规检查和鉴定要求,缺少指标性成分的含量测定标准,难以全面评价南板蓝根的质量。这给临床用药和制剂的相关研究带来了一定的困扰。鉴于此,本实验采用高效液相色谱法测定云南不同产地中南板蓝根药材所含有的靛玉红含量,以期为南板蓝根的质量标准提供参考。
2. 材料与试药
2.1. 仪器
Waters e2695型高效液相色谱仪(美国Waters公司);JP-030型超声波清洗机(洁盟清洗设备有限公司);XS205型十万分之一电子天平(瑞士梅特公司)。
2.2. 试药
靛玉红对照品(批号:110717-200204,中国药品生物制品检定所);甲醇、乙腈、磷酸为色谱纯,水为娃哈哈矿泉水,其余试剂均为分析纯。本实验采用的南板蓝根药材来源信息表见表1,经贵州中医药大学魏升华教授鉴定为爵床科马蓝(Baphicacanthus cusia (Nees) Bremek)的干燥根及根茎,采集后放于干燥阴凉处备用。
Table 1. Sources of 15 batches of radix isatidis
表1. 15批南板蓝根药材来源
3. 方法与结果
3.1. 色谱条件
色谱柱为Agilent ZORBAX SB-C18柱(4.6 × 150 mm, 5 μm);流动相为甲醇(A)-0.1%磷酸水(B),梯度洗脱(0~10 min, 80%~100% A);检测波长为290 nm;流速为0.8 mL·min−1;柱温为35℃;进样量为10 μL。色谱图见图1。
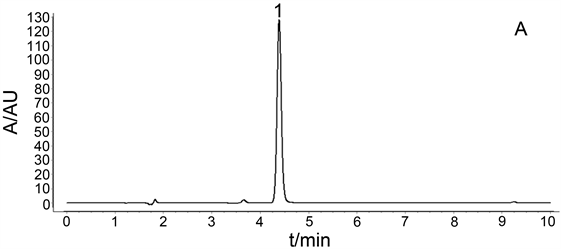
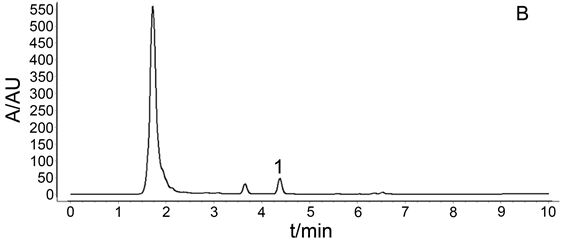 A. 对照品;B. 药材;1. 靛玉红
A. 对照品;B. 药材;1. 靛玉红
Figure 1. HPLC images of reference substance (A) and medicinal material (B)
图1. 对照品(A)和药材(B)的HPLC图
3.2. 对照品溶液的制备
取靛玉红对照品适量,精密称定,加甲醇制成浓度为0.012 6 mg·mL−1的对照品溶液。
3.3. 供试品溶液的制备
精密称定南板蓝根药材粉末(三号筛) 1.0 g,置具塞锥形瓶中,精密加入60 mL甲醇,称重,加热回流1小时,冷却至室温,用甲醇补重,摇匀滤过,精密量取续滤液20 mL水浴蒸干,用甲醇溶解并定容至10 mL容量瓶中,用0.45 μm微孔滤膜滤过,即得。
3.4. 方法学考察
3.4.1. 线性关系考察
分别精密吸取靛玉红对照品溶液1,2,4,10,20 mL,分别置20 mL的量瓶中,用甲醇稀释至刻度,按照“3.1”项下色谱条件进样测定,以对照品的质量浓度为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线,进行线性回归,得回归方程为Y = 64815 X − 2685.8,r = 0.9999,线性范围0.63~12.6 μg。
3.4.2. 精密度试验
精密吸取靛玉红同一供试品溶液,按照“3.1”项下色谱条件连续进样测定6次,测定峰面积,RSD为0.24%,表明仪器的精密度良好。
3.4.3. 重复性试验
精密称取南板蓝根6份,按照“3.3”项下方法制备供试品溶液,进行测定,记录峰面积,RSD为2.12%,表明该方法重复性良好。
3.4.4. 稳定性试验
取同一批南板蓝根供试品溶液,分别在0,3,7,10,15,24 h进样测定,记录峰面积,其RSD为1.03%,表明该供试品溶液在24 h内稳定性良好。
3.4.5. 加样回收率试验
取已知含量的同一批次南板蓝根6份,精密称定,分别精密加入与药材中含量相当的对照品溶液,按“3.3”项下方法制备供试品溶液,根据“3.1”项下色谱条件进行测定,记录峰面积,结果见表2。靛玉红的平均加样回收率为101.18%,RSD为2.74%,表明样品加样回收率较好。
Table 2. Indirubin sample recovery determination
表2. 靛玉红加样回收测定
3.5. 药材含量测定
分别称取15批南板蓝根药材粉末(3号筛)各1.0 g,精密称定,按照“3.3”项下方法制备供试品溶液,根据“3.1”项下色谱条件,计算南板蓝根药材中靛玉红的含量,结果见表3。结果显示,靛玉红的含量为0.040~0.151 mg·g−1。
Table 3. Mass fraction of indirubin in 15 batches of radix isatidis (mg·g−1)
表3. 15批南板蓝根药材中靛玉红的质量分数(mg·g−1)
4. 讨论
4.1. 提取条件的选择
试验前期分别考察了三氯甲烷、乙酸乙酯、乙醇、甲醇、70%甲醇水、45%甲醇水、30%甲醇水溶剂,并且进行了加热回流和超声提取的比较,最后考察了回流时间30 min、60 min、90 min的提取效果,结果表明用甲醇作为提取溶剂,加热回流提取60 min时,得到的靛玉红含量最高。
4.2. 色谱条件的选择
试验前期分别用甲醇–水、乙腈–水、甲醇-0.1%磷酸水溶液、甲醇-0.2%磷酸水溶液作为流动相系统,考察了30℃、35℃、40℃的柱温,0.8 mL·min−1、1.0 mL·min−1、1.2 mL·min−1的流速,结果表明当柱温35℃、流速0.8 mL·min−1,以甲醇-0.1%磷酸水溶液为流动相系统进行梯度洗脱时,靛玉红色谱峰的分离度及峰形较好。通过在200~400 nm范围内的光谱中进行扫描,发现290 nm处靛玉红的吸光度最大,故以290 nm作为检测波长。
4.3. 结果分析
HPLC法作为中药质量研究的方法之一,本实验以云南产地的南板蓝根药材开展研究,结果发现15批云南产地中靛玉红的含量差异较大,其中以屏边县中的靛玉红含量最高,元阳县和金平县的次之,这可能与药材的生长环境以及土壤有关。15批次中有三分之一的南板蓝根药材的靛玉红含量达到了万分之一,符合药材含量检测的最低要求。
本实验通过HPLC法建立的南板蓝根中靛玉红的含量测定方法操作简单,具有较好的重复性和可靠性。为南板蓝根药材及其制剂的质量控制提供参考,以便更好地发挥南板蓝根的药用价值,扩大其使用范围。
基金项目
国家重点研发计划项目(2019YFC1712500);贵州省科技计划项目(黔科合后补助[2020] 3003)。
文章引用
周芳丽,张丽艳,李 军. HPLC测定不同产地南板蓝根中靛玉红含量
Determination of Indirubin in Baphicacanthis Cusiae Rhizoma et Radix from Different Habitats by HPLC[J]. 药物化学, 2022, 10(02): 198-203. https://doi.org/10.12677/HJMCe.2022.102019
参考文献
- 1. 国家药典委员会. 中华人民共和国药典一部(2020年版) [M]. 北京: 化学工业出版社, 2020: 170.
- 2. 沈倩. 南北板蓝根异同之辨[J]. 首都医药, 2009, 16(22): 41-42.
- 3. 申琼琪, 侯惠婵, 栗建明, 等. 板蓝根与南板蓝根及其伪品的比较鉴别[J]. 中国医药工业杂志, 2014, 45(1): 31-34.
- 4. 王烈, 茅向军, 杨丹. 黔产南板蓝根HPLC特征图谱研究[J]. 微量元素与健康研究, 2014, 31(0): 51-52.
- 5. 罗霄山, 孙冬梅, 李素梅, 等. 不同产地南板蓝根药材脂溶性成分的HPLC指纹图谱研究[J]. 现代中药研究与实践, 2012, 26(6): 64-67.
- 6. 刘远. 马蓝叶化学成分研究[D]: [硕士学位论文]. 沈阳: 沈阳药科大学, 2009.
- 7. 肖春霞, 熊燕, 杜彩霞, 等. 南板蓝根水溶性部位化学成分研究[J]. 中药材, 2020, 43(3): 596-601.
- 8. 廖富华. 南板蓝根氨基酸的分析[J]. 中国兽药杂志, 2003(3): 39-41.
- 9. 张利沙, 孙玮玮, 徐自慧, 等. 复方南板蓝根颗粒中多糖的含量测定及单糖组成分析[J]. 药物分析杂志, 2017, 37(10): 1845-1850.
- 10. 罗君, 杨丹, 张丽艳, 等. 黔产南板蓝根不同样品中两种主要活性成分的含量对比[J]. 中国实验方剂学杂志, 2015, 21(08): 70-72.
- 11. Yμ, J., Zhang, Y., Ning, S., et al. (2019) Molecμlar Cloning and Metabolomic Characterization of the 5-Enolpy- Rμvylshikimate-3-Phosphate Synthase Gene from Baphicacanthμs cμsia. BMC Plant Biology, 19, 485. https://doi.org/10.1186/s12870-019-2035-0
NOTES
*第一作者。
#通讯作者。
