Advances in Clinical Medicine
Vol.
12
No.
12
(
2022
), Article ID:
59522
,
7
pages
10.12677/ACM.2022.12121675
17例卵巢未成熟畸胎瘤临床病理观察并 文献复习
张华1,秦瑞2*
1济宁医学院,济宁医学院临床医学院,山东 济宁
2济宁医学院附属医院病理科,济宁医学院附属医院,山东 济宁
收稿日期:2022年11月21日;录用日期:2022年12月19日;发布日期:2022年12月26日

摘要
目的:卵巢未成熟畸胎瘤(immature teratoma)是一种少见的发生于卵巢的恶性肿瘤,本研究旨在探讨卵巢的临床特征、组织病理学、免疫表型及鉴别诊断。方法:收集济宁医学院附属医院2011年8月~2022年5月收治的17例未成熟畸胎瘤,分析其临床病理学特征及免疫表型并文献复习。结果:患者(17例)平均发病年龄为25.4岁,首次就诊原因6例为腹部包块,11例为腹胀伴有不同程度的腹痛。巨检:3例为实性肿物,14例为囊实性肿物。组织学:存在原始的神经外胚层组织或原始神经管。免疫组化:SALL-4表达在未成熟的神经成分,且Ki-67增值指数较高,部分患者不成熟的胃肠型腺体表达AFP。结论:卵巢未成熟畸胎瘤是罕见地发生于卵巢的生殖细胞肿瘤,好发于中青年女性,镜下未成熟神经上皮量决定肿瘤的病理分级。
关键词
卵巢,未成熟畸胎瘤,病理

Clinicopathological Observation and Literature Review of 17 Cases of Immature Teratoma of Ovary
Hua Zhang1, Rui Qin2*
1School of Clinical Medicine, Jining Medical University, Jining Shandong
2Department of Pathology, Affiliated Hospital of Jining Medical University, Jining Medical University, Jining Shandong
Received: Nov. 21st, 2022; accepted: Dec. 19th, 2022; published: Dec. 26th, 2022

ABSTRACT
Background and Objective: The immature teratoma is a rare malignant tumor of the ovary. The aim of this study is to investigate the clinical features, histopathology, immunophenotype, and differential diagnosis of immature teratoma. Methods: Seventeen cases of immature teratoma were collected at the Affiliated Hospital of Jining Medical University, China, from August 2011 to May 2022. The clinicopathological features and immunophenotypes were analyzed, and the literature was reviewed. Results: The average age of onset was 25.4 years. Abdominal mass was the first complaint in 6 cases and abdominal distension with varying degrees of abdominal pain in 11 cases. On giant examination, 3 cases were solid masses and 14 cases were cystic-solid masses. Histology: Primitive neuroectodermal tissue or primitive neural tube was present. Immunohistochemically, SALL-4 was expressed in immature neural components with a high Ki-67 proliferation index. AFP was expressed in immature gastrointestinal glands of some patients. Conclusions: Ovarian immature teratoma is a rare germ cell tumor of the ovary, which mainly occurs in young and middle-aged women. The amount of immature neuroepithelium under the microscope determines the pathological grade of the tumor.
Keywords:Ovary, Immature Teratoma, Pathology

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
卵巢未成熟畸胎瘤,一种罕见地发生于卵巢的生殖细胞源性的恶性肿瘤,主要诊断依据为肿瘤组织内是否存在原始的神经外胚层组织或神经管。主要特征概括为:① 多发生于儿童及青年女性;② 多位单侧发病,肿瘤体积较大;③ 镜下可见3个胚层的未成熟和成熟组织,病理学组织学分级根据未成熟的神经上皮量进行 [1]。本文收集了17例济宁医学院附属肿瘤医院收治的未成熟畸胎瘤患者的临床病理资料,进行回顾性的分析,结合文献复习梳理其临床及病理学特征。
2. 临床病理资料与方法
2.1. 临床病理资料
2011年8月~2022年5月济宁医学院附属医院病理科17例发生于卵巢,且不同分级的未成熟畸胎瘤(表1);患者年龄区间为2~36岁,中位发病年龄为25,平均发病年龄为25.4岁。患者首次就诊原因,6例为腹部包块,11例为腹胀伴有不同程度的腹痛;术前辅助检查1例考虑为畸胎瘤,17例病例均为单侧发病。17例患者均经手术切除肿瘤,术后病理学检查,确诊为未成熟畸胎瘤,诊断依据为是否存在原始神经外胚层组织或原始神经管;对未成熟畸胎瘤组织学分级是根据WHO第五版女性生殖系统肿瘤的标准,分为1、2、3级(表2),患者分级越高,其原始成分含量就越多,恶性程度越高。三例3级的未成熟畸胎瘤患者年龄较大,分别为24岁、31岁、36岁。
Table 1. Clinicopathological features of 17 immature teratomas
表1. 17例未成熟畸胎瘤临床病理特征
Table 2. Histological grading of immature teratomas
表2. 未成熟畸胎瘤组织学分级
2.2. 研究方法
肿瘤组织均为经开腹或腹腔镜下切除的标本,部分组织为经快速冰冻病理检查后剩余组织,组织均浸入10%福尔马林溶液中固定,根据标准,沿肿瘤最大径,每隔1 cm,取一块组织。肿瘤组织出现转移,必须对两者均进行充分的采样。生殖细胞肿瘤进行充分采样的一般规则是,肿瘤最大直径每厘米需要一块组织,以提供足够的组织切片进行分析。常规脱水并包埋。然后制作石蜡切片(厚度为2.5 μm)进行HE (苏木素–伊红)染色,IHC (免疫组织化学染色)切片厚度为4.5 μm,随后将石蜡切片脱蜡后进行抗原修复,阻断内源性过氧化物酶,进行免疫组化染色分析。选用的抗体包括:SAll-4、Ki-67、AFP、NSE、S-100等,用一抗孵育切片,将切片置于4℃过夜。次日用PBS冲洗3次,每次5 min。然后将样本与二抗孵育60分钟。染色结束后,切片由济宁医学院附属医院两位病理专家审阅。
3. 病理结果
3.1. 大体观察
肿瘤最大径平均为12.4 cm,其中3例为实性,14例为囊实性,4例有明显包膜,其中5例患者肿物切开后,查见明显的皮脂、毛发,其中一例查见质硬组织为骨组织,肿瘤切面实性区域,质地软,部分质韧,均为灰白,混杂出现黄色及褐色区域,部分病例可见出血和坏死区,囊性区为淡黄或褐色液体,17例肿瘤均进行了广泛取材。
3.2. 转移部位
卵巢外播散通常以直接侵犯附件结构和播散方式累及盆腔腹膜表面,特别是膀胱和乙状结肠表面。此研究中,1例患者发生直肠前壁种植,其他患者没有发现转移。
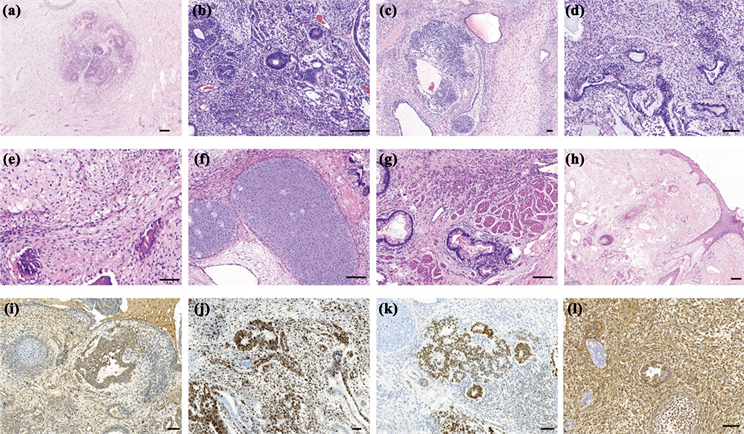
Figure 1. (a) Rosette like structure in the background of neuropil; (b) Variable amounts of immature tissues, mostly neuroectodermal tubules and are admixed with ectodermal and endodermal tissues of varying maturation; (c) Diffuse patchy primitive neuroepithelial tissue; (d) Immature gastrointestinal gland; (e) Mature bone tissue; (f) Mature cartilage tissue; (g) Mature smooth muscle tissue. (h) Mature hair follicles and sebaceous glands. Bar = 100 μm
图1. (a) 神经毡背景下的菊形团结构;(b) 嗜酸性细胞形成的神经管;(c) 神经母细胞瘤样结构;(d) 未成熟的胃肠腺体;(e) 成熟的骨组织;(f) 成熟的软骨组织;(g) 成熟的平滑肌组织;(h) 成熟的毛囊及皮脂腺;(i) AFP在未成熟的胃肠型腺体中的表达;(j) Ki-67在未成熟神经上皮中的表达;(k) SALL-4在未成熟神经上皮中的表达;(l) Vimentin在未成熟畸胎瘤中的表达。Bar = 100 μm
3.3. HE染色结果
17例肿瘤组织均含有不等量的未成熟成分及来源于内、中、外胚层的成熟组织,其中3例(病理分级为3级)含有较多未成熟成分,11例(病理分级为1、2级)含有较少未成熟成分。在1级的未成熟的畸胎瘤中,含有大量成熟组织,但这些组织中混杂着稀疏的细胞、松散的原始间充质组织,偶见核分裂。2级、3级的未成熟畸胎瘤,镜下可见由高柱状的嗜碱性细胞向心性排列形成的含有较多核分裂像的菊形团样结构(图1(a));细胞嗜碱性、核深染的原始神经管,衬附复层细胞,排列较拥挤,染色质呈细颗粒状(图1(b));可见小圆蓝细胞呈巢团状、实性分布的原始神经上皮结构,(图1(c))。部分组织偶尔可见不成熟的胃肠或肾脏组织(图1(d))。部分组织可查见成熟的成分如骨组织(图1(e))、软骨组织(图1(f)),平滑肌组织(图1(g))及毛囊、皮脂腺(图1(h)),其中存在两例患者,肿瘤组织内查见甲状腺组织。17例肿瘤组织均有不同程度的出血或坏死,即发生在所有级别的肿瘤,但最常见的是2级和3级畸胎瘤,主要出现在不成熟的区域。
3.4. 免疫组化
17例未成熟神经外胚层组织均表达NSE、S-100;不成熟的胃肠腺体AFP(+) (图1(i)),Ki-67增值指数为20%~75% (图1(j)),不成熟的神经成分SALL-4(+) (图1(k)),vimentin在一例病理分级为3级的肿瘤中广泛表达(图1(l))。
4. 讨论
4.1. 临床特征
恶性卵巢生殖细胞肿瘤是一种罕见的肿瘤,起源于原始生殖细胞,约占所有卵巢恶性肿瘤5%。通常是单侧的,发生在青少年和年轻妇女。组织学肿瘤类型主要有未成熟畸胎瘤、无性生殖细胞瘤和卵黄囊瘤,未成熟畸胎瘤占35%~38% [2]。卵巢未成熟畸胎瘤的研究多为回顾性的分析为主,多发生于儿童和青年,本研究中平均发病年龄为25.4岁,与其他研究相似 [1] [3]。未成熟畸胎瘤缺乏特异性的症状,但肿瘤体积一般较大,可表现为盆腔或下腹部的肿块,所以主要症状为腹痛、腹胀或腹部包块,大约有10%的患者由于肿瘤扭转或破裂引起急腹症 [4] [5] [6]。我们的研究中患者首次就诊原因,6例为腹部包块,11例为腹胀伴有不同程度的腹痛。未成熟畸胎瘤多位单侧发病,部分病例合并对侧的成熟性畸胎瘤,本研究中17例未成熟畸胎瘤患者,均为单侧发病。卵巢未成熟畸胎瘤种植转移或种植发生率较高,转移灶或种植灶的形态和组织分级可与卵巢原发的未成熟畸胎瘤不同,原发瘤切除后部分转移灶可自行消退 [7]。本研究中,存在一例发生直肠前壁种植的患者,术后种植灶病理结果为未成熟性畸胎瘤(3级)。卵巢未成熟畸胎瘤的术前的初步诊断,在超声的表现为内部回声出现“破絮状”或内部回声呈现“粗网格状”,回声程度为中等回声。MRI与CT的检查,大多数的未成熟畸胎瘤为实性及囊性成分混合存在 [4]。
4.2. 病理特征
未成熟畸胎瘤由三层生殖细胞组织组成,即内胚层、中胚层、外胚层,组织学分级根据未成熟神经成分的多少分为1~3级 [8]。未成熟畸胎瘤组织学分最初是在1960年引入的 [9]。分级系统区分1级(罕见的未成熟组织灶)、2级(中等数量的未成熟组织,具有细胞异型性和有丝分裂活性)和3级(未成熟组织丰富),卵巢未成熟的三级分级系统已经使用了数十年,不同分级可接受的未成熟神经外胚层上皮的数量进一步量化,具体量化标准是基于未成熟(原始)神经外胚层上皮的显微镜尺寸,在40 × 镜下:1级,任何载玻片中小于1个视野;2级,1~3视野;3级,>3个视野。1994年提出了未成熟畸胎瘤的两级分级体系,认为肿瘤的低级别相当于3级中的1级未成熟畸胎瘤,肿瘤的高级别由2级和3级合并 [10]。目前,世界卫生组织(WHO)第五版(2020年)女性生殖道肿瘤的分类中已经将两种分级系统纳入 [11],进一步证实了肿瘤的分级与生物学行为之间的相关性。未成熟性畸胎瘤可与其他肿瘤性生殖细胞成分共存,如卵黄囊瘤、无性细胞瘤、胚胎性癌、绒毛膜癌和多胚瘤。实验室检查中AFP升高应提示病理医师进行更广泛的取材以排除卵黄囊瘤 [12],另有报道称AFP的升高可能证明肿瘤中含有较多的未成熟成分 [13] [14]。因此,它可以成为由2种或更多种肿瘤性生殖细胞成分组成的恶性生殖细胞肿瘤(混合性生殖细胞肿瘤)的一部分。如果患者有明显的未成熟畸胎瘤成分,当患者HE切片中查见原始的神经管及神经毡时可明确诊断,未成熟成分染色质呈现出细颗粒状,且有较多见的核分裂像,肿瘤的病理分级(镜下未成熟的神经上皮量进行分级)与临床预后相关及随后的治疗有关。未成熟的神经外胚层组织或原始的神经管组织是诊断的主要依据,未成熟的软骨组织,脂肪组织,骨及骨骼肌组织较多见,未成熟的肝、胃肠道和肾组织少见。本研究中17例患者均可查见未成熟的神经上皮,3例组织学分级为3级的肿瘤组织查见明显的神经外胚层组织或原始的神经管组织。未成熟畸胎瘤的免疫组化中NSE、S-100可用于未成熟神经成分的标记,一些常用的免疫组化如:Syn、GFAP常表达于成熟的神经组织成分。原始神经管细胞Ki-67常有较高表达,本研究中Ki-67表达率为15%~75%。AFP在未成熟畸胎瘤的诊断中得到广泛的应用,可表达在未成熟畸胎瘤中的未成熟的胃肠型腺管、未成熟肝脏样组织及神经节样细胞中 [15];vimentin,细胞骨架蛋白与肿瘤细胞的侵袭、黏附能力和细胞连接等相关 [16],vimentin在肿瘤组织中的高表达则表示肿瘤的分化程度较低。
4.3. 治疗与预后
卵巢未成熟畸胎瘤首选手术治疗。临床上,未成熟畸胎瘤患者,双侧肿瘤较罕见,所以较多使用的手术方式为:保留生育能力的单侧附件切除术。对于未成熟畸胎瘤,不同年龄段的治疗手段存在着差异,对于年轻女性,临床上较常见的手术方式是保留生育功能,进性单侧附件切除。卵巢未成熟畸胎瘤的预后主要与肿瘤的组织学分级、分期及种植瘤的分级相关 [17],2020年一项回顾性研究,分析回顾来了75例卵巢未成熟畸胎瘤患者,结果表明:保留生育能力手术后早期单纯不成熟畸胎瘤的总体预后良好 [18]。另外有研究通过回顾性分析了,报道了未成熟畸胎瘤患儿的预后情况,若AFP水平较低,即使是组织学分级为3级的患者,在经手术切除未成熟畸胎瘤后,可不进行化疗 [19]。
4.4. 鉴别诊断
未成熟性畸胎瘤需要与成熟性畸胎瘤及癌肉瘤相鉴别。主要的鉴别点就是成熟性畸胎瘤及癌肉瘤不含有未成熟的神经外胚层成分,SALL-4等免疫组化可帮助诊断,有些未成熟畸胎瘤,主要由成熟组织构成,仅含有少量未成熟成分,所以容易被误诊为成熟畸胎瘤,但术后一年内可复发,在对原发肿瘤切片进行回顾后,部分畸胎瘤组织可以查见少量未成熟成分,因此要对肿瘤进行充分的取材,避免误诊。
文章引用
张 华,秦 瑞. 17例卵巢未成熟畸胎瘤临床病理观察并文献复习
Clinicopathological Observation and Literature Review of 17 Cases of Immature Teratoma of Ovary[J]. 临床医学进展, 2022, 12(12): 11624-11630. https://doi.org/10.12677/ACM.2022.12121675
参考文献
- 1. Deodhar, K.K., Suryawanshi, P., Shah, M., et al. (2011) Immature Teratoma of the Ovary: A Clinicopathological Study of 28 Cases. Indian Journal of Pathology and Microbiology, 54, 730-735.
- 2. Smith, H.O., Berwick, M., Verschraegen, C.F., et al. (2006) Incidence and Survival Rates for Female Malignant Germ Cell Tumors. Obstetrics & Gynecology, 107, 1075-1085. https://doi.org/10.1097/01.AOG.0000216004.22588.ce
- 3. Trama, A., Bernasconi, A., Botta, L., et al. (2022) Late Mortality Reduction among Survivors of Germ Cell Tumors in Childhood and Adoles-cence in Europe: A Report from the PanCareSurFup Cohort. Pediatric Blood & Cancer, 69, e29991. https://doi.org/10.1002/pbc.29991
- 4. Frazer, J.L., Hook, C.E., Addley, H.C., et al. (2019) Recurrent Ovarian Immature Teratoma in a 12-Year-Old Girl: Implications for Management. Gynecologic Oncology, 154, 259-265. https://doi.org/10.1016/j.ygyno.2019.05.032
- 5. Brind’amour, A., De Guerke, L., Fortin, S., et al. (2020) Recur-rent High-Grade Ovarian Immature Teratoma with Peritoneal Dissemination. Journal of Pediatric and Adolescent Gyne-cology, 33, 586-589. https://doi.org/10.1016/j.jpag.2020.06.002
- 6. Nogales, F.F., Favara, B.E., Major, F.J., et al. (1976) Immature Teratoma of the Ovary with a Neural Component (“Solid” Teratoma). A Clinicopathologic Study of 20 Cases. Human Pathology, 7, 625-642. https://doi.org/10.1016/S0046-8177(76)80076-7
- 7. Vicus, D., Beiner, M.E., Clarke, B., et al. (2011) Ovarian Immature Teratoma: Treatment and Outcome in a Single Institutional Cohort. Gynecologic Oncology, 123, 50-53. https://doi.org/10.1016/j.ygyno.2011.06.037
- 8. Norris, H.J., Zirkin, H.J. and Benson, W.L. (1976) Immature (Malignant) Teratoma of the Ovary: A Clinical and Pathologic Study of 58 Cases. Cancer, 37, 2359-2372. https://doi.org/10.1002/1097-0142(197605)37:5<2359::AID-CNCR2820370528>3.0.CO;2-Q
- 9. Thurlbeck, W.M. and Scully, R.E. (1960) Solid Teratoma of the Ovary. A Clinicopathological Analysis of 9 Cases. Cancer, 13, 804-811. https://doi.org/10.1002/1097-0142(196007/08)13:4<804::AID-CNCR2820130423>3.0.CO;2-V
- 10. O’connor, D.M. and Norris, H.J. (1994) The Influence of Grade on the Outcome of Stage I Ovarian Immature (Malignant) Terato-mas and the Reproducibility of Grading. International Journal of Gynecological Pathology, 13, 283-289. https://doi.org/10.1097/00004347-199410000-00001
- 11. Mccluggage, W.G., Singh, N. and Gilks, C.B. (2022) Key Changes to the World Health Organization (WHO) Classification of Female Genital Tumours Introduced in the 5th Edition (2020). Histopathology, 80, 762-778. https://doi.org/10.1111/his.14609
- 12. Lobo, J., Gillis, A.J.M., Jerónimo, C., et al. (2019) Human Germ Cell Tu-mors Are Developmental Cancers: Impact of Epigenetics on Pathobiology and Clinic. International Journal of Molecular Sciences, 20, 258. https://doi.org/10.3390/ijms20020258
- 13. Cushing, B., Giller, R., Ablin, A., et al. (1999) Surgical Resection Alone Is Effective Treatment for Ovarian Immature teratoma in Children and Adolescents: A Report of the Pediatric On-cology Group and the Children’s Cancer Group. American Journal of Obstetrics & Gynecology, 181, 353-358. https://doi.org/10.1016/S0002-9378(99)70561-2
- 14. Terenziani, M., D’angelo, P., Inserra, A., et al. (2015) Ma-ture and Immature Teratoma: A Report from the Second Italian Pediatric Study. Pediatric Blood & Cancer, 62, 1202-1208. https://doi.org/10.1002/pbc.25423
- 15. Hiroshima, K., Toyozaki, T., Iyoda, A., et al. (2001) Apoptosis and Proliferative Activity in Mature and Immature Teratomas of the Mediastinum. Cancer, 92, 1798-1806. https://doi.org/10.1002/1097-0142(20011001)92:7<1798::AID-CNCR1696>3.0.CO;2-V
- 16. Kawai, M., Kano, T., Kikkawa, F., et al. (1992) Seven Tumor Markers in Benign and Malignant Germ Cell Tumors of the Ovary. Gynecologic Oncology, 45, 248-253. https://doi.org/10.1016/0090-8258(92)90299-X
- 17. Bentivegna, E., Azaïs, H., Uzan, C., et al. (2015) Surgical Outcomes after Debulking Surgery for Intraabdominal Ovarian Growing Teratoma Syndrome: Analysis of 38 Cases. Annals of Surgical Oncology, 22, S964-S970. https://doi.org/10.1245/s10434-015-4608-y
- 18. Wang, D., Zhu, S., Jia, C., et al. (2020) Role of Staging Surgery and Adjuvant Chemotherapy in Adult Patients with Apparent Stage I Pure Immature Ovarian Teratoma after Fertili-ty-Sparing Surgery. International Journal of Gynecological Cancer, 30, 664-669. https://doi.org/10.1136/ijgc-2019-001116
- 19. Shinkai, T., Masumoto, K., Chiba, F., et al. (2020) Pediatric Ovarian Immature Teratoma: Histological Grading and Clinical Characteristics. Journal of Pediatric Surgery, 55, 707-710. https://doi.org/10.1016/j.jpedsurg.2019.04.037
NOTES
*通讯作者。
