Hans Journal of Food and Nutrition Science
Vol.
08
No.
04
(
2019
), Article ID:
33165
,
8
pages
10.12677/HJFNS.2019.84039
Effect of Enzymatic Glycosylation Modification on the Structure and Properties of Casein
Yongkang Fan, Ting Xiang, Xiaoqin Wu, Yufeng Chen, Jianfu Shen*
College of Biosystem Engineering and Food Science, Zhejiang University, Hangzhou Zhejiang

Received: Nov. 4th, 2019; accepted: Nov. 20th, 2019; published: Nov. 27th, 2019

ABSTRACT
The structure of casein was analyzed by FTIR, CD and DSC by using transglutaminase as catalyst and chitosan oligosaccharide as acyl receptor. The results showed that the secondary structure of casein after glycosylation modification became more orderly, and DSC results showed that the thermal stability of casein was enhanced. The emulsifying activity, emulsion stability and surface hydrophobicity of casein and its modified products were analyzed. The results showed that the emulsifying activity of the modified product was reduced, and the emulsion stability and surface hydrophobicity were improved.
Keywords:Casein, Chitosan Oligosaccharide, Transglutaminase, Structure, Nature
酶法糖基化修饰对酪蛋白结构及性质的影响
樊永康,项婷,吴晓琴,陈玉峰,沈建福*
浙江大学生物系统工程与食品科学学院,浙江 杭州

收稿日期:2019年11月4日;录用日期:2019年11月20日;发布日期:2019年11月27日

摘 要
以转谷氨酰胺酶为催化剂,壳寡糖为酰基受体,通过糖基化修饰酪蛋白,利用FTIR、CD、DSC对酪蛋白的结构进行分析。结果表明:酪蛋白经糖基化修饰之后的二级结构变得更加有序,DSC结果表明酪蛋白热稳定性有所增强。对酪蛋白及其修饰产物的乳化活性、乳化稳定性、表面疏水性进行分析。结果表明修饰产物的乳化活性有所降低,乳化稳定性和表面疏水性有所提高。
关键词 :酪蛋白,壳寡糖,转谷氨酰胺酶,结构,性质

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
酪蛋白(Cas)是牛乳中含量最多的蛋白质,约占牛奶蛋白80%左右,包括以下4个组分:αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白组成,它们在牛奶中的比例约为40:10:35:15,分子量在19 kDa~25 kDa [1]。酪蛋白是牛乳中营养价值最丰富的蛋白质,含有人体必需的8种氨基酸,为人体发育提供必要的营养物质。对酪蛋白进行糖基化改性可以提高酪蛋白的性质使其更好地应用于食品工业中。
在食品工业中,常采用美拉德反应来改善蛋白质的溶解性、乳化性、流变性,表面疏水性等性质。但是,该反应存在反应时间长、反应条件难以控制、产物营养成分下降等缺点 [2]。微生物转谷氨酰胺酶(transglutaminase, TGase)是一种可以催化蛋白质分子之间发生共价交联的酰基转移酶,广泛应用于食品加工中。TGase催化的酰基转移反应中,谷氨酰胺残基上的甲酰胺基提供酰基供体,赖氨酸残基上的 -氨基作为酰基受体,就形成了蛋白质分子内和分子间的交联反应。当酰基受体由壳寡糖、氨基葡萄糖等含有伯氨基团的糖提供时,则蛋白质的酶法糖基化和分子内分子间的交联反应同时进行 [3]。付淼等 [4] 利用分子量大于5 kDa的壳寡糖来修饰酪蛋白和大豆蛋白并对它们的性质进行研究,结果表明糖基化产物的持水性、吸油性、表面疏水性等性质都有所提高。曲悦等 [5] 利用低聚氨基葡萄糖糖基化修饰玉米醇溶蛋白并对修饰产物的结构和流变学特性进行了研究,结果表明糖基化之后的玉米醇溶蛋白的热稳定性和表观黏度都显著提高。
酪蛋白是牛乳中含量最多也是营养最为丰富的蛋白质,因此对酪蛋白进行修饰改性提高其功能性质具有重大的意义。本研究在前人研究的基础上,采用分子量为1.5 kDa的壳寡糖修饰酪蛋白,并对修饰产物的结构和性质进行测定,为进一步拓宽酪蛋白的应用提供理论依据。
2. 实验部分
2.1. 试剂与仪器
酪蛋白,辣根过氧化酶,蛋白质Mark购自上海阿拉丁生化科技有限公司;壳寡糖(分子量1 kDa,Cos),购自浙江金壳药业有限公司;转谷氨酰胺酶(TGase,酶活:130 U/g),由江苏一鸣精细化工有限公司提供;无水乙醇、浓盐酸、氢氧化钠、氯化钙、三氯乙酸,均为市售分析纯,购自上海国药试剂有限公司。
冷冻干燥机,德国 Christ 公司;AVATAR370傅里叶红外光谱仪,美国NICOLET公司;SLHW-4四联加热数显恒温磁力搅拌器,杭州仪表电机有限公司;Bio-rad电泳仪,美国伯乐公司;FVS-6000圆二色谱,购自日本JASCO公司;Cary Eclipse荧光分光光度计,美国VARIAN公司;UV-2600紫外可见分光光度计,日本岛津公司。
2.2. 方法
2.2.1. 酪蛋白糖基化交联及修饰产物的制备
参考王晓杰 [6] 的方法并作修改,将质量浓度为10 g/L的Cas与质量浓度为20 g/L的Cos按体积比2:3混合,TGase的添加量为20 U/g酪蛋白,用1 mol/L的NaoH调节溶液pH值至7.5,混匀溶液置于37℃的水浴锅中水浴震荡加热4 h。反应结束后,将样品置于85℃的水浴锅中加热灭酶5 min,冷却至室温。调节pH值至4.6,离心并收集沉淀,将沉淀用pH为4.6的等电点水水洗两次,在水中分散并用1 mol/L的NaoH调节pH值至7.0,冻干,得到Cas-Cos糖基化产物。Cas-Cas自交联产物按照同样的方法制备,将Cos溶液换成水,其余不变。
2.2.2. 傅里叶红外光谱(FTIR)
采用溴化钾压片法进行傅里叶红外光谱分析,扫描波长为400~4000 cm−1。
2.2.3. 圆二色谱(CD)
参考刘夫国 [7] 的方法,并作适当修改。采用远紫外圆二色谱法研究糖基化交联对蛋白质二级结构的影响。分别用PBS缓冲液(pH 7.0)配制浓度为0.2 g/L的Cas、Cas-Cas、Cas-Cos溶液,然后置于1 mm的样品池中,设定温度为25℃,扫描速度50 nm/min,扫描范围185~260 nm,重复扫描3次,记录扫描光谱。
2.2.4. 差示扫描量热分析(DSC)
参考冯进 [8] 的方法。取2 mg~10 mg的冻干样品置于铝盘上,然后用铝盖密封,空盘作为对照。氮气流速为25 mg/mL,样品升温范围为25℃~200℃,升温速度为10℃/min。使用软件分析熔融峰温度(Tp)和焓变( )。
2.2.5. 乳化活性和乳化稳定性的测定
参考文献 [9] 并作适当修改,将样品用0.1 mol/L的磷酸盐缓冲液(pH值为7.0)溶解成为0.5 g/L的蛋白质溶液,取75 mL蛋白质溶液与25 mL牡丹籽油混合,于12,000 r/min均质1 min,静置10 min。乳化液分别在0 min和静止10 min时用移液器取出,用质量浓度为1 g/L的SDS溶液稀释100倍,混匀,于500 nm处测定吸光度(用1 g/L的SDS调零)。乳化活性(EAI)和乳化稳定性(ESI)按照下式计算:
(1)
(2)
式中:T——2.303;A0——0 min时的吸光值;C——蛋白质浓度(g/L); ——油相体积分数,为1/4;A10——静置10 min后的吸光值。
2.2.6. 表面疏水性
参考文献 [10] 的方法来测定蛋白质的表面疏水性。将2.2.1中的冻干样品用0.1 mol/L的磷酸盐缓冲液(pH值为7.0)溶解成为浓度为10 g/L的蛋白质溶液,样品于10,000 g离心15 min,收集上清液,再将其稀释成为0.1~0.5 g/L。以1-苯胺-8-萘-磺酸盐(ANS)作为荧光探针,取4 mL稀释好的不同浓度的蛋白质溶液,加入20 的ANS (用0.1 mol/L,pH为7.0的磷酸盐缓冲液配制成8.0 mmol/L),避光反应15 min,用Cary Eclipse 荧光分光光度计检测样品的相对荧光强度。参数设置:激发波长为390 nm;发射波长为470 nm;狭缝为5 nm。以蛋白质浓度的百分含量为横坐标,相对荧光强度为纵坐标作图,斜率为样品的表面疏水性的值。
2.3. 数据处理
所得数据使用Origin 8.0绘制相关图表,使用SPSS20.0对其进行方差分析(ANOVA),且利用邓肯式多重比较对差异显著性进行分析(P < 0.05:具有显著性差异),图中字母完全不同的两组数据具有显著性差异。每次测试前需更换样品,且每组实验均重复3次。
3. 实验结果与讨论
3.1. 傅里叶红外光谱(FTIR)
FTIR用来评估蛋白质分子化学基团的振动强弱,对蛋白质样品在400~4000 cm−1进行扫描,得到Cas、Cos、Cas-Cas、Cas-Cos的扫描图谱。如图1所示,与Cas和Cas-Cas相比,Cas-Cos在3300~3600 cm−1之间有更宽的吸收峰、基团的振动幅度更强且最大吸收峰发生了位移,Cas-Cas和Cas-Cos都向左移动了11 nm,这表明蛋白质的-NH2发生了反应。研究表明,此处为O-H和N-H基团的伸缩振动特征区(酰胺A带) [11]。Cas-Cas和Cas-Cos在1652 cm−1处也表现出更大的吸收峰(酰胺I带,代表C-O伸缩和C-N伸缩) [12]。同时,Cas-Cos在1000~1150 cm−1也有着较强的吸收峰,此处为O-H的变形振动特征吸收区 [11]。这也说明了Cas-Cos接入了更多的羟基。对于Cos,其在1037 cm−1处有较强的吸收峰,这是C-O和C-C的伸缩振动以及C-H的变形振动。在Cos共价接入Cas后,这个峰在Cas中的强度减弱,这是因为壳寡糖为多羟基化合物,它与酪蛋白的谷氨酰胺基团反应之后增加了肽链上的羟基数量。因此在FTIR光谱上可以看到Cas-Cos的羟基振动加强。以上研究表明,酶法糖基化修饰蛋白质会导致一些蛋白质和多糖中的一些功能性基团增强或减弱,也会导致基团发生位移,这与美拉德糖基化的研究一致 [13] [14]。
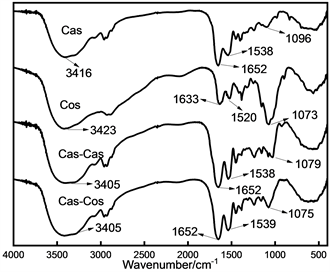
Figure 1. Infrared spectrum of Cas and its modified products
图1. Cas及其修饰产物的红外光谱图
3.2. 圆二色谱(CD)
蛋白质肽键在远紫外波长185~260 nm处具有圆二色性,所以,CD光谱常用来评估蛋白质的二级结构的变化。Cas、Cas-Cas和Cas-Cos的CD光谱如图2所示,从图中可以看出,Cas和修饰产物表现出不同的二级结构特征。与Cas相比,Cas-Cas和Cas-Cos在200 nm处的椭圆率的绝对值减小,这是无规卷曲的典型吸收峰 [15],这表明Cas-Cas和Cas-Cos的无规卷曲结构减少;其次,Cas-Cos在215 nm和220 nm处有更大的负的椭圆率,这两处分别代表β-折叠和α-螺旋结构。在220~230 nm范围内,Cas-Cos同样具有更大的负的椭圆率,这一范围是β-转角的特征吸收区域。综上所述,Cas经过糖基化之后,二级结构中的有序结构(α-螺旋、β-折叠、β-转角)增加,无规卷曲数量减少,酶法糖基化使Cas的二级结构变得更加有序。这与Fu等 [16] 研究一致。另外,Zhang等 [17] 利用美拉德反应制备山茶籽蛋白–阿拉伯糖糖基化产物,并对产物的二级结构进行分析。与山茶籽蛋白相比,修饰产物的β-折叠含量显著上升,无规卷曲的含量下降,二级结构变得更加有序。

Figure 2. CD spectrum of Cas and its modified products
图2. Cas及其修饰产物的CD光谱图
3.3. 差示扫描量热分析(DSC)
DSC作为一种热效应的分析手段,可以有效的分析物质的热稳定性。从图3和表1中可以看出,Cas的熔融峰温度(Tp)和ΔH (焓变)分别为72.17℃和267.13 J/g,而Cas-Cas和Cas-Cos的Tp和ΔH分别81.97℃、271.51 J/g和85.62℃、293.95 J/g。Tp表示蛋白质的热稳定性,Tp越高,表明蛋白质具有更好的热稳定性,从而表明了TGase催化的糖基化使Cas形成了分子量更大的化合物。ΔH与蛋白质的构象有关,ΔH的绝对值越高,说明蛋白质的二级结构越有序,这一结果也与CD光谱的结果相符。Yang等 [18] 利用TGase协同壳寡糖糖基化修饰铁蛋白,结果表明修饰之后的产物具有更高的Tp和ΔH。Sareh等 [19] 利用美拉德反应制备大豆分离蛋白–葡聚糖糖基化产物。DSC表明,与大豆分离蛋白相比,糖基化产物的Tp都有所增加,从73.8℃增加至80.5℃;但ΔH有所下降,从3.2 J/g降低至2.1 J/g。这说明美拉德反应导致蛋白质二级有序结构减少,这可能是由于美拉德反应温度过高,破坏了蛋白质的构象。
Table 1. Melting peak temperature and enthalpy change of Cas and its modified products
表1. Cas及其修饰产物的熔融峰温度和焓变
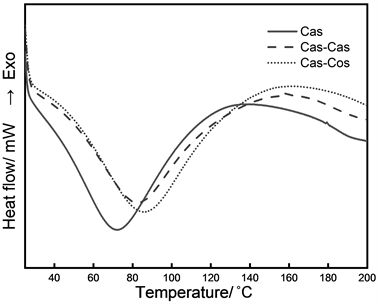
Figure 3. DSC heat map of Cas and its modified products
图3. Cas及其修饰产物的DSC热量图谱
3.4. 乳化活性和乳化稳定性
对Cas、Cas-Cas和Cas-Cos的乳化活性和乳化稳定性进行评价,结果如图4所示。Cas经过糖基化交联修饰之后,它的乳化活性指数有所降低。Cas、Cas-Cas和Cas-Cos的乳化活性指数分别为65.17 m2/g、48.13 m2/g、53.29 m2/g;而乳化稳定性指数有所上升,分别为41.27%、38.44%、46.95%。这表明Cas发生自交联之后,其乳化活性和乳化稳定性都会有一定程度上的下降,而糖基化能够提高其乳化活性和乳化稳定性。与Cas相比,糖基化之后的产物的乳化稳定性提高更多。Liu等 [20] 利用干法美拉德反应制备卵白蛋白–葡萄糖糖基化产物,并对产物的乳化活性和乳化稳定性进行分析。结果表明,糖基化产物的乳化活性和乳化稳定性都有一定的提高。乳化活性从30 m2/g增加到47 m2/g,乳化稳定性从26%增加到38%。这样的结果表明,TGase和美拉德反应的糖基化都能增加蛋白质的乳化稳定性,但TGase催化的糖基化产物的乳化活性有一定程度上的下降。

Figure 4. Emulsification activity and emulsion stability of Cas and its modified products
图4. Cas及其修饰产物的乳化活性及乳化稳定性
3.5. 表面疏水性(H0)
Cas、Cas-Cas和Cas-Cos的表面疏水性如图5所示。Cas的表面疏水性为559,Cas-Cas和Cas-Cos的表面疏水性分别为1012和879。结果表明,Cas经过TGase催化之后,表面疏水性出现明显的增加,这可能是TGase催化使得Cas内部的疏水基团暴露在表面,从而增加了Cas的表面疏水性。但是,Cas经过TGase糖基化修饰之后,其表面疏水性有一定程度上的下降,这表明糖基的接入会降低Cas的表面疏水性。这可能壳寡糖是多羟基分子,其共价接入Cas后,在一定程度上会降低Cas的表面疏水性。由于Cas-Cos是糖基化交联蛋白,所以其表面疏水性仍高于Cas。Xu等 [21] 利用美拉德反应制备大豆分离蛋白–麦芽糖糖基化产物,并对产物的表面疏水性进行测定。结果表明,与大豆分离蛋白相比,修饰产物的表面疏水性有所降低,从4229降低到3082,这也同样表明美拉德反应为蛋白质引入更多的亲水性基团,从而降低了蛋白质的表面疏水性。

Figure 5. Surface hydrophobicity of Cas and its modified products
图5. Cas及其修饰产物的表面疏水性
4. 结论
本文利用TGase糖基化修饰酪蛋白,并对酪蛋白及修饰产物的结构和性质进行表征。结果表明:利用FTIR、CD、DSC对酪蛋白及修饰产物的结构进行表征。FTIR图谱表明了酪蛋白在经过糖基化修饰后引入了更多的O-H基团。CD光谱表明酪蛋白在经过糖基化修饰之后,其二级结构中的有序结构增加(β-折叠、α-螺旋),无规卷曲减少。DSC热量图谱表明酪蛋白在经过修饰之后,其热稳定性有所增强。对酪蛋白及修饰产物的乳化活性、乳化稳定性、表面疏水性进行测定,结果表明,糖基化之后的酪蛋白乳化活性有所降低,从65.17 m2/g降低至53.29 m2/g;乳化稳定性增强,从41.27%增加至46.95%;表面疏水性有所增加,从556增加至879。
文章引用
樊永康,项 婷,吴晓琴,陈玉峰,沈建福. 酶法糖基化修饰对酪蛋白结构及性质的影响
Effect of Enzymatic Glycosylation Modification on the Structure and Properties of Casein[J]. 食品与营养科学, 2019, 08(04): 296-303. https://doi.org/10.12677/HJFNS.2019.84039
参考文献
- 1. Fox, P.F. (2003) Milk Proteins: General and Historical Aspects. In: Fox, P.F. and McSweeney, P.L.H., Eds., Advanced Dairy Chemistry-Proteins, Springer, New York, 1-48.
https://doi.org/10.1007/978-1-4419-8602-3_1 - 2. Zhu, D., Damodaran, S. and Lucey, J.A. (2008) Formation of Whey Protein Isolate (WPI)? Dextran Conjugates in Aqueous Solutions. Journal of Agricultural and Food Chemistry, 56, 7113-7118.
https://doi.org/10.1021/jf800909w - 3. Motoki, M. and Seguro, K. (1998) Transglutaminase and Its Use for Food Processing. Trends in Food Science & Technology, 9, 204-210.
https://doi.org/10.1016/S0924-2244(98)00038-7 - 4. Fu, M. (2011) Effects of TGase-Induced Chitosan Oligo-saccharide Glycosylation and Cross-Linking on the Properties of Two Proteins. Northeast Agricultural University, Haerbin.
- 5. Qu, Y., Wang, X.J., Liu, X.L., et al. (2018) Effects of Enzymatic Glycosylation Modification on the Structure and Rheological Properties of Zein. Food and Machinery, 34, 11-14.
- 6. Wang, X.J., Liu, X.L., Cong, W.S., et al. (2018) Glycosylation Modification and Product Properties of Corn Gluten-Soluble Protease. Journal of Chinese Institute of Food Science and Technology, 18, 141-148.
- 7. Liu, F.G. (2017) Preparation of Pro-tein-Polyphenol-Carbohydrate Covalent Complex and Its Steady-State Effect on Functional Factors. China Agricultural University, Beijing.
- 8. Feng, J. (2017) Preparation and Characterization of Bioactive Substance Carrier Based on Glucose Gemini Surfactant and Ovalbumin. Zhejiang University, Hangzhou.
- 9. Jiang, S.J., Feng, Z. and Zhao, X.H. (2011) Casein Transglutaminase Enzymatic Glycosylation Cross-Linking Conditions and Product Properties. China Dairy Industry, No. 7, 25-28.
- 10. Hayakawa, S. and Nakai, S. (1985) Relationships of Hydrophobicity and Net Charge to the Solubility of Milk and Soy Proteins. Journal of Food Science, 50, 486-491.
https://doi.org/10.1111/j.1365-2621.1985.tb13433.x - 11. Sheng, L., Sun, P., Han, K., et al. (2017) Synthesis and Structural Characterization of Lysozyme-Pullulanconjugates Obtained by the Maillard Reaction. Food Hydrocolloids, 71, 1-7.
https://doi.org/10.1016/j.foodhyd.2017.04.026 - 12. Guo, X.B., Guo, X.M., Yu, S.J. and Kong, F. (2018) Influences of the Different Chemical Components of Sugar Beet Pectin on the Emulsifying Performance of Conjugates Formed between Sugar Beet Pectin and Whey Protein Isolate. Food Hydrocolloids, 82, 1-10.
https://doi.org/10.1016/j.foodhyd.2018.03.032 - 13. Mao, L., Pan, Q.Y., Hou, Z.Q., Yuan, F. and Gao, Y.X. (2018) Development of Soy Protein Isolate-Carrageenan Conjugates through Maillard Reaction for the Microencapsu-lation of, Bifidobacterium Longum. Food Hydrocolloids, 84, 489-497.
https://doi.org/10.1016/j.foodhyd.2018.06.037 - 14. Zha, F.C., Dong, S.Y., Rao, J.J. and Chen, B. (2019) The Structural Modification of Pea Protein Concentrate with Gum Arabic by Controlled Maillard Reaction Enhances Its Functional Properties and Flavor Attributes. Food Hydrocolloids, 92, 30-40.
https://doi.org/10.1016/j.foodhyd.2019.01.046 - 15. Johnson, W.C. (1990) Protein Secondary Structure and Cir-cular Dichroism: A Practical Guide. Proteins Structure Function and Genetics, 7, 205-214.
https://doi.org/10.1002/prot.340070302 - 16. Fu, M. and Zhao, X.H. (2017) Modified Properties of a Glycated and Cross-Linked Soy Protein Isolate by Transglutaminase and an Oligochitosan of 5 kDa. Journal of the Science of Food and Agriculture, 97, 58-64.
https://doi.org/10.1002/jsfa.7682 - 17. Yang, R., Zuo, P., Zhang, M., et al. (2019) Transglutaminase Induced Oligochitosan Glycosylation of Ferritin as a Novel Nanocarrier for Food Bioactive Molecules. Food Hydrocolloids, 94, 500-509.
https://doi.org/10.1016/j.foodhyd.2019.03.049 - 18. Boostani, S., Aminlari, M., Moosavi-Nasab, M., Niakosari, M. and Mesbahi, G. (2017) Fabrication and Characterization of Soy Protein Isolate-Grafted Dextran Biopolymer: A Novel Ingredient in Spray-Dried Soy Beverage Formulation. International Journal of Biological Macromolecules, 102, 297-307.
https://doi.org/10.1016/j.ijbiomac.2017.04.019 - 19. Zhang, S.Y., Zheng, L.L., Zheng, X.Y., et al. (2019) Effect of Steam Explosion Treatments on the Functional Properties and Structure of Camellia (Camellia oleifera Abel.) Seed Cake Protein. Food Hydrocolloids, 93, 189-197.
https://doi.org/10.1016/j.foodhyd.2019.02.017 - 20. Liu, L., Li, Y., Prakash, S., Dai, X. and Meng, Y.Y. (2018) Enzymolysis and Glycosylation Synergistic Modified Ovalbumin: Functional and Structural Characteristics. International Journal of Food Properties, 21, 395-406.
https://doi.org/10.1080/10942912.2018.1424198 - 21. Xu, W. and Zhao, X.H. (2019) Structure and Property Changes of the Soy Protein Isolate Glycated with Maltose in an Ionic Liquid through the Maillard Reaction. Food & Function, 10, 1948-1957.
https://doi.org/10.1039/C9FO00096H
NOTES
*通讯作者。
