Hans Journal of Agricultural Sciences
Vol.08 No.08(2018), Article ID:26452,12
pages
10.12677/HJAS.2018.88133
QTL Mapping of Drought Resistance in Seedling Stage of Seven Maize-Large Humble Grass Recombinant Inbred Lines
Jingwei Lin1*, Xiao Han1*, Siya Zhou1, Haoge Li1, Shuisen Chen1, Lijun Zhang1,2, Zhenhai Cui1,2, Yanye Ruan1,2#
1Liaoning Province Research Center of Plant Genetic Engineering Technology, Liaoning Province Key Laboratory of Agricultural Technology, College of Bioscience and Biotechnology, Shenyang Agricultural University, Shenyang Liaoning
2Beijing Key Laboratory of Crop, National Maize Improvement Center of China, China Agricultural University, Beijing

Received: Jul. 31st, 2018; accepted: Aug. 9th, 2018; published: Aug. 16th, 2018

ABSTRACT
In order to achieve drought resistance breeding of maize, the influence of various shape index shapes on maize drought resistance was explored. In this experiment, QTL mapping was carried out in the RIL group of maize-large straw recombinant inbred lines (MX) for the control of maize plant height, root length, plant fresh weight, root fresh weight, plant dry weight, root dry weight and root-crown ratio of 7 characters. The results showed that plant height, root length, root fresh weight, dry weight, root dry weight and root-crown ratio had higher heritability, which was influenced by genotype. Of the 11 QTLs to be located, 9 primary QTLs were obtained, they were located on 2nd, 3rd, 4th, 5th and 8th chromosome, of which 1 came from plant height traits, 2 from root length characters, 2 from root fresh weight traits, 1 from dry weight traits, 2 from root dry weight traits, and 1 from root and crown ratio traits. The phenotypic contribution rate is from 6.0% (qMXRSR5) to 10.25% (qmxdrw3-2). The results of this study are helpful to further study the genetic basis of various drought resistance traits in maize, especially in seedling stage, and provide theoretical basis and reference for improving the quality of maize varieties by molecular breeding.
Keywords:Maize, Drought Resistance of Seedling Stage, QTL Mapping, Recombinant Inbred Lines
七个玉米–大刍草重组自交系苗期抗旱性形态指标QTL定位
林景卫1*,韩笑1*,周思雅1,李浩戈1,陈水森1,张立军1,2,崔震海1,2,阮燕晔1,2#
1沈阳农业大学生物技术学院,辽宁农业技术重点实验室,辽宁省植物基因工程技术研究中心,辽宁 沈阳
2中国农业大学,国家玉米改良中心,北京市作物重点实验室,北京

收稿日期:2018年7月31日;录用日期:2018年8月9日;发布日期:2018年8月16日

摘 要
为了实现玉米抗旱育种,探究各形态指标形状对玉米抗旱性的影响,本试验以玉米–大刍草重组自交系(MX RIL)群体为材料,对苗期调控玉米株高、根长、株鲜重、根鲜重、株干重、根干重以及根冠比7个性状的基因进行QTL定位分析。结果表明,株高、根长、根鲜重、株干重、根干重以及根冠比具有较高的遗传性,受基因型的影响。从定位到的11个QTL中,得到9个主效QTL,分别位于2,3,4,5和8号染色体上,其中1个来自株高性状,2个来自根长性状,2个来自根鲜重性状,1个来自株干重性状,2个来自根干重性状,1个来自根冠比性状;表型贡献率从6.0% (qMXRSR5)到10.25% (qMXDRW3-2)。本研究结果有助于进一步研究玉米尤其是苗期多种抗旱性状的遗传基础,并为通过分子育种提高玉米品种的品质提供理论依据和参考。
关键词 :玉米,苗期抗旱性,QTL定位,重组自交系

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
玉米是世界上重要的粮食作物,同时,还是饲料、工业、能源等行业的重要原料。作为世界玉米生产与消费的第二大国,我国对玉米产量的需求急剧增加,玉米已成为国内第一大粮食作物 [1] 。然而,全国平均每年受旱面积2713万平方公顷,成灾面积900万平方公顷左右,直接减收粮食100亿千克以上,干旱已成为我国农业生产的最大挑战。胡端法等 [2] 指出干旱是制约我国玉米产量与生产的第一限制因素,干旱对玉米产量影响介于20%~50%。因此,培育抗旱种质、选育抗旱新品种和推广抗旱栽培等技术对提高玉米产量,保障我国的粮食安全具有十分重要的战略意义。
玉米对于干旱的胁迫较为敏感,而季节性干旱也已成为玉米生产的一个主要限制因素。干旱胁迫会使作物生长发育迟缓,进而影响作物的形态,使产量降低 [3] 。康绍忠 [4] 等认为,作物品质与品种、施肥、气候、水分、生长环境等多种因素有关,而水分是实现对作物品质改善的介质。由此可见,水分对玉米的品质及其农艺性状有着至关重要的影响。玉米抗旱的形态特征表现在方方面面,其中,根系形态特征通常表现为根系发达,根冠比大。Fischer等 [5] 指出,根的多少和重量与产量有关。而根的深度与产量无关,这就是说增大根冠比,对增强玉米品种的抗旱能力,从而提高干旱胁迫环境下的籽粒产量是有益的。杨成书等 [6] 在玉米品种抗旱性筛选鉴定中亦获得类似结果。在土壤水分和养分亏缺的情况下,玉米会增加根系的长度和细根的数量,结果表明干旱胁迫条件下玉米根系的生长发育对植株起着重要的作用。根的性状主要包括侧根数、根干重、主根长、根冠比等 [7] 。胡荣海 [8] 指出,胚根数较多的品种在干旱条件下存活率高,抗旱性较强,因而初生根条数可作为干旱环境下玉米的抗旱指标。有研究表明发芽后的胚根粗与抗旱性呈显著正相关。吴子恺 [9] 认为理想的抗旱玉米品种首先是苗期有较高的根苗比。在玉米株高方面,胡荣海 [8] 指出,在干旱情况下株高下降的百分数可作为评价品种抗旱性的指标。Johnson等(1992)和Fischer等 [5] 先后报道降低株高的选择对增强品种抗旱性是有利的。Balanos等 [10] 发现在干旱条件下经八轮全同胞轮回选择后的“Tuxpeno Sequia”玉米群体,抗旱性得到改良,株高平均每轮降低0.9%。有人认为理想的抗旱玉米品种植株较矮。张正斌等 [11] 研究认为干旱胁迫会影响玉米植株生长,导致玉米自交系开花–吐丝间隔天数(ASI)值增加,而株高和穗位高降低。于永涛等 [12] 认为,株高、穗位高、值等可以作为玉米耐旱性鉴选的形态指标,且通过形态指标的鉴选较为直接和简单 [12] 。
数量性状基因座(Quantitative Trait Locus),是指控制数量性状的基因在基因组中的位置。对QTL的定位必须使用遗传标记,人们通过寻找遗传标记和感兴趣的数量性状之间的联系,将一个或多个QTL定位到位于同一染色体的遗传标记旁,标记和QTL是连锁的。近几年QTL定位应用的较为广泛,在人类基因上与疾病有关的基因定位甚多;植物上,模式植物抗逆性基因的定位较多。分子标记技术及QTL定位技术的快速发展为玉米株型、根系等性状的QTL定位研究提供了基础保障,通过QTL定位研究,可以进一步确定玉米株型、根系等形态性状的QTL位置、数量及作用方式等,从而改良玉米遗传方向,大幅提髙玉米抗旱性。有研究表明,根系的数目及其在土壤中的分布(根系构型)与作物吸收水分和养分的能力密切相关 [13] 。并且良好的根系构型对干旱胁迫下的作物产量有很大的影响,其可以最大程度地吸收土壤中的水分和养分,从而有利于植物在干旱条件下的生长和发育。高世斌等 [14] 对田间两种水分条件下的玉米根数目、根重与产量的QTL进行了鉴定,发现虽然在正常条件下根性状与产量是没有显著正相关,但在干旱条件下根重与产量是显著正相关的,并且在第4号染色体和7号染色体上发现了与产量存在连锁的QTL位点。郑德波等 [15] 用复合区间作图模型对2个群体的株高、穗位高表型进行QTL定位分析。结果显示,在广西南宁和湖北武汉两种环境条件下共定位到21个株高QTL和27个穗位高QTL;单个QTL表型变异贡献率的变幅为4.9%~17.9%;株高和穗位高QTL的作用方式以加性和部分显性为主;第7染色体上可能存在控制株高和穗位高的主效QTL。何坤辉等 [16] 通过对玉米株高和穗位高进行多环境的QTL分析,结果显示玉米株高和穗位高的遗传受环境影响较大,大部分QTL只能在1种或2种环境中被检测到,3个主效QTL可以在3种及以上环境中被检测到,能够稳定地遗传,且贡献率高,有望在分子育种上得到应用。
本试验选取7个玉米形态性状,分别为:株高、根长、株鲜重、根鲜重、株干重、根干重及根冠比,利用已构建完成的Mo17 × 大刍草(Mo17/X26-4)连锁群体作为材料,基因分型采用IIIumina公司的MaizeSNP50芯片,本芯片包含56,110个SNP位点,通过连锁分析的方法,寻找并鉴定调控玉米7个形态性状的数量性状基因,从而为玉米抗旱性状品种的选育提供分子基础。
2. 材料与方法
2.1. 试验材料
本试验所构建的玉米群体由中国农业大学国家玉米改良中心杨小红教授提供:以自交系Mo17、X26-4为材料,构建的Mo17/X26-4重组自交系(RIL)群体,共191个自交系。其中,Mo17属于Lancaster类群,具有适应性广泛、抗倒伏等优点;X26-4为大刍草(Teosinte),是起源于墨西哥和中美洲一年生和多年生玉蜀黍属植物的统称 [17] [18] [19] 。
2.2. 干旱胁迫试验
供试玉米为MX(MO17/X26-4)RIL群体。试验分别于2015和2016年两年3~11月,在沈阳农业大学生物科学技术学院实验室种植,盆栽。所用花盆直径11 cm,高8 cm,每盆平均装土135 g。盆土以营养土与蛭石3:1的比例拌匀。每盆种植5粒种子,种植深度1 cm,种植后浇透水,待4~5 d发芽,每4天正常供应水分,至三叶一心期定苗,每盆留长势一致的苗3株。并在此时期进行水分胁迫,利用20%聚乙二醇(PEG6000)高渗溶液代替水进行浇灌,模拟干旱环境,平均每盆25 ml,7 d内胁迫两次,胁迫结束后测量相应株型数据。共进行两次重复。每个处理设置一盆对照组,不进行水分胁迫;两盆试验组进行干旱胁迫试验。
2.3. 性状测定与分析
2.3.1. 性状测定
株高:测量玉米苗最长叶叶尖到株间红点的长度。
根长:测量玉米苗株间红点到主根根尖的长度。
株鲜重:测量玉米苗主株部分重量。
根鲜重:测量玉米苗根部重量,去掉种子。
株干重:玉米苗在80℃的烘箱中烘干12小时,测量主株部分干重。
根干重:玉米苗在80℃的烘箱中烘干12小时,测量根部干重。
根冠比 = 根干重/株干重。
2.3.2. 统计分析
所有统计用SAS软件执行操作。混合线性模型拟合获得最佳线性无偏估计(BLUP)为支撑的根系性状:yi = µ + fi + ei + εi,其中yi是个体表型值;µ是所有环境的总平均值;fi是遗传效应;ei是三个环境效应;εi是随机误差。总平均为固定效应,基因型和环境视为随机效应。利用SAS的MIXED程序获得BLUP值。采用以下混合模型对关联面板中所有支撑根性状进行方差分析:yijk = μ + el + rk(l) + fi + (fe)il + εlik,其中µ是各性状的总平均;fi是每个单株的遗传效应;el是每个环境的环境效应;(fe)il是遗传效应与环境效应的交互作用;rk(l)是在环境中复制的影响;εlik是残余误差。利用SAS中的PROC GLM得到方差分量,这些方差分量被用来计算广义遗传力:h2 = σg2/(σg2 + σe2/n) [20] ,其中σg2是遗传方差;σe2是残余误差;n是环境数量。
2.3.3. 基因分型与Bin和遗传连锁图谱的构建
Mo17/X26-4的RIL群体材料获得的试验数据,采用Illumina MaizeSNP50芯片进行SNP基因分型。利用PLINK软件评估每个SNP的漏检率,微小等位基因的发生频率和杂合性,以及每个单株的漏检率和杂合性 [21] 。经过质量管理后,用经济学的go-wrong结合Linux系统下有机构内部Perl脚本的Carthagene软件(https://www.maizego.org/Resources.html),来构建由两个亲本结合出的56,110个SNP位点的遗传连锁图谱 [22] 。完全共分离标记被分配到一个染色体图谱,每个图谱视为一个标记 [23] [24] 。
2.3.4. QTL图谱
利用Windows QTL cartographer 2.5对不同环境中穗夹角性状的表型值与BLUP值进行QTL定位。采用复合区间作图法以步长为0.5 cM进行全基因组扫描,窗口大小设置为10 cM,模型选择Model 6 (The standard model)进行正反向回归运算。在P = 0.05水平下,经1000次置换检验(Permutation Test)确定每个环境中控制穗夹角性状QTL的LOD值阈值。
3. 结论与分析
3.1. MX群体7个性状间的表型变异和相关分析
在MX RIL群体的7个抗旱相关性状中,株高、根长、株鲜重、根鲜重、根干重均呈正态分布,表明控制这5个性状的等位基因存在于双亲中;仅株干重和根冠比呈偏左状态。相关系数从0.0019到0.78。其中,PH与RL (R = 0.32, P < 0.01)呈极显著正相关;PH与WPW (R = 0.78, P < 0.01)呈极显著正相关;PH与DPW (R = 0.19, 0.01 < P < 0.05)呈显著相关;PH与DRW (R = −0.25, P < 0.01)呈极显著负相关;PH与RSR (R = −0.44, P < 0.01)呈极显著负相关;RL与WPW (R = 0.46, P < 0.01)呈极显著正相关;RL与WRW (R = 0.44, P < 0.01)呈极显著正相关;WPW与WRW (R = 0.40, P < 0.01)呈极显著正相关;WPW与DPW (R = 0.35, P < 0.01)呈极显著正相关;WPW与RSR (R = −0.35, P < 0.01)呈极显著负相关;WRW与DPW (R = 0.27, P < 0.01)呈极显著正相关;WRW与DRW (R = 0.65, P < 0.01)呈极显著正相关;DPW与DRW (R = 0.18, 0.01 < P < 0.05)呈显著正相关;DPW与RSR (R = −0.35, P < 0.01)呈极显著负相关。最佳线性无偏预测(BLUP)显示,MX群体的7个性状都接近中亲值(图1)。方差分析结果表明,基因型对除株干重外的其余6个性状的影响非常显著(表1)。其中,株高、根长、根鲜重表型数据的广义遗传力(H2)估计值为高,分别为64.46%、63.1%和53.9%,表明这三个性状的表型变异由MX RIL群体的基因决定;株干重和根冠比表型数据的广义遗传力(H2)估计值为0,表明这两个性状的表型变异不受基因型的影响。
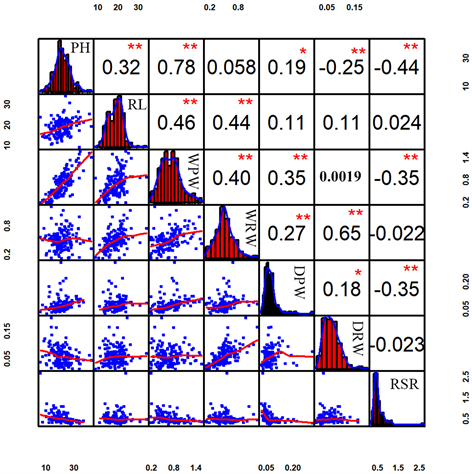 柱形图显示各性状的表型分布,这些值是皮尔森相关系数,相应的图是玉米个性状的散点图。Bar charts show the phenotypic distribution of each traits, the values are Pearson correlation coefficients and the corresponding plots are scatter plots of maize traits. *P ≤ 0.05, **P ≤ 0.01.
柱形图显示各性状的表型分布,这些值是皮尔森相关系数,相应的图是玉米个性状的散点图。Bar charts show the phenotypic distribution of each traits, the values are Pearson correlation coefficients and the corresponding plots are scatter plots of maize traits. *P ≤ 0.05, **P ≤ 0.01.
Figure 1. Frequency distributions and correlations of maize traits in MX RIL population
图1. MX RIL群体中玉米7个抗旱性状的相关性和表型变异
Table 1. Ear angle data in the two maize RILs and their parental lines
表1. 两个玉米重组自交系及其亲本的穗夹角数据
a: G表示基因型,b: E表示误差,c: 基于中亲值的广义遗传力(%),**表示P值 ≤ 0.01。a: G indicates genotype. B: E indicates error. C: Family-mean-based broad-sense heritability (%). **Significant at P ≤ 0.01.
3.2. MX群体7个性状的QTL定位
利用7个性状的BLUP值对性状QTL进行连锁图谱分析。经1000次置换检验,在MX群体中,共检测到9个LOD值大于3的QTL (图2;表2)。这些QTLs分布在5个染色体上,分别为2、3、4、5和8号染色体。七个性状QTL的表型贡献率从6.0% (qMXRSR5)到10.25% (qMXDRW3)。表型贡献率最大的qMXDRW位于MX群体的3号染色体,标记区间为PUT-163a-60351350-2652--PZE-103148487,加性效应为0.0044%。表型贡献率第二大的是qMXWRW2,位于MX群体的2号染色体,标记区间为SYN29040--PZE-102108114,加性效应为0.0231%。
为了进一步确认这9个QTLs的稳定性,我们利用MX群体两次重复的BLUP值进行了连锁图谱分析(图2)。结果表明,MX群体中检测到的QTL稳定存在,尽管有一些性状中的LOD峰值并没有达到设定的阈值,但依然有显著的峰出现。另外,MX群体中的每一个QTL的加性效应显示,玉米6个性状受微效多基因控制,并非单一基因控制其性状。
3.3. MX群体7个抗旱性状的独立遗传控制
图3显示了两个群体7个性状QTLs之间的重叠。在所有的8个QTL中,有一对重叠的QTL (qMXDRW3-1和qMXDRW3-2),均在MX群体的2号染色体上;而其他6个性状的QTLs可能是相对独立的遗传控制。同一群体遗传背景下,QTL分析发现在所有的9个QTL中,有一对重叠QTL,分别为qMXDRW3-1和qMXDRW3-2。我们将这9个稳定的QTLs与先前研究中玉米苗期抗旱相关性状的QTLs进行比较,发现在当前研究中鉴定的QTLs与先前研究定位到的QTLs存在重叠区段(图3) (Ruta et al. 2010)。其中,2号染色体上,qMXWRW2与Lrt2存在重叠区段;qMXWRW2与LA2存在重叠区段;qMXWRW2与DWrt2存在重叠区段;qMXRL2-1与LA2存在重叠区段;qMXRL2-1与DWst2存在重叠区段;qMXPH2与NOcr2存在重叠区段。各区段间的重叠表明,本研究所定位到的QTL与之前研究中定位到的Q各QTL区段中的候选基因可能存在共同调控的基因。
4. 讨论
4.1. MX群体7个性状的遗传组成
在MX群体中,7个性状都存在着广泛的自然变异,除株干重和根冠比性状稍微偏左,其他性状均呈正态分布。各性状之间均有极显著差异。各群体中穗夹角性状遗传贡献率均达到显著水平,而遗传与环境的效应也都达到了显著水平。




水平线指示经验确定的LOD阈值,具有1000个随机排列,其值分别为3.0。PH, RL, WPW, WRW, DPW, DRW, RSR分别表示株高,根长,株鲜重,根鲜重,株干重,根干重,根冠比。1为第一次重复,2为第二次重复。BLUP表示每个性状的最佳线性无偏预测值进行的QTL作图的结果。Horizontal lines indicate LOD thresholds determined empirically with 1000 random permutations separately with values of 3.0. PH, RL, WPW, WRW, DPW, DRW, RSR denote plant height, root length, plant fresh weight, root fresh weight, plant dry weight, root dry weight, root/shoot ratio, respectively. 1 for rep 1, 2 for rep 2. BLUP represents the results of QTL mapping using the best linear unbiased prediction value of maize seven traits.
Figure 2.Chromosome-wise logarithm of the odds (LOD) scores of seven maize drought resistance QTLs in MX RIL population. PEG treated maize lines simulating drought stress
图2. 干旱胁迫组MX RIL群体中7个玉米抗旱性性状的QTL峰值图
 在以前的研究中检测到的QTLs如下:Lrt, 根长;NOcr,不定根数;NOse,种子根数;LA,叶面积;DWst,株干重;DWrt,根干重;DWstrt,根冠比;LArl,叶面积根长比。QTLs detected in previous studies are as follows: Lrt, root length; NOcr, number of crown roots; NOse, number of seminal roots; LA, leaf area; DWst, shoot dry weight; DWrt, root dry weight; DWstrt, ratio of dry weight of root to shoot; LArl, leaf area to root length ratio.
在以前的研究中检测到的QTLs如下:Lrt, 根长;NOcr,不定根数;NOse,种子根数;LA,叶面积;DWst,株干重;DWrt,根干重;DWstrt,根冠比;LArl,叶面积根长比。QTLs detected in previous studies are as follows: Lrt, root length; NOcr, number of crown roots; NOse, number of seminal roots; LA, leaf area; DWst, shoot dry weight; DWrt, root dry weight; DWstrt, ratio of dry weight of root to shoot; LArl, leaf area to root length ratio.
Figure 3. Co-localization of seven maize drought resistance QTLs on maize chromosomes identified in the current study
图3. 7个MX抗旱性状QTL的共定位
4.2. MX群体7个性状QTL的关联
本研究通过对MX RIL群体的7个抗旱相关性状进行QTL定位分析,发现QTL之间主要受加性效应影响。其中,qMXWRW4主控基因来自母本;其余7个QTL的主控基因均来自父本。共检测到48个QTL,QTL共定位表明,同一群体遗传背景下,QTL分析发现在所有的8个QTL中,仅根干重性状有一对重叠QTL,表明7个性状的QTLs可能是相对独立的遗传控制。
在实践研究中,亲本之间性状差异越大,效应值就越大;如果差异小可能就检测不出QTL。此外,群体样本容量大小也会影响QTL初级定位的精确度,群体过大不仅会增加工作量和费用,同时也会使田间试验误差加大,相应的难度也会加大,从而导致QTL初级定位的精度不够,不能够准确的为分子标记辅助选择提供信息。因此,还必须在初级定位基础上,继续加大分子标记密度,在目标QTL区域建立高分辨率的分子标记图谱,实现QTL的精细定位,为控制优良性状QTL的进一步克隆和提高分子辅助标记的选择提供分子基础。
文章引用
林景卫,韩 笑,周思雅,李浩戈,陈水森,张立军,崔震海,阮燕晔. 七个玉米–大刍草重组自交系苗期抗旱性形态指标QTL定位
QTL Mapping of Drought Resistance in Seedling Stage of Seven Maize-Large Hum-ble Grass Recombinant Inbred Lines[J]. 农业科学, 2018, 08(08): 899-910. https://doi.org/10.12677/HJAS.2018.88133
参考文献
- 1. 刘晓昱. 黑土流失与整治[J]. 水土保持研究, 2005, 12(5): 132-133 + 156.
- 2. 胡瑞法, Mengerikach, 张世煌, 等. 采用参与式方法评估中国玉米研究的优先序[J]. 中国农业科学, 2004, 37(6): 781-787.
- 3. 刘慧, 魏永霞. 黑土区土壤侵蚀厚度对土地生产力的影响及其评价[J]. 农业工程学报, 2014, 246(20): 288-296.
- 4. 杨爱峥, 魏永霞, 张忠学, 等. 坡耕地综合治理技术模式的蓄水保土及增产效应[J]. 农业工程学报, 2011, 173(11): 222-226.
- 5. Fischer, K.S., Edmeades, G.O. and Johnson, E.C. (1989) Selection for the Improvement of Maize Yield under Moisture-Deficits. Field Crops Research, 22, 227-243. https://doi.org/10.1016/0378-4290(89)90094-4
- 6. 杨成书, 薛吉全, 郝引川, 等. 玉米品种抗旱性筛选鉴定指标研究[J]. 陕西农业科学, 1993, 3(3): 1-4.
- 7. 刘胜群, 宋凤斌, 王燕. 玉米根系性状与地上部性状的相关性研究[J]. 吉林农业大学学报, 2007, 29(1): 1-6.
- 8. 胡荣海. 农作物抗旱鉴定方法和指标[J]. 作物品种资源, 1986(4): 36-39.
- 9. 吴子恺. 玉米抗旱育种[J]. 玉米科学, 1994, 2(1): 6-9.
- 10. Bolaños, J., Edmeades, G.O. and Martinez, L. (1993) Eight Cycles of Selection for Drought Tolerance in Lowland Tropical Maize. Iii. Responses in Drought-Adaptive Physiological and Morphological Traits. Field Crops Research, 31, 269-286. https://doi.org/10.1016/0378-4290(93)90066-V
- 11. 张正斌. 作物抗旱节水的生理遗传育种基础[J]. 西北植物学报, 2003(13): 23.
- 12. 于永涛, 刘成, 吕玲, 等. 玉米品种耐旱性评价及相关鉴定指标的研究[J]. 作物杂志, 2008, 125(4): 55-58.
- 13. Lynch, J. (1995) Root Architecture and Plant Productivity. Plant Physiology, 109, 7-13. https://doi.org/10.1104/pp.109.1.7
- 14. 高世斌, 冯质雷, 李晚忱, 等. 干旱胁迫下玉米根系性状和产量的QTLs分析[J]. 作物学报, 2005, 31(6): 718-722.
- 15. 郑德波, 杨小红, 李建生, 等. 基于SNP标记的玉米株高及穗位高QTL定位[J]. 作物学报, 2013(3): 549-556.
- 16. 何坤辉, 常立国, 崔婷婷, 等. 多环境下玉米株高和穗位高的QTL定位[J]. 中国农业科学, 2016(8): 1443-1452.
- 17. Doebley, J. (1990) Molecular Evidence and the Evolution of Maize. Economic Botany, 44, 6-27. https://doi.org/10.1007/BF02860472
- 18. Sanchez, G.J., Kato, T.Y., Aguilar, M.S., Hernandez, J.C., Lopez, A.R., et al. (1998) Dis-tribucion y Caracterizacion del Teocintle. Instituto Nacional de Investigaciones Forestales. Agricolas y Pecuarias, Guadalaja-ra.
- 19. Wilkes, H.G. (1967) Teosinte: The Closest Relative of Maize. Bussey Institute of Harvard University, Cambridge.
- 20. Knapp, S.J., Stroup, W.W. and Ross, W.M. (1985) Exact Confidence-Intervals for Heritability on a Progeny Mean Basis. Crop Science, 25, 192-194. https://doi.org/10.2135/cropsci1985.0011183X002500010046x
- 21. Li, Q., Yang, X.H., Xu, S., Cai, Y., Zhang, D.L., Han, Y.J., Li, L., Li, J.S. and Yan, J.B. (2012) Genome-Wide Association Studies Identified Three Independent Polymorphisms Association with α-Tocopherol Content in Maize Kernels. PLos ONE, 7, e36807. https://doi.org/10.1371/journal.pone.0036807
- 22. Ganal, M.W., Durstewitz, G. and Polley, A. (2011) A Large Maize (Zea mays L.) SNP Genotyping Array: Development and Germplasm Genotyping, and Genetic Mapping to Compare with the B73 Reference Genome. PLos ONE, 6, e28334. https://doi.org/10.1371/journal.pone.0028334
- 23. De Givry, S., Bouchez, M., Chabrier, P., Milan, D. and Schiex, T. (2005) CARHTA GENE: Multi-Population Integrated Genetic and Radiation Hybrid Mapping. Bioinformatics, 21, 1703-1704. https://doi.org/10.1093/bioinformatics/bti222
- 24. Pan, Q., Li, L., Yang, X., Tong, H., Xu, S., et al. (2016) Genome-Wide Re-combination Dynamics Are Associated with Phenotypic Variation in Maize. The New Phytologist, 210, 1083-1094. https://doi.org/10.1111/nph.13810
NOTES
*同等贡献作者。
#通讯作者。

