Advances in Clinical Medicine
Vol.
14
No.
03
(
2024
), Article ID:
82805
,
8
pages
10.12677/ACM.2024.143766
小肠细菌过度生长相关轻微肝性 脑病口–盲通过时间差异性分析
孟毓珊,黄伊宁,张航,王佳,丛羽晨,王蕾,王艳婷, 魏宏云,任科雨,毛庆东,崔铭娟,曹彬*
青岛大学附属医院消化内科,山东 青岛
收稿日期:2024年2月19日;录用日期:2024年3月12日;发布日期:2024年3月19日

摘要
目的:探讨小肠细菌过度生长(Small Intestinal Bacterial Overgrowth, SIBO)相关性轻微肝性脑病(Minimal Hepatic Encephalopathy, MHE)患者口–盲通过时间(the Oral-Cecal Transit Time, OCTT)情况。方法:选择2021年12月至2023年10月在青岛大学附属医院消化内科住院的符合入选要求的110例肝硬化确诊患者,通过数字连接试验(Number Connection Test-A and Number Connection Test-B, NCT-A和NCT-B)诊断轻微肝性脑病,乳果糖氢呼气试验(Lactulose Hydrogen Breath Test, LHBT)诊断小肠细菌过度生长及明确口–盲通过时间,分为小肠细菌过度生长阳性轻微肝性脑病组、小肠细菌过度生长阴性轻微肝性脑病组、非肝性脑病组,比较三组间口–盲通过时间差异,采用SPSS软件对数据进行统计学分析。呈正态分布的计量资料采用双尾t检验,以 表示。计数资料以例数和百分数表示,组间比较采用ANOVA检验。结果:110例肝硬化住院患者中,轻微肝性脑病阳性率为53.6% (59/110),在轻微肝性脑病患者中,小肠细菌过度生长阳性率71.19% (42/59),三组间在口–盲通过时间方面有统计学差异(F = 3.671, P < 0.05),其中SIBO阳性MHE组与非MHE组在口–盲通过时间方面有统计学差异(P < 0.05),与SIBO阴性MHE组在口–盲通过时间有统计学差异(P < 0.05)。结论:小肠细菌过度生长相关轻微肝性脑病的肝硬化患者口–盲通过时间相较于无小肠细菌过度生长和轻微肝性脑病的肝硬化患者延长,消化道动力明显障碍。
关键词
肝硬化,小肠细菌过度生长,轻微肝性脑病,口–盲通过时间,氢呼气试验

Difference Analysis of the Oral-Cecal Transit Time in Small Intestinal Bacterial Overgrowth Associated Minimal Hepatic Encephalopathy
Yushan Meng, Yining Huang, Hang Zhang, Jia Wang, Yuchen Cong, Lei Wang, Yanting Wang, Hongyun Wei, Keyu Ren, Qingdong Mao, Mingjuan Cui, Bin Cao*
Department of Gastroenterology, The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Feb. 19th, 2024; accepted: Mar. 12th, 2024; published: Mar. 19th, 2024

ABSTRACT
Objective: To investigate the oral-cecal transit time (OCTT) of patients with minimal hepatic encephalopathy (MHE) associated with small intestinal bacterial overgrowth (SIBO). Methods: 110 patients with liver cirrhosis admitted to the Department of Gastroenterology, Affiliated Hospital of Qingdao University from December 2021 to October 2023 were studied. The minimal hepatic encephalopathy was diagnosed by number connection test (NCT-A and NCT-B), and the small intestinal bacterial overgrowth was diagnosed by lactulose hydrogen breath test (LHBT), and the oral-cecal transit time was determined as above. They were divided into three groups: the minimal hepatic encephalopathy group with positive small intestinal bacterial overgrowth, the minimal hepatic encephalopathy group without small intestinal bacterial overgrowth, and the negative minimal hepatic encephalopathy group. The differences of oral-cecal transit time among the three groups were compared by SPSS software. The measurement data with normal distribution adopts two-tailed t test, which is expressed by . Counting data were expressed by the number of cases and percentage, and ANOVA test was used for comparison between groups. Results: Among 110 in patients with liver cirrhosis, the positive rate of minimal hepatic encephalopathy was 53.6% (59/110), among which the positive rate of small intestine bacterial overgrowth in small intestine was 71.19%(42/59). There was a statistical difference among the three groups (F = 3.671, P < 0.05). There was a statistical difference in oral-cecal transit time between SIBO positive MHE group and non-MHE group (P < 0.05), and so as between SIBO negative MHE group (P < 0.05). Conclusions: The oral-cecal transit time of patients with cirrhosis associated with small intestinal bacterial overgrowth and minimal hepatic encephalopathy is longer than that of patients without small intestinal bacterial overgrowth and minimal hepatic encephalopathy, and the gastrointestinal motility is obviously impaired.
Keywords:Cirrhosis, Small Intestinal Bacterial Overgrowth, Minimal Hepatic Encephalopathy, Oral-Cecal Transit Time, Hydrogen Breath Test

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
轻微肝性脑病(Minimal Hepatic Encephalopathy, MHE)是肝性脑病(Hepatic Encephalopathy, HE)发病过程中一个早期隐匿阶段,表现为肝硬化患者认知功能正常、无定向力障碍且无扑翼样震颤,但有神经心理学或神经生理学异常 [1] 。患者虽形似正常,但操作能力和应急反应能力减低,在从事高空作业、机械或驾驶等工作时容易发生意外,如不进行有效治疗,部分患者智能及精神状态将在1年内进一步衰退,发展为症状型肝性脑病,病死率可高达50% [2] [3] 。国内外相关研究发现,肝硬化并发轻微肝性脑病患者小肠细菌过度生长(Small Intestinal Bacterial Overgrowth, SIBO)和肠道细菌转位发生率均较高,同时肠道生态失衡常伴随肠道功能改变,进一步加重肝脏损害、诱发肝性脑病 [4] 。为了解小肠细菌过度生长及口–盲通过时间(the Oral-Cecal Transit Time, OCTT)与轻微肝性脑病之间的关系,本研究对2021年12月至2023年10月青岛大学附属医院110例肝硬化住院患者进行乳果糖氢呼气试验,通过分析有无小肠细菌过度生长及口–盲通过时间情况,以期指导临床用药,减少肝性脑病的发生以及改善肝性脑病患者的预后。
2. 研究对象与方法
2.1. 研究对象
选择2021年12月至2023年10月在青岛大学附属医院消化内科住院的110例肝硬化确诊患者。纳入标准:根据2021年AASLD肝硬化指南诊断为肝硬化患者;生活、饮食较规律;无其他系统性疾病及恶性肿瘤;受试者为有能力理解本次临床试验特征的有完全民事行为的人,同意参与本项研究,并自愿签署知情同意书。排除标准:(1) 有脑出血、脑梗死、脑肿瘤、颅内感染、癫痫等脑部疾病患者;有酮症酸中毒、低血糖、肾性脑病、肺性脑病等代谢性脑病患者;有酒精性脑病、重金属中毒性脑病、戒断综合征等中毒性脑病患者。(2) 有精神疾病病史患者。(3) 显性肝性脑病或既往有显性肝性脑病病史患者。(4) 有糖尿病、严重心肺疾病、肾功能不全、甲状腺疾病、肠梗阻等易引起胃肠动力不足疾病患者;乳糖不耐受患者;有其他可导致营养不良、慢性腹泻等的肝外疾病患者;6周内有消化道出血病史患者;有持续性活动性感染患者。(5) 两周内接受过幽门螺杆菌根除治疗或服用过抗生素、乳果糖、益生菌、PPI及胃肠动力药如莫沙比利、多潘立酮等的患者;1个月内接受过灌肠或结肠镜检测的患者。(6) 接受过胃、肠切除等腹部手术患者。(7) 存在听力、视力障碍以致不能接受数字连接试验和数字符号试验检查的患者。(8) 依从性差及存在其他可能影响本次实验结果因素的患者。
2.2. 研究方法
2.2.1. 轻微肝性脑病检测
对受试对象进行数字连接试验(NCT-A及NCT-BC)检查,向受试者介绍操作方法及过程,嘱患者快速且准确地完成连线测试,开始计时,中间纠正提醒计入试验时间。根据结果评估患者是否患有轻微肝性脑病。
2.2.2. 小肠细菌过度生长及口–盲通过时间检测
嘱受试者检测前一日21:00后禁饮食,检测期间需全程保持空腹状态,次日早晨5:00起床清洁口腔,吹“0”号集气袋至吹满。后立即喝下15 ml乳果糖;饮用乳果糖后停留30分钟,后吹“1”号集气袋,之后每隔30分钟吹1个集气袋,以此类推吹完2~8号集气袋;吹完后封紧袋口。每次吹气前先深吸一口气,停留10~20秒,再缓缓呼出。当日将所收集标本通过碳氢呼气分析仪(华亘公司生产,型号:13C/H2-BTF)进行检测,测得的氢浓度以第一个90分钟内出现高峰(较基础值升高 ≥ 20 ppm)可诊断为SIBO阳性;连续2次呼气氢浓度较基础值升高 ≥ 10 ppm作为到达回盲部的标志,结合检测结果确定受试者是否具有小肠细菌过度生长及口盲通过时间延长。健康人口–盲通过时间为60~120分钟,结合相关临床资料及文献报道,将消化道动力障碍分为轻、中、重三级代表口–盲通过时间延长情况:120~180分钟为消化道动力轻度障碍,180~240分钟为消化道动力中度障碍,≥241分钟为消化道动力中度障碍 [5] 。
2.3. 数据分析
研究数据应用SPSS 25.0软件对数据进行统计学分析。呈正态分布的计量资料采用双尾t检验,以 表示。计数资料以例数和百分数表示,组间比较采用ANOVA分析。P < 0.05为差异有统计学意义。
3. 结果
3.1. 患者一般资料及临床资料
2021年12月至2023年10月收集的青岛大学附属医院110例肝硬化住院患者中,男81人,女29人,平均年龄58.22 ± 9.623岁,其中轻微肝性脑病阳性率为53.6% (59/110),在轻微肝性脑病患者中,小肠细菌过度生长阳性率71.19% (42/59),肝硬化患者病因中以乙型病毒性肝炎最常见(占56.4%,62/110),其次是酒精性肝病(19.1%, 21/110)和自身免疫性肝病(11.8%, 13/110),其他病因包括丙型肝炎、戊型肝炎、药物性肝病、未明确病因的肝病等占12.7% (14/110)。平均血氨浓度为35.874 ± 22.1703 umol/L,Child-Pugh分级中,A级占比30.9% (34/1110),B级占比49.1% (54/110),C级占比20% (22/110) (表1)。经统计学检验,三组之间在性别、血氨、Child-Pugh分级方面均无统计学差异(P > 0.05);SIBO阳性MHE组和SIBO阴性MHE组在年龄方面差异无统计学差异,在病因方面有统计学差异(P < 0.05),与非MHE组在病因方面无显著性差异,在年龄存在统计学差异(P < 0.05);SIBO阴性MHE组与非MHE组存在统计学差异(表2)。
Table 1. General data and clinical data of patients
表1. 患者一般资料及临床资料情况
Table 2. Statistical results of differences in various factors between groups
表2. 组间各因素差异性统计学结果
注:*P < 0.05;**P < 0.01。
3.2. 小肠细菌过度生长相关性轻微肝性脑病与口–盲通过时间差异性分析
结合诊断标准,42例小肠细菌过度生长阳性的轻微肝性脑病患者中,口–盲时间未延长占比9.5% (4/42),轻度延长占比33.3% (14/42),中度延长占比45.2% (19/42),重度延长占比11.9% (5/42) (表3)。上消化道运动中度障碍占比最多,轻度障碍次之(图1)。
Table 3. The gastrointestinal motility of patients
表3. 患者消化道动力情况
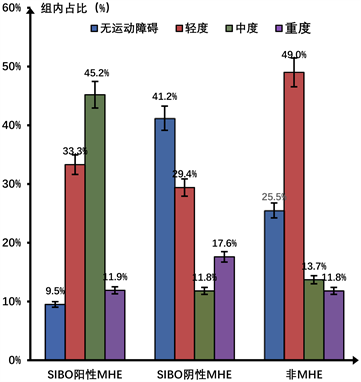
Figure 1. The degree of gastrointestinal motility disorder between groups
图1. 各组间肠道运动障碍程度
17例小肠细菌过度生长阴性的轻微肝性脑病患者中,口–盲时间未延长、轻度延长、中度延长、重度延长占比分别为:41.2% (7/17)、29.4% (5/17)、11.8% (2/17)、17.6% (3/17) (表3)。无上消化道动力障碍占比最多,轻度障碍次之(图1)。
51例非肝性脑病患者中,口–盲时间未延长、轻度延长、中度延长、重度延长占比分别为:25.5% (13/51)、49% (25/51)、13.7% (7/51)、11.8% (6/51) (表3)。轻度上消化道动力障碍占比最多,无动力障碍次之(图1)。
经统计,三组患者在口–盲通过时间方面有统计学差异(F = 3.671, P < 0.05),其中SIBO阳性MHE组与非MHE组在口–盲通过时间方面有统计学差异(P < 0.05),与SIBO阴性MHE组在口–盲通过时间有统计学差异(P < 0.05)。
4. 讨论
人体肠道是菌群生存的主要场所,作为人体“第二基因组”,目前研究表明多种疾病与肠道菌群密切相关,肠道菌群在疾病的预防、治疗及药物研究等领域有着越来越重要的作用 [6] 。口–盲通过时间(the Oral-Cecal Transit Time, OCTT)是指进食后食物从口到盲肠过程中通过的时间,主要反映小肠运动功能。疾病、神经/功能器质性病变以及药物均可引起口–盲通过时间的变化。小肠细菌过度生长(Small intestinal bacterial overgrowth, SIBO)是小肠内细菌移位并过度增多的一种常见的胃肠道疾病,可见于肝硬化、胃肠术后、回盲瓣缺失、消化道出血以及胃肠道动力改变如IBS等消化系统疾病,常见的胃肠道症状包括预期的吸收不良和过度细菌发酵的症状,如腹泻、腹胀、排气过多和体重减轻,而特定的营养缺乏可导致其他症状,如外周水肿和多发性神经病 [7] ,上述一个或多个因素的异常都会导致SIBO。
Marshall于1998年提出了肠–肝轴的概念,门静脉供应70%以上的肝脏血流,肠道的静脉血主要汇入门脉系统,大部分肠道产物也随之传递给肝脏,当肝脏发生病变时,门静脉高压使得肠道粘膜充血水肿,肠道清除力减弱、致病菌大量繁殖 [8] 。Oumi M等人通过对结合及非结合胆盐诱导后的肠壁形态学变化进行观察发现,细菌对肠壁的直接毒性作用引起肠上皮绒毛萎缩和肠壁炎症,小肠上部细菌过度生长产生的解偶联胆汁盐可导致不同程度和严重程度的上皮内层连接完整性破坏 [9] ,从而使肠道吸收面积减少、粘膜变薄,屏障功能减弱,进一步引起肠道动力失调,影响肠道转运功能。细菌及代谢产物进入血液,使发生败血症的风险增加,也可以经免疫系统侵入肝脏,反过来进一步加重肝脏损害 [10] 。
Morencos在约1/3的酒精性肝硬化患者中检测到细菌过度生长 [11] [12] 。在Liu, Q [13] 研究中,60%的非HE肝硬化患者患有MHE,且存在肠道微生态的严重紊乱。Ankur Gupta [14] 及Chesta [15] 研究发现MHE的肝硬化患者SIBO患病率明显升高,且与Child分级严重程度相关,多项相关研究也得出类似的结论 [16] [17] [18] [19] 。
本研究分析2021年12月至2023年10月在青岛大学附属医院住院的110例肝硬化患者结果显示,肝硬化患者中轻微肝性脑病阳性率为53.6%,轻微肝性脑病患者中,小肠细菌过度生长阳性率71.19%,明显高于非MHE的患者,结果与性别无明显相关性。这与文献中的研究结果基本一致,在健康状态下,成人肠道中的菌群环境相对稳定,肠道生态系统主要以厚壁菌门和拟杆菌门为优势菌群,肠蠕动、胃酸和粘膜免疫阻止了SIBO的发展。而肝硬化患者由于门静脉回流受阻,肠道粘膜充血水肿,引起肠道蠕动减弱、粘膜屏障受损,使得自主清除能力下降、致病菌繁殖,肠道微生态发生严重紊乱,非优势菌群大肠杆菌和葡萄球菌过度生长,并通过受损肠壁进入肠系膜淋巴结及门静脉系统,进一步加重肝脏炎症及纤维化,同时产氨菌群增加,更易诱发肝性脑病 [4] 。
本研究中Child-Pugh分级及血氨在组间无显著性差异,不同于Ankur Gupta及Chesta等人的研究,考虑与研究样本例数不足、患者入院前于急诊接受一定程度治疗有关,不除外MHE测定过程中不同学历、年龄、视力情况及主观因素造成的结果差异。而三组间年龄、病因存在一定的差异,患有轻微肝性脑病的患者普遍年龄偏高,肝硬化程度重、预后差,考虑与文化水平及就医意愿有关,长期饮酒史、既往卫生条件较差,患者多以乙肝肝硬化、酒精性肝硬化为主,且多数患者早期健康意识较弱,未及时就医获得有效诊治,疾病发展伴随年龄进展,导致肝硬化进展成为轻微肝性脑病。
Roland BC等人在对34名研究对象进行无线运动胶囊和氢呼气试验研究中发现,SIBO患者的OCTT延迟且与小肠动力有关(P = 0.02) [20] ,Gupta A等人对57名肝硬化患者研究中也发现这一结论(P < 0.0001) [16] 。在J.S. Galati的随机对照研究中,肝硬化门脉高压组口盲时间相对健康对照组延长,而测定的两组胃排空时间无明显差异,说明肝硬化门脉高压患者口盲时间延长可能是由于小肠转运时间的延迟 [11] 。Van Thiel等人在对肝性脑病患者的测试中也得出了相同的结论 [21] 。相关研究表明肝移植术后病人胃肠动力较前好转 [22] 。丁学文等人 [23] 研究发现,SIBO阳性患者的OCTT显著延长。本次研究的三组患者中,SIBO相关MHE组患者消化道动力障碍主要以中度和轻度为主,相较于多为轻度动力障碍及无动力障碍的SIBO阴性MHE组和非MHE组,其OCTT时间显著延长。
本研究还有一些不足之处,对于病例患者收集、测验过程患者依从性较差,缺乏有效配合,以及待形成严谨、规范化的标准,确保实验数据的准确性;其次,应纳入客观化的检测方式如颅脑MR、电生理等相关检测减少主观因素影响;同时,氢呼气试验气体收集和检测的时间、过程有一定的设备限制,相关设备研制开发目前不够成熟,测试的精确性存在一定误差。
综上所述,本研究中三组间口–盲通过时间存在差异,其中SIBO相关MHE患者口–盲通过时间较其他组延长,消化道动力以中度和轻度障碍为主,而其余两组患者多存在损伤消化道动力轻度障碍或不存在消化道动力障碍的情况。因此对于处于轻微肝性脑病的肝硬化伴小肠细菌过度生长的患者,可以通过调节肠道菌群、维持肠道上皮的完整性、上调抗炎细胞因子和生长因子、生成短链和支链脂肪酸,以及调节神经内分泌与脑-肠轴相互作用,达到调节肠道生态、稳定肠道动力、恢复肠道功能的作用 [24] ,在目前关于肠道微生态研究中,治疗SIBO的相关药物利福昔明、益生菌等制剂可以有效改善肠道生态环境,抑制致病菌繁殖,降低血氨水平,改善MHE预后 [25] [26] [27] [28] 。同时,积极有效宣传卫生知识,提高患者防范及早期诊治的健康意识,做到源头防治、早期治疗,通过降低发病率、提高治疗效果,从而有效预防或改善肝硬化患者预后。
致谢
感谢恩师曹彬老师在研究期间给予的帮助和鼓励,跟随老师学习期间受益匪浅,对于老师的教诲,我会谨记于心,在未来的科研道路上也会一直激励着我勇往直前。也要感谢消化内科各位老师们的热心帮助,带领我在科研道路上不断探索,一路前行。
基金项目
青岛西海岸新区2020年度科技惠民专项项目(2020-58);青岛大学附属医院临床 + X项目(QDFY + X2023114)。
文章引用
孟毓珊,黄伊宁,张 航,王 佳,丛羽晨,王 蕾,王艳婷,魏宏云,任科雨,毛庆东,崔铭娟,曹 彬. 小肠细菌过度生长相关轻微肝性脑病口–盲通过时间差异性分析
Difference Analysis of the Oral-Cecal Transit Time in Small Intestinal Bacterial Overgrowth Associated Minimal Hepatic Encephalopathy[J]. 临床医学进展, 2024, 14(03): 750-757. https://doi.org/10.12677/ACM.2024.143766
参考文献
- 1. 曹彬, 丰义宽, 李国庆. 轻微肝性脑病的诊断与治疗进展[J]. 现代消化及介入诊疗, 2006, 11(4): 239-242.
- 2. Gimenez-Garzo, C., Garces, J.J., Urios, A., et al. (2017) The PHES Battery Does Not Detect All Cir-rhotic Patients with Early Neurological Deficits, Which Are Different in Different Patients. PLOS ONE, 12, e0171211. https://doi.org/10.1371/journal.pone.0171211
- 3. 谢丛, 马敏阁, 孟毓珊, 等. 肝性脑病的影像学表现研究现状[J]. 分子影像学杂志, 2022, 45(2): 289-293.
- 4. 鲁冰洁, 赵亚红, 安泳潼, 等. 肠道微生物在肝硬化及相关并发症中的研究进展[J]. 临床肝胆病杂志, 2018, 34(11): 2433-2437.
- 5. 季利江. 乳果糖氢呼气试验测定口盲通过时间在慢性功能性便秘诊断及分类中的价值[D]: [硕士学位论文]. 南京: 南京中医药大学, 2005.
- 6. 秦子文, 刘晶涛, 范晓红, 等. 肠道菌群与肝性脑病的关系[J]. 胃肠病学和肝病学杂志, 2021, 30(1): 34-37.
- 7. Massey, B.T. and Wald, A. (2021) Small Intestinal Bacterial Overgrowth Syndrome: A Guide for the Appropriate Use of Breath Testing. Digestive Diseases and Sciences, 66, 338-347. https://doi.org/10.1007/s10620-020-06623-6
- 8. 郭栗良子, 王立生. 肝硬化患者肠道菌群失衡的研究现状[J]. 中国微生态学杂志, 2018, 30(1): 104-108, 113.
- 9. Oumi, M. and Yamamoto, T. (2000) A Scanning Electron Microscope Study on the Effects of Different Bile Salts on the Epi-thelial Lining of Jejunal Mucosa. Medical Electron Microscopy, 33, 11-15. https://doi.org/10.1007/s007950000002
- 10. Ghosh, G. and Jesudian, A.B. (2019) Small Intestinal Bacterial Over-growth in Patients with Cirrhosis. Journal of Clinical and Experimental Hepatology, 9, 257-267. https://doi.org/10.1016/j.jceh.2018.08.006
- 11. Galati, J. S., Holdeman, K.P., Bottjen, P.L., et al. (1997) Gastric Emptying and Orocecal Transit in Portal Hypertension and End-Stage Chronic Liver Disease. Liver Transplantation and Surgery, 3, 34-38. https://doi.org/10.1002/lt.500030105
- 12. Morencos, F.C., De Las Heras Castano, G., Martin Ramos, L., et al. (1995) Small Bowel Bacterial Overgrowth in Patients with Alcoholic Cirrhosis. Digestive Diseases and Sciences, 40, 1252-1256. https://doi.org/10.1007/BF02065533
- 13. Liu, Q., Duan, Z.P., Ha, D.K., et al. (2004) Synbiotic Mod-ulation of Gut Flora: Effect on Minimal Hepatic Encephalopathy in Patients with Cirrhosis. Hepatology, 39. 1441-1449. https://doi.org/10.1002/hep.20194
- 14. Gupta, A., Dhiman, R.K., Kumari, S., et al. (2010) Role of Small Intestinal Bacterial Overgrowth and Delayed Gastrointestinal Transit Time in Cirrhotic Patients with Minimal Hepatic Encephalo-pathy. Journal of Hepatology, 53, 849-855. https://doi.org/10.1016/j.jhep.2010.05.017
- 15. Chesta, J., Silva, M., Thompson, L., et al. (1991) [Bacterial Overgrowth in Small Intestine in Patients with Liver Cirrhosis. Revista Médica de Chile, 119, 626-632.
- 16. Lunia, M.K., Sharma, B.C. and Sachdeva, S. (2013) Small Intestinal Bacterial Overgrowth and Delayed Orocecal Transit Time in Patients with Cirrhosis and Low-Grade Hepatic Encephalopathy. Hepatology In-ternational, 7, 268-273. https://doi.org/10.1007/s12072-012-9360-9
- 17. Pande, C., Kumar, A. and Sarin, S.K. (2009) Small-Intestinal Bacterial Overgrowth in Cirrhosis Is Related to the Severity of Liver Disease. Alimentary Pharmacology & Therapeutics, 29, 1273-1281. https://doi.org/10.1111/j.1365-2036.2009.03994.x
- 18. 曹彬, 王玉, 丰义宽, 等. 小肠细菌过度生长相关性轻微肝性脑病患者的血浆内毒素水平[J]. 胃肠病学和肝病学杂志, 2009, 18(7): 618-620.
- 19. 曹彬, 丰义宽, 李国庆. 肝硬化患者小肠细菌过度生长与轻微肝性脑病的相关性研究[J]. 国际内科学杂志, 2008, 35(2): 65-67.
- 20. Roland, B.C., Ciarleglio, M.M., Clarke, J.O., et al. (2015) Small Intestinal Transit Time Is Delayed in Small Intestinal Bacterial Overgrowth. Journal of Clinical Gastroenterology, 49, 571-576. https://doi.org/10.1097/MCG.0000000000000257
- 21. Van Thiel, D.H., Fagiuoli, S., Wright, H.I., et al. (1994) Gastrointestinal Transit in Cirrhotic Patients: Effect of Hepatic Encephalopathy and Its Treatment. Hepatology, 19, 67-71. https://doi.org/10.1002/hep.1840190112
- 22. Madrid, A.M., Brahm, J., Buckel, E., et al. (1997) Orthotopic Liver Transplantation Improves Small Bowel Motility Disorders in Cirrhotic Patients. The American Journal of Gastroenter-ology, 92, 1044-1045.
- 23. Ding, X.W., Liu, Y.X., Fang, X.C., et al. (2017) The Relationship between Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome. European Review for Medical and Pharmacological Sciences, 21, 5191-5196.
- 24. Pisarek, W. (2021) Minimal Hepatic Encephalopathy—Diagnosis and Treatment. Przegląd Gastroen-terologiczny, 16, 311-317. https://doi.org/10.5114/pg.2021.111389
- 25. Zhang, Y., Feng, Y., Cao, B., et al. (2015) Effects of SIBO and Rifaximin Therapy on MHE Caused by Hepatic Cirrhosis. International Journal of Clinical and Experimental Medicine, 8, 2954-2957.
- 26. Yokoyama, K., Sakamaki, A., Takahashi, K., et al. (2022) Hydro-gen-Producing Small Intestinal Bacterial Overgrowth Is Associated with Hepatic Encephalopathy and Liver Function. PLOS ONE, 17, e0264459. https://doi.org/10.1371/journal.pone.0264459
- 27. Bajaj, J.S., Heuman, D.M., Wade, J.B., et al. (2011) Rifaximin Improves Driving Simulator Performance in a Randomized Trial of Patients with Minimal Hepatic Encephalopathy. Gas-troenterology, 140, 478-487.E1. https://doi.org/10.1053/j.gastro.2010.08.061
- 28. Sidhu, S.S., Goyal, O., Mishra, B.P., et al. (2011) Rifaximin Im-proves Psychometric Performance and Health-Related Quality of Life in Patients with Minimal Hepatic Encephalopathy (The RIME Trial). American Journal of Gastroenterology, 106, 307-316. https://doi.org/10.1038/ajg.2010.455
NOTES
*通讯作者。
