Material Sciences
Vol.
12
No.
04
(
2022
), Article ID:
50985
,
11
pages
10.12677/MS.2022.124035
Sn掺杂Cs2AgBiCl6纳米晶的制备及其光学性能研究
夏悦,戢威,K. P. Homewood,高云*
湖北大学材料科学与工程学院,湖北 武汉
收稿日期:2022年3月23日;录用日期:2022年4月20日;发布日期:2022年4月29日

摘要
无铅Cs2AgBiCl6双钙钛矿材料作为有毒铅卤钙钛矿光伏材料的替代品,具备环境友好,稳定性高等优势而备受关注。Cs2AgBiCl6材料具备间接带隙半导体特性,由于强载流子–声子耦合相互作用形成的本征自限,增大了载流子的非辐射复合,降低了辐射复合效率,从而限制了其光电领域的进一步应用。理论计算表明,Sn掺杂可以改变Cs2AgBiCl6双钙钛矿内部结构形成直接带隙,抑制非辐射复合。本工作采用热注入法制备Sn掺杂的Cs2AgBiCl6双钙钛矿纳米晶,采用XRD,TEM,XPS等研究材料的相结构、微观形貌及价键特征,并探究了其光吸收和荧光发光特性。研究表明,Sn原子可以有效掺杂进入Cs2AgBiCl6晶格结构,并显著提高其荧光量子效率。
关键词
双钙钛矿纳米晶,Sn掺杂,荧光

Preparation and Optical Properties of Sn-Doped Cs2AgBiCl6 Nanocrystals
Yue Xia, Wei Ji, K. P. Homewood, Yun Gao*
School of Materials Science and Engineering, Hubei University, Wuhan Hubei
Received: Mar. 23rd, 2022; accepted: Apr. 20th, 2022; published: Apr. 29th, 2022

ABSTRACT
As the alternatives to toxic lead-halide perovskite photovoltaic materials, the lead-free Cs2AgBiCl6 double perovskites have recently attracted much attention due to their environmental friendliness and high stability. However, Cs2AgBiCl6 material is of intrinsic self-limitation due to its strong carrier-phonon coupling as an indirect bandgap semiconductor. The non-radiative recombination of carriers greatly reduces its radiative recombination efficiency and therefore limits its application in optoelectronics. The oretical calculation has indicated that Sn doping will give rise to changes in the internal structure of the Cs2AgBiCl6 double perovskite, resulting in the formation of direct band gap and thus reducing the non-radiative recombination. In this work, Sn-doped Cs2AgBiCl6 double perovskite nanocrystals were prepared by a thermal injection method, and the crystal structure, optical properties and valence structure were investigated by means of XRD, TEM and XPS, The experimental results show that Sn atoms are effectively doped in the structure of the lead-free perovskite nanocrystals, leading to a significant improvement in the fluorescence quantum yield.
Keywords:Double Perovskite, Nanocrystals, Sn Doping, Fluorescence

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
铅基卤素钙钛矿APbX3材料(其中A = Cs+; X = Cl, Br or I)具备出色的光电性能,如高光吸收性能、低激子结合能,长扩散长度,高载流子迁移率,制备简单等,自20世纪以来得到持续广泛的研究 [1] [2] [3]。2014年的无机铅卤钙钛矿纳米晶被首次制备出,其具有明亮的窄带隙荧光发射特征,且可以通过改变粒径尺寸或者卤素比例来调节从紫外到近红外的发射光波长,成为学者们研究的热点 [4] [5]。尽管无机铅卤钙钛矿纳米晶的稳定性相比于有机或者杂化钙钛矿材料有所提高,但由于本身强离子结构特征,易受水、氧、热等因素破坏,急需进一步寻求解决方案以获得高稳定性钙钛矿纳米晶。目前已经报道的解决方案包括:表面钝化 [6] [7]、卤素离子取代 [8] [9]、有机或者无机封装 [10] 等。
全无机铅卤钙钛矿材料稳定性差的主要原因是晶体的形成能比较低。前期的研究采用B位取代以提高全无机钙钛矿纳米晶的形成能。使用元素周期表中同一族的Ge2+、Sn2+来取代位于B位的Pb2+是最直接的取代办法 [11] [12] [13]。研究者发现B位的形成能大于A位和X位,这使得B位阳离子的部分取代比其他两个位置更难 [14]。且实验证明Sn2+不稳定,极易被氧化成Sn4+;在Ge2+中由于其4s2电子拥有更低的结合能,氧化现象更为明显 [15]。因此,选择结构稳定环境友好的非铅钙钛矿材料替代铅基,并通过能带工程提升其荧光性能,是解决这一问题的有效途径。
理论计算表明卤化物双钙钛矿结构A2B’B’’X6,B位由一个单价阳离子和一个三价阳离子同时取代两个Pb2+,具备优异的稳定性,是实现无铅稳定量子点的优异材料 [16]。目前报道合成的双钙钛矿单晶和纳米晶均表现出对热、光、湿具有良好稳定性 [17]。实验和计算结果表明,大多数双钙钛矿卤化物的电子结构主要为间接带隙半导体特征,其强载流子–声子的耦合作用导致低发光效率,限制了其在光伏及光电器件方面的应用 [18]。掺杂是改变电子结构的有效途径之一。研究表明,将Pb重新掺杂引入双钙钛矿Cs2AgBiX6 (X = Cl、Br、I)中可以得到理想的电子结构,获得直接带隙特征,但是掺杂其他族的元素却并不成功 [19] [20] [21]。目前暂未出现双钙钛矿纳米晶Sn掺杂的实验研究,2021年,Zhenyu Li等人 [22] 通过理论计算指出,Sn掺杂Cs2AgBiCl6可以将其转变为直接带隙材料。在本实验中将通过热注入方法,制备Sn2+掺杂Cs2AgBiCl6双钙钛矿纳米晶,研究掺杂对纳米晶结构及荧光性能的影响,验证理论计算结果,并为提升双钙钛矿纳米晶发光性能提供思路。
2. 实验部分
2.1. 实验试剂与药品规格
本实验中所使用的试剂与药品详见表1,所有试剂与药品购买后未经二次提纯直接使用。整个实验过程均在室温大气常压下进行。
Table 1. Reagents and their specifications involved in the work
表 1. 实验药品及规格
2.2. 纳米晶的制备
2.2.1. 纯的Cs2AgBiCl6纳米晶制备
1) 油酸铯前驱体的制备:在100 mL的三孔烧瓶中加入8 mL 1-十八烯,500 uL油酸,162.8 mg碳酸铯(Cs2CO3)。真空条件下加热到120℃并保持45 min,再加热到150℃直至生成淡黄色均匀稳定的油酸铯液体。
2) 在100 mL的三孔烧瓶中加入8 mL 1-十八烯,2 mL油酸,2 mL油胺,200 uL盐酸(盐酸浓度为12 M),63.06 mg氯化铋(BiCl3),34 mg硝酸银(AgNO3)。真空条件(主要为了排出水和空气)下加热到120℃保持30 min,再加热到200℃形成均匀稳定无沉淀的透明液体。在N2气氛下将预热过后的3.2 mL油酸铯前驱体溶液快速注入,剧烈搅拌中5~10秒后转移到冰水浴中快速冷却。
3) 纯纳米晶的洗涤:将冷却之后的混合溶液转移到离心管中加入等体积的正己烷混合均匀,转入离心机中,8000 rpm,10 min保留下层沉淀物,将其分散在等体积的正己烷与乙酸乙酯混合溶液,转入离心机,8000 rpm,10 min保留下层沉淀物。再将其分散在正己烷中,10,000 rpm,10 min移去下层的大颗粒,保留上层均匀透明液体以待接下来的测试表征。
2.2.2. Sn掺杂Cs2AgBiCl6纳米晶制备
1) 油酸铯前驱体的制备和纳米晶的洗涤过程与纯Cs2AgBiCl6纳米晶制备中的一样。在第二步中按摩尔比将SnCl2∙2H2O加入AgNO3、BiCl3溶液。例如样品Sn0.125制备中为29.75 mg AgNO3、55.18 mg BiCl3和11.28 mgSnCl2∙2H2O;样品Sn0.25制备中为25.50 mg AgNO3、 47.30 mg BiCl3和22.57 mg SnCl2∙2H2O。其中样品编号Sn0.125、Sn0.25中数字代表Sn占B位置(Sn+ Ag+ Bi)原子的比例。
2.3. 纳米晶的测试与表征
测试所用到的仪器见表2,使用透射电镜来观察纳米晶的形貌和大小;使用X-射线衍射仪测试纳米晶的晶体结构,确定晶相;使用紫外–可见分光光度计进行样品的光吸收测试;使用稳/瞬态荧光光谱仪进行稳态光致发光光谱和瞬态寿命测试;X射线光电子能谱仪用于得到各元素电子结合能等信息。
Table 2. Test instrument model and content
表2. 测试仪器型号与内容
3. 实验结果与讨论
通过热注射法合成制备纯Cs2AgBiCl6纳米晶,洗涤纯化之后将其分散在非极性溶剂正己烷中,形成黄色溶液,从上至下纳米晶的分散浓度增加,如图1(b)所示,在紫外光照射下显示发蓝白光。将含纳米晶正己烷溶液稀释之后滴在碳支持膜上,室温风干之后进行透射电镜(TEM)测试。结果如图1(a)所示。可以看到纳米晶粒径均匀,并具备良好的分散性。右上角缩图的粒径分布图显示纳米晶尺寸为以6.73 nm为中心的正态分布,其尺寸范围为4~9 nm。

Figure 1. (a) TEM picture of Cs2AgBiCl6 nanocrystals dispersed in n-hexane; (b) Picture of Cs2AgBiCl6 nanocrystals dispersed in n-hexane and insert: under 375 nm UV-light
图1. (a) 200℃合成的纯Cs2AgBiCl6纳米晶TEM图片;(b) Cs2AgBiCl6纳米晶分散在正己烷溶剂中,缩图为纳米晶在375 nm的紫外灯照射下
为了进一步研究Sn掺杂浓度对Cs2AgBiCl6纳米晶的晶体结构的影响,将分散在正己烷溶剂中的纳米晶滴在载玻片上,烘干蒸发掉溶剂后对其进行了X射线粉末衍射测试。如图2(a)和图2(b)分别为不同Sn掺杂浓度的Cs2AgBiCl6纳米晶XRD谱图及其局部放大图。当Sn的掺杂量在小于等于50%时,晶体结构与纯Cs2AgBiCl6保持一致,没有出现相分离。然而,位于22.94˚、32.74˚的(220)、(004)晶面衍射峰随掺杂浓度的增加向小角度方向偏移,向小角度的偏移从0.39˚增加到0.60˚,表示Sn离子的成功掺入Cs2AgBiCl6晶体结构中,并引起晶格参数变大。位于B位的离子半径分别为:Ag+:1.15Å、Bi3+:1.03Å而Sn离子半径分别为Sn2+:1.15Å、Sn4+:0.69Å [23] [24] [25],可以判断,Sn2+同步替代Ag+和Bi3+会引起晶格常数增大。因此,可以认为掺杂进入晶格中的离子为二价Sn2+离子。当Sn的掺杂量达到75%时,Cs2SnCl6对应的衍射峰出现,Cs2AgBiCl6对应的衍射峰极弱,为Cs2AgBiCl6和Cs2SnCl6两相共存的状态,其中主体为Cs2SnCl6。由于Cs2SnCl6具有与Cs2AgBiCl6相同的空间群( ),Ag和Bi为分别由一个Sn4+和空位占据 [26]。0.75Sn的样品的衍射峰与纯Cs2SnCl6样品的衍射峰相比,呈现整体向小角度偏移的现象,说明0.75Sn样品中Ag、Bi离子掺杂进Cs2SnCl6晶体,引起晶格常数增大。此外,随着掺杂浓度的增加,衍射峰的半高宽明显出现展宽,说明离子的掺杂伴随着晶粒细化的过程。晶粒尺寸D可以通过谢乐公式进行计算:
(1)
其中,λ为X射线波长,B为衍射峰半高宽,θ为晶面衍射角。应用位于低角度的(220)、(004)和(224)的晶面衍射峰计算出不同掺杂浓度对应的晶粒尺寸,取算数平均值得到平均晶粒尺寸,结果如表3所示。纯Cs2AgBiCl6纳米晶平均晶粒尺寸为6.92 nm,与TEM测试结果一致。Sn掺杂后晶粒平均尺寸减小至3~4 nm。
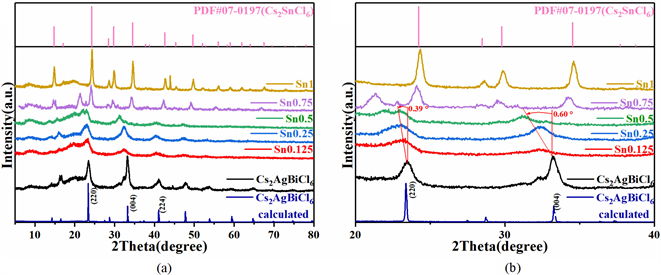
Figure 2. (a) XRD patterns of Cs2AgBiCl6 nanocrystals with different Sn doping amounts; (b) Partial enlargement
图2. (a) 不同Sn掺杂量下的Cs2AgBiCl6纳米晶XRD谱图;(b) 局部放大图
Table 3. Average grain size of samples with different Sn doping levels
表3. 不同Sn掺杂量样品的平均晶粒尺寸
对Cs2AgBiCl6 NCs、Sn0.25和Sn0.5样品进行了XPS能谱测试,用来进一步验证Sn成功掺杂入晶格中。图3上分别为纯Cs2AgBiCl6 NCs以及Sn0.25和Sn0.5样品的Cs3d、Ag3d、Bi4f和Cl2p的精细扫描XPS轨道能谱。相比纯的Cs2AgBiCl6纳米晶,Sn掺杂后的样品Cs3d轨道的XPS峰位并未发生明显偏移,而Ag3d、Bi4f和Cl2p轨道的XPS峰位都随掺杂量的增加而逐步向结合能大的方向偏移。在Cs2AgBiCl6、Sn0.25和Sn0.5样品中,Ag3d5/2轨道电子结合能峰位分别为:367.49、368.24、368.24,最大偏移量为0.75 eV;Cl2p3/2轨道电子结合能峰位分别为:197.81、198.35、198.45,最大偏移量0.64 eV。这说明Sn掺杂引起[AgCl6]正八面体电子结构的电子发生转移,周围电子云密度减小,相应电子结合能增大。随着Sn掺杂,Bi4f7/2轨道电子结合能位于159.17的Bi3+峰劈裂成两个峰,对应峰位位置为158.52 eV和159.77 eV,这一结果说明,部分[BiCl6]正八面体中的电子与[AgCl6]正八面体中的电子一样出现了电荷的转出,而部分Bi位得到电子。这与Sn2+同时替位Ag+和Bi3+位点相一致。由于Bi3+与Sn2+的离子半径差距较大,引起替位前后Bi位周围的八面体晶格畸变差距较大,导致Bi位的轨道峰位发生劈裂。为了确认Sn在晶格中的价态,分别测试了样品Sn0.25和Sn0.5的Sn3d轨道XPS精细能谱,其Sn3d5/2轨道峰位分别位于486.87 eV和486.82 eV,对应于自于Sn2+价态 [27]。这说明Sn2+成功地掺杂进Ag、Bi位置,这与XRD测试到晶格常数增大的结果分析一致。
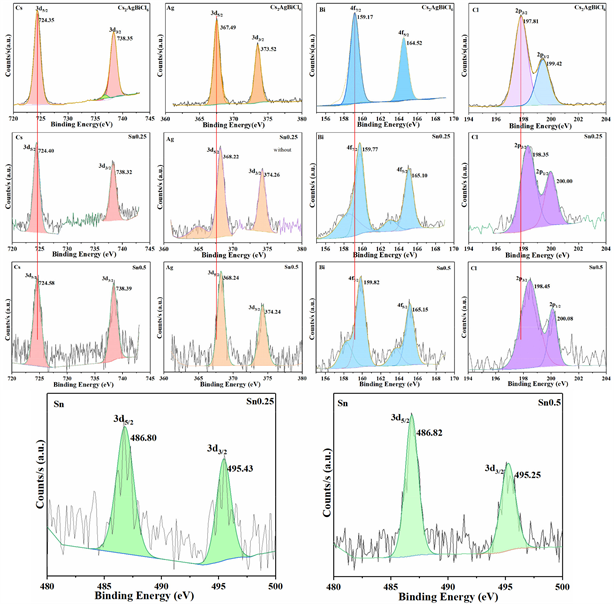
Figure 3. X-ray Photoelectron Spectroscopy (XPS) of Cs2AgBiCl6 nanocrystals and Sn-doped Cs2AgBiCl6 nanocrystals
图3. Cs2AgBiCl6纳米晶和Sn掺杂Cs2AgBiCl6纳米晶的X射线光电子能谱(XPS)图
为了探究Sn掺杂对纳米晶光学性能的影响,对不同掺杂量的纳米晶进行了紫外–可见吸收光谱和稳/瞬态荧光光谱测试。图4(a)是样品的光吸收图谱,可以看到纯Cs2AgBiCl6纳米晶在365 nm (3.40 eV)附近的存在一个激子吸收峰,与之前的报道基本一致 [28]。这个激子吸收峰主要是由于双钙钛矿(Cs2AgBiX6, X = Cl、Br、I)纳米晶结构中占主导地位的Bi3+离子的6s-6p跃迁引起的。随着的Sn掺入,在335nm (3.7 eV) 附近产生了第二个吸收峰,该吸收峰位值不随掺杂浓度而改变。而且这个吸收峰在纯Cs2SnCl6样品中并没有出现。以上结果说明该吸收峰产生的可能原因是客体Sn离子的掺入Cs2AgBiCl6晶格对原有晶体的电子结构扰动。图4(b)显示了用Tauc plot得到各Sn掺杂量样品的光学带隙制成的折线图。纯的Cs2AgBiCl6纳米晶带隙为3.21 eV,纯的Cs2SnCl6纳米晶带隙为4.97 eV。Sn掺杂Cs2AgBiCl6引起纳米晶的带边微弱蓝移,这个结果与Sn掺入Pb基钙钛矿中一致 [29]。而Ag、Bi掺杂Cs2SnCl6 (Sn0.75样品)引起Cs2SnCl6纳米晶的吸收边蓝移至3.40 eV。纯Cs2AgBiCl6纳米晶与之前报道的单晶样品带隙(2.62 eV) [30] 相比发生了0.59 eV的蓝移,这是由于其纳米尺寸引起的量子限制效应。

Figure 4. Cs2AgBiCl6 nanocrystals with different Sn doping amounts’ (a) UV-Vis absorption spectra; (b) The band gap line graph drawn by the absorption edge according to the Tauc-plot; (c) Photoluminescence (PL) spectra; (d) Time-resolved photoluminescence (TRPL) spectra
图4. 不同Sn掺杂量Cs2AgBiCl6纳米晶的(a) 紫外–可见吸收光谱图;(b) 根据Tauc plot得到吸收边绘制的带隙折线图;(c) 光致荧光(PL)光谱图;(d) 时间分辨光致荧光(TRPL)光谱图
激发光源选取375 nm波长激光,加载400 nm的长通滤波片进行荧光光谱测试。图4(c)室温条件下得到的光致发光光谱。光谱由两个荧光峰组成,1号峰位于470 nm (2.64 eV)附近,具备较宽的半高宽(~141 nm),且随Sn掺杂量的增加有一定程度上的蓝移(见表4),来自于间接带隙半导体声子辅助的带边复合。2号峰位于435 nm (2.85 eV)附近,半高宽相对较窄(~23 nm),来自于子带隙复合。对比稳态吸收光谱和荧光光谱可以看到荧光峰位置与吸收边有一定的偏移,这是在双钙钛矿由于强载流子–声子耦合引起的斯托克斯位移的效应,是其作为间接带隙半导体的显著特征 [31]。纯Cs2AgBiCl6纳米晶的荧光强度很弱,随着Sn的掺杂,光致荧光强度逐渐增加。当Sn浓度达到0.5时,其荧光强度急剧提升了100倍以上。Sn0.75样品的荧光强度最大,超过纯的Cs2SnCl6和Sn0.5掺杂的Cs2AgBiCl6纳米晶。这说明Sn掺杂达到0.5时,产生了扩展的离子掺杂能带,有利于打破间接带隙材料辐射复合跃迁需要声子辅助以达到动量守恒的要求,极大地提高了材料的辐射复合效率。
Table 4. Steady/transient spectral data of samples with different Sn doping levels
表4. 不同Sn掺杂量样品的稳/瞬态光谱数据
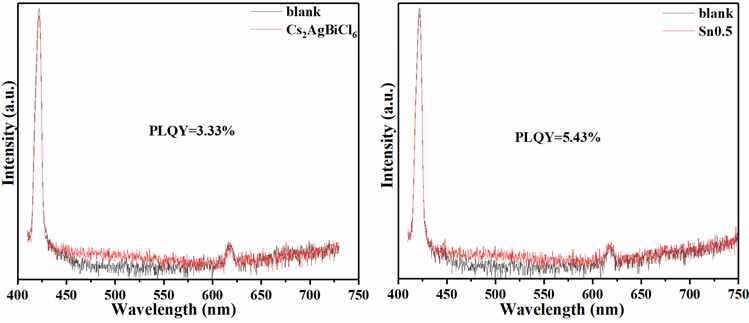
Figure 5. (a) Photoluminescence quantum yield (PLQY) diagram of Cs2AgBiCl6 nanocrystals; (b) Photoluminescence quantum yield (PLQY) diagram of Sn0.5 sample
图5. (a) Cs2AgBiCl6纳米晶的光致发光量子产率(PLQY)谱图;(b) Sn0.5样品的光致发光量子产率(PLQY)谱图
固定荧光峰位对应的波长470 nm进行瞬态荧光光谱分析,所得瞬态荧光光谱如图4(d)所示。荧光寿命通过对光谱进行三指数拟合得到,结果如表4显示,拟合得到的三个荧光寿命均小于10 ns。考虑到在钙钛矿纳米晶中观察到的自陷态缺陷发光的寿命一般都较长(大于100 ns),可以确认,这里测得的470 nm发光光谱源于声子辅助的带边复合。随着Sn掺杂Cs2AgBiCl6浓度增加,荧光寿命呈现增加趋势。这表示Sn的掺杂有利于提高载流子在激发态的平均弛豫时间,增加辐射复合几率。以375 nm Laser作为光源,BaSO4为全反射材料,用石英比色皿中加正己烷纯溶剂为空白对照样,采用积分球模式进行Cs2AgBiCl6纳米晶和Sn0.5样品的量子产率测试,测试结果如图5所示。结果表明,Cs2AgBiCl6纳米晶样品量子产率为3.33%,Sn掺杂后量子产率提升到5.43%,进一步说明了Sn掺杂有效提升了Cs2AgBiCl6辐射复合发光性能。
4. 结论
本文通过热注入法成功制备出Sn掺杂的Cs2AgBiCl6纳米晶。在Sn掺杂量不大于50%时为与原Cs2AgBiCl6一致的立方相结构,而Sn大于50%后转变为与Cs2SnCl6一致的晶体结构。掺杂量的增加引起纳米晶尺寸减小,晶格常数增大。Sn的掺入造成双钙钛矿结构中[AgCl6]和部分[BiCl6]正八面中电子向Bi位转移,产生外层电子离域。在光学性能方面,Sn掺杂纳米晶吸收边整体吸收边微弱蓝移,受激载流子平均弛豫时间增加,荧光强度大幅度增加,光致发光量子效率变为原来的1.63倍。以上结果说明了Sn掺杂有效提高了Cs2AgBiCl6辐射复合发光,为改善双钙钛矿的光电性能提供了实验依据。
基金项目
本研究由国家自然科学基金(批准号:12174092和11874144)资助。
文章引用
夏 悦,戢 威,K. P. Homewood,高 云. Sn掺杂Cs2AgBiCl6纳米晶的制备及其光学性能研究
Preparation and Optical Properties of Sn-Doped Cs2AgBiCl6 Nanocrystals[J]. 材料科学, 2022, 12(04): 341-351. https://doi.org/10.12677/MS.2022.124035
参考文献
- 1. Møller, C.K. (1958) Crystal Structure and Photoconductivity of Cæsium Plumbohalides. Nature, 182, 1436.
- 2. Weber, D. (1978) CH3NH3PbX3, ein Pb(II)-System mit kubischer Perowskitstruktur [CH3NH3PbX3, a Pb(II)-System with Cubic Perovskite Structure]. Zeitschrift für Naturforschung B, 33, 1443-1445. https://doi.org/10.1515/znb-1978-1214
- 3. Onoda-Yamamuro, N., Matsuo, T. and Suga, H. (1992) Dielectric Study of CH3NH3PbX3 (X=Cl, Br, I). Journal of Physics and Chemistry of Solids, 53, 935-939. https://doi.org/10.1016/0022-3697(92)90121-S
- 4. Hassan, Y., Ashton, O.J., Park, J.H., et al. (2019) Facile Synthesis of Stable and Highly Luminescent Methylammonium Lead Halide Nanocrystals for Efficient Light Emitting Devices. Journal of the American Chemical Society, 141, 1269- 1279. https://doi.org/10.1021/jacs.8b09706
- 5. Wu, L., Hu, H., Xu, Y., et al. (2017) From Nonluminescent Cs4PbX6 (X = Cl, Br, I) Nanocrystals to Highly Luminescent CsPbX3 Nanocrystals: Water-Triggered Transformation through a CsX-Stripping Mechanism. Nano Letters, 17, 5799-5804. https://doi.org/10.1021/acs.nanolett.7b02896
- 6. Chen, S.C., Wang, D. and Zheng, Q. (2020) Surface Passivation of All-Inorganic CsPbI2Br with a Fluorinated Organic Ammonium Salt for Perovskite Solar Cells with Efficiencies over 16%. Solar RRL, 4, Article ID: 2000321. https://doi.org/10.1002/solr.202000321
- 7. He, J., Su, J., Lin, Z., et al. (2021) Enhanced Efficiency and Stability of All-Inorganic CsPbI2Br Perovskite Solar Cells by Organic and Ionic Mixed Passivation. Advanced Science, 8, Article ID: 2101367. https://doi.org/10.1002/advs.202101367
- 8. Zhang, P., Zhu, G., Shi, Y., et al. (2018) Ultrafast Interfacial Charge Transfer of Cesium Lead Halide Perovskite Films CsPbX3 (X=Cl, Br, I) with Different Halogen Mixing. The Journal of Physical Chemistry C, 122, 27148-27155. https://doi.org/10.1021/acs.jpcc.8b07237
- 9. Wang, F., Zhang, H., Sun, Q., et al. (2020) Low-Temperature Solution Growth and Characterization of Halogen (Cl, I)-Doped CsPbBr3 Crystals. Crystal Growth & Design, 20, 1638-1645. https://doi.org/10.1021/acs.cgd.9b01368
- 10. Ma, X., Yang, W., Ge, X., et al. (2021) Design a Novel Multifunctional (CsPbBr3/Fe3O4)@MPSs@SiO2 Magneto- Optical Microspheres for Capturing Circulating Tumor Cells. Applied Surface Science, 551, Article ID: 149427. https://doi.org/10.1016/j.apsusc.2021.149427
- 11. Zou, S., Liu, C., Li, R., et al. (2019) From Nonluminescent to Blue-Emitting Cs4PbBr6 Nanocrystals: Tailoring the Insulator Bandgap of 0D Perovskite through Sn Cation Doping. Advanced Materials, 31, Article ID: 1900606. https://doi.org/10.1002/adma.201900606
- 12. Liu, D., Liang, L. and Sa, R. (2021) First-Principles Calculations of Structural, Electronic, and Optical Properties of Double Perovskites Cs2Sn1-xBxI6 (B=Si, Ge; x=0, 0.25, 0.50, 0.75, 1). Chemical Physics, 542, Article ID: 111075. https://doi.org/10.1016/j.chemphys.2020.111075
- 13. Liu, D., Peng, H., Li, Q., et al. (2022) A DFT Study of the Stability and Optoelectronic Properties of All-Inorganic Lead-Free Halide Perovskites. Journal of Physics and Chemistry of Solids, 161, Article ID: 110413. https://doi.org/10.1016/j.jpcs.2021.110413
- 14. Swarnkar, A., Mir, W.J. and Nag, A. (2018) Can B-Site Doping or Alloying Improve Thermal- and Phase-Stability of All-Inorganic CsPbX3 (X=Cl, Br, I) Perovskites? ACS Energy Letters, 3, 286-289. https://doi.org/10.1021/acsenergylett.7b01197
- 15. Stoumpos, C.C., Malliakas, C.D. and Kanatzidis, M.G. (2013) Semiconducting Tin and Lead Iodide Perovskites with Organic Cations: Phase Transitions, High Mobilities, and Near-Infrared Photoluminescent Properties. Inorganic Chemistry, 52, 9019-9038. https://doi.org/10.1021/ic401215x
- 16. Zhao, X.G., Yang, J.H., Fu, Y., et al. (2017) Design of Lead-Free Inorganic Halide Perovskites for Solar Cells via Cation- Transmutation. Journal of the American Chemical Society, 139, 2630-2638. https://doi.org/10.1021/jacs.6b09645
- 17. Slavney, A.H., Hu, T., Lindenberg, A.M., et al. (2016) A Bismuth-Halide Double Perovskite with Long Carrier Recombination Lifetime for Photovoltaic Applications. Journal of the American Chemical Society, 138, 2138-2141. https://doi.org/10.1021/jacs.5b13294
- 18. Filip, M.R., Hillman, S., Haghighirad, A.A., et al. (2016) Band Gaps of the Lead-Free Halide Double Perovskites Cs2BiAgCl6 and Cs2BiAgBr6 from Theory and Experiment. The Journal of Physical Chemistry Letters, 7, 2579-2585. https://doi.org/10.1021/acs.jpclett.6b01041
- 19. Kangsabanik, J., Sugathan, V., Yadav, A., et al. (2018) Double Perovskites Overtaking the Single Perovskites: A Set of New Solar Harvesting Materials with Much Higher Stability and Efficiency. Physical Review Materials, 2, Article ID: 055401. https://doi.org/10.1103/PhysRevMaterials.2.055401
- 20. Slavney, A.H., Leppert, L., Bartesaghi, D., et al. (2017) Defect-Induced Band-Edge Reconstruction of a Bismuth- Halide Double Perovskite for Visible-Light Absorption. Journal of the American Chemical Society, 139, 5015-5018. https://doi.org/10.1021/jacs.7b01629
- 21. Du, K.Z., Meng, W., Wang, X., et al. (2017) Bandgap Engineering of Lead-Free Double Perovskite Cs2AgBiBr6 through Trivalent Metal Alloying. Angewandte Chemie International Edition, 56, 8158-8162. https://doi.org/10.1002/anie.201703970
- 22. Ma, X., Li, Z. and Yang, J. (2021) Efficient Direct Band Gap Photovoltaic Material Predicted via Doping Double Perovskites Cs2AgBiX6 (X=Cl, Br). The Journal of Physical Chemistry C, 125, 10868-10875. https://doi.org/10.1021/acs.jpcc.1c01871
- 23. Hoefler, S.F., Trimmel, G. and Rath, T. (2017) Progress on Lead-Free Metal Halide Perovskites for Photovoltaic Applications: A Review. Monatshefte für Chemie, 148, 795-826. https://doi.org/10.1007/s00706-017-1933-9
- 24. Kieslich, G., Sun, S. and Cheetham, A.K. (2015) An Extended Tolerance Factor Approach for Organic-Inorganic Perovskites. Chemical Science, 6, 3430-3433. https://doi.org/10.1039/C5SC00961H
- 25. Sani, F., Shafie, S., Lim, H.N., et al. (2018) Advancement on Lead-Free Organic-Inorganic Halide Perovskite Solar Cells: A Review. Materials, 11, Article No. 1008. https://doi.org/10.3390/ma11061008
- 26. Maughan, A.E., Ganose, A.M., Bordelon, M.M., et al. (2016) Defect Tolerance to Intolerance in the Vacancy-Ordered Double Perovskite Semiconductors Cs2SnI6 and Cs2TeI6. Journal of the American Chemical Society, 138, 8453-8464. https://doi.org/10.1021/jacs.6b03207
- 27. Das Adhikari, S., Masi, S., Echeverría-Arrondo, C., et al. (2021) Continuous-Flow Synthesis of Orange Emitting Sn(II)- Doped CsBr Materials. Advanced Optical Materials, 9, Article ID: 2101024. https://doi.org/10.1002/adom.202101024
- 28. Creutz, S.E., Crites, E.N., De Siena, M.C., et al. (2018) Colloidal Nanocrystals of Lead-Free Double-Perovskite (Elpasolite) Semiconductors: Synthesis and Anion Exchange to Access New Materials. Nano Letters, 18, 1118-1123. https://doi.org/10.1021/acs.nanolett.7b04659
- 29. Zhang, X., Cao, W., Wang, W., et al. (2016) Efficient Light-Emitting Diodes Based on Green Perovskite Nanocrystals with Mixed-Metal Cations. Nano Energy, 30, 511-516. https://doi.org/10.1016/j.nanoen.2016.10.039
- 30. McClure, E.T., Ball, M.R., Windl, W., et al. (2016) Cs2AgBiX6 (X=Br, Cl): New Visible Light Absorbing, Lead-Free Halide Perovskite Semiconductors. Chemistry of Materials, 28, 1348-1354. https://doi.org/10.1021/acs.chemmater.5b04231
- 31. Rajeev Kumar, N. and Radhakrishnan, R. (2018) Electronic, Optical and Mechanical Properties of Lead-Free Halide Double Perovskites Using First-Principles Density Functional Theory. Materials Letters, 227, 289-291. https://doi.org/10.1016/j.matlet.2018.05.082
NOTES
*通讯作者。
