Advances in Clinical Medicine
Vol.
10
No.
02
(
2020
), Article ID:
34338
,
12
pages
10.12677/ACM.2020.102025
Analysis of Treatment Methods and Curative Effect of Craniopharyngioma in Children
Shuai Luo1, Jianning Zhang2, Hulin Zhao2, Mangmang Bai1, Xiaolong Li1*
1Department of Neurosurgery, Affiliated Hospital of Yan’an University, Yan’an Shaanxi
2Department of Neurosurgery, The Sixth Medical Center PLA General Hospital, Beijing

Received: Feb. 5th, 2020; accepted: Feb. 20th, 2020; published: Feb. 27th, 2020

ABSTRACT
Objective: To summarize the different treatment methods of children’s craniopharyngioma and their efficacy through literature review, seek the best treatment options at present, and explore the research directions of craniopharyngioma treatment methods for children in the future. Methods: Read the representative craniopharyngioma literature at home and abroad in the past 5 years, summarize the craniopharyngioma classification and its applicability to children and the guiding significance of surgical approach; classify and sort out the current treatment methods and curative effects of craniopharyngioma in children, and analyze the best treatment options and possible future research directions. Results: Surgical treatment is still the mainstream treatment method for craniopharyngioma in children. The craniopharyngioma’s classification can help guide surgical evaluation; microsurgical trauma, long postoperative recovery period, high incidence of treaty-related hypothalamus and pituitary dysfunction, affect the quality of life, growth and development of children. In recent years, endoscopic endonasal surgery, with the advantages of direct-view operation, clear surgical field, and low hypothalamus interference, has been highly respected, especially suitable for midline central tumors; IMRT and gamma knife can effectively control the recurrent craniopharyngioma tumor cells growth and prolong the duration of surgical intervention. However, the adhesion of radioactive tissue increases the difficulty of gross total resection, and radioactive damage will occur. Proton therapy can avoid/reduce the radioactive side effects, but it is currently in the research stage. Radioisotope interstitial radiotherapy is an ideal treatment option for cystic craniopharyngioma, but the rate of tumor control is limited, meanwhile with a high rate of recurrence and serious complications caused by leakage. The side effect of toxicity of interferon is small, but the effectiveness and safety need to be further studied due to the limited data. Genetic research is gradually deepening, which promotes us to understand the molecular pathogenesis of craniopharyngioma and provides a solid theoretical support for molecular targeted therapy. And case reports have confirmed the effectiveness of targeted drugs. Conclusions and Outlook: Surgery based on the guidance of craniopharyngioma classification is still the main treatment method for children’s craniopharyngioma. And radiation can effectively help control residual lesions and recurrence tumors after surgery. Potential safety and efficacy of cystic craniopharyngioma interstitial radiotherapy and drug therapy need further prospective research. Proton therapy for children craniopharyngioma has promising prospects. Targeted drug therapy has shown initial efficacy, and in-depth study of molecular mechanisms will provide new treatment options for children craniopharyngioma.
Keywords:Children Craniopharyngioma, Surgery, Radiation Therapy, Proton Therapy, Intracystic Treatment, Gene Therapy

儿童颅咽管瘤的治疗方法及其疗效现状分析
罗帅1,张剑宁2,赵虎林2,白茫茫1,李小龙1*
1延安大学附属医院神经外科,陕西 延安
2中国人民解放军总医院第六医学中心神经外科研究所,北京

收稿日期:2020年2月5日;录用日期:2020年2月20日;发布日期:2020年2月27日

摘 要
目的:通过文献复习归纳儿童颅咽管瘤的不同治疗方法及其疗效,寻求目前最佳的治疗选择,探索未来儿童颅咽管瘤治疗方法研究的方向。方法:阅读近5年国内外具有代表性的颅咽管瘤文献,归纳颅咽管瘤分型及其对儿童的适用性和对手术入路的指导意义;分类整理儿童颅咽管瘤现阶段的治疗方法及疗效,分析得出现阶段最佳治疗方案和未来治疗可能研究的方向。结果:外科手术治疗仍为现阶段儿童颅咽管瘤主流的治疗方法,颅咽管瘤分型能协助指导手术评估;显微手术创伤性大、术后恢复周期长、治疗相关性下丘脑及垂体功能障碍发生率高,影响患儿生活质量、生长发育;近年经鼻内镜手术备受推崇,镜下直视操作、术野清晰、下丘脑干扰小,中线中央区域尤为适用;调强适形放疗、伽玛刀能有效控制原发和复发颅咽管瘤肿瘤细胞增长,延长手术介入的时限,但放射性组织粘连增加完全切除难度,同时会产生放射性损伤,质子治疗能规避/减小放射性副损伤,但目前处于研究阶段;放射性同位素间质内放疗为儿童囊性颅咽管瘤理想的治疗选择,但肿瘤控制率有限,复发率高,存在泄露导致严重并发症的风险,理论和实际相差甚远;干扰素毒副反应小,限于数据量小,有效性、安全性尚待进一步研究;基因水平研究的深入,提升了对颅咽管瘤发病机制分子水平的认识,为分子靶向治疗提供坚实的理论支撑,现有报道已证实靶向药物的有效性。结论与展望:颅咽管瘤分型指导下外科手术仍为现阶段儿童颅咽管瘤主要的治疗方法,放射能协助控制术后残留病灶和复发肿瘤;囊性颅咽管瘤间质内放疗和药物化疗制剂的选择及潜在的安全性、有效性尚待进一步前瞻性研究;儿童颅咽管瘤质子刀治疗前景可观;靶向治疗初现成效,分子致病机制的深入探索将为儿童颅咽管瘤开起新的治疗选择。
关键词 :儿童颅咽管瘤,外科手术,放射治疗,质子治疗,囊内治疗,基因治疗

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
颅咽管瘤(craniopharyngioma, CP)是Rathke囊或颅咽管残存的胚胎上皮细胞化生而来的良性病变,低度恶性进展,WHO I级 [1] [2]。人群年发病率为0.5~2/百万,儿童和青少年占30%~50%,占儿童颅内肿瘤的1%~10%,集中在5~14岁 [1] [3]。CP位置深在,毗邻关系复杂,使完全切除(gross total resection, GTR)成为所有神经外科医生面临的重大挑战,且GTR创伤大、并发症发生率高。经鼻内镜技术弥补了常规显微手术的缺陷,具有微创、视野暴露充分等特点,为直视下肿瘤GTR提供便利 [2] [4]。然而,对于组织黏连紧密不能GTR、复发不能耐受再次手术的患儿,放疗为肿瘤控制提供有力的支持,延长手术介入时限。但常规放疗副反应重,远期认知功能障碍发生率高,因而质子束治疗淡出视线,近年备受关注 [5]。囊性CP同位素间质内放疗、药物化疗间断有所报道,但限于其机制不明、疗效及副反应的不确定性,尚需进一步前瞻性研究。同时,CP分子机制深入研究,将为儿童CP治疗带来新的希冀。
2. 外科手术
儿童CP的外科治疗百家争鸣,瘤体位置深在,紧邻视神经、垂体、下丘脑及颈内动脉系统等重要结构,争议的焦点主要集中在手术入路选择及毗邻重要结构功能的保护。
2.1. 颅咽管瘤分型
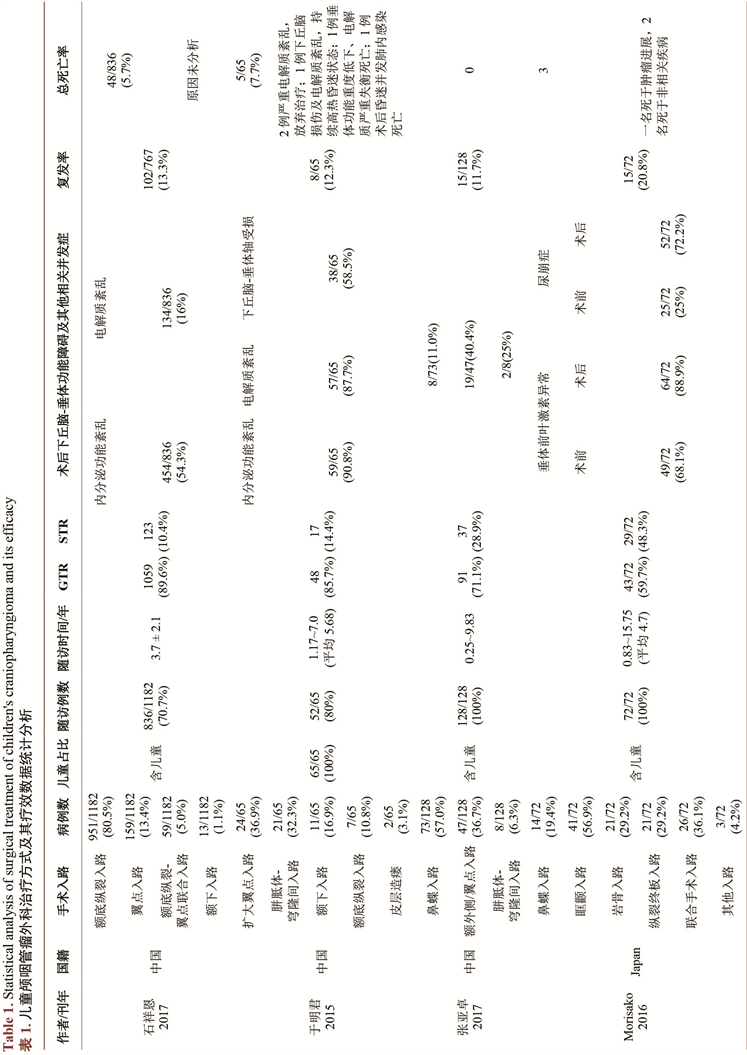
基于肿瘤起源部位和膜性概念,漆松涛将CP分为三型(图1),即QST分型 [6]。Q型:起源于鞍膈下的垂体中间叶,通过鞍膈孔凸向鞍上时,呈现雪人征;S型:起源于鞍膈上垂体柄袖套外及袖套间段,部分外层蛛网膜和内层蛛网膜与结节漏斗部相隔;T型:起源于垂体柄疏松部袖套内段,与结节漏斗广泛粘连,肿瘤通过第三脑室底卷向第三脑室底内或蛛网膜内生长,结节漏斗部正中结构被推挤变形,第三脑室内膜延续于肿瘤上方,第三脑室底内层蛛网膜及liliequest膜的间脑叶将肿瘤与脚间池相隔。
 图注:A.垂体柄分段:① 蛛网膜袖套内段 红色;② 蛛网膜袖套间段 绿色;③ 蛛网膜袖套外–鞍膈上段 青色;④ 鞍膈下段 蓝色。分型:Q型(鞍膈下型 蓝色虚线) S型(鞍上–蛛网膜腔型 绿色及青色虚线) T型(结节漏斗型 红色虚线)。蛛网膜:1. 内层蛛网膜;2. 外层蛛网膜(紫线:室管膜;绿线:蛛网膜;黄线:软膜;浅蓝色线:硬膜);B-D:生长模式图(绿线:蛛网膜;褐色线:硬膜;黑色部分为肿瘤)
图注:A.垂体柄分段:① 蛛网膜袖套内段 红色;② 蛛网膜袖套间段 绿色;③ 蛛网膜袖套外–鞍膈上段 青色;④ 鞍膈下段 蓝色。分型:Q型(鞍膈下型 蓝色虚线) S型(鞍上–蛛网膜腔型 绿色及青色虚线) T型(结节漏斗型 红色虚线)。蛛网膜:1. 内层蛛网膜;2. 外层蛛网膜(紫线:室管膜;绿线:蛛网膜;黄线:软膜;浅蓝色线:硬膜);B-D:生长模式图(绿线:蛛网膜;褐色线:硬膜;黑色部分为肿瘤)
Figure 1. Schematic diagram of pituitary stem segmentation and QST typing of craniopharyngioma based on membrane concept
图1. 基于膜性概念的垂体柄分段及颅咽管瘤QST分型示意图 [6]
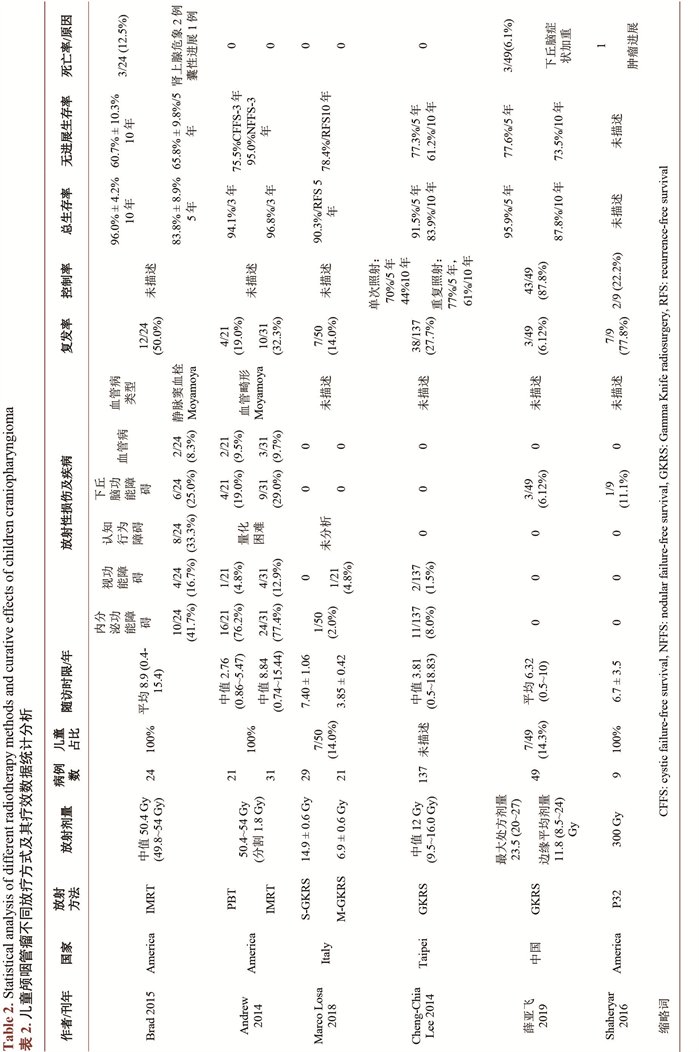
Morisako依据肿瘤的部位、起源及生长模式将CP分为四型 [7],基于分型选择手术入路(图2),并对结果进行分析(表1)。
 图注:A-B:鞍内型,起源于垂体柄鞍内段,常见鞍底扩大;C-D:视交叉前型,起源于垂体柄前部并向上生长,视交叉及前交通动脉被瘤体推挤上抬;E-F:视交叉后型,起源于垂体柄后部并向后颅窝生长,视交叉及前交通动脉位置正常;G-H:三脑室型,起源于三脑室底壁,脑室内生长。红点:前交通动脉;紫点:肿瘤起源部位
图注:A-B:鞍内型,起源于垂体柄鞍内段,常见鞍底扩大;C-D:视交叉前型,起源于垂体柄前部并向上生长,视交叉及前交通动脉被瘤体推挤上抬;E-F:视交叉后型,起源于垂体柄后部并向后颅窝生长,视交叉及前交通动脉位置正常;G-H:三脑室型,起源于三脑室底壁,脑室内生长。红点:前交通动脉;紫点:肿瘤起源部位
Figure 2. Anatomy pattern of craniopharyngioma
图2. 颅咽管瘤解剖学分型模式图 [7]
Kassam教授认为基于瘤体与视交叉、三脑室位置关系的CP分型,对开颅手术有重要的指导意义,但对于扩大经鼻入路手术而言,病变向鞍上扩张的程度与漏斗的关系更具有指导意义 [8]。因此将CP分为四型(图3):I型:漏斗前生长;II型:漏斗内外沟通生长(瘤体伸入垂体柄);III型:漏斗后生长,延伸至垂体及垂体柄后方,分为两个亚型(a.向三脑室生长;b.向脚间池生长);IV:远离三脑室(经鼻蝶不能探及,MR影像未展示)。

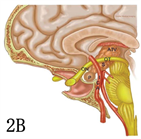
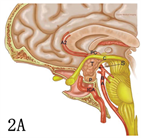
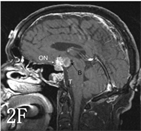

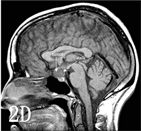 图注:A,D:I型矢状位示意图及增强MR;B,E:II型矢状位示意图及增强MR;C,F:III型矢状位示意图及增强MR。字母标识:参见原文献[8]
图注:A,D:I型矢状位示意图及增强MR;B,E:II型矢状位示意图及增强MR;C,F:III型矢状位示意图及增强MR。字母标识:参见原文献[8]
Figure 3. Schematic of CP classification based on the relationship between the degree of CP expansion to the saddle and the funnel and image comparison
图3. 基于CP向鞍上扩张的程度与漏斗的关系的CP分型与影像对照示意图 [8]
综上CP分型,一方面能提升对CP的深入认识;另一方面能协助手术入路设计及术前安全性评估。
2.2. 显微外科手术
现代神经影像技术能有效协助术前评估,对于肿瘤定位清晰、无下丘脑-垂体轴及视路侵犯的患儿,追求肿瘤GTR为诸多神经外科专家所青睐。然而,肿瘤定位及分界不清,术前已存在内分泌及视功能障碍者,追求肿瘤全切亦或部分切除后辅助放疗尚无统一意见。
石祥恩对1182例CP患者治疗结果进行分析(表1),GTR1059例/89.6%,部分切除(subtotal resection, STR)123例/10.4%,2年生存率分别为98.7%和85.0% (P < 0.05),6年生存率分别为94.6%和54.8% (P < 0.05),STR复发率(69/69, 100%),复发后再次手术的并发症和死亡风险明显增加 [9]。结论:手术切除程度与生存率存在显著相关性,倡导初次患者进行根除切除,避免反复手术,降低手术风险;术后残留病灶推荐辅助放疗。Morisako认为CP解剖分型能为手术制定个体化的入路选择,以实现肿瘤的侵袭性切除,并对72例进行分析(表1),GTR43例/59.7%,STR29例/48.3%,术后均发生不同程度下丘脑-垂体功能障碍,但GTR无瘤生存期明显优于STR者 [7]。基于QST分型指导术前评估及手术入路选择,漆松涛对117例初治患者进行剖析,结果显示(表1):不同QST型别下其内分泌指标、手术入路以及预后的差异均有统计学意义,坚持原发CP的GTR,并强调膜性结构(蛛网膜)的完全解剖与破坏将导致复发瘤体与周边结构更为广泛而复杂的关系,再次手术更为困难 [6]。Mohammed教授分享了60年儿童CP的诊疗经验 [1],统计结果显示:追求GTR与STR后辅助放疗相比较,肿瘤复发及并发症发生率基本一致,但保守治疗能降低侵袭性切除所致并发疾病的发生,改善远期生活质量,坚持术中重要结构功能的保护。
2.3. 内镜经鼻手术
近年,青年医生对内镜技术掌握纯熟,内镜经鼻手术得到极大推广。鞍内型CP为内镜经鼻手术(endoscopic endonasal surgery, EES)的最佳适应症,鞍内型突破鞍隔向鞍上生长的CP,扩大经鼻蝶入路(expanded endonasal approach, EEA)时有报道,且肿瘤全切率高,由20%~75%升至56%~94%,且EES术后下丘脑–垂体功能障碍发生率明显降低,术后视力改善达75%~100% [10]。
张亚卓对128例采用EES的原发CP患者进行回顾性分析(表1),依据肿瘤分型及手术可能对下丘脑–垂体功能的影响选择手术入路,其中73例采用EEA (鞍内型19例),对于鞍内型EEA可到达肿瘤主体。术后下丘脑–垂体功能低下8例/11.0%,明显低于开颅手术组,但4例发生脑脊液漏。结论:EES对下丘脑干扰小,术后水电解质紊乱、内分泌功能障碍发生率低,但EEA增加脑脊液鼻漏风险 [11]。Peter将开颅组与EES组进行实验对照,GTR (EES85.7%,开颅53.3%),配对及非配对队列研究均显示:术后肿瘤残余体积、下丘脑缺血、下丘脑性肥胖,在EES组与开颅组有显著差异,EES组明显优于开颅组 [4]。孟肖利对18例(含儿童)采用EEA的患者术后神经内分泌功能进行评估,结果显示术前存在的神经内分泌功能障碍,术后明显改善,新的神经内分泌功能障碍发生率低 [12]。屈延对6例儿童CP采用EEA,实现100% GTR,并指出EEA需要较高的手术技巧及较长时间的学习曲线 [13]。
EES具有如下优势 [2] [4] [11] :① 镜像清晰,角度广,无死角,便于垂体–垂体柄暴露和保护,利于肿瘤全切;② 神经血管结构牵拉小,术后视功能障碍、下丘脑缺血性损伤等发生率低;③ 镜下直视肿瘤及毗邻重要结构,便于及时调整手术策略。
3. 放射治疗
儿童CP为良性病变、低度恶性进展,因此GTR是必要的,但并非均能实现100%GTR,且术后复
发率达20%~50% [14],放射治疗(radiotherapy, RT)在术后肿瘤残余及复发治疗中扮演重要角色。
3.1. 调强适形放疗
调强适形放疗(Intensity-modulated radiation therapy, IMRT)通过对放射野内每一束输出强度进行调节,达到肿瘤靶区的高剂量分布适形,主要适用于相对固定的实体肿瘤。Brad将24例儿童CP分为手术联合放疗组和单纯放疗组,结果提示(表2):5年和10年总生存率分别为96.0% ± 4.2%和83.8% ± 8.9%,无进展生存率分别为65.8% ± 9.8%和60.7% ± 10.3%,证实了IMRT治疗的有效性,但总生存率和无进展生存率组间无差异 [3]。但限于病例数少,可推广性受限。且儿童CP囊性居多,囊性成分的不稳定性致使放疗诱导的神经病变不可控,因此IMRI在CP的应用报道较少。
3.2. 伽玛刀
伽玛刀与常规放疗相比精度高,适用于边界清的小体积肿瘤(直径 < 3 cm),术后残留或复发的CP尤为适用。1995年Prasad报道了伽玛刀在CP治疗中的有效性和安全性 [15],后期得到逐渐推广。Marco分析50例接受单分割和多分割治疗后患者的远期疗效 [14],结果显示(表2):对于距离神经组织(视神经及交叉)小于2~3 mm的大型瘤体更适合低剂量(<10 Gy)多分割治疗;实体肿瘤较囊性或囊实性病灶对治疗更敏感,可能与实体成分容易勾画靶向病灶并获得均质的射线相关;二者在并发症、肿瘤控制率方面并无统计学意义差异。Lee将CP按实性、囊性、囊实性分组,对1993~2012就诊于台北荣民总医院接受伽玛刀治疗的137例术后残留和复发病例进行肿瘤控制、并发症、生存率分析(表2),进一步证实伽玛刀治疗的有效性和安全性。同时指出肿瘤体积与肿瘤控制及远期预后存在相关性,体积越小获益越多 [16]。
3.3. 32P间质内放疗
2016年Shaheryar回顾了32P盛行期间该中心13例儿童CP的治疗效果(表2)。对其中9例单用立体定向辅助32P胶体内放疗的患儿进行随访 [17],结果联用外放射组进行对比,复发率差异显著,联合外照射组复发率仅28.6%。Shahzadi同期评估32P胶体内放疗对于儿童囊性CP的有效性,对47例患儿临床数据分析结果显示:总有效率78.1%,平均生存时限113.1 ± 11月,生存率(73%/5年,52%/10年),治疗期间无死亡、视功能及内分泌障碍严重并发症,证实32P胶体内放疗的安全性及有效性 [18]。从数据分析,32P间质内放疗不失为一种理想的CP治疗方案,但单独应用效果不甚理想,较常规放疗组生存率及有效率低,其外部泄漏的神经血管并发症令人堪忧,且仅针对囊性成分,对于实性肿瘤效果差,2016年Zhang对32P间质内放疗给与否定 [19],近年少有报道。
3.4. 质子治疗
CP鞍区多发,位置特殊性及儿童快速发育的阶段性特征对放疗的精度提出更高的要求。传统放疗无年龄限制,但儿童脑白质处于快速发育阶段,放射性白质纤维束受损显著影响远期预后,年龄越小认知及适应性功能障碍发生率越高。美国著名心里学专家Palmer教授在研究脑白质纤维束与认知功能相关性时对上述观点进一步给与数据支持 [20]。但质子束放射治疗(PRT, Proton beam radiation therapy)能有效规避常规放疗的限制区(如晶体、视神经),剂量分布优于常规放疗,可以减少视神经、下丘脑、脑干等正常结构的整体照射剂量。
Fitzek最先将PRT应用于STR和术后复发的CP。随后,在“儿童颅内肿瘤(CP28例)PRT与认知功能及适应能力改变的相关性”研究中,Margaret将患儿年龄(≥6岁,<6岁)及治疗方式(craniospinal irradiation CSI组和focal radiation FR组)分为四组 [21],用FSIQ (Full Scale Intelligence Quotient)/MDI (Mental Development Index)和SIB-R (Scales of Independent Behavior-Revised)两项指标分别评价治疗前后认知功能和
适应能力变化与PRT的相关性。结果显示:两年龄组FSIQ/MDI下降6.3和0.9 (95%CI);SIB-R值年幼者下降5.3,年长者增长0.15。结论:年龄和治疗方式与认知功能障碍发生率存在显著相关性,CSI组明显高于FR组,年龄越小放射性认知功能障碍发生率越高;适应能力与治疗初始基本的适应能力相关,与年龄与放射性治疗方式并无关系。同时指出,儿童CP的PRT应局灶性精准化、基于年龄个体化,以减少副反应及并发症。Andrew同期对PRT与IMRT之间差异进行比较,通过“疾病控制、毒副反应、囊的早期及远期动态变化”分析 [22],结果提示二者无显著差异(表2)。目前儿童CP的PRT尚无不良反应报道,未来其安全性及有效性仍需前瞻性研究进一步证实。
4. 囊内药物治疗
干扰素(interferon, IFN)为鳞状细胞癌的活性药物,通过抑制细胞增殖、细胞毒性作用及调节宿主免疫反应等途径发挥抗癌作用。2005年Cavalheiro首次报道了9例儿童囊性CP的采用IFN治疗,证实其对于囊性部分的有效性 [23]。2010年Cavalheiro进行了多中心(巴西、意大利、智利)前瞻性研究,纳入60例儿童囊性CP患者,从临床、影像、副反应、剂量四个方面对IFN的有效性、安全性进行评价。结果显示:影像改善率76%,新发内分泌障碍率13%,最常见的副反应为头疼(33%),视乳头水肿28%、发热、疲乏 [24]。2016年John-Paul对56例囊性为主的儿童CP进行了21个中心联合研究 [25],PFS25%/10年,OS91% ± 6%/10年,对IFN与先前放疗等措施对于疾病的进展时限的延长进行对比,结果提示:IFN治疗对于疾病进展延长明显占优势(中值延长年限 = 0.8年[95% CI: 0.3~1.3年] vs 0.4年[95% CI: 0.2~0.6年],P = 0.022),囊性CP更显著。先前存在的不适治疗后得到不同程度改善,无药物毒性反应导致死亡的病例。该文献目前数额最多(56例),对儿童囊性CP有一定治疗前景,但限于IFN对延长瘤体进展的分子基础还只限于假设,有待进一步阐明,疾病控制的有效性尚待有力的循证医学证据。
5. 基因新进展
基于分子及基因表型不同CP分为造釉细胞型(adamantinomatous craniopharyngioma, aCP)和鳞状乳头型(papillary craniopharyngioma, pCP),儿童以aCP主 [26]。随诊基因检测技术的进步,越来越多的CP患者进行了基因测序,目前CP的基础研究正逐步向微观过度,从组织学向分子生物学和基因突变迈步。研究显示,69%~100%的aCP亚型能见到21号染色体CTNNB1基因突变,突变细胞核质聚集β-catenin(链蛋白),可能与CTNNB1基因上3位外显子氨基酸调控异常相关。异常的肿瘤细胞和β-catenin过度表达能激活WNT通路,下游细胞生物学信号通路被激活或抑制,导致β-catenin降解受阻,肿瘤新生。特征性的基因改变证实肿瘤病理亚型的特异性,同时为儿童CP分子靶向治疗提供有力的佐证 [27]。
针对基因靶位及下游信号通路的靶向治疗在不断探索,2016年Martinez针对SHH (Sonic Hedgehog)信号通路 [28],使用维莫替尼进行了动物实验,同期进行了针对酪氨酸激酶信号通路的达沙替尼临床前期实验,尚无结论。但已有报道证实靶向药物(维莫非尼、达拉非尼)对携带BRAFV600E的pCP有效 [29],但机制尚未阐明。其中编码β-catenin的CTNNB1突变是儿童aCP研究的热点,但由于体外细胞培养困难,肿瘤细胞的分子谱不清,尚无针对儿童aCP可喜的临床实验结果。但aCP基因、转录水平的分子变异已被证实,为分子靶向研究提供有力依据,Leslie和Sandro博士分析了从CTNNB1基因突变到下游SHH和EGFR信号通路 [30],阐释了分子靶向治疗研究的价值和意义,预示目前的实验研究不仅能加深对CP的理解,也将为儿童CP的治疗提供新的、最佳的治疗选择。
6. 结论与展望
儿童CP是神经外科医生面临的重大挑战,现有的治疗方案缺乏前瞻性临床随机对照研究,目前仍无标准的治疗方法。基于解剖及膜性结构的CP分型能提升对于疾病的认知,协助术前安全评估及入路选择。目前,在视功能及下丘脑结构的完整的前提下,实现GTR仍为大数神外专家尊崇。与传统开颅手术相比,EES/EEA具有“直视下操作、无需牵拉脑组织、创伤小、下丘脑干扰小、病残率低”等优点,中央核心区CP为最佳选择,应用前景广阔。然而,出于并发症的考虑,STR辅助放疗同样被多数学者所接受。科技进步促进儿童CP在放疗领域的进展,催生放疗革新,PRT作为新生代放射技术,与IMRT、伽玛刀、同位素间质内放疗相比较,剂量分布优越,靶区能量集中,能有效规避常规放疗受限部位,为儿童CP在放疗领域不二选择。但PRT资源有限,价格昂贵,目前临床数据有限,其安全性和有效性需进一步评估。囊内药物治疗具有手术损伤小、并发症少、可单独或联合手术及放疗使用等优势,理论上是一种有效的治疗方法,但限于不良反应的不确定性,文献报道结果层次不齐,其疗效和安全性尚存异议,至今在儿童CP治疗的地位有待商榷,需系统性前瞻性临床随机对照试验支撑。pCP靶向治疗的有效性已有报道,但分子机制不明,未来随着CP分子机制进一步阐明,将为儿童CP治疗开启新的篇章,未来将改变神经外科医生的治疗策略。
文章引用
罗 帅,张剑宁,赵虎林,白茫茫,李小龙. 儿童颅咽管瘤的治疗方法及其疗效现状分析
Analysis of Treatment Methods and Curative Effect of Craniopharyngioma in Children[J]. 临床医学进展, 2020, 10(02): 148-159. https://doi.org/10.12677/ACM.2020.102025
参考文献
- 1. Fouda, M.A., Scott, R.M., Marcus, K.J., et al. (2019) Sixty Years Single Institutional Experience with Pediatric Craniopharyngioma: Between the Past and the Future. Child’s Nervous System: ChNS: Official Journal of the Interna-tional Society for Pediatric Neurosurgery, 36. https://doi.org/10.1007/s00381-019-04294-x
- 2. Patel, V.S., Thamboo, A., Quon, J., et al. (2017) Outcomes after Endoscopic Endonasal Resection of Craniopharyngiomas in the Pediatric Population. World Neurosurgery, 108, 6-14. https://doi.org/10.1016/j.wneu.2017.08.058
- 3. Greenfield, B.J., Okcu, M.F., Baxter, P.A., et al. (2015) Long-Term Disease Control and Toxicity Outcomes Following Surgery and Intensity Modulated Radiation Therapy (IMRT) in Pediatric Craniopharyngioma. Radiotherapy and Oncology, 114, 224-229. https://doi.org/10.1016/j.radonc.2014.11.035
- 4. Madsen, P.J., Buch, V.P., Douglas, J.E., et al. (2019) Endo-scopic Endonasal Resection versus Open Surgery for Pediatric Craniopharyngioma: Comparison of Outcomes and Complications. Journal of Neurosurgery: Pediatrics, 2019, 1-10.
- 5. Fournier-Goodnight, A.S., Ashford, J.M., Mer-chant, T.E., et al. (2017) Neurocognitive Functioning in Pediatric Craniopharyngioma: Performance before Treatment with Proton Therapy. Journal of Neuro-Oncology, 134, 97-105. https://doi.org/10.1007/s11060-017-2492-y
- 6. 漆松涛, 潘军, 包贇, 等. 颅咽管瘤的QST分型特点和手术治疗[J]. 中华神经外科杂志, 2017, 33(11): 1088-1093.
- 7. Morisako, H., Goto, T., Goto, H., et al. (2016) Aggressive Surgery Based on an Anatomical Subclassification of Craniopharyngiomas. Neurosurgical Focus, 41, E10. https://doi.org/10.3171/2016.9.FOCUS16211
- 8. Kassam, A.B., Gardner, P.A., Snyderman, C.H., et al. (2008) Expanded Endonasal Approach, a Fully Endoscopic Transnasal Approach for the Resection of Midline Suprasellar Craniopharyngiomas: A New Classification Based on the Infundibulum. Journal of Neurosurgery, 108, 715-728. https://doi.org/10.3171/JNS/2008/108/4/0715
- 9. 石祥恩, 周忠清, 吴斌, 等. 颅咽管瘤切除术与下丘脑功能保护(附1182例报告)[J]. 中华神经外科杂志, 2017, 33(11): 1107-1112.
- 10. Yano, S., Hide, T. and Shinojima, N. (2017) Surgical Outcomes of Endoscopic Endonasal Skull Base Surgery of Craniopharyngiomas Evaluated According to the Degree of Hypothalamic Extension. World Neurosurgery, 100, 288-296. https://doi.org/10.1016/j.wneu.2017.01.005
- 11. 桂松柏, 李储忠, 赵澎, 等. 颅咽管瘤手术入路的选择策略[J]. 中华神经外科杂志, 2017, 33(11): 1083-1087.
- 12. 孟肖利, 万经海. 神经内镜下经扩大鼻蝶入路手术切除颅咽管瘤[J]. 中国临床神经外科杂志, 2019, 24(5): 262-265.
- 13. 王举磊, 衡立君, 张治国, 等. 扩大经蝶入路切除儿童颅咽管瘤临床分析[J]. 中华神经外科疾病研究杂志, 2018, 17(3): 216-218.
- 14. Losa, M., Pieri, V., Bailo, M., et al. (2018) Single Fraction and Multisession Gamma Knife Radiosurgery for Craniopharyngioma. Pituitary, 21, 499-506. https://doi.org/10.1007/s11102-018-0903-5
- 15. Prasad, D., Steiner, M. and Steiner, L. (1995) Gamma Knife Surgery for Craniopharyngioma. Acta Neurochirurgica (Wien), 134, 167-176. https://doi.org/10.1007/BF01417685
- 16. Lee, C.C., Yang, H.C., Chen, C.J., et al. (2014) Gamma Knife Surgery for Craniopharyngioma: Report on a 20-Year Experience. Journal of Neurosurgery, 121, 167-178. https://doi.org/10.3171/2014.8.GKS141411
- 17. Ansari, S.F., Moore, R., Boaz, J.C., et al. (2016) Efficacy of Phosphorus-32 Brachytherapy without External-Beam Radiation for Long-Term Tumor Control in Patients with Craniopharyngioma. Journal of Neurosurgery: Pediatrics, 17, 439-445. https://doi.org/10.3171/2015.8.PEDS15317
- 18. Shahzadi, S., Soltani, A., Shahzadi, A., et al. (2017) Treatment of Cystic Craniopharyngioma with Intracystic Stereotactic Instillation of Phosphorus 32. Iranian Journal of Child Neurology, 11, 31-36.
- 19. Zhang, S., Fang, Y., Cai, B.W., et al. (2016) Intracystic Bleomycin for Cystic Craniopharyngiomas in Children. Cochrane Database of Systematic Reviews, 7, D8890. https://doi.org/10.1002/14651858.CD008890.pub4
- 20. Palmer, S.L., Glass, J.O., Li, Y., et al. (2012) White Matter Integrity Is Associated with Cognitive Processing in Patients Treated for a Posterior Fossa Brain Tumor. Neuro-Oncology, 14, 1185-1193. https://doi.org/10.1093/neuonc/nos154
- 21. Pulsifer, M.B., Duncanson, H., Grieco, J., et al. (2018) Cognitive and Adaptive Outcomes after Proton Radiation for Pediatric Patients with Brain Tumors. International Journal of Radiation Oncology Biology Physics, 102, 391-398. https://doi.org/10.1016/j.ijrobp.2018.05.069
- 22. Bishop, A.J., Greenfield, B., Mahajan, A., et al. (2014) Proton Beam Therapy versus Conformal Photon Radiation Therapy for Childhood Craniopharyngioma: Multi-Institutional Analysis of Outcomes, Cyst Dynamics, and Toxicity. International Journal of Radiation Oncology Biology Physics, 90, 354-361. https://doi.org/10.1016/j.ijrobp.2014.05.051
- 23. Cavalheiro, S., Dastoli, P.A., Silva, N.S., et al. (2005) Use of Interferon Alpha in Intratumoral Chemotherapy for Cystic Craniopharyngioma. Child’s Nervous System, 21, 719-724. https://doi.org/10.1007/s00381-005-1226-1
- 24. Cavalheiro, S., Di Rocco, C., Valenzuela, S., et al. (2010) Craniopharyngiomas: Intratumoral Chemotherapy with Interferon-Alpha: A Multicenter Preliminary Study with 60 Cases. Neurosurgical Focus, 28, E12. https://doi.org/10.3171/2010.1.FOCUS09310
- 25. John-Paul, K. and Bartels, U. (2017) Intracystic Interfer-on-Alpha in Pediatric Craniopharyngioma Patients-Reply. Neuro-Oncology, 19, 1420-1421. https://doi.org/10.1093/neuonc/nox147
- 26. Goschzik, T., Gessi, M., Dreschmann, V., et al. (2017) Genomic Al-terations of Adamantinomatous and Papillary Craniopharyngioma. Journal of Neuropathology and Experimental Neu-rology, 76, 126. https://doi.org/10.1093/jnen/nlw116
- 27. Yang, J., Hou, Z., Wang, C., et al. (2018) Gene Expression Profiles Reveal Key Genes for Early Diagnosis and Treatment of Adamantinomatous Craniopharyngioma. Cancer Gene Therapy, 25, 227-239. https://doi.org/10.1038/s41417-018-0015-4
- 28. Martinez-Gutierrez, J.C., D’Andrea, M.R., Cahill, D.P., et al. (2016) Diagnosis and Management of Craniopharyngiomas in the Era of Genomics and Targeted Therapy. Neurosurgical Focus, 41, E2. https://doi.org/10.3171/2016.9.FOCUS16325
- 29. Borrill, R., Cheesman, E., Stivaros, S., et al. (2019) Papillary Craniopharyngioma in a 4-Year-Old Girl with BRAF V600E Mutation: A Case Report and Review of the Literature. Child’s Nervous System, 35, 169-173. https://doi.org/10.1007/s00381-018-3925-4
- 30. Robinson, L.C., Santagata, S. and Hankinson, T.C. (2016) Po-tential Evolution of Neurosurgical Treatment Paradigms for Craniopharyngioma Based on Genomic and Transcriptomic Characteristics. Neurosurgical Focus, 41, E3. https://doi.org/10.3171/2016.9.FOCUS16308