Advances in Clinical Medicine
Vol.
10
No.
07
(
2020
), Article ID:
36418
,
10
pages
10.12677/ACM.2020.107186
In Vitro Synergistic Antitumor Effect of Niclosamide Ethanolamine Combined with Icotinib on HCC827 Cell
Jun Zhang, Hongmei Wang
Department of Respiratory Medicine, Affiliated Hospital of Qingdao University, Qingdao Shandong

Received: Jun. 5th, 2020; accepted: Jun. 30th, 2020; published: Jul. 7th, 2020

ABSTRACT
Objective: To investigate the inhibitory effect of clonsalimine ethanolamine and ectinib hydrochloride on HCC827 cells in human lung adenocarcinoma in vitro and explore whether the combination of the two drugs has a synergistic anti-tumor effect. Methods: The half inhibitory concentration of ectinib hydrochloride and the half inhibitory concentration of niclosamine ethanolamine were determined, and the inhibition of HCC827 cell proliferation was investigated according to the fixed IC50 concentration of niclosamine ethanolamine. The inhibition curve of the combination of two drugs on HCC827 cell proliferation was drawn to detect the synergistic effect of the two drugs. Results: The IC50 of ectinib hydrochloride on HCC827 cells was 0.61 M. The IC50 of niclosamide ethanolamine against HCC827 cells was 0.46 M. When the two drugs were used together, the inhibition of cell growth was the most obvious in the treatment group of 1 M of niclosamide ethanolamine, and the growth of cells was significantly inhibited at very low concentration. Both ectinib hydrochloride and niclosamine could promote apoptosis of HCC827 cells. The ratio of late apoptosis and necrosis of HCC827 cells was increased in the combined group compared with the single group. Conclusion: Clonsalimine ethanolamine can inhibit the proliferation of HCC827 cell lines in human lung cancer, and clonsalimine ethanolamine combined with ectinib hydrochloride can promote the apoptosis of HCC827 cell lines in human lung cancer.
Keywords:Chloronitramine Ethanolamine, Icotinib, Synergistic Antitumor

氯硝柳胺乙醇胺联合埃克替尼体外对肺腺癌HCC827细胞的协同抗肿瘤效应
张君,王红梅
青岛大学附属医院呼吸内科,山东 青岛

收稿日期:2020年6月5日;录用日期:2020年6月30日;发布日期:2020年7月7日

摘 要
目的:明确氯硝柳胺乙醇胺与盐酸埃克替尼联合应用在体外对人肺腺癌HCC827细胞的增殖抑制作用,探索两药合用是否具有协同抗肿瘤效应。方法:确定盐酸埃克替尼的半数抑制浓度、氯硝柳胺乙醇胺的半数抑制浓度,根据已确定的氯硝柳胺乙醇胺的IC50固定三个浓度,考察HCC827细胞增殖受到的抑制情况。绘制两药联合对HCC827细胞增殖的抑制曲线,检测两药是否有协同效应。结果:盐酸埃克替尼对HCC827细胞的IC50为0.61 μM。氯硝柳胺乙醇胺对HCC827细胞的IC50为0.46 μM。两药联用时,氯硝柳胺乙醇胺1.0 μM的处理组对细胞的抑制作用最明显,在极低浓度下细胞的生长即可被明显抑制。盐酸埃克替尼、氯硝柳胺均可以促进HCC827的细胞凋亡。联合应用组与单独应用组相比,HCC827细胞的晚期凋亡和坏死的比例都有所增加。结论:氯硝柳胺乙醇胺对人肺癌HCC827细胞株的增殖具有抑制作用,氯硝柳胺乙醇胺联合盐酸埃克替尼对人肺癌HCC827细胞有协同促进凋亡的作用。
关键词 :氯硝柳胺乙醇胺,盐酸埃克替尼,协同抗肿瘤

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肺癌是全世界死亡率最高的恶性肿瘤 [1] [2],在确诊时,超过80%的NSCLC患者处于晚期(IIIB或IV期),已失去了手术的机会,全身化疗仍是标准的治疗方案,但对生存期改善甚微 [3]。大多数晚期NSCLC患者接受铂类化疗的生存率小于1年 [4]。表皮生长因子受体(EGFR)突变阳性的NSCLC是一种重要的肺癌亚型,占非鳞状肿瘤的10%~15%。这种亚型在女性中比男性更常见,而且与吸烟的关系较小 [5]。EGFR-TKI被批准一线用于EGFR突变阳性的晚期NSCLC患者。EGFR-TKI药物分为三代,第一代为厄洛替尼、吉非替尼、埃克替尼。第二代为阿法替尼和达克替尼。第三代为奥西替尼。其中埃克替尼是我国首个拥有自主知识产权的EGFR-TKI药物,也是世界上第三个EGFR-TKI药物。埃克替尼于2011年6月被国家食品药品监督管理局批准用于治疗晚期NSCLC患者。它的批准是基于注册的III期试验(ICOGEN),试验表明埃克替尼与吉非替尼疗效相近,且埃克替尼毒副作用少于吉非替尼 [6]。
关于EGFR突变阳性的晚期NSCLC治疗,一线应用EGFR-TKI药物早已在指南中明确地位,而一、二、三代靶向药物均在一线推荐。鉴于不同药物的肿瘤抑制率和耐药后药物选择,一线应用包括盐酸埃克替尼在内的第一代TKI药物时推荐联合治疗方案,包括联合化疗及血管靶向药物;或者在单药治疗耐药后,尚没有新的靶向药物可选时更换为化疗或联用抗血管药物逆转耐药。因此目前很多研究涉及一代EGFR-TKI可联合的增加抗癌效应、逆转耐药的药物,例如氯硝柳胺、二甲双胍、阿司匹林、N-乙酰半胱氨酸等 [7] [8] [9] [10]。其中氯硝柳胺是一种经典的抗寄生虫药,是美国食品和药物管理局批准的口服抗蠕虫药物,其对人体和外界环境是低毒的,人体对氯硝柳胺的耐受性良好,已被批准用于人类将近50年 [11] [12]。
近年来,越来越多的研究发现氯硝柳胺也有一定的抗肿瘤作用,包括在急性髓系白血病、结肠癌、乳腺癌、前列腺癌等多种肿瘤细胞中显示了抗增殖作用 [13] [14] [15] [16]。但其确切的抗肿瘤作用机制尚不明确。有证据支持氯硝柳胺靶向多种信号通路,其中它可以抑制Wnt/β-catenin途径和线粒体功能,刺激线粒体中腺苷三磷酸酶的活性,诱导线粒体破碎,促进细胞凋亡和自噬性死亡,从而导致不同类型癌症的生长抑制和凋亡 [17] [18] [19]。通过抑制STAT3和NF-ĸB以及调节代谢信号途径作用于癌细胞。氯硝柳胺联合厄洛替尼可通过抑制STAT3信号通路而有效抑制厄洛替尼耐药的头颈癌异种移植物和肺癌异种移植物 [20] [21]。它对肿瘤起始细胞的抑制作用和与化疗药物联合使用时的协同效应使氯硝柳胺成为肿瘤治疗的备选药物 [22] [23]。有研究证明氯硝柳胺对肿瘤干细胞具有抗肿瘤活性 [24] [25]。在减缓小鼠遗传性肝肿瘤和患者源性异种移植物生长方面比氯硝柳胺更有效,其破坏了肝癌细胞细胞分裂周期37和热休克蛋白90之间的相互作用,同时抑制了它们的下游信号通路 [26]。Lee等 [27] 观察氯硝柳胺对食管癌细胞的抗肿瘤作用的研究,发现氯硝柳胺可下调食管癌细胞STAT3信号通路,抑制细胞增殖。此外,氯硝柳胺与化疗药物的联合治疗选择性地降低了化疗药物的剂量需求,以获得IC50的疗效。这些结果表明氯硝柳胺可作为食管癌的单一或联合药物治疗。氯硝柳胺对急性髓系白血病(AML)干细胞(CD34+、CD38−)有一定的杀伤作用,但对正常骨髓中的前体细胞的杀伤作用最小 [13]。氯硝柳胺对急性髓系白血病和结直肠癌细胞等癌细胞具有活性,不仅作为单一疗法,而且作为联合疗法的一部分,在联合疗法中发现它与一线化疗药物具有协同作用 [28]。Myeong等 [29] 使用1771个临床批准的化合物进行高通量筛选后确定氯硝柳胺是一种对NSCLC细胞有效的CIP2A抑制剂。研究发现氯硝柳胺通过增加NSCLC细胞线粒体ROS的产生,抑制了CIP2A的表达,激活了抑癌基因PP2A,而且氯硝柳胺通过抑制NSCLC细胞的多种致癌途径而具有抗肿瘤活性。研究证明氯硝柳胺通过CIP2A抑制增加PP2A活性,而CIP2A抑制又使作为抑癌磷酸酶的多种致癌信号失活。鉴于其潜在的抗肿瘤活性,氯硝柳胺及其衍生物的临床试验值得用于癌症治疗。本实验基于过去相关的研究结果,探索我国第一个EGFR-TKI药物盐酸埃克替尼与氯硝柳胺乙醇胺联合对HCC827细胞是否有协同抗肿瘤作用。
实验结果采用graphpad prism 8进行实验数据的分析以及绘图。各组进行统计学处理前,均先通过方差齐性检验,检验水准α设定为0.05,统计结果显示为P < 0.05时,数据之间的差异具有统计学意义。采用单因素方差分析进行组间数据比较。
2. 实验方法
2.1. 考察盐酸埃克替尼对HCC827细胞的增殖抑制作用
由于盐酸埃克替尼难溶于水,直接加入水中会产生沉淀,无法给药。应用细胞培养用二甲基亚砜(DMSO)配置(在常温时,DMSO的终浓度控制在0.1%以内对细胞实验是无干扰的),将配置好的盐酸埃克替尼溶液作为储备液用于后续实验。用电子分析天平称取固定剂量盐酸埃克替尼,加入DMSO,配置成10 mg/ml的盐酸埃克替尼母液,梯度稀释法稀释成不同浓度,将埃克替尼母液用DMSO和PBS混合液体(体积比1:1)稀释10倍,配置成1 mg/ml的盐酸埃克替尼溶液,用PBS稀释10倍,配置成0.1 mg/ml的盐酸埃克替尼溶液备用。
向处于对数生长期的HCC827细胞加入含0.25% EDTA的胰蛋白酶消化3~5分钟,加入配置好的RPMI1640完全培养基,1000 rpm离心3 min,吸去上清液。再次加入RPMI1640完全培养基,反复吹打HCC827细胞使之成单细胞悬液,吸取20微升细胞悬液利用细胞计数仪计数,按照6000个/孔的密度铺到96孔细胞培养板中,十字交叉晃动96孔细胞培养板使细胞在各孔中均匀分布,之后放置于37℃、5% CO2氛围的细胞培养箱中,继续培养24小时,倒置荧光显微镜下观察到细胞贴壁后,移除旧培养基。向96孔板中的HCC827细胞加入含不同浓度盐酸埃克替尼的新鲜培养基(加入前预热至37℃),使各孔的盐酸埃克替尼的浓度范围为0.01 μmol/L~25 μmol/L。之后将细胞放入培养箱继续培养48小时,取出96孔细胞培养板,向各孔细胞加入10微升CCK-8检测试剂,放回细胞培养箱孵育2小时,之后取出96孔细胞培养板,室温冷却5分钟,振荡30秒混匀,利用酶标检测仪测定各孔细胞培养液在450 nm波长处的OD值。以没有加药的HCC827细胞孔作为对照,没有接种细胞但加了培养液的孔为空白组,计算盐酸埃克替尼各给药组的细胞活力,按照下列公式计算,公式中的A代表酶标检测仪测定的OD值:
盐酸埃克替尼每个浓度进行5个复孔的考察,绘制盐酸埃克替尼对HCC827细胞的抑制曲线,计算IC50,为后续实验的盐酸埃克替尼浓度范围提供依据。
肿瘤细胞的无限增殖是其恶性程度的主要特征之一,因此我们采用CCK-8法考察了盐酸埃克替尼对体外培养的HCC827细胞增殖的抑制作用。图1为生长状态良好的HCC827细胞在不同浓度的盐酸埃克替尼作用48小时的情况下,细胞增殖所受到的影响,可以看出盐酸埃克替尼对HCC827细胞的增殖抑制存在剂量依赖的相关性,(Y = −6.3893X + 86.35, r = −0.828)随着浓度从0.01 μM增加到25 μM,细胞存活数量逐渐减少,细胞的增殖受到明显抑制,在浓度达到0.5 μM之后,细胞增殖抑制不再随盐酸埃克替尼浓度的增加而明显增加,我们推测,可能是部分细胞对盐酸埃克替尼耐受作用比较强。经计算,盐酸埃克替尼在48小时的作用情况下,对HCC827细胞的IC50为0.61 μM。

Figure 1. Effects of ectinib hydrochloride at different concentrations on the proliferation of HCC827 cells (P < 0.05)
图1. 不同浓度的盐酸埃克替尼对HCC827细胞的增殖能力的影响(P < 0.05)
2.2. 氯硝柳胺乙醇胺与盐酸埃克替尼对HCC827细胞增殖的协同作用
同盐酸埃克替尼一样,氯硝柳胺乙醇胺也难溶于水,并且其溶解度要小于盐酸埃克替尼,在水中极易形成沉淀析出,由于其溶解度小,故口服难以吸收。我们配制氯硝柳胺乙醇胺储备溶液的方法与盐酸埃克替尼类似,首先利用电子分析天平称取一定量的氯硝柳胺乙醇胺,加入细胞培养用二甲基亚砜(DMSO),配制成5 mg/ml的氯硝柳胺乙醇胺母液。然后采用梯度稀释法配制不同浓度的氯硝柳胺乙醇胺溶液,在稀释的过程中有机溶剂DMSO的比例要高于盐酸埃克替尼,第一步稀释先将氯硝柳胺乙醇胺母液用DMSO和PBS的混合液(体积比1:1)稀释5倍,配制成1 mg/ml的氯硝柳胺乙醇胺溶液,之后继续用PBS稀释10倍配制成0.1 mg/ml的氯硝柳胺乙醇胺溶液作为储备液用于后续实验,配制好的氯硝柳胺乙醇胺稀溶液呈亮黄色,澄清无沉淀。氯硝柳胺乙醇胺稳定性较差,在光照条件下易分解,因此其溶液需要避光保存。氯硝柳胺乙醇胺溶液在长期储存过程中容易出现沉淀析出,用前需要检查溶液状态,最好是现配现用。
为考察氯硝柳胺乙醇胺与盐酸埃克替尼对HCC827细胞增殖的协同作用,首先按照考察盐酸埃克替尼对HCC827细胞增殖抑制作用的方法,实验中向各孔细胞中分别给予含0.01、0.05、0.25、0.5、1.0、2.5、5、10、25 μM盐酸埃克替尼和0.1、0.5、1.0 μM的氯硝柳胺乙醇胺(根据IC50确定)的新鲜培养基(加入前预热至37℃),并设置对照组,每组5个复孔。绘制氯硝柳胺乙醇胺的浓度抑制曲线,计算在48小时作用情况下,氯硝柳胺乙醇胺对HCC827细胞的半数抑制浓度IC50。
向处于对数生长期的HCC827细胞中加入胰酶,消化3~5分钟,加入配置好的RPMI1640完全培养基,1000 rpm离心3分钟,吸去上清液,加入配置好的RPMI1640完全培养基,反复吹打细胞为单细胞悬液,吸取20微升细胞悬液计数,以6000个/孔铺到96孔细胞培养板中,十字交叉晃动细胞培养板使细胞在各空中分布均匀,置入37℃、5% CO2氛围的细胞培养箱中,培养24小时,镜下观察细胞贴壁后移除旧培养基后将细胞铺于96孔板,向各孔细胞中分别加入含不同浓度药物的新鲜培养基,放入培养箱培养48小时,取出96孔细胞培养板,冷却5分钟,震荡30秒混匀,酶标检测仪测定各孔细胞培养液在450 nm波长处的OD值。
氯硝柳胺乙醇胺本身具有抗肿瘤作用,为考察氯硝柳胺乙醇胺对盐酸埃克替尼的增效作用,我们先采用CCK-8法考察了氯硝柳胺乙醇胺对体外培养的HCC827细胞增殖的抑制作用,以确定氯硝柳胺乙醇胺的联用浓度。
图2为生长状态良好的HCC827细胞在不同浓度的氯硝柳胺乙醇胺作用48小时下所受到的影响,可以看出氯硝柳胺乙醇胺对HCC827细胞的增殖抑制同样存在剂量依赖的相关性,随着浓度从0.01 μM增加到25 μM,细胞的增殖受到的抑制也在增加,在浓度达到2.5 μM之后,细胞增殖抑制达到饱和状态。经计算,氯硝柳胺乙醇胺在48小时的作用情况下,对HCC827细胞的IC50为0.46 μM。

Figure 2. Effects of different concentrations of niclosamide ethanolamine on the proliferation ability of HCC827 cells (P < 0.05)
图2. 不同浓度的氯硝柳胺乙醇胺对HCC827细胞增殖能力的影响(P < 0.05)
随后我们考察氯硝柳胺乙醇胺对盐酸埃克替尼的增效作用。图3为固定氯硝柳胺乙醇胺的浓度为0.1、0.5和1.0 μM三个浓度,增加盐酸埃克替尼的浓度,考察HCC827细胞增殖受到的抑制情况。可以看出,与单用盐酸埃克替尼相比,氯硝柳胺乙醇胺1.0 μM组的盐酸埃克替尼对细胞的抑制作用最明显,在极低浓度下细胞的生长即可被明显抑制。在埃克替尼浓度达到2.5 μM之后,细胞增殖抑制达到饱和状态。固定浓度的氯硝柳胺联合盐酸埃克替尼,不同浓度的盐酸埃克替尼各组之间的细胞存活率进行统计学分析,p < 0.05,差异具有统计学意义。
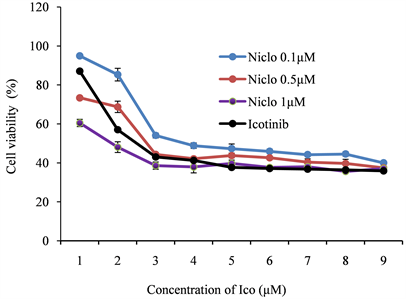
Figure 3. Effects of ectinib hydrochloride combined with niclosamine on cell proliferation
图3. 盐酸埃克替尼联合氯硝柳胺对细胞增殖能力的影响
2.3. 氯硝柳胺乙醇胺联合盐酸埃克替尼对HCC827细胞凋亡的影响
在预处理好的细胞中加入含盐酸埃克替尼、氯硝柳胺乙醇胺、盐酸埃克替尼 + 氯硝柳胺乙醇胺的新鲜培养基(加入前预热至37℃),并设置空白对照组。进行流式细胞仪检测时,按照Annexin V-FITC细胞凋亡检测试剂盒提供的方案进一步处理,由于Annexin V-FITC和Propidium iodide是光敏物质,在操作时应注意避光;反应完毕后尽快检测,由于细胞凋亡是一个不断变化的过程,反应1 h后荧光强度即开始衰减。
向对数生长期的HCC827细胞中加入胰酶,消化3~5分钟,加入配置好的RPMI1640完全培养基,1000 rpm离心3分钟,去上清液,再次加入37℃预热的RPMI1640完全培养基,反复吹打细胞使之成单细胞悬液,吸取20微升细胞悬液利用细胞计数仪计数,2 × 105个/孔的密度铺到6孔细胞培养板中,晃动6孔细胞培养板使细胞在各孔中均匀分布,置于37℃、5% CO2氛围的细胞培养箱中,培养24小时使细胞充分贴壁生长,加入不同浓度的药物,于培养箱继续培养24小时,取出6孔细胞培养板,移除培养基,PBS冲洗2次,加入胰蛋白酶消化3~5 min,加入2 ml 4℃预冷的PBS,轻轻吹打细胞,收集细胞并进行细胞计数。取3 × 105个细胞,200目细胞筛网过滤,1000 g、4℃离心5 min,弃上清液,加入冷的PBS 1 ml重悬,再次1000 g、4℃离心5 min,吸去PBS,重悬细胞于200 μl 1× Annexin V binding缓冲液,向细胞中加入10 μl的FITC-Annexin V试液轻轻混匀,4℃避光反应15分钟,加入10 μl × Annexin V binding,使终反应体积为500 μl,加入5 μl PI试液,以未处理HCC827细胞孔作为空白,进行流式细胞仪检测。
为了进一步研究盐酸埃克替尼与氯硝柳胺乙醇胺对HCC827细胞的协同作用,我们利用流式细胞术考察了两药联合作用时的细胞凋亡情况。从图4可以看出,未处理的细胞,细胞凋亡的比例比较低,早期凋亡、晚期凋亡加坏死细胞的比例总和不超过10%,且基本不存在细胞坏死的情况。图5为将各组的凋亡比例的柱状图。可见单独使用盐酸埃克替尼可以引起比较明显的细胞凋亡,主要表现在增加晚期凋亡的细胞比例,坏死细胞的比例也有明显增加,并且0.5 μM盐酸埃克替尼组的细胞凋亡和坏死比例均明显高于0.1 μM盐酸埃克替尼组,说明HCC827的凋亡与盐酸埃克替尼存在剂量相关性。单独使用氯硝柳胺乙醇胺也可以促进HCC827的细胞凋亡,主要表现为晚期凋亡细胞的比例增加。联合应用组与单独应用组相比,HCC827细胞的晚期凋亡和坏死的比例都有所增加,而细胞早期凋亡的比例没有明显变化,说明联合应用可以促进细胞凋亡的发生,并加速细胞坏死。联合组比盐酸埃克替尼单药组有更高的细胞凋亡比例,表明氯硝柳胺乙醇胺与盐酸埃克替尼对HCC827细胞凋亡有协同促进作用。

Figure 4. Apoptosis of HCC827 in each group was determined by flow cytometry
图4. 流式细胞术测定各组HCC827凋亡情况

Figure 5. The proportion of cells in each treatment group at different apoptotic stages
图5. 各处理组的细胞不同凋亡时期所占的比例
3. 实验结果
氯硝柳胺联合盐酸埃克替尼对人HCC827细胞株的增殖抑制效应:未予以氯硝柳胺或者盐酸埃克替尼的细胞,细胞生长状态良好,可连成片,融合在一起。当予以盐酸埃克替尼或氯硝柳胺处理后,细胞数量减少、分布稀疏。单独使用盐酸埃克替尼可以引起比较明显的细胞凋亡,主要表现在增加晚期凋亡的细胞比例,坏死细胞的比例也有明显增加。单独使用氯硝柳胺也可以促进HCC827的细胞凋亡,主要表现为晚期凋亡细胞的比例增加。联合应用组与单独应用盐酸埃克替尼、单独应用氯硝柳胺组相比,HCC827细胞的晚期凋亡和坏死的比例都有所增加,而细胞早期凋亡的比例没有明显变化,说明联合应用可以促进细胞凋亡的发生,并加速细胞坏死。以上实验均提示我们,氯硝柳胺和盐酸埃克替尼的抗肿瘤作用不仅仅是二者的简单相加,氯硝柳胺除了自身发挥抗肿瘤作用之外,可以对盐酸埃克替尼的抗肿瘤效应进行辅助,即氯硝柳胺联合盐酸埃克替尼具有协同抗肿瘤效应。但氯硝柳胺协同盐酸埃克替尼抗肿瘤的机制目前尚未明确。
4. 讨论
随着医学界对分子生物学和细胞生物学的进一步研究,肿瘤的治疗已从细胞毒性药物治疗时代迈入到基于基因组测序的精准靶向治疗新时代。经过充分的临床证明,分子靶向治疗不仅能精准地杀灭肿瘤细胞,而且能延缓肿瘤进展、延长患者带瘤生存期。EGFR敏感突变是NSCLC中的主要驱动基因之一,该突变在亚洲人群中占30%~50% [30]。EGFR-TKI的出现,彻底改变了EGFR突变阳性NSCLC的治疗。但绝大多数EGFR突变的晚期NSCLC患者对EGFR-TKI最初治疗效果显著,在大约12个月的中位时间后,出现继发性耐药,导致EGFR-TKI治疗效果丧失,出现疾病的进展。
氯硝柳胺(C13H8Cl2N2O4, MW:327.119)是美国食品和药物管理局批准的对人体绦虫有效的替尼酰胺类驱虫药。它通过抑制绦虫体内线粒体氧化磷酸化和厌氧反硝化作用而发挥其驱虫作用 [31]。氯硝柳胺是一种耐受性好、价格低廉、易得的药物。动物研究表明,氯硝柳胺在肿瘤组织和血浆中的浓度可达到1 μM,因此表明氯硝柳胺易于吸收 [14] [32]。Takuya等 [33] 的研究示,在植入人类结直肠癌异种移植物的小鼠中,口服氯硝柳胺具有良好的耐受性,达到了与生物活性相关的血浆和肿瘤水平,并导致了肿瘤的控制。体外对非肿瘤细胞无明显毒性作用,应用氯硝柳胺处理的小鼠无明显副作用。
最近,氯硝柳胺被认为是一种新的小分子STAT3抑制剂,Li等 [21] 的研究报道称,厄洛替尼对EGFR的抑制导致了头颈部癌细胞中STAT3信号的激活,这种作用可能导致厄洛替尼治疗头颈部癌的疗效降低。You等 [34] 用细胞活性筛选法测定氯硝柳胺增强NSCLC细胞系H1299的放射敏感性。这表明氯硝柳胺可能是肺癌患者的一种放射增敏剂。Liu等人 [24] 报道了氯硝柳胺单独或联合顺铂抑制对顺铂耐药的三阴性乳腺癌细胞异种移植瘤的生长。Chai WH等 [35] 有报道称,氯硝柳胺在体内外均能有效降低人肺癌的放射抵抗力,其机制包括抑制辐射诱导的JAK2-STAT3活性。左喻芳等 [36] [37] 研究氯硝柳胺与DDP联合应用对顺铂耐药的肺癌细胞是否具有协同作用的实验中,通过设置不同的药物浓度,氯硝柳胺处理的细胞在所有浓度下对顺铂的敏感性均增加,计算顺铂与氯硝柳胺合用的协同指数值 < 1,研究结果提示氯硝柳胺对A549和A549/DDP细胞的生长具有剂量依赖性的抑制作用,氯硝柳胺联合顺铂可促进A549/DDP细胞的凋亡进而增强肿瘤抑制作用。Rui等 [20] 的研究示:氯硝柳胺抑制STAT3/Bcl2/Bcl-XL生存途径可克服获得性厄洛替尼的体内外抗性。另外,S100A4在NSCLC、肝细胞癌、膀胱癌、结直肠癌等肿瘤中表达,S100A4的表达增加与肿瘤的侵袭性、转移能力和患者生存率低密切相关 [38]。
从本实验结果可以看出,氯硝柳胺乙醇胺和盐酸埃克替尼单独或联合作用,都可以发挥促进凋亡的作用,这种作用效应以联合组最显著。本实验的不足之处在于未进一步研究两药协同抗肿瘤的作用机制,未观察药物在体内的抗肿瘤效应。需要进一步行Western Blot实验检测细胞中凋亡相关蛋白及激酶信号通路中相关蛋白、肿瘤干细胞标志物等的表达;实时荧光定量PCR检测mRNA表达水平;建立HCC827细胞裸鼠移植瘤模型,观察氯硝柳胺乙醇胺、盐酸埃克替尼单药或两药联合对移植瘤的抑制情况及对裸鼠状态、体重的影响。氯硝柳胺乙醇胺与盐酸埃克替尼的联合治疗方案有着重要的临床意义:增加肺癌细胞对盐酸埃克替尼的敏感性,延缓盐酸埃克替尼的耐药时间,减轻应用盐酸埃克替尼产生的不良反应,进一步提高患者的生活质量,减轻患者的经济负担。故氯硝柳胺乙醇胺联合盐酸埃克替尼治疗NSCLC可能是一种新的有效的治疗策略。
文章引用
张 君,王红梅. 氯硝柳胺乙醇胺联合埃克替尼体外对肺腺癌HCC827细胞的协同抗肿瘤效应
In Vitro Synergistic Antitumor Effect of Niclosamide Ethanolamine Combined with Icotinib on HCC827 Cell[J]. 临床医学进展, 2020, 10(07): 1211-1220. https://doi.org/10.12677/ACM.2020.107186
参考文献
- 1. Zhang, X., Liu, S., Liu, Y., et al. (2017) Economic Burden for Lung Cancer Survivors in Urban China. International Journal of Environmental Research and Public Health, 14, 308. https://doi.org/10.3390/ijerph14030308
- 2. Barnfield, P.C. and Ellis, P.M. (2016) Second-Line Treatment of Non-Small Cell Lung Cancer: New Developments for Tumours Not Harbouring Targetable Oncogenic Driver Mutations. Drugs, 76, 1321-1336. https://doi.org/10.1007/s40265-016-0628-6
- 3. Ramalingam, S. and Belani, C. (2008) Systemic Chemotherapy for Advanced Non-Small Cell Lung Cancer: Recent Advances and Future Directions. Oncologist, 13, 5-13. https://doi.org/10.1634/theoncologist.13-S1-5
- 4. Schiller, J.H., Harrington, D., Belani, C.P., et al. (2002) Comparison of Four Chemotherapy Regimens for Advanced Non-Small-Cell Lung Cancer. The New England Journal of Medicine, 346, 92-98. https://doi.org/10.1056/NEJMoa011954
- 5. Greenhalgh, J., Dwan, K., Boland, A., et al. (2016) First-Line Treatment of Advanced Epidermal Growth Factor Receptor (EGFR) Mutation Positive Non-Squamous Non-Small Cell Lung Cancer. Cochrane Database of Systematic Reviews, 5, CD010383. https://doi.org/10.1002/14651858.CD010383.pub2
- 6. Shi, Y., Zhang, L., Liu, X., et al. (2013) Icotinib versus Gefitinib in Previously Treated Advanced Non-Small-Cell Lung Cancer (ICOGEN): A Randomised, Double-Blind Phase 3 Non-Inferiority Trial. Lancet Oncology, 14, 953-961. https://doi.org/10.1016/S1470-2045(13)70355-3
- 7. Li, L., Han, R., Xiao, H., et al. (2014) Metformin Sensitizes EGFR-TKI-Resistant Human Lung Cancer Cells in Vitro and in Vivo through Inhibition of IL-6 Signaling and EMT Reversal. Clinical Cancer Research, 20, 2714-2726. https://doi.org/10.1158/1078-0432.CCR-13-2613
- 8. Li, J. and Wang, X.H. (2020) Combined Treatment with N-Acetylcysteine and Gefitinib Overcomes Drug Resistance to Gefitinib in NSCLC Cell Line. Cancer Medicine, 9, 1495-1502. https://doi.org/10.1002/cam4.2610
- 9. Zhang, Y., Lv, C., Dong, Y., et al. (2020) Aspirin-Targeted PD-L1 in Lung Cancer Growth Inhibition. Thoracic Cancer, 11, 1587-1593.
- 10. Chuang, S.-E. (2013) Aspirin Antagonizes the Cytotoxic Effect of Methotrexate in Lung Cancer Cells. Oncology Reports, 30, 1497-1505. https://doi.org/10.3892/or.2013.2561
- 11. Andrews, P., Thyssen, J. and Lorke, D. (1982) The Biology and Toxicology of Molluscicides, Bayluscide. Pharmacology & Therapeutics, 19, 245-295. https://doi.org/10.1016/0163-7258(82)90064-X
- 12. Al-Hadiya, B.M.H. (2005) Niclosamide: Comprehensive Profile. Profiles of Drug Substances, Excipients and Related Methodology, 32, 67-96. https://doi.org/10.1016/S0099-5428(05)32002-8
- 13. Jin, Y., Lu, Z., Ding, K., et al. (2010) Antineoplastic Mechanisms of Niclosamide in Acute Myelogenous Leukemia Stem Cells: Inactivation of the NF-kB Pathway and Generation of Reactive Oxygen Species. Cancer Research, 70, 2516-2527. https://doi.org/10.1158/0008-5472.CAN-09-3950
- 14. Osada, T., Chen, M., Yang, X.Y., et al. (2011) Antihelminth Compound Niclosamide Downreguates WNT Signaling and Elicits Antitumor Responses in Tumors with Activating APC Mutations. Cancer Research, 71, 4172-4182. https://doi.org/10.1158/0008-5472.CAN-10-3978
- 15. Sack, U., Walther, W., Scudiero, D., et al. (2011) Novel Effect of Antihelminthic Niclosamide on S100A4-Mediated Metastatic Progression in Colon Cancer. Journal of the National Cancer Institute, 103, 1018-1036. https://doi.org/10.1093/jnci/djr190
- 16. Ren, X., Duan, L., He, Q., et al. (2010) Identification of Niclosamide as a New Small-Molecule Inhibitor of the STAT3 Signaling Pathway. ACS Medicinal Chemistry Letters, 1, 454-459. https://doi.org/10.1021/ml100146z
- 17. Liu, Z., Li, Y., Lv, C., et al. (2016) Anthelmintic Drug Niclosamide Enhances the Sensitivity of Chronic Myeloid Leukemia Cells to Dasatinib through Inhibiting Erk/Mnk1/eIF4E Pathway. Biochemical and Biophysical Research Communications, 478, 893-899. https://doi.org/10.1016/j.bbrc.2016.08.047
- 18. Arend, R.C., Londoño-Joshi, A.I., Samant, R.S., et al. (2014) Inhibition of Wnt/β-Catenin Pathway by Niclosamide: A Therapeutic Target for Ovarian Cancer. Gynecologic Oncology, 134, 112-120. https://doi.org/10.1016/j.ygyno.2014.04.005
- 19. Park, S.J., Shin, J.H., Kang, H., et al. (2011) Niclosamide Induces Mitochondria Fragmentation and Promotes Both Apoptotic and Autophagic Cell Death. BMB Reports, 44, 517-522. https://doi.org/10.5483/BMBRep.2011.44.8.517
- 20. Li, R., Hu, Z., Sun, S.Y., et al. (2013) Niclosamide Overcomes Acquired Resistance to Erlotinib through Suppression of STAT3 in Non-Small Cell Lung Cancer. Molecular Cancer Therapeutics, 12, 2200-2212. https://doi.org/10.1158/1535-7163.MCT-13-0095
- 21. Li, R., You, S., Hu, Z., et al. (2013) Inhibition of STAT3 by Niclosamide Synergizes with Erlotinib against Head and Neck Cancer. PLoS One, 8, e74670. https://doi.org/10.1371/journal.pone.0074670
- 22. Li, Y., Li, P.K., Roberts, M.J., et al. (2014) Multi-Targeted Therapy of Cancer by Niclosamide: A New Application for an Old Drug. Cancer Letters, 349, 8-14. https://doi.org/10.1016/j.canlet.2014.04.003
- 23. Yo, Y.-T., Lin, Y.-W., Wang, Y.-C., et al. (2012) Growth Inhibition of Ovarian Tumor-Initiating Cells by Niclosamide. Molecular Cancer Therapeutics, 11, 1703-1712. https://doi.org/10.1158/1535-7163.MCT-12-0002
- 24. Liu, J., Chen, X., Ward, T., et al. (2016) Combined Niclosamide with Cisplatin Inhibits Epithelial Mesenchymal Transition and Tumor Growth in Cisplatin-Resistant Triple-Negative Breast Cancer. Tumor Biology, 37, 9825-9835. https://doi.org/10.1007/s13277-015-4650-1
- 25. Wang, Y.-C., Chao, T.-K., Chang, C.-C., et al. (2013) Drug Screening Identifies Niclosamide as an Inhibitor of Breast Cancer Stem-Like Cells. PLoS One, 8, e74538. https://doi.org/10.1371/journal.pone.0074538
- 26. Chen, B., Wei, W., Ma, L., et al. (2017) Computational Discovery of Niclosamide Ethanolamine, a Repurposed Drug Candidate That Reduces Growth of Hepatocellular Carcinoma Cells in Vitro and in Mice by Inhibiting Cell Division Cycle 37 Signaling. Gastroenterology, 152, 2022-2036. https://doi.org/10.1053/j.gastro.2017.02.039
- 27. Lee, M.-C., Chen, Y.-K., Hsu, Y.-J., et al. (2020) Niclosamide Inhibits the Cell Proliferation and Enhances the Responsiveness of Esophageal Cancer Cells to Chemotherapeutic Agents. Oncology Reports, 43, 549-561.
- 28. Chang, X., Zhen, X., Liu, J., et al. (2017) The Antihelmenthic Phosphate Niclosamide Impedes Renal Fibrosis by Inhibiting Homeodomain-Interacting Protein Kinase 2 Expression. Kidney International, 92, 612-624. https://doi.org/10.1016/j.kint.2017.01.018
- 29. Kim, M.-O., Choe, M.H., Yoon, Y.N., et al. (2017) Antihelminthic Drug Niclosamide Inhibits CIP2A and Reactivates Tumor Suppressor Protein Phosphatase 2A in Non-Small Cell Lung Cancer Cells. Biochemical Pharmacology, 144, 78-89. https://doi.org/10.1016/j.bcp.2017.08.009
- 30. Gahr, S., Stoehr, R., Geissinger, E., et al. (2013) EGFR Mutational Status in a Large Series of Caucasian European NSCLC Patients: Data from Daily Practice. British Journal of Cancer, 109, 1821-1828. https://doi.org/10.1038/bjc.2013.511
- 31. Lee, M.C., Chen, Y.K., Hsu, Y.J., et al. (2020) Niclosamide Inhibits the CELL proliferation and Enhances the Responsiveness of Esophageal Cancer Cells to Chemotherapeutic Agents. Oncology Reports, 43, 549-561. https://doi.org/10.3892/or.2019.7449
- 32. Pan, J.-X., Ding, K. and Wang, C.-Y. (2012) Niclosamide, an Old Antihelminthic Agent, Demonstrates Antitumor Activity by Blocking Multiple Signaling Pathways of Cancer Stem Cells. Chinese Journal of Cancer, 31, 178-184. https://doi.org/10.5732/cjc.011.10290
- 33. Chen, W., Mook Jr., R.A., Premont, R.T. and Wang, J.B. (2018) Niclosamide: Beyond an Antihelminthic Drug. Cellular Signalling, 41, 89-96. https://doi.org/10.1016/j.cellsig.2017.04.001
- 34. You, S., Li, R., Park, D., et al. (2014) Disruption of STAT3 by Niclosamide Reverses Radioresistance of Human Lung Cancer. Molecular Cancer Therapeutics, 13, 606-616. https://doi.org/10.1158/1535-7163.MCT-13-0608
- 35. Chai, W.-H., Li, Y.-R., Lin, S.-H., et al. (2020) In Vitro Antihelminthic Niclosamide Induces Autophagy and Delayed Apoptosis in Human Non-small Lung Cancer Cells and. Anticancer Research, 40, 1405-1417. https://doi.org/10.21873/anticanres.14082
- 36. 左瑜芳, 杨东雁, 徐祖敏, 等. 氯硝柳胺对肺癌细胞株顺铂敏感性的影响[J]. 广东医科大学学报, 2017, 35(2): 144-147.
- 37. Zuo, Y., Yang, D., Yu, Y., et al. (2018) Niclosamide Enhances the Cytotoxic Effect of Cisplatin in Cisplatin-Resistant Human Lung Cancer Cells via Suppression of Lung Resistance-Related Protein and c-myc. Molecular Medicine Reports, 17, 3497-3502.
- 38. Helfman, D.M., Kim, E.J., Lukanidin, E. and Grigorian, M. (2005) The Metastasis Associated Protein S100A4: Role in Tumour Progression and Metastasis. British Journal of Cancer, 92, 1955-1958. https://doi.org/10.1038/sj.bjc.6602613