Advances in Clinical Medicine
Vol.
10
No.
11
(
2020
), Article ID:
38588
,
6
pages
10.12677/ACM.2020.1011378
不典型A型胸腺瘤的MSCT表现
刘金玲,赵晗
青岛大学附属医院放射科,山东 青岛

收稿日期:2020年10月16日;录用日期:2020年11月6日;发布日期:2020年11月13日

摘要
目的:探讨不典型A型胸腺瘤的MSCT影像学特点,提高CT诊断水平。方法:回顾性分析18例经手术与病理证实为不典型A型胸腺瘤的临床资料和影像学资料。结果:18例肿块均呈软组织密度,其中位于前上纵隔16例、前中纵隔2例、伴钙化4例。增强扫描12例肿块呈轻度不均匀强化,2例肿块呈轻中度均匀强化,2例呈环形强化,13例内部可见片状低密度延迟强化区,内含粗大血管10例,伴液化坏死14例。结论:MSCT对不典型胸腺瘤的诊断有一定价值。
关键词
不典型A型胸腺瘤,MSCT
The MSCT Appearance of Atypical Thymoma Type A
Jinling Liu, Han Zhao
Department of Radiology, Affiliated Hospital of Qingdao University, Qingdao Shandong

Received: Oct. 16th, 2020; accepted: Nov. 6th, 2020; published: Nov. 13th, 2020

ABSTRACT
Objective: To investigate the imaging features of atypical thymoma type A (MSCT) in order to improve CT diagnosis. Methods: The clinical and imaging data of 18 cases with atypical thymoma type A confirmed by surgery and pathology were retrospectively analyzed. Results: All the 18 cases showed soft tissue density, including 16 cases in anterior superior mediastinum, 2 cases in anterior mediastinum and 4 cases with calcification. On contrast-enhanced scan, 12 cases of mass presented mild heterogeneous enhancement, 2 cases presented mild to moderatehomogeneous enhancement, 2 cases presented circular enhancement, 13 cases showed internal patchy low-density delayed enhancement area, including 10 cases of thick vessels and 14 cases accompanied by liquefied-necrosis. Conclusion: MSCT is valuable in the diagnosis of atypical thymoma.
Keywords:Atypical Thymoma Type A, MSCT

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
不典型A型胸腺瘤作为A型胸腺瘤的一个新亚型,于2015年3月国际癌症研究机构(International Agency for Research on Cancer, IARC)出版的新的WHO胸腺上皮性肿瘤分类 [1] 中正式被提出,该亚型病理学分类较复杂,易出现误差,国内关于不典型A型胸腺瘤影像方面的文献较少,多以个案报道和探讨病理方面表现为主。近年来CT对于胸腺瘤诊断发挥重要作用 [2],笔者收集本院不典型A型胸腺瘤病例18例,探讨其CT表现,并结合国内外相关文献,总结分析其影像学特点,提高CT诊断的准确率,为该病的诊治提供更有价值的依据。
2. 资料与方法
2.1. 一般资料
收集采集收集自2015年1月至2018年1月根据2015版WHO新分类诊断的不典型A型胸腺瘤共18例。本组资料其中男性12例,女性6例,年龄43~63岁,平均年龄53岁,中位年龄为52岁。其中9例有临床症状,包括呼吸困难1例,胸闷4例,咳嗽、咳血咯血4例。体检意外发现9例。所有病例均不伴发重症肌无力。
2.2. 检查方法
18例行CT平扫检查,采用Siemenensation cardiac 64层螺旋CT机,扫描范围为肺尖至双肾门水平,层厚5 mm,层间距5 mm,螺距为0.9,准直器宽度为64 × 0.625 mm,管电流为200 mA,管电压为120 kV,矩阵是256 × 256。其中16例在平扫后后3后2周内行动态增强扫描,经静脉团注60~100 mL非离子型对比剂(碘海醇,Iohexol),流速3.0 mL/s,经肘静脉注射后30 s和60 s扫描。
2.3. 影像分析
由3~4名具有5年以上CT诊断经验的医师结合患者临床表现来分析,如有分歧协商达成一致。分析要点包括:肿瘤的位置(前纵隔偏侧、中间、双侧),大小(最大横截面径线),形态(分叶状、非分叶状),钙化,心包积液、心包增厚,胸膜增厚、胸腔积液,淋巴结肿大(短径 > 10 mm)。增强扫描见液化坏死(增强后未强化区),粗大强化血管影,周围血管侵犯(血管有无充盈缺损)及片状低密度区(增强后延迟强化区)。
3. 结果
3.1. 不典型A型胸腺瘤的临床表现
男性12例,女性6例,年龄43~63岁,平均年龄53岁,中位年龄为52岁。其中9例有临床症状,包括呼吸困难1例,胸闷4例,咳嗽、咯血4例。体检意外发现9例,不伴发重症肌无力。
3.2. 不典型A型胸腺瘤CT平扫表现
本组病例88.9% (16/18)位于纵隔偏侧,77.8% (14/18)呈分叶状,22.2% (4/18)伴有钙化,16.7% (3/18)伴有心包增厚或(和)心包积液,11.1% (2/18)伴有胸腔积液。肿块最大者范围约8.1 cm × 3.8 cm,最小者范围约2.1 cm × 1.7 cm。
3.3. 不典型A型胸腺瘤CT增强表现
本组病例87.5% (14/16)存在斑片状或片状液化坏死区,呈不均匀强化;62.5% (10/16)出现线状强化血管影。81.3% (13/16)出现片状低密度延迟强化区。
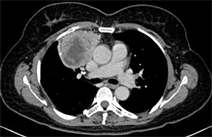


患者男 63Y CT平扫示右前中纵隔团块状软组织密度影,边界清晰,内密度不均。CT增强扫描病灶呈明显不均匀强化,内见片状坏死区,动脉期内部可见多发小血管影。
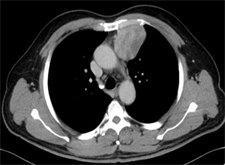

患者男性53Y左前上纵隔椭圆形软组织密度影,边界清晰,CT增强扫描中度不均匀强化,动脉期内部可见小血管影,静脉期部分延迟强化,平扫CT值约35 HU,动脉期CT值51 HU,静脉期CT值约75 HU。



患者男性 53YCT平扫示前上纵隔类圆形软组织密度影,边界清晰,CT增强扫描中度不均匀强化,部分延迟强化,平扫CT值约51 HU,动脉期CT值56 HU,静脉期CT值约95 HU。
3.4. 病理表现
本组18例均位于前纵隔。18例肿瘤呈边界较光整,其中4例呈类圆形肿块,14例呈分叶状肿块。18例患者均行手术治疗,术后巨检:肿块包膜完整,境界清晰; 切面示:灰白或灰红质软。镜下观察:细胞丰富,生长活跃,部分区域核分裂像 > 4个/10HPF,呈囊性或实性排列,可有小灶状坏死。免疫表型:不典型A型胸腺瘤的上皮细胞显示EMA显示灶状阳性,而波形蛋白、p63、CK19、CK pan弥漫强阳性,多不表达CD20,而Ki-67阳性指数较高,本组病例范围在3%~30%。间质淋巴细胞为多表达CD3和CD5而几乎不表达TdT的成熟T淋巴细胞。免疫组织化学检测CD117(-)16例,CD 1α(-) 13例,TDT(-)15例,CK(+) 11例、CK14(+) 11例,Syn(-) 12例,P63(+) 15例,CgA(-) 11例,CD20(-) 13例,CK5/6(+),Ki67阳性率约30% 2例,10% 14例,5% 2例,3% 1例。
4. 讨论
2015年3月国际癌症研究机构出版了新的WHO胸腺上皮性肿瘤分类,新分类基于国际胸腺肿瘤协作组2011年12月组织的多学科研讨会上对胸腺肿瘤达成的共识,提出不典型A型胸腺瘤作为A型胸腺瘤的一个亚型,其具有一定程度的不典型性。有的学者认为 [3] [4] [5] [6],各类胸腺瘤与胸腺癌之间的CT特征有着一定的差异性,故CT对于诊断胸腺瘤很有价值,可以从密度、形态、位置、大小等方面来辅助对胸腺瘤的诊断,尤其是在对于纵隔淋巴结肿大、心包侵犯等有明显的价值。不典型A型胸腺瘤作为A型胸腺瘤的一个亚型,Tomiyama等人认为类圆形、边缘光整多提示A型 [7]。A型胸腺瘤长期以来被认为是非侵袭性肿瘤,因为他们的临床进展很慢 [8],不典型A型胸腺瘤虽然体积大,但是是非侵袭性肿瘤,这点在Nonaka等人的一项早期研究中也得到了证实,Nonaka等人描述了13例具有非典型特征的非典型A型胸腺瘤,没有患者在延长的随访期内出现复发或转移性疾病 [9]。胸腺瘤的不同影像表现,表明不同胸腺瘤的生物学行为及程度的不同 [10]。在胸腺瘤的各种分型中,A型胸腺瘤相对少见,而作为A型胸腺瘤的亚型–不典型A型胸腺瘤更罕见。总结现有18例资料显示不典型A型胸腺瘤好发于成年男性患者,发病年龄在43~63岁,中位年龄约在52岁,可有呼吸困难、胸痛等非特异性临床症状,多数患者于体检或其他疾病偶然发现,不伴发重症肌无力。
不典型A型胸腺瘤好发于前上纵隔,且多偏侧,体积多偏大。本组病例均位于前纵隔,约88.9% (16/18)呈偏侧生长,因胸腺位于上纵隔血管前间隙,呈分叶状,肿瘤常发生于其中一叶,故多表现为偏侧性,而且一般来说不会跨界生长,故集中于一侧叶比较多见。在本组病例中最大者范围约8.1 cm × 3.8 cm,最小者范围约2.1 cm × 1.7 cm,该病体积偏大的原因和ki67增值指数高有关,这与文献的报道一致 [11]。
不典型A型胸腺瘤大多形态欠规整,呈分叶状,本组病例14例呈分叶状,占77.8%。这与其内部各部分分化程度、生长速度不一致有关,也与生长过程中周围大血管阻碍、限制其生长有关系 [12]。
不典型A型胸腺瘤在增强后可见强化血管影,本组病例71.4% (10/14)出现此征象,该征象在一定程度上与病理分级有关,其原因可能是因为肿瘤体积过大,血供比较丰富。有学者发现病理上部分肿瘤细胞显示出明显的血管周细胞瘤样生长模式,并带有许多分支的鹿角形分支血管 [13]。
不典型A型胸腺瘤在增强CT上可见低密度区延迟强化,考虑为纤维成分,纤维成分的原因可能与其组织学特征有关。组织学上显示肿瘤周围有一个不完全纤维囊,肿瘤细胞之间有较厚的纤维带 [1],在本组病例中,81.3% (13/14)可见纤维成分,增强扫描可见延迟强化,平扫CT值约在40~60 HU,动脉期CT值约在50~80 HU,静脉期CT值约在90~120 HU,这与纤维结构的强化特点完全吻合。
不典型A型胸腺瘤坏死多见,本组病例87.5% (14/16)出现此征象,CT增强扫描上表现为未强化的低密度区,这与肿瘤局部生长速度过快,局部血供及营养供应欠佳,更易造成缺血坏死。但是本组样本量较少,尚未能得出确切结论,可通过扩大样本量来进一步研究。
不典型A型胸腺瘤少见钙化,本组病例发生率也很低。本组钙化发生率仅22.2% (4/18)出现点状钙化。
本组病例中所有肿瘤与周围结构分界清晰,原因可能与肿瘤异型性有关,属于组织学良性,但增值指数高,只是生物学偏恶,因此并不会出现侵犯、转移。本组病例内均未出现纵隔及肺门淋巴结转移,该征象与病理分级密切相关,原因可能是因为其组织学良性。
本研究存在的不足:不典型A型胸腺瘤发病率较低,本研究收集病例相对较少,MSCT征象在一定程度上为诊断提供了帮助,但还需加大样本量或多中心合作取得进一步的研究结果。
文章引用
刘金玲,赵 晗. 不典型A型胸腺瘤的MSCT表现
The MSCT Appearance of Atypical Thymoma Type A[J]. 临床医学进展, 2020, 10(11): 2504-2509. https://doi.org/10.12677/ACM.2020.1011378
参考文献
- 1. 杜军, 周晓军. 新版WHO (2015)胸腺上皮性肿瘤分类解读[J]. 诊断病理学杂志, 2015, 22(8): 449-495.
- 2. Gao, L., Wang, C., Fang, W., et al. (2013) Outcome of Multimodality Treatment for 188 Cases of Type B3 Thymoma. Journal of Thoracic Oncology, 8, 1329-1334. https://doi.org/10.1097/JTO.0b013e31829ceb50
- 3. 李家尧, 张卫东, 曾敬, 王军业. 胸腺瘤的CT影像学特征与临床病理相关性分析[J]. 中华肿瘤防治杂志, 2011, 18(19): 1548-1550.
- 4. 杨志惠, 等. 胸腺瘤CT影像学特点与病理的关系分析[J]. 中国CT和MRI杂志, 2016, 14(9): 59-61.
- 5. 杨艳, 刘斌, 印建国. 胸腺瘤螺旋CT表现与其WHO病理分型对照研究[J]. 西北国防医学杂志, 2009, 30(4): 259-261.
- 6. 陈敬锋, 肖玉联. CT诊断非侵袭性胸腺瘤和侵袭性胸腺瘤的价值探讨[J]. Chinese Journal of CT and MRI, 2014, 12(3): 49-51.
- 7. Tomiyama, N., Johkoh, T., Mihara, N., et al. (2002) Using the World Health Organization Classification of Thymic Epithelial Neoplasms to Describe CT Findings. AJR, 179, 881. https://doi.org/10.2214/ajr.179.4.1790881
- 8. Okumura, M., Ohta, M., Tateyama, H., et al. (2002) The World Health Organization Histologic Classification System Reflects the Oncologic Behavior of Thymoma: A Clinical Study of 273 Patients. Cancer, 94, 624-632. https://doi.org/10.1002/cncr.10226
- 9. Nonaka, D. and Rosai, J. (2012) Is There a Spectrum of Cytologic Atypia in Type A Thymomas Analogous to That Seen in Type B Thymomas? A Pilot Study of 13 Cases. The American Journal of Surgical Pathology, 36, 889-894. https://doi.org/10.1097/PAS.0b013e31824fff50
- 10. 崔怀钢. 胸腺瘤的CT表现与临床分期及病理分型的相关性研究[J]. 吉林医学, 2014, 35(5): 993-994.
- 11. Hashimoto, M. and Shimizu, S. (2016) A Case of Atypical Type A Thymoma Variant. Surgical Case Reports, 2, 116. https://doi.org/10.1186/s40792-016-0245-3
- 12. 王泽国, 张亮, 赵晓丹. 胸腺神经内分泌肿瘤的MSCT表现与其病理分级的相关性[J]. 实用放射学杂志, 2017, 33(3): 389-392.
- 13. Inoue, A., Tomiyama, N. and Fujimoto, K. (2006) MR Imaging of Thymic Epithelialtumors: Correlation with World Health Organization Classification. Radiation Medicine, 24, 171. https://doi.org/10.1007/s11604-005-1530-4