Hans Journal of Food and Nutrition Science
Vol.07 No.03(2018), Article ID:26664,9
pages
10.12677/HJFNS.2018.73029
Dynamic Characteristics of the Absorption and Accumulation of DEHP in the Leaves of Benincasa hispida
Zunyi Wu, Hujun Xie, Qizhen Du
School of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou Zhejiang

Received: Aug. 16th, 2018; accepted: Aug. 24th, 2018; published: Aug. 30th, 2018

ABSTRACT
The absorption and accumulation characteristics of B. hispida leaves on DEHP were compared and analyzed by comparing the absorption and accumulation of DEHP between isolated B. hispida leaves and living B. hispida leaves. The results showed that the absorption and accumulation of DEHP in isolated B. hispida leaves was mainly the distribution mechanism, and the Lagergren two-stage reaction kinetics could be used to describe the process of DEHP in vitro. The absorption and accumulation of DEHP in the air melon leaf conformed to the characteristics of the two-compartment model and was well fitted with the actual results (R2 > 0.9).
Keywords:B. hispida, DEHP, Two-Compartment Model, Dynamic Characteristics
冬瓜叶吸收积累DEHP的动力学特性
吴遵义,谢湖均,杜琪珍
浙江工商大学,食品与生物工程学院,浙江 杭州

收稿日期:2018年8月16日;录用日期:2018年8月24日;发布日期:2018年8月30日

摘 要
通过离体冬瓜叶与活体冬瓜叶对DEHP吸收累积的对比分析,描述了冬瓜叶对DEHP吸收累积的特性。结果表明:离体冬瓜叶对DEHP的吸收累积主要是分配作用机制,符合Lagergren二级反应动力学过程;活体冬瓜叶对大气中DEHP的吸收累积符合二室模型特征,与实际结果拟合效果良好(R2 > 0.9)。
关键词 :冬瓜,DEHP,二室模型,动力学特性

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
邻苯二甲酸二(2-乙基己基)酯(di-(2-ethylhexyl) phthalate, DEHP)是邻苯二甲酸酯(phthalic acid ester, PAE)中最常用的化合物,被广泛用于塑料制品、纺织品、包装材料等,进入环境的量巨大 [1]。DEHP从环境迁移到农作物,通过食物链进入人体,能引起睾丸和肝的损伤,诱发肝癌,对人的健康造成重大危害 [2][3]。由于其广泛应用和大量生产,DEHP已成为各种环境中普遍存在的污染物。
前期的研究结果表明冬瓜对DEHP有很好的吸收作用 [4],植物吸收累积低极性有机污染物的途径已取得基本一致的认识,即主要是地上部分从大气吸收 [5],但其吸收特性还缺乏系统的研究,特别是有关蔬菜对DEHP吸收和累积的动力学特征等方面几乎还是空白。本文以冬瓜植株为研究对象,通过离体冬瓜叶与活体冬瓜叶对DEHP吸收累积的对比分析,描述了冬瓜叶对DEHP吸收累积的特性,为从一个很低的极性层面描述植物吸收有机物的行为提供了科学依据,丰富了选择性环境修复有机污染物的理论参考。
2. 材料和方法
2.1. 实验材料
将从浙江省农科院购得的黑皮冬瓜种子用1%双氧水浸种30 min,然后用蒸馏水冲洗3次,摊晾5 h,再将种子浸入70℃左右的无菌热水中,浸种1 h后置于有两层湿润滤纸的培养皿(Φ9 cm)中在25℃~30℃条件下黑暗催芽。等瓜苗长至有2~3片真叶时将其定植在普通玻璃温室的包含5 kg土壤和没有DEHP污染的肥料的30 cm直径锅中。在冬瓜结果期之后,三个含有10 cm长度果实的植物个体被转移到温室中。DEHP标准品(GC色谱纯,购自Sigma公司),三氯甲烷、二氯甲烷、甲醇、无水硫酸钠等购自华东医药股份有限公司。
2.2. 离体冬瓜叶吸附DEHP
取适量的冬瓜叶,洗净后用滤纸吸干样品表面水分,再用剪刀剪开冬瓜叶,放入真空冷冻干燥机,干燥48 h,取出,用高速粉碎机粉粹,用18目的筛子过筛,转入样品袋,封口后放入真空干燥器中保存,备用。用批量平衡法绘制冬瓜叶对DEHP的等温吸附曲线。将未被DEHP污染的冬瓜叶粉末于105℃下烘干24 h后取出,为防止空气中的水分进入植物粉末内影响吸附效果,取出后尽快使用。配置5个浓度点(0.01, 0.02, 0.04, 0.05, 0.06 mg/L)的DEHP溶液,准确称取一定质量的冬瓜叶样品,倒入25 mL离心管中,加入DEHP溶液,其吸附固液比为2:25,用内垫锡箔纸的螺口塞拧紧,让后将离心管放到20 r/min的旋转振荡器上振荡72 h,取下离心管在25.4 ± 0.5℃和4000 r/min的转速下离心15 min,取其上清液,用GC/MC方法测定有机污染物DEHP浓度。空白对比实验表明:挥发、光降解、生物降解和瓶子吸附造成的损失均可忽略不计。为此,冬瓜叶对DEHP的吸附量可用其起始浓度和吸附平衡浓度的差值来计算。根据冬瓜叶对DEHP的吸附量Qe (mg/kg)和平衡时DEHP的浓度Ce (mg/L),采用批量的方法绘制其等温吸附曲线。
2.3. 活体冬瓜叶吸收DEHP
设计一个长、宽、高均为3 m的温室(钢化玻璃材料)。墙墙上有三个孔(Φ5 cm),一个在从顶部中线往下30 cm处(出风口),一个在其对立墙面从地面往上30 cm处(进风口),一个是在强的中间(主要用于取样),该口设计成可关闭的窗口)。为保持整个活体冬瓜植株在恒定的DEHP浓度中实验,设计了如图1的实验装置:空气发生器(1),一个容积为25 mL的玻璃容器(2),内装20 mL DEHP,该容器被安置在一个水溶锅(3)中,玻璃容器通过一根毛细管和三通(4)连接并与载气管相衔接,进气口设在温室的下口,出气口设计在温室的上口并与排风扇(6)相连接。在容器和毛细管上部浓度的迫使DEHP通过毛细管扩散,其扩散速率主要依赖毛细管的尺寸和水浴锅的温度及鼓风速度。在温室的顶部中心,安装有一个电风扇,以1 rpm的速度转动以获得速度非常低的气流。以这种方式,冬瓜植株是有可能暴露在一个恒定的DEHP浓度中的。例如,为获取一个温室中DEHP浓度为78.6 μg/m3的温室环境,使用参数为:鼓风机的转速为2800 r/min,水浴锅温度为32.6℃,毛细管长10 cm,直径为0.75 mm。为检查所产生的DEHP浓度,采用QCD-5000智能空气取样器并进行GC/MC分析测定,分四次采样,取平均值。
2.4. 活体样品的前处理
称取适量磨碎后的冬瓜叶样品,用滤纸包好,置入索氏抽提管内,然后注入90 mL分析纯二氯甲烷,在88℃温度下抽提20 h,再旋转蒸发浓缩至5 mL。选用10 mm × 300 mm的玻璃柱,用脱脂棉堵住其下端,在玻璃柱中依次装入约100~120 mm长的中性氧化铝,约30~40 mm长的硅胶和约30~40 mm长的无水硫酸钠。中性氧化铝使用前需进行250℃条件下在马弗炉内中烘4 h的处理,硅胶使用前需进行用二氯甲烷进行索式抽提12 h,并在130℃~140℃条件下烘干的处理,无水硫酸钠需进行250℃条件下马弗炉内中烘4 h的处理。上样前先用二氯甲烷对柱子进行充分湿润,再将浓缩好的样品转移至柱子过柱,最后用二氯甲烷定容至10.0 mL,上机检测。
2.5. 样品中DEHP测定
按Sablayrolles等 [6]的方法用Agilent 6890 GC/5975 MS气相色谱/质谱联用仪(Agilent Technologies, Palo Alto, CA, USA)测定DEHP。GC测定条件为:色谱柱用HP-5MS毛细管柱(长30 m,直径0.25 mm,孔径0.25 μm);升温程序:100℃保持1 min,以15℃∙min−1升至280℃,保持8 min,以25℃∙min−1升至290℃,保持1 min;载气为He,流速为1.0 mL∙min−1;不分流进样,进样量为1 μL。MS测定条件为:
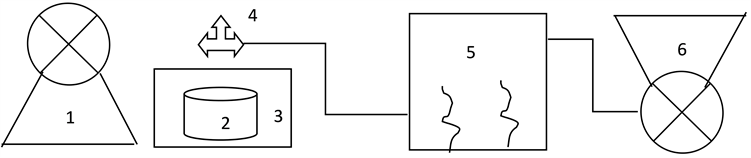
Figure 1. The device of DEHP uptake by the leaves of Benincasa hispida
图1. 冬瓜叶吸收DEHP的实验装置图
电子轰击(EI)离子源;电子能量70 eV;离子源温度230℃;四极杆温度150℃,扫描范围50~500 amu,全扫描方式。溶剂切除时间3 min。DEHP的含量按如下两个校准曲线计算y = 5 × 10−6x + 0.2638 (浓度范围1~50 µg∙mL−1,R2 = 0.9930)及y = 4 × 10−6x + 3.4439 (浓度范围50~500 µg∙mL−1,R2 = 0.9973)。所有实验均重复3次。
3. 结果与讨论
3.1. 冬瓜叶静态吸附DEHP
通过吸附试验中DEHP的浓度变化来计算出其吸附总量和吸附速率。吸附总量和吸附效率的计算式如下:
(1)
(2)
式中, 为单位质量冬瓜叶的吸附量(mg/g);Ce为吸附后溶液中的DEHP浓度(mg/L);C0为溶液中DEHP的初始浓度(mg/L);V为溶液体积(mL);W为冬瓜叶的质量(g);X则为吸附效率(%)。
由图2可知,冬瓜叶对DEHP的吸附效率随冬瓜叶用量的增加而增加,其单位冬瓜叶的吸附量呈下降趋势,这表明在冬瓜叶样品用量较大时,DEHP在冬瓜叶上的吸附达到平衡,从而导致冬瓜叶上的DEHP量无明显增加。当冬瓜叶用量在0.4~0.5 g时,其吸附量和吸附效率变化平缓,此时,溶液中DEHP的最高去除率可达到86%左右,故将0.5 g定位离体冬瓜叶的静态吸附试验中冬瓜叶样品添加量。
由图3可知,在10~20 h范围内随着吸附时间的增加,冬瓜叶吸附DEHP的效率变化幅度较大,20 h后冬瓜叶吸附DEHP的效率随时间增加变化的幅度变小,这可能是因为吸附初期,在冬瓜叶的表面有较多的吸附空位,吸附效率较高,然后随着吸附空位被占据,吸附效率也逐渐下降;在50~60 h范围内吸附变得非常平缓,可能是因为冬瓜叶对DEHP的吸附与脱附逐渐达到动态平衡。
图4为冬瓜离体叶对DEHP的吸附等温线。其吸附等温线呈现良好的线性关系(R2 > 0.99),表明冬瓜叶DEHP的作用机理主要是分配作用 [6]。
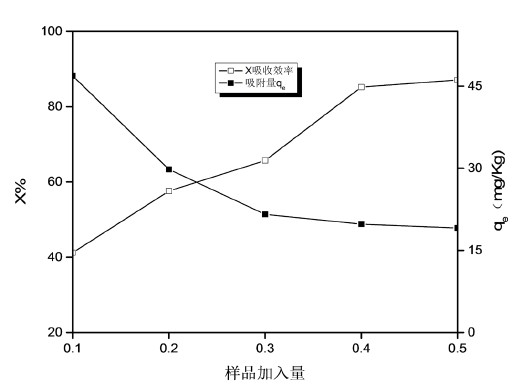
Figure 2. Chang curves of DEHP adsorption efficiency and adsorption amount with the addition of Benincasa hispida leaves
图2. DEHP的吸吸附量和吸附效率随冬瓜叶添加量的变化曲线

Figure 3. The change of DEHP adsorption efficiency and adsorption amount with the change of reaction time
图3. DEHP吸附效率和吸附量随反应时间的变化

Figure 4. Adsorption isotherms of DEHP by Benincasa hispida leaves
图4. 冬瓜叶对DEHP的吸附等温线
3.2. 温度对冬瓜叶吸附DEHP的影响
图5是T = 25℃时,C0,DEHP = 5 μg/mL条件下,冬瓜叶对DEHP等温吸附的动力学特征图。由图可知,冬瓜叶对DEHP的吸附总量随着时间的延长而逐渐增加,其增加幅度是先快后慢,具体是在开始的10 h内吸附总量增加得较快,之后增加趋势比较缓慢。在其吸附反应进行40 h之后基本处于吸附平衡状态。
为揭示冬瓜叶对DEHP吸附过程的动力学机制,我们分别采用Lagergren二级反应动力学方程、Elovich方程、双常数方程、准一级反应动力学方程和内部扩散方程对其吸附数据进行拟合。拟合参数如表1:
一级反应动力学模型是建立在吸附量与非吸附量成比例的假设基础之上,Lagergren二级反应动力学模型则是建立在其速率控制步骤是化学反应或通过电子共享或电子得失的化学吸附。从表1可以看出,Lagergren二级反应动力学模型能够较好地描述离体冬瓜叶静态吸附DEHP的吸附动力学特征,同时双常数方程和Elovich方程的拟合效果均较好(R2 > 0.9),准一级反应动力学方程拟合效果较差。
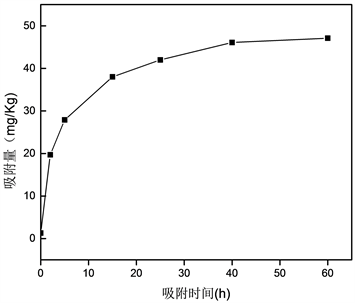
Figure 5. The kinetic parameters of the equations to describe the adsorbing DEHP of Benincasa hispida leaves (25˚C)
图5. 描述冬瓜叶吸附DEHP方程的动力学参数(25℃)
Table 1. The kinetic parameters of the equations to describe the adsorbing DEHP of B. hispida leaves
表1. 描述冬瓜叶吸附DEHP方程的动力学参数
同理,用Lagergren二级反应动力学模型拟合冬瓜叶在35℃的动力学方程得到:35℃的最大吸附量Qmax = 321.4 mg/kg,小于25℃时的最大吸附量,这表明高温不利于该吸附反应。
温度是最重要的环境参数之一,不同温度条件下,植物角质层吸附性能的差异对植物吸收积累有机污染物具有重要影响 [7]。温度对吸附能力的影响可以用热动力学特征参数:标准热力学摩尔自由能变化( ),标准热动力学焓变化( )和标准熵变化( )。根据方程(3)、(4)、(5)和吸附常数可计算出它们的变化值。计算结果如表2所示。
(3)
Vant Hoff Equ (4)
Gibbs-Helmholtz Equ (5)
其中R是气体常数,k1、k2是在T1,T2温度情况下的吸附常数。
由表2可知,冬瓜叶吸附DEHP在两温度下吸附反应的 都是正值,说明冬瓜叶对DEHP的吸附过程中混乱度增加,表明冬瓜叶对DEHP的吸附反应是自发进行的。另外,冬瓜叶吸附DEHP是自发进行也可从实验中标准热动力学自由能变化 为负值来判断。由于35℃条件下的 小于25℃条件下的 ,说明较低的温度有利于冬瓜叶对DEHP的吸附反应,而是一个放热过程,这与该吸附反应的标准焓变 < 0相吻合。另外,从吸附热 绝对值不到50 kJ/mol可判断该吸附过程应介于物理吸附热与化学吸附热之间(通常认为 小于40 kJ/mol的过程为物理吸附,而化学吸附的 通常大于40 kJ/mol) [8],由此可以推断冬瓜叶对DEHP的吸附机制为表面化学吸附与物理吸附共同控制,但以物理吸附为主。这与Lagergren二级反应动力学能很好描述冬瓜叶对DEHP的吸附情况相一致。
温度变化引起植物的吸附性能差异对有机污染物在植物体内分布和迁移影响明显,如由温度差异而引起的季节效应(由于低温,冬天植物有机污染物含量高于夏天,纬度效应(由于低温,高纬度地区植物吸收积累有机污染物的量比低纬度地区多),和山坡的南北面差异(由于低温,北面植物的浓度比南面高2~6倍)可见,低温有助于植物从环境中吸收积累有机污染物 [7][9]。
3.3. 活体冬瓜叶吸收累积大气中的DEHP
图6为活体冬瓜叶吸收空气中DEHP的时间变化曲线。由图可知,随时间的延长,冬瓜也中DEHP的浓度呈现先增加后减少,其后保持恒定的变化趋势,与冬瓜叶的静态吸附变化情况不一样。造成这种现象的原因可能DEHP在活体冬瓜叶的累积过程中还涉及到DEHP在冬瓜体内的运转和迁移。根据两厢模型 [5]:冬瓜叶由一系列均匀的吸收舱组成,将叶子模拟成两个吸附室(A室和B室),对于A室,主要与空气中的DEHP完成吸附-解吸平衡,对于B室,除与空气中的DEHP完成吸附平衡外,DEHP还会从B室中迁移。用数学关系描述如下:
对A室: (a)
对B室: (b)
假设B室的消除符合方程 ,在此前提下降A、B两室污染物量对时间求导:
(c)
(d)
冬瓜叶中总的DEHP的浓度为: (e)
经解微分方程(c)和(d),并代入方程(e)得:
式中k1A、k2A、k1B、k2B、mA、mB、VA、VB是常数。对图7,利用上述方程,通过Origin进行拟合(如图6),其中各参数为;VA = 0.1317,VB(0) = 4.059,mA(0) = 3.04,mB(0) = 2.38,k1B = 0.059,k2B = 0.0089,k1A = 0.0258,k2A = 0.0018,Cair = 0.304,k3 = 0.0193,R2 = 0.9823。
Table 2. The thermodynamic parameters of the adsorption of DEHP on Benincasa hispida leaves
表2. 冬瓜叶吸附DEHP的热力学参数
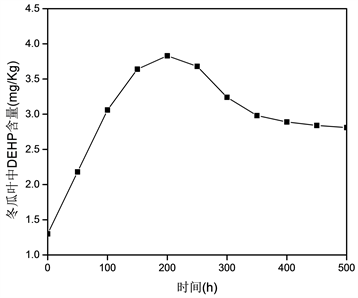
Figure 6. Change curves of DEHP adsorption amount with the increase of time
图6. 冬瓜叶从空气中吸收的DEHP量随时间的变化曲线
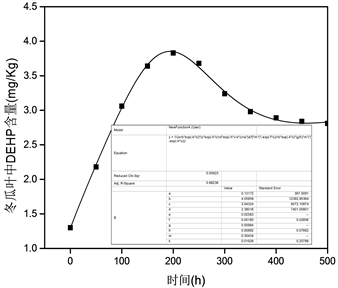
Figure 7. Fitting between the determined values and the calculate values by the two-compartment model equation
图7. 二室模型方程的拟合
根据拟合情况(R2 = 0.9823)发现:冬瓜叶在空气中对DEHP的吸附机制可用二室来予以描述。另外,由拟合参数也可知,隔舱A和B不一定要相互对等。在第一隔舱的吸收归因于角质层,是由于分子从大气的扩散到角质层表面而发生。在第二隔舱的吸收归因于冬瓜叶内部的脂溶性成分,气态污染物可以通过两种途径到达:1) 通过角质层向内在植物细胞扩散;2) 通过气孔摄取,从而达到间隙,然后通过植物细胞扩散、迁移。
4. 结论
冬瓜叶对DEHP有较强的吸附能力,其作用机理主要是分配作用;离体冬瓜叶对DEHP的吸附动力学符合Lagergren二级反应动力学,吸附热力学证实其吸附过程属于自发进行过程,该吸附过程是放热反应,低温有利于吸附反应的进行;二室模型能较好地描述活体冬瓜叶对空气中DEHP的吸收累积情况。
基金项目
浙江省科技厅项目资助(2017F82G2050025);浙江工商大学校级项目资助(1110KU1017020)。
文章引用
吴遵义,谢湖均,杜琪珍. 冬瓜叶吸收积累DEHP的动力学特性
Dynamic Characteristics of the Absorption and Accumulation of DEHP in the Leaves of Benincasa hispida[J]. 食品与营养科学, 2018, 07(03): 241-249. https://doi.org/10.12677/HJFNS.2018.73029
参考文献
- 1. Wang, M.J. and Jones, K.C. (1994) Uptake of Chlorobenzenes by Carrots from Spiked and Sewage Sludge-Amended Soil. Environmental Science & Technology, 28, 1260-1267. https://doi.org/10.1021/es00056a013
- 2. Wild, E., Dent, J., Thomas, G.O. and Jones, K.C. (2006) Visualizing the Air-to-Leaf Transfer and Within-Leaf Movement and Distribution of Phenanthrene:Further Studies Utilizing Two-Photon Excitation Microscopy. Environmental Science & Technology, 40, 907-916. https://doi.org/10.1021/es0515046
- 3. Wild, E., Dent, J., Thomas, G.O. and Jones, K.C. (2005) Real-Time Visualization and Quantification of PAH Photodegradation on and within Plant Leaves. Environmental Science & Technology, 39, 268-273. https://doi.org/10.1021/es0494196
- 4. 方杰. 浙江蔬菜DEHP含量分析及冬瓜累积DEHP途径[D]: [硕士学位论文]. 杭州: 浙江工商大学, 2008.
- 5. Keymeulen, R., Schamp, N. and Van Langenhove, H. (1995) Uptake of Gaseous Toluene in Plant Leaves: A Two Compartment Model. Chemosphere, 31, 3961-3975. https://doi.org/10.1016/0045-6535(95)00269-E
- 6. Sablayrolles, C., Montrejaud-Vignoles, M., Benanou, D., Patria, L. and Treilhou, M. (2005) Development and Validation of Methods for the Trace Determination of Phthalates in Sludge and Vegetables. Journal of Chromatography A, 1072, 233-242.
- 7. Satchivi, N.M., Stoller, E.W., Wax, L.M., et al. (2000) A Nonlinear Dynamic Simulation Model for Xenobiotic Transport and Whole Plant Allocation Following Foliar Application. I. Conceptual Foundation for Model Development. Pesticide Biochemistry and Physiology, 68, 67-82. https://doi.org/10.1006/pest.2000.2501
- 8. Hung, H.W., Lin, T.F. and Chiou, C.T. (2010) Partition Coefficients of Organic Contaminants with Carbohydrates. Environmental Science & Technology, 44, 5430-5436. https://doi.org/10.1021/es1004413
- 9. Riederer, M. and Schönherr, J. (1986) Thermodynamic Analysis of Nonelectrolyte Sorption in Plant Cuticles: The Effects of Concentration and Temperature on Sorption of 4-Nitrophenol. Planta, 169, 69-80. https://doi.org/10.1007/BF01369777
