Hans Journal of Agricultural Sciences
Vol.
09
No.
08
(
2019
), Article ID:
31819
,
8
pages
10.12677/HJAS.2019.98099
Effect of Exogenous Methyl Jasmine on Physiology of Kidney Bean Seedlings under Drought Stress
Jinling Wang1, Shenluobu Jian2, Qilin Dai2, Shizhang Du1*
1College of Life Science and Technology, Mianyang Teachers’ College, Mianyang Sichuan
2School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang Sichuan

Received: Aug. 3rd, 2019; accepted: Aug. 15th, 2019; published: Aug. 22nd, 2019

ABSTRACT
Drought stress is one of the most important factors that affect crop yield. Under drought stress, methyl jasmine (MeJA) is involved in the process of plant growth regulation and immune response. In this study, the physiological effects of methyl jasmine on kidney bean (Phaseolus vulgaris L.) seedlings under drought stress were investigated. The results showed that with the increase of PEG stress degree, the chlorophyll content in leaves of kidney bean seedlings gradually decreased; the electrolyte leakage went up and membrane peroxidation were very serious as well as the malondialdehyde content gradually increased . At the same time, the content of osmotic regulatory substances such as proline, soluble protein, and soluble sugar in plants and the activity of antioxidant enzymes (such as SOD, POD, and CAT) increased. But at the same PEG stress concentration, The chlorophyll content of kidney bean seedlings affected by exogenous MeJA increased, while the content of proline, soluble protein and soluble sugar osmotic regulators also increased, and the activity of antioxidant enzyme systems including SOD, POD and CAT showed a trend of increasing first and decreasing later. The results above indicated that exogenous MeJA can enhance the osmotic regulator content and antioxidant enzymes activity in leaves of kidney bean seedlings to alleviate the injury of drought stress on the seedlings of kidney bean, and so it can improve the resistant ability of kidney bean seedlings against drought stress.
Keywords:Methyl Jasmonate, Kidney Beans (Phaseolus vulgaris L.), Drought Stress
外源茉莉酸甲酯对PEG等干旱胁迫下四季豆幼苗的生理影响
王金玲1,坚参罗布2,代其林2,杜世章1*
1绵阳师范学院生命科学与技术学院,四川 绵阳
2西南科技大学生命科学与工程学院,四川 绵阳

收稿日期:2019年8月3日;录用日期:2019年8月15日;发布日期:2019年8月22日

摘 要
干旱是最常见的影响农作物产量的重要因素之一,在干旱胁迫下,茉莉酸甲酯参与了植物的生长调控和免疫应答过程。本研究旨在探讨干旱胁迫下茉莉酸甲酯对四季豆(Phaseolus vulgaris L.)幼苗生理的影响。研究结果表明,在受到干旱胁迫时,随着胁迫程度的增加,四季豆幼苗叶片叶绿素含量逐渐下降,细胞内电解质外渗增加,膜质过氧化严重,丙二醛含量逐渐增加,同时植物体内脯氨酸、可溶性蛋白和可溶性糖等渗透调节物质的含量以及抗氧化酶类如超氧化歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性增加。在一定干旱胁迫浓度下,经外源茉莉酸甲酯处理的四季豆幼苗的叶绿素含量增加,同时如脯氨酸、可溶性蛋白和可溶性糖渗透调节物质的含量也会增加,而且抗氧化物酶系统包括SOD、POD和CAT活性呈先增后降的趋势。以上结果说明外源茉莉酸甲酯可以通过增加叶绿素含量、渗透调节物质及增加抗氧化物酶体系活性来缓解干旱胁迫对四季豆幼苗的伤害,从而提高四季豆幼苗抗干旱的能力。
关键词 :茉莉酸甲酯,四季豆,干旱胁迫

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
干旱胁迫是影响植物生长发育和作物产量的重要环境因子。在水利用率低的干旱和半干旱地区,土壤干旱(也叫土壤缺水)对植物生长发育的影响是一个缓慢的过程 [1] 。而在植物生长过程中的外界气候条件变化是随机和不可预测的,所以植物的干旱胁迫也受多种因素(如基因型、胁迫强度和持续时间、气候条件、植物的生长发育阶段)的影响 [1] [2] 。干旱胁迫会引起植物细胞缺水,细胞紧张度丧失,细胞生长速率及体积变化降低,从而使植物生长发育,茎叶生长减弱,气孔直径变小。同时干旱胁迫还通过影响植物的碳水化合物代谢途径直接或间接地影响光合作用,使干旱胁迫下的植物光合作用降低,营养器官和生殖器官之间获取碳水化合物的竞争加剧,从而严重影响作物的生长、产量、产品构成和品质性状 [3] 。为了应对土壤水分亏缺引起的干旱,植物可以进化出相应的抗旱机制,用以维持组织水势等 [4] [5] 。
茉莉酸(JA)和茉莉酸甲酯(MeJA)是一类亚麻酸衍生物,被认为是内源性调节物质,在植物生长发育和防御反应中起着重要作用,在植物受伤、果实成熟和干旱胁迫期间均会过量产生 [6] [7] 。施用外源JA和MeJA可以抑制或促进植物的形态和生理变化,其作用受其浓度不同而异 [8] 。适当浓度的MeJA会使茉莉酸的生物合成和次生代谢以及其胁迫抗性和防御蛋白基因的表达增加 [9] 。
四季豆(Phaseolus vulgaris L.)属豆科菜豆属一年生、缠绕或近直立草本植物,是我国重要的蔬菜作物之一,对干旱较为敏感。因此,本研究以四季豆为材料,研究了干旱胁迫对四季豆生长的抑制作用,喷施外源MeJA是否能保护植物免受干旱胁迫以及在抗旱过程中MeJA是否参与了抗氧化活性、脯氨酸含量、相对含水量的调节。这有助于阐明MeJA在植物中减轻干旱胁迫的生理机制。
2. 材料和方法
2.1. 植物材料
本研究选取无蔓地豆王1号为材料,该材料是以矮生芸豆83-3选出的白荚品系作母本,以蔓生芸豆白不老品系171作父本的杂交后代,具有生长快,早熟,高产,抗病等特点,属早熟品种,品质及产量均优于其他品种。播种后45~50 d就能完成从出苗到开始生长过程,而且结荚集中,可以播种下茬作物,其角宽2.5 cm,扁平白色或绿色。豆荚有或无红晕无纤维,食用口感极佳,商业率高,是有发展前途的优良品种。
2.2. 种子预处理
选取饱满的四季豆种子,用0.1% H2O2溶液消毒处理15 min,用蒸馏水清洗后在25℃的温室中浸种催芽2 d,选取出芽长势一致的四季豆种子,栽种在装有壤土的塑料小花盆中(规格为10 cm × 10 cm × 10 cm),每盆3棵幼苗,然后置于25℃ ± 1℃、12 h/12 h光/暗周期、200 μmol∙m−2∙s−1条件下的培养室中培养。当四季豆幼苗培养至第3片复叶展开时,把四季豆幼苗均分成两组,一组四季豆幼苗叶片上均匀喷施0.5 mmol∙L−1浓度的茉莉酸甲酯(MeJA)溶液,另一组四季豆叶片喷施蒸馏水作为对照。静置1 d后,把经MeJA和蒸馏水处理的四季豆幼苗分别放入含0、5、10、15、20和25%聚乙二醇6000 (PEG6000)的MS营养液中培养1 d (每个处理均重复放6盆幼苗),然后取四季豆幼苗的第2片复叶为研究材料,每个实验均重复3次,取其平均值。
2.3. 四季豆幼苗叶片叶绿素、丙二醛、脯氨酸和可溶性糖含量的测定
参照李合生的《植物生理生化实验原理和技术》 [10] 测定以下生理指标:四季豆幼苗叶片叶绿素、丙二醛、游离脯氨酸和可溶性糖含量以及抗氧化酶活性的测定。
2.4. 四季豆幼苗叶片粗酶液的提取及抗氧化酶类活性的测定
取四季豆第二复叶0.5 g,剪碎后用磷酸缓冲液(pH 6.8)在冰浴下(0℃)研磨,在4℃,4000 g下离心20 min,取上清液,并在上清液中加入适量甘油混匀,再分成若干管,于−80℃超低温冰箱中保存备用,用于蛋白含量的测定和抗氧化酶类活性的测定 [10] 。
3. 结果与分析
3.1. 在PEG等干旱胁迫下MeJA对四季豆幼苗叶片丙二醛含量和相对电导率的影响
在PEG等干旱胁迫下,大部分植物体内的细胞代谢会失去平衡,膜酯过氧化作用会变大,其产物丙二醛含量增加。增加的丙二醛与其他物质发生反应,使细胞膜的通透性增加,细胞膜的选择透过性降低或丧失,细胞质中带电离子或其他物质穿过细胞膜进入到外界的环境中,会让环境介质的导电性能增加,从而导电率增加。由图1可以看出,随着PEG浓度的增加,四季豆幼苗叶片的丙二醛含量和相对电导率均逐渐增加,但在每个PEG胁迫浓度下,经MeJA预处理的四季豆幼苗丙二醛含量和相对电导率均低于未经MeJA预处理的含量和电导率,说明在PEG等干旱胁迫下,植物体内产生的MDA会引起植物膜受损伤,细胞内容物外渗增加,其相对电导率也逐渐增大,而施用外源MeJA可以使膜酯过氧化作用降低,MDA的含量也减少,从而减轻逆境下丙二醛对生物膜的损害,使细胞膜稳定性增加,质膜透性较小,细胞质外渗减弱。
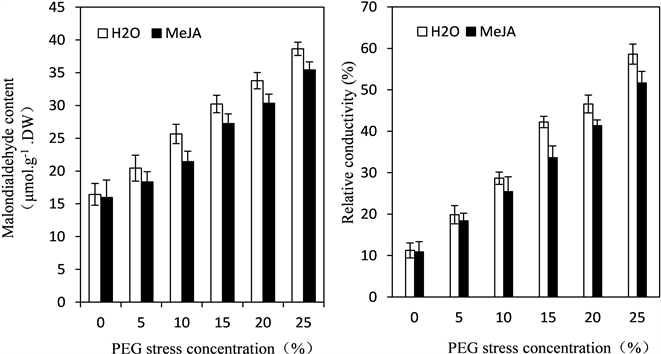
Figure 1. Effects of exogenous MeJA on MDA content of leaves inkidney bean seedlings under PEG stress
图1. PEG胁迫下MeJA对四季豆幼苗叶片丙二醛(MDA)含量和相对电导率的影响
3.2. 在PEG等干旱胁迫下MeJA对四季豆幼苗叶片叶绿素含量的影响
叶绿素是植物叶绿体中的一个极其重要的色素,对植物光合作用的影响很大,植物的光合作用对外界的逆境胁迫十分敏感,所以叶绿素含量的变化可检测逆境胁迫对四季豆光合能力的影响。如图2所示,随着PEG浓度的增加,四季豆幼苗叶片的叶绿素含量均逐渐下降,但在每个PEG胁迫浓度下,经MeJA预处理的四季豆幼苗叶绿素含量均高于未经MeJA预处理的含量,说明在干旱胁迫下,茉莉酸甲酯可以减缓四季豆叶片中叶绿素量的降低。

Figure 2. Effect of MeJA on the content of cholophyllin of leaves in kidney bean seedlings under PEG stress
图2. PEG胁迫下MeJA对四季豆幼苗叶片叶绿素含量的影响
3.3. 在PEG等干旱胁迫下MeJA对四季豆幼苗叶片脯氨酸、可溶性糖和可溶性蛋白含量 的影响
在干旱等不利环境胁迫下,植物代谢尤其是水分代谢会发生紊乱。为了应对外界不利因素的影响,植物体内会积累大量的小分子物质如无机离子或其他有机化合物如可溶性糖、可溶性蛋白和脯氨酸等(图3),植物可以利用这些物质的积累来调节细胞水势,维持植物的参透压,从而维持植物细胞的正常生理活动。其中可溶性糖和可溶性蛋白是渗透压调节不可缺少的物质,既是必须的营养物质,又具有亲水作用,具有保水功能。而脯氨酸是植物体内非常常见的物质,能够高效准确的调节植物细胞的渗透压从而避免了干旱引起的细胞渗透压不平稳的问题。它也能保持细胞中的大分子物质如蛋白质的稳定性等从而保持植物细胞膜的完整,植物体内脯氨酸含量的高低是来检测植物在逆境中的受伤程度的重要指标之一。
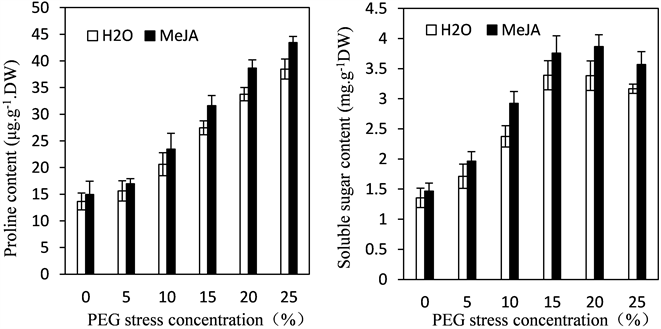

Figure 3. Effects of exogenous MeJAon the content of proline, soluble sugar and soluble protein of leaves in kidney bean seedings under PEG stress
图3. PEG胁迫下MeJA对四季豆幼苗叶片脯氨酸、可溶性糖和可溶性蛋白含量的影响
随着PEG浓度的增加,四季豆幼苗叶片脯氨酸含量也逐渐增加,而可溶性糖和可溶性蛋白含量呈现出先增加后减少的趋势,二者分别在20%和15%达到最高,但在每个PEG胁迫浓度下,经MeJA预处理的四季豆幼苗脯氨酸、可溶性糖和可溶性蛋白的含量总高于未经MeJA预处理的含量(见图3),说明在干旱胁迫下,MeJA可以提高脯氨酸、可溶性糖和可溶性蛋白含量来增加四季豆幼苗叶片的渗透调节能力。
3.4. 在PEG等干旱胁迫下MeJA对四季豆幼苗叶片抗氧化酶活性的影响
在逆境胁迫中,植物体内自由基含量的动态平衡被打破,大量积累活性氧,而这些活性氧对植物细胞造成很大伤害,因此在逆境中植物必须要清除活性氧,细胞内的抗氧化酶系统(超氧化物歧化酶SOD、过氧化氢酶CAT和过氧化物酶POD等)在清除活性氧过程起了重要作用。如图4所示,随着PEG浓度升高,四季豆幼苗的保护酶SOD、POD和CAT活性均呈现先升高后降低的趋势,分别在15%、15%和20%达到最大活性,随后三种抗氧化酶活性下降。但在各个胁迫浓度下,经MeJA预处理的四季豆幼苗SOD、POD和CAT活性均大于未经MeJA预处理的酶活性。
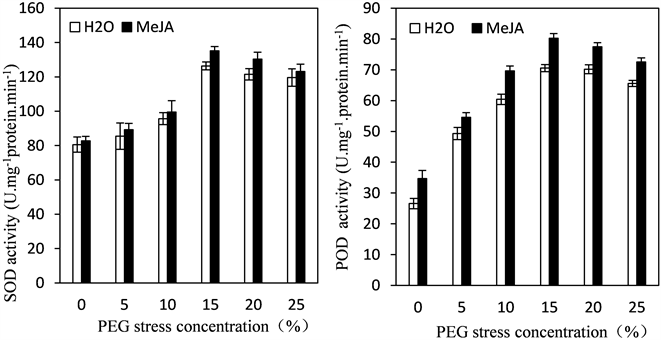
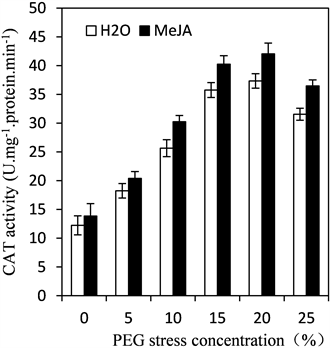
Figure 4. Effects of exogenous MeJA on the activities of POD, SOD and CAT of leaves in kidney bean seedlings under PEG stress
图4. PEG胁迫下MeJA对四季豆SOD、CAT和POD过氧化物酶活性的影响
4. 讨论
水分胁迫期间植物的生长、光合作用和冠层结构均受到抑制 [11] 。水分胁迫使叶片的相对含水量降低,叶片萎蔫而细胞膨大度下降 [5] 。在干旱条件下,干旱胁迫使植物受氧化胁迫显著增加,脂质过氧化作用增强,从而导致细胞质膜受损伤。干旱胁迫降低了夏枯草的许多生长参数,而外源MeJA在一定浓度下可增加了夏枯草植物的抗旱能力 [12] 。施用外源MeJA可以改变大豆内其他内源激素、多胺和蛋白质带型,引发植物对多种环境胁迫发生形态变化和生理反应,缓解干旱胁迫所引起的伤害 [6] [13] [14] 。同时在植物对干旱胁迫应答中,茉莉酸应答基因的表达增加,应用外源MeJA也可以增强茉莉酸应答基因的诱导表达 [12] [15] 。在本研究中,四季豆植株在干旱胁迫下,施用0.5 mM的茉莉酸甲酯可有效减轻干旱胁迫的危害,使丙二醛含量相对降低,膜脂过氧化作用相对减弱,细胞质膜稳定性相对增加,从而细胞内容物外渗减少。
渗透调节被认为是植物增加对干旱胁迫适应性的重要过程 [16] 。在干旱胁迫下脯氨酸含量增加,脯氨酸作为氨基酸在渗透调节中起关键作用,可能是植物作为提高抗旱性的一种策略,而施用MeJA的植物在干旱胁迫下脯氨酸含量更进一步增加 [5] [17] [18] 。本研究的结果表明,干旱胁迫能增加四季豆幼苗脯氨酸含量,但施用了外源MeJA后的四季豆幼苗在干旱胁迫下脯氨酸含量更高,说明脯氨酸含量的增加可能是四季豆植株保持细胞膨胀度和减少膜损伤的原因。
在干旱胁迫条件下,其抗氧化活性也会发生改变。在干旱胁迫等不利环境经常引起氧化应激反应,其体内活性氧种类的量增加 [19] 。植物的抗氧化活性可能直接与它们的自由基清除活性直接相关 [20] 。植物对各种胁迫的抵抗力与抗氧化能力相关,抗氧化剂水平的提高可能会阻止胁迫损伤 [21] 。植物对环境胁迫响应,可能是通过激活参与抗氧化生物合成基因做出作为的响应机制 [22] 。外源供给的MeJA可以增加植物在水分胁迫下的抗氧化酶的转录水平和活性,说明MeJA可能通过基因转录、翻译或转录后修饰的改变影响酶活性 [7] [13] [23] [24] 。在干旱胁迫下,四季豆幼苗的保护酶SOD、POD和CAT活性均呈现先升高后降低的趋势,分别在15%、15%和20%达到最高活性,但在不同胁迫浓度下,经MeJA预处理的四季豆幼苗SOD、POD和CAT活性均大于未经MeJA预处理的酶活性,这与这几位学者 [7] [13] [23] [24] 的研究结果一致。
总之,干旱胁迫抑制植物生长,降低植物叶绿素的含量,使植物的电导率和丙二醛含量上升,植物的细胞质膜稳定降低,同时具有渗透调节作用物质如脯氨酸、可溶性糖和可溶性蛋白质含量以及抗氧化活性相对增加,而施用MeJA改善了所有胁迫诱导的参数,MeJA可以通过增加脯氨酸、可溶性糖和可溶性蛋白质含量以及抗氧化活性来诱导四季豆幼苗的抗旱能力。
文章引用
王金玲,坚参罗布,代其林,杜世章. 外源茉莉酸甲酯对PEG等干旱胁迫下四季豆幼苗的生理影响
Effect of Exogenous Methyl Jasmine on Physiology of Kidney Bean Seedlings under Drought Stress[J]. 农业科学, 2019, 09(08): 697-704. https://doi.org/10.12677/HJAS.2019.98099
参考文献
- 1. Rosegrant, M.W. and Cline, S.A. (2003) Global Food Security: Challenges and Policies. Science, 302, 1917-1919. https://doi.org/10.1126/science.1092958
- 2. Rohwer, C.L. and Erwin, J.E. (2008) Horticultural Applications of Jasmonates: A Review. Journal of Horticultural Science and Biotechnology, 83, 283-304. https://doi.org/10.1080/14620316.2008.11512381
- 3. Alishah, O. and Ahmadikhah, A. (2009) The Effects of Drought Stress on Improved Cotton Varieties in Golesatn Province of Iran. International Journal of Plant Production, 3, 17-26.
- 4. Price, A.H., Cairns, J.E., Horton, P., Jones, G. and Griffiths, H. (2002) Linking Drought-Resistance Mechanisms to Droughavoidance in Upland Rice Using a QTL Approach: Progress and New Opportunities to Integrate Stomatal and Mesophyll Responses. Environmental and Experimental Botany, 53, 989-1004. https://doi.org/10.1093/jexbot/53.371.989
- 5. Redy, T.Y., Reddy, V.R. and Anbumozhi, V. (2003) Physiological Responses of Groundnut (Arachis hypogea L.) to Drought Stress and Its Amelioration a Critical Review. Plant Growth Regulation, 41, 75-88.
- 6. Creelman, R. and Mullet, J.E. (1995) Jasmonic Acid Distribution and Action in Plants: Reg-ulation during Development and Response to Biotic and Abiotic Stress. Proceedings of the National Academy of Sciences, 92, 4114-4119. https://doi.org/10.1073/pnas.92.10.4114
- 7. Shan, C.J. and Liang, Z.S. (2010) Jasmonic Acid Regulates Ascor-bate and Glutathione Metabolism in Agropyron cristatum Leaves under Water Stress. Plant Science, 178, 130-139. https://doi.org/10.1016/j.plantsci.2009.11.002
- 8. Zalewski, K., Nitkiewicz, B., Lahuta, L.B., Glowacka, K., Socha, A. and Amarowicz, R. (2010) Effect of Jasmonic Acid Methyl Ester on the Composition of Carbohydrates and Germina-tion of Yellow Lupine (Lupinus luteus L.) Seeds. Journal of Plant Physiology, 167, 967-973. https://doi.org/10.1016/j.jplph.2010.01.020
- 9. Cheong, J.J. and Choi, Y.D. (2003) Methyl Jasmonate as a Vital Substance in Plants. Trends in Genetics, 19, 409-413. https://doi.org/10.1016/S0168-9525(03)00138-0
- 10. 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
- 11. Shao, H., Chu, L., Jaleel, C.A. and Zhao, C. (2008) Water-Deficit Stress-Induced Anatomical Changes in Higher Plants. Comptes Rendus Biologies, 331, 215-225. https://doi.org/10.1016/j.crvi.2008.01.002
- 12. Mohamet, M. and Abdu, M. (2004) Growth and Oil Production of Fennel (Foeniculum vulgar Mill): Effect of Irrigation and Organic Fertilization. Biological Agriculture and Horticulture, 22, 31-39. https://doi.org/10.1080/01448765.2004.9754986
- 13. Ghasem, F., Poustini, K., Besharati, F., Mohammadi, H.V.A., Abooei Mehrizi, F. and Goettfert, M. (2012) Pre-Incubation of Sinorhizobium meliloti with Luteolin, Methyl jasmonate and Genistein Affecting Alfalfa (Medicago sativa L.) Growth, Nodulation and Nitrogen Fixation under Salt Stress Conditions. Journal of Agricultural Science and Technology, 14, 1255-1264.
- 14. Hassanein, R.A., Hassanein, A.A., El-Din, Salama, M. and Hashem, H.A. (2009) Role of Jasmonic Acid and Abscisic Acid Treatments in Alleviating the Adverse Effects of Drought Stress and Regulating Trypsin Inhibitor Production in Soybean Plant. Australian Journal of Basic and Applied Sciences, 3, 904-919.
- 15. Agrawal, G.K., Tamogamib, S., Iwahashic, H., Agrawala, V.P. and Rakwal, R. (2003) Transient Regulation of Jasmonic AcidInducible Rice MAPkinase Gene (OsBWMK1) by Diverse Bi-otic and Abiotic Stresses. Plant Physiology and Biochemistry, 41, 355-361. https://doi.org/10.1016/S0981-9428(03)00030-5
- 16. Yazdanpanah, S., Baghizade, A. and Abbasi, S. (2011) The Interaction between Drought Stress and Salicylic Acid and Ascorbic Acid on Some Biological Characteristics of Satureja hortensis. African Journal of Agricultural Research, 6, 798-807.
- 17. Anjum, S.A., Wang, L., Farooq, M., Khan, I., Xue, L., Methyl Jasmonate-Anjum, S.A., Wang, L., Farooq, M., Khan, I. and Xue, L. (2011) Methyl Jasmonate-Induced Alteration in Lipid Peroxidation, Antipxidative Defense System and Yield in Soybeans under Drought. African Journal of Biotechnology, 197, 296-301. https://doi.org/10.1111/j.1439-037X.2011.00468.x
- 18. Mahmood, M., Shirani Bidabadi, S., Ghobadi, C. and Gray, D. (2012) Effect of Methyl Jasmonate Treatment on Alleviation of Polyethylene Glycolmediated Water Stress in Banana (Musa acuminate cv. Berangan) Shoot Tip Cultures. Plant Growth Regulation, 68, 161-169. https://doi.org/10.1007/s10725-012-9702-6
- 19. Larson, R.A. (1988) The Antioxidants of Higher Plants. Phyto-chemistry, 27, 969-978. https://doi.org/10.1016/0031-9422(88)80254-1
- 20. Huang, Y.C., Chang, Y.H. and Shao, Y.Y. (2006) Effects of Genotype and Treatment on the Antioxidant Activity of Sweet Potato in Taiwan. Food Chemistry, 98, 529-538. https://doi.org/10.1016/j.foodchem.2005.05.083
- 21. Bor, M., Ozdemir, F. and Turkan, I. (2003) The Effect of Salt Stress on Lipid Peroxidation and Antioxidants in Leaves of Sugar Beet Beta vulgaris L. and Wild Beet Beta maritima L. Plant Science, 164, 77-84. https://doi.org/10.1016/S0168-9452(02)00338-2
- 22. Oh, M.M., Trick, H.N. and Rajashekar, C. (2009) Secondary Metabolism and Antioxidants Are Involved in Environmental Adaptation and Stress Tolerance in Lettuce. Plant Physiol-ogy, 166, 180-191. https://doi.org/10.1016/j.jplph.2008.04.015
- 23. Sylviane, M., Comparot, C., Graham, M. and Reid, M.D. (2002) Methyl Jasmonate Elicits a Differential Antioxidant Response in Light- and Dark-Grown Canola (Brassicanapus) Roots and Shoots. Plant Growth Regulation, 38, 21-30. https://doi.org/10.1023/A:1020970319190
- 24. Miranshahi, B. and Sayyari, M. (2016) Methyl Jasmonate Miti-gates Drought Stress Injuries and Affects Essential Oil of Summer Savory. Journal of Agricultural Science and Tech-nology, 18, 1635-1645.