Hans Journal of Agricultural Sciences
Vol.
10
No.
11
(
2020
), Article ID:
38852
,
12
pages
10.12677/HJAS.2020.1011144
基于烟草蚜传病毒病的黄瓜花叶病(CMV)和马铃薯Y病毒病(PVY) LAMP检测体系研究
匡传富1,孙现超2,陈德鑫3
1湖南省烟草公司郴州市公司,湖南 郴州
2西南大学,重庆
3中国农业科学院烟草研究所,山东 青岛
收稿日期:2020年11月7日;录用日期:2020年11月20日;发布日期:2020年11月27日

摘要
本文对基于烟草蚜传病毒病的黄瓜花叶病(CMV)和马铃薯Y病毒病(PVY),在优化LAMP体系、LAMP反应的最佳体系、LAMP产物的检测、LAMP灵敏性检测、田间样品的检测等几个方面进行了研究。结果表明:LAMP体系Mg2+的最佳浓度为6 mM,dNTPs的最佳浓度为1.2 mM;LAMP的最佳反应条件为反应温度63℃、反应时间为40 min;CMV和PVY的阳性LAMP产物显示为绿色,阴性LAMP产物显示为橘黄色;检测方法的灵敏度在DNA水平上可达到10~3 ng/μL;田间采集样品随机检测表明,建立的LAMP检测体系准确可靠。
关键词
烟草,蚜传病毒病,黄瓜花叶病(CMV),马铃薯Y病毒病(PVY),LAMP检测体系
Studies on LAMP Detection System of Cucumber Mosaic Virus (CMV) and Potato Virus Y (PVY) Transmitted by Tobacco Aphids Virus
Chuanfu Kuang1, Xianchao Sun2, Dexin Chen3
1Hunan Tobacco Company, Chenzhou Company, Chenzhou Hunan
2Southwest University, Chongqing
3Tobacco Research Institute, China Academy of Agricultural Sciences, Qingdao Shandong
Received: Nov. 7th, 2020; accepted: Nov. 20th, 2020; published: Nov. 27th, 2020

ABSTRACT
Based on cucumber mosaic virus (CMV) and potato virus (PVY) transmitted by tobacco aphid, the optimization of LAMP system, the optimum system of LAMP reaction, the detection of LAMP products, the sensitivity of LAMP and the detection of field samples were studied. The results showed that the optimum concentration of Mg2+ in LAMP system was 6 mM; the optimum concentration of dNTPs was 1.2 mM; the optimum reaction condition of LAMP system was 63˚C; the reaction time was 40 min; the positive products of CMV and PVY were green; the negative products of LAMP were orange; the sensitivity of LAMP assay was 10 - 3 ng/L at DNA level. The results of random sampling in field showed that the LAMP assay was accurate and reliable.
Keywords:Tobacco, Aphid-Transmitted Virus Disease, Cucumber Mosaic Disease (CMV), Potato Virus Y Disease (PVY), LAMP Detection System

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
目前针对于烟草蚜传病毒的检测方法主要有生物学检测、血清学检测、以PCR为基础的分子检测技术,包括普通PCR、实时荧光定量PCR、巢式PCR等。传统的生物学方法耗时长,血清学检测方法特异性差,容易受到外界因素的影响。而PCR的原理是建立在模板变性延伸的基础上,因而需要特殊的试验设备,难以得到普遍推广。LAMP作为一种新的核酸扩增方法,不需要模板的预变性,具有速度快、时间短、操作简单等优点 [1] [2]。LAMP主要是针对于目的基因的6个区域而设计2条内引物和2条外引物,利用链置换的原理在60℃~65℃扩增30~60 min,就可以获得大量的核酸产物。LAMP技术主要用于检测香蕉条斑病毒(Banana streak virus, BSV)、水稻黑条矮缩病毒(Rise black-streaked dwarf virus, RBSDV)、草莓潜隐环斑病毒(Strawberry latent rings pot virus, SLRSV)、马铃薯卷叶病毒(Potato leafroll virus, PLRV)、李属坏死环斑病毒(Prunus necrotic ringspot virus, PNRSV)、菜豆荚斑驳病毒(Bean pod mottle virus, BPMV)、甘薯褪绿矮化病毒(Sweet potato chlorotic stunt virus, SPCSV)、柑橘衰退病毒(Citrus tristeza virus, CTV)、番茄黄化曲叶病毒(Tomato yellow leaf curl virus, TYLCV)等 [3]。本试验以SYBR Green I为指示剂,建立CMV和PVY的等温环介导可视化快速检测体系,探讨快速检测CMV和PVY的LAMP检测体系可行性。
2. 材料与方法
2.1. 试验样品
具有典型病毒病症状的田间样品采自湖南郴州桂阳试验基地,经RT-PCR验证的CMV的阳性样品来源于本试验室。黄瓜花叶病毒(Cucumber mosaic virus, CMV)、马铃薯Y病毒(Potato virus Y, PVY)质粒由试验室保存。
2.2. 试剂与仪器
2.2.1. 试验试剂
2.2.2. 试验仪器
2.3. 试验方法
2.3.1. 植物总RNA的提取
用新鲜叶样来提取RNA,提取RNA的方法参照RNA试剂盒,用Invitrogen Trizol法来提取RNA。
1) 在1.5 mL离心管中加入RLT (500 μL)和PLANTaid (50 μL),把它们混合备用。
2) 预冷研钵,分别称取感病叶片和健康叶片0.1~0.2 g放入预冷的研钵中,液氮研磨样品至细粉。
3) 将研磨好的细粉转入离心管中,立即剧烈震荡20 s,56℃水浴3 min。
4) 涡旋或者用枪头抽打无解物30 s,室温,13,000 rpm离心10 min。
5) 将上清液转到新管,加入0.5体积的无水乙醇(一般为250 μL~225 μL)。
6) 将上一步混合的液体加入吸附柱,13,000 rpm离心2 min,弃去废液。
7) 在离心管中加入700 μL的去蛋白液RW1,室温放置30 s后,13,000 rpm离心30 s,弃去废液。
8) 在离心管中加入500 μL漂洗液RW,12,000 rpm离心30 s,弃去废液。
9) 重复操作上一步,打开管盖,让漂洗液充分挥发,以免影响后续的试验。
10) 将吸附柱放入收集管中,13,000 rpm离心2 min,弃去废液。
11) 找一新管,将吸附柱放入,加入30~50 μL RNase free water,室温放置1 min。
12) 12,000 rpm离心1 min,弃去吸附柱,收集样品。
13) 样品收集后,取3 μL进行电泳,检测RNA。
2.3.2. 反转录cDNA的合成
反转录cDNA的合成见表1。
Table 1. Synthesis and dosage of reverse transcription cDNA
表1. 反转录cDNA的合成组分及用量
反应程序为:37℃ 15 min,85℃ 20 s。
2.3.3. LAMP引物的合成
LAMP引物合成见表2。
Table 2. LAMP primer sequence
表2. LAMP引物序列
注:表中退火温度为62℃。
2.4. LAMP体系的建立与优化
25 µL的反应体系,1.0 µL DNA,1× ThermoPol buffer,1.6 μM FIP,1.6 μM BIP,0.2 μM F3,0.2 μM B3,8U (Bst) DNA polymerase,MgSO4 (2、4、6、8、10 mM),dNTPs (0.4、0.8、1.2、1.6、2.0 mM),反应时间(30 min、40 min、50 min、60 min、70 min),反应温度(60℃、61℃、62℃、63℃、64℃、65℃)。
2.5. LAMP产物的检测
LAMP产物的检测方法分别利用沉淀反应、显色反应、凝胶琼脂糖电泳进行。沉淀反应:LAMP反应完成后,进行快速离心,观察PCR管底是否有白色沉淀。显色反应:LAMP反应完成后,加入1 µL的SYBR Green I,阴性结果应为橘黄色,阳性结果应为绿色。凝胶琼脂糖电泳:取5 µL的LAMP产物于2%凝胶琼脂糖电泳,紫外灯下观察结果,观察是否有梯状条带的产生。
2.6. LAMP灵敏性检测
分别以CMV CP质粒和PVY CP为模板,以10倍的梯度稀释质粒,依次稀释1~108倍,以此为模板,分别进行PCR和LAMP反应。
2.7. 田间样品的检测
利用建立起来的LAMP体系对田间样品进行检测。
3. 结果与分析
3.1. LAMP体系的优化
CMV LAMP体系的优化。CMV Mg2+:对于CMV Mg2+的浓度,设置5个不同的梯度,终浓度分别为2 mM、4 mM、6 mM、8 mM、10 mM,反应中的其他条件不变,以健康的叶片作为阴性对照来进行LAMP反应。LAMP反应完成之后,进行2%的凝胶琼脂糖电泳,120 V电泳30 min。Mg2+的浓度从2 mM到10 mM逐渐增加,反应条带也越来越清晰,当Mg2+的浓度达到6 mM时,亮度最亮,且再增加浓度,条带的亮度没有很明显的变化,因此确定CMV LAMP Mg2+的最佳浓度为6 mM (图1)。
 注:M:marker I;1:2 mM;2:4 mM;3:6 mM;4:8 mM;5:10 mM;6:阴性对照。
注:M:marker I;1:2 mM;2:4 mM;3:6 mM;4:8 mM;5:10 mM;6:阴性对照。
Figure 1. Influence of Mg2+ concentration on CMV LAMP reaction
图1. Mg2+浓度对于CMV LAMP反应的影响
CMV dNTPs:对于CMV dNTPs的浓度,设置5个不同的梯度,终浓度分别为0.4 mM、0.8 mM、1.2 mM、1.6 mM、2.0 mM,反应中的其他条件不变,以健康的叶片作为阴性对照来进行LAMP反应。LAMP反应完成之后,进行2%的凝胶琼脂糖电泳,120 V电泳30 min。dNTPs的浓度从0.4 mM到2.0 mM逐渐增加,反应条带也越来越清晰,当dNTPs的浓度达到1.2 mM时,亮度最亮,且再增加浓度,条带的亮度没有很明显的变化,因此确定CMV LAMP dNTPs的最佳浓度为1.2 mM (图2)。
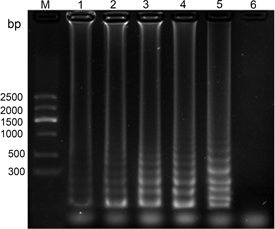 注:M:marker V;1:0.4 mM;2:0.8 mM;3:1.2 mM;4:1.6 mM;5:2.0 mM;6:阴性对照。
注:M:marker V;1:0.4 mM;2:0.8 mM;3:1.2 mM;4:1.6 mM;5:2.0 mM;6:阴性对照。
Figure 2. The effect of dNTPs concentration on the CMV LAMP reaction
图2. dNTPs浓度对于CMV LAMP反应的影响
CMV反应时间:为了确定CMV LAMP反应的最佳反应时间,对于LAMP的反应时间设置5个不同的梯度,分别为30 min、40 min、50 min、60 min、70 min。从图中可以看出,在所设置的5个时间梯度中,LAMP都可以正常的进行,在反应时间为30 min的时候就可以产生反应条带,但是条带比较淡,40min的时候条带的亮度明显增强,随着反应时间的延长,条带亮度基本上没有变化,因此确定CMV LAMP的最佳反应时间为40 min (图3)。
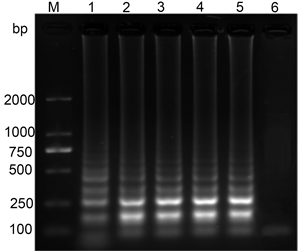 注:M:DL2000;1:30 mM;2:40 mM;3:50 mM;4:60 mM;5:70 mM;6:阴性对照。
注:M:DL2000;1:30 mM;2:40 mM;3:50 mM;4:60 mM;5:70 mM;6:阴性对照。
Figure 3. Effect of reaction time on CMV LAMP
图3. 反应时间对于CMV LAMP的影响
CMV反应温度:为了确定CMV LAMP反应的最佳反应温度,对于LAMP的反应温度设置6个不同的梯度,分别为60℃、61℃、62℃、63℃、64℃、65℃。反应中的其他条件不变,以健康的叶片作为阴性对照来进行LAMP反应。LAMP反应完成之后,进行2%的凝胶琼脂糖电泳,120 V电泳30 min。从图中可以看出,当温度为60℃时,LAMP出现微弱的反应条带,当温度为61℃时,LAMP条带亮度陡然增强,温度继续增加,条带亮度不变,因此确定CMV LAMP的最佳反应温度为61℃ (图4)。
 注:M:marker I;1:65˚C;2:64˚C;3:63˚C;4:62˚C;5:61˚C;6:60˚C;7:阴性对照。
注:M:marker I;1:65˚C;2:64˚C;3:63˚C;4:62˚C;5:61˚C;6:60˚C;7:阴性对照。
Figure 4. Effect of reaction temperature on CMV LAMP
图4. 反应温度对于CMV LAMP的影响
3.2. PVY LAMP体系的优化
PVY Mg2+:对于PVY Mg2+的浓度,设置5个不同的梯度,终浓度分别为2 mM、4 mM、6 mM、8 mM、10 mM,反应中的其他条件不变,以健康的叶片作为阴性对照来进行LAMP反应。LAMP反应完成之后,进行2%的凝胶琼脂糖电泳,120 V电泳30 min。Mg2+的浓度从2 mM到10 mM逐渐增加,反应条带也越来越清晰,当Mg2+的浓度达到6 mM时,亮度最亮,且再增加浓度,条带的亮度没有很明显的变化,因此确定PVY LAMP Mg2+的最佳浓度为6 mM (图5)。
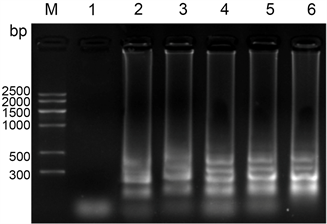 注:M:marker V;1:阴性对照;2:2 mM;3:4 mM;4:6 mM;5:8 mM;6:10 mM。
注:M:marker V;1:阴性对照;2:2 mM;3:4 mM;4:6 mM;5:8 mM;6:10 mM。
Figure 5. Influence of Mg2+ concentration on PVY LAMP reaction
图5. Mg2+浓度对于PVY LAMP反应的影响
PVY dNTPs:对于PVY dNTPs的浓度,设置5个不同的梯度,终浓度分别为0.4 mM、0.8 mM、1.2 mM、1.6 mM、2.0 mM,反应中的其他条件不变,以健康的叶片作为阴性对照来进行LAMP反应。LAMP反应完成之后,进行2%的凝胶琼脂糖电泳,120 V电泳30 min。dNTPs的浓度从0.4 mM到2.0 mM逐渐增加,反应条带也越来越清晰,当dNTPs的浓度达到1.2 mM时,亮度最亮,且再增加浓度,条带的亮度没有很明显的变化,因此确定PVY LAMP dNTPs的最佳浓度为1.2 mM (图6)。
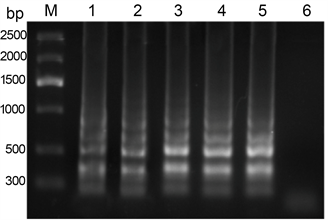 注:M:marker V;1:0.4 mM;2:0.8 mM;3:1.2 mM;4:1.6 mM;5:2.0 mM;6:阴性对照。
注:M:marker V;1:0.4 mM;2:0.8 mM;3:1.2 mM;4:1.6 mM;5:2.0 mM;6:阴性对照。
Figure 6. The effect of dNTPs concentration on PVY LAMP reaction
图6. dNTPs浓度对于PVY LAMP反应的影响
PVY反应时间:为了确定PVY LAMP反应的最佳反应时间,对于LAMP的反应时间设置5个不同的梯度,分别为30 min、40 min、50 min、60 min、70 min。反应中的其他条件不变,以健康的叶片作为阴性对照来进行LAMP反应。LAMP反应完成之后,进行2%的凝胶琼脂糖电泳,120 V电泳30 min。从图中可以看出,在所设置的5个时间梯度中,LAMP都可以正常的进行,在反应时间为30 min的时候就可以产生反应条带,但是条带比较淡,40 min的时候条带的亮度明显增强,随着反应时间的延长,条带亮度基本上没有变化,因此确定PVY LAMP的最佳反应时间为40 min (图7)。
 注:M:marker I;1:30 min;2:40 min;3:50 min;4:60 min;5:70 min;6:阴性对照。
注:M:marker I;1:30 min;2:40 min;3:50 min;4:60 min;5:70 min;6:阴性对照。
Figure 7. Effect of reaction time on PVY LAMP
图7. 反应时间对于PVY LAMP的影响
PVY反应温度:为了确定PVY LAMP反应的最佳反应温度,对于LAMP的反应温度设置6个不同的梯度,分别为60℃、61℃、62℃、63℃、64℃、65℃。反应中的其他条件不变,以健康的叶片作为阴性对照来进行LAMP反应。LAMP反应完成之后,进行2%的凝胶琼脂糖电泳,120 V电泳30 min。从图中可以看出,当温度在60℃~62℃时,LAMP出现微弱的反应条带,当温度为63℃时,LAMP条带亮度陡然增强,温度继续增加,条带亮度不变,因此确定PVY LAMP的最佳反应温度为63℃ (图8)。
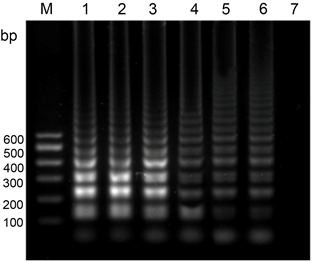 注:M:marker I;1:65˚C;2:64˚C;3:63˚C;4:62˚C;5:61˚C;6:60˚C;7:阴性对照。
注:M:marker I;1:65˚C;2:64˚C;3:63˚C;4:62˚C;5:61˚C;6:60˚C;7:阴性对照。
Figure 8. Effect of reaction temperature on PVY LAMP
图8. 反应温度对于PVY LAMP的影响
3.3. LAMP反应的最佳体系
在体系中无论是否添加甜菜碱,都能产生梯状条带,所以,本试验最终确定在LAMP反应体系中,不添加甜菜碱。为了综合考虑CMV和PVY的反应体系以及反应条件,最终确定了LAMP的最佳反应体系(表3),最佳反应条件为63℃反应40 min,80℃终止2 min。
3.4. LAMP产物的检测
LAMP反应完成后,进行快速离心,发现阳性反应管底有白色沉淀的产生,在加入1 µL的SYBR Green I后显示为绿色,凝胶琼脂糖电泳结果显示有梯状条带的产生。而阴性反应管和阴性对照没有白色沉淀,染色结果为橘黄色,也无梯状条带的产生(图9)。
Table 3. The optimum reaction system of 3-LAMP reaction
表3. LAMP反应的最佳反应体系
 (A) 沉淀观察;(B) LAMP产物的染色结果;(C) LAMP产物的电泳结果;M: marker I;1:LAMP阴性结果;2~4:LAMP阳性结果;5:阴性对照。
(A) 沉淀观察;(B) LAMP产物的染色结果;(C) LAMP产物的电泳结果;M: marker I;1:LAMP阴性结果;2~4:LAMP阳性结果;5:阴性对照。
Figure 9. Detection of LAMP products
图9. LAMP产物的检测
3.5. LAMP灵敏性检测分析
3.5.1. CMV LAMP体系的灵敏性分析
CMV的菌液提取质粒,测得质粒的浓度为1.987 × 103 ng/μL,以10倍的梯度稀释质粒,依次稀释101~108倍,以此为模板,分别进行PCR反应和LAMP反应。电泳的结果显示(图10),PCR检测的最高限度为1.987 × 10−1 ng/μL,继续稀释,没有反应条带的产生,此时,质粒的稀释倍数达到104,在101~104稀释过程中,反应条带的亮度会随着稀释倍数的增加而减弱。而LAMP检测的最高限度是在质粒浓度稀释到1.987 × 10−3 ng/μL时,继续稀释,没有产生反应条带。此时,质粒的稀释倍数为106。在101~106稀释过程中,反应条带的亮度会随着稀释倍数的增加而减弱,到了105和106,反应条带已经很模糊,但是还是可以隐约看到有条带。综上所述,CMV LAMP的灵敏度高于常规的PCR,大概为100倍。
3.5.2. PVY LAMP体系的灵敏性分析
PVY的菌液提取质粒,测得质粒的浓度为2.045 × 10−3 ng/μL,以10倍的梯度稀释质粒,依次稀释101~108倍,以此为模板,分别进行PCR反应和LAMP反应。电泳的结果显示(图11),PCR检测的最高限度为2.045 × 10−1 ng/μL,继续稀释,没有反应条带的产生,此时,质粒的稀释倍数达到104,在101~104稀释过程中,反应条带的亮度会随着稀释倍数的增加而减弱。而LAMP检测的最高限度是在质粒浓度稀释到2.045 × 10−3 ng/μL时,继续稀释,没有产生反应条带。此时,质粒的稀释倍数为106。在101~106稀释过程中,反应条带的亮度会随着稀释倍数的增加而减弱,到了105和106,反应条带已经很模糊,但是还是可以隐约看到有条带。综上所述,PVY LAMP的灵敏度高于常规的PCR,大概为100倍。
 注:M:marker V;1:1.987 × 103 ng/μL;2:1.987 × 102 ng/μL;3:1.987 × 10 ng/μL;4:1.987 ng/μL;5:1.987 × 10−1 ng/μL;6:1.987 × 10−2 ng/μL;7:1.987 × 10−3 ng/μL;8:1.987 × 10−4 ng/μL;9:1.987 × 10−5 ng/μL;10:阴性对照。
注:M:marker V;1:1.987 × 103 ng/μL;2:1.987 × 102 ng/μL;3:1.987 × 10 ng/μL;4:1.987 ng/μL;5:1.987 × 10−1 ng/μL;6:1.987 × 10−2 ng/μL;7:1.987 × 10−3 ng/μL;8:1.987 × 10−4 ng/μL;9:1.987 × 10−5 ng/μL;10:阴性对照。
Figure 10. Comparison of PCR and LAMP CMV sensitivities
图10. CMV PCR和CMV LAMP灵敏度的比较测定
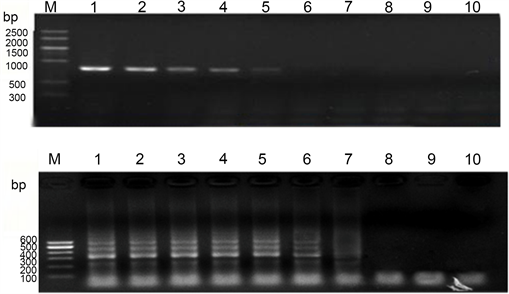 注:M:marker V;1:2.045 × 103 ng/μL;2:2.045 × 102 ng/μL;3:2.045 × 10 ng/μL;4:2.045 ng/μL;5:2.045 × 10−1 ng/μL;6:2.045 × 10−2 ng/μL;7:2.045 × 10−3 ng/μL;8:2.045 × 10−4 ng/μL;9:2.045 × 10−5 ng/μL;10:阴性对照control。
注:M:marker V;1:2.045 × 103 ng/μL;2:2.045 × 102 ng/μL;3:2.045 × 10 ng/μL;4:2.045 ng/μL;5:2.045 × 10−1 ng/μL;6:2.045 × 10−2 ng/μL;7:2.045 × 10−3 ng/μL;8:2.045 × 10−4 ng/μL;9:2.045 × 10−5 ng/μL;10:阴性对照control。
Figure 11. Comparison of PVY PCR and PVY LAMP sensitivity
图11. PVY PCR和PVY LAMP灵敏度的比较测定
3.6. 田间样品的检测分析
在郴州各地采集的14份田间样品的CMV检测中,PCR检测到9份阳性样品,LAMP检测到10份阳性样品,两种检测方法的结果基本一致(图12)。
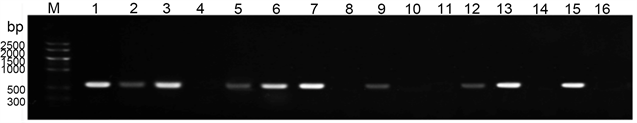
 M:marker V;marker I;1-14:田间样品A1~A14;15:阳性对照;16:阴性对照。
M:marker V;marker I;1-14:田间样品A1~A14;15:阳性对照;16:阴性对照。
Figure 12. PCR and LAMP results of CMV from a field sample
图12. 田间样品CMV的PCR和LAMP结果
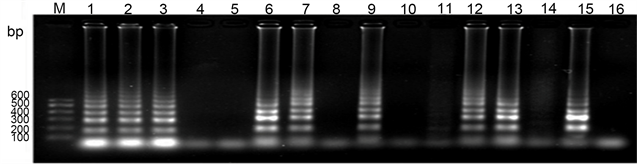
在郴州烟区采集的13份田间样品的PVY检测中,PCR检测到7份阳性样品,LAMP检测到7份阳性样品,两种检测方法的结果一致(图13)。
 M:marker V;1~13:田间样品B1~B14;14:阳性对照;15:阴性对照。
M:marker V;1~13:田间样品B1~B14;14:阳性对照;15:阴性对照。
Figure 13. PCR and LAMP results of PVY field samples
图13. 田间样品PVY的PCR和LAMP结果
4. 讨论与结论
1) 田间样品CMV的检测中,A5号样品PCR为阳性,而LAMP为阴性,具体原因有待进一步分析。样品A11和样品A14的PCR显示为阴性,LAMP却有微弱的条带产生,推测原因是LAMP的灵敏度高于PCR,所以可以检测到微量的病毒。样品A2、A5、A9、A12的PCR条带很暗,但相对应的LAMP却是清晰可见,同样可以说明LAMP的灵敏度比普通的PCR高。在田间样品PVY的检测中,样品B1、B2、B3、B4、B5的PCR条带微暗,但LAMP的条带很清晰。PCR和LAMP两种检测方法的结果一致。
2) 作为一种新的核酸扩增手段,LAMP也有自身的缺陷。引物设计原理比较复杂,如果引物设计不成功,往往导致高频率假阳性的扩增。LAMP的4条引物只有和目的基因完全匹配的情况下,扩增才能顺利进行,因此在很大程度上,扩增的特异性会很高,但是若目的基因发生突变,则LAMP扩增无法进行。
基金项目
湖南省烟草公司重点科研项目(项目编号:14-16ZDAa02)。
文章引用
匡传富,孙现超,陈德鑫. 基于烟草蚜传病毒病的黄瓜花叶病(CMV)和马铃薯Y病毒病(PVY) LAMP检测体系研究
Studies on LAMP Detection System of Cucumber Mosaic Virus (CMV) and Potato Virus Y (PVY) Transmitted by Tobacco Aphids Virus[J]. 农业科学, 2020, 10(11): 947-958. https://doi.org/10.12677/HJAS.2020.1011144
参考文献
- 1. 刘亚东, 冷雪, 时坤, 等. 环介导等温扩增技术检测方法的研究进展[J]. 中国人兽共患病学报, 2018(5): 76-81.
- 2. 杨粤, 付博宇, 张蕴哲, 等. 环介导等温扩增检测技术的应用与方法改进[J]. 食品安全质量检测学报, 2016(4): 174-178.
- 3. 黄海龙, 朱鹏, 杨浩. LAMP-LFD技术及其在生物快检方面应用[J]. 中国生物工程杂志, 2015(12): 95-101.
