Botanical Research
Vol.07 No.03(2018), Article ID:25187,8
pages
10.12677/BR.2018.73041
Research of Gene Editing by CRISPR/Cas9 System in Nicotiana sylvestris
Yuan Zhang1, Zhengjie Liu1, Zichao Mao1, Ge Wang2*, Huangwen Yang2*
1College of Agriculture and Biotechnology, Yunnan Agricultural University (YNAU), Kunming Yunnan
2College of Tobacco Science, Yunnan Agricultural University (YNAU), Kunming Yunnan

Received: May 2nd, 2018; accepted: May 23rd, 2018; published: May 30th, 2018

ABSTRACT
In this study, Nicotiana sylvestris was used as research material for carrying out the CRISPR/Cas9 gene editing researches. In this paper, the leaves of aseptic seedlings of tobacco (Nicotiana sylvestris) were used as explants. The eukaryotic expression vector pBI121-EGFP was transformed into tobacco by Agrobacterium tumefaciens mediated leaf disc method to obtain transgenic plants with green fluorescence. Then, the CRISPR/Cas9 gene knockout carrier containing the guide sequence of the GEP gene was constructed and the transgenic plant leaves of pBI121-EGFP were used as explants to conduct genetic transformation by Agrobacterium mediated transformation, and the transgene transformation of Agrobacterium mediated by Agrobacterium tumefaciens was carried out. It was found that the green fluorescence was knocked out successfully, and the CRISPR/Cas9 system was constructed to edit the gene of forest tobacco, which provided a technical basis for the establishment of the gene function research platform in tobacco.
Keywords:CRISPR/Cas9 System, Genetic Transformation, Green Fluorescent Protein, Nicotiana sylvestris
利用CRISPR/Cas9系统对林烟草 基因编辑的研究
张园1,刘正杰1,毛自朝1,王戈2*,杨焕文2*
1云南农业大学农学与生物技术学院,云南 昆明
2云南农业大学烟草学院,云南 昆明

收稿日期:2018年5月2日;录用日期:2018年5月23日;发布日期:2018年5月30日

摘 要
本研究以野生林烟草(Nicotiana sylvestris)为研究材料,进行基于CRISPR/Cas9系统的基因编辑的研究。本文以林烟草无菌苗叶片为外植体,利用农杆菌介导的叶盘法将真核表达载体pBI121-EGFP转化至林烟草中,获得可发绿色荧光的转基因植株;然后构建含有GEP基因guide序列的CRISPR/Cas9基因敲除载体,并以pBI121-EGFP转基因植株叶片为外植体,进行农杆菌介导的遗传转化,经检测发现已成功将绿色荧光敲除,从而构建了利用CRISPR/Cas9系统对林烟草的基因进行编辑的系统,为烟草中基因功能研究平台的建立提供了技术基础。
关键词 :CRISPR/Cas9系统,遗传转化,GFP (绿色荧光蛋白),林烟草(Nicotiana sylvestris)

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
基因组定点编辑(site-specific genome editing)技术是指可以在基因组水平上对DNA序列进行定点改造的遗传操作技术。它在基因组改造、基因功能研究和转基因新品种培育等方面都具有重大的应用价值。然而基因组定点编辑技术的发展一直进展缓慢,直到21世纪,随着蛋白质结构和功能领域研究的新突破和人工核酸内切酶(engineered endonuclease, EEN)技术出现,将特意识别与结合DNA的蛋白质结构域和EEN结构域融合,创造出了能特异切割DNA的序列特异性核酸酶(sequence-specific nucleases, SSNs),从而真正上实现了简单、快速、高效和精确地对基因组特定位点进行靶向编辑的目的 [1] 。SSNs主要包括锌指核酸酶(Zinc finger nucleases, ZFNs)、类转录激活因子效应物核酸酶(Transcription activator-like effector nucleases, TALENs)和成簇的规律间隔的短回文重复序列及其相关系统(Clustered regularly interspaced short palindromic repeats/CRISPR-associated 9, CRISPR/Cas9 system)。它们的共同特点是能在基因组靶定的位置上切割DNA双链,造成DNA双链的断裂(DNA double-strand breaks, DSBs),而DSBs的发生能够极大地提高重组事件发生的概率 [2] 。而发生DSBs后,在随后的修复过程中,将外源DNA整合入DSB中或者将DSB处部分序列删除(或插入)就会导致移码突变的发生,并最终实现DNA大片段的删除和植物的基因编辑 [3] 。
CRISPR/Ca9编辑系统自1987年发现 [4] 至今,已形成了开发利用CRISPR的研究热潮 [5] ,如今CRISPR研究已经风靡科学界。随着CRISPR/Cas9系统的成型,以及具有的低成本、构建简单和高效等优点 [6] ,使其广泛地应用于人类、动物、植物等生物体的基因组编辑上。在植物基因组定点编辑方面,CRISPR/Cas9系统也迅速地被应用到拟南芥、烟草 [7] 等双子叶植物和水稻 [8] [9] 、高粱 [7] 、小麦 [10] 、玉米 [11] 等单子叶植物中,并且获得较高的诱导突变率和可稳定遗传的基因组编辑植株。
烟草作为一种典型的双子叶模式植物,其本身也是一种具有重要经济价值的植物。目前,已有研究将CRISPR/Cas9系统应用于烟草中并取得了成功 [7] [12] 。同时,烟草也是进行转基因以及植物基因功能验证的重要模式植物。特别是烟草中农杆菌介导的遗传转化方法已非常成熟。因此在烟草中建立的CRISPR/Cas9系统可以快速推广于马铃薯、番茄、辣椒、矮牵牛等中。林烟草(Nicotiana sylvestris)和绒毛状烟草(Nicotiana tomentosiformis)是栽培烟草的两个祖先种 [13] ,绒毛状烟草和林烟草全基因组序列图谱的完成,具有重要的科学价值和战略意义,也为CRISPR/Cas9系统在林烟草进行基因编辑提供了基础。
本研究为建立以CRISPR/Cas9系统为基础的基因编辑研究体系,以绿色荧光蛋白(GFP)为示踪蛋白,将pBI121-EGFP转化至林烟草中获得抗性植株,并进行分子鉴定与GFP检测获得阳性转基因植株;进一步,以上述转基因阳性植株为受体,转化含有GEP基因guide序列的CRISPR/Cas9基因敲除载体,并获得GFP蛋白编码基因敲除的再生植株,从而构建了烟草中以CRISPR/Cas9系统为手段的基因编辑系统,为后续功能基因的分析提供了研究基础。
2. 材料与方法
2.1. 材料与试剂
2.1.1. 植物材料
以本实验室保存的林烟草种子为实验材料,通过无菌处理,诱导无菌组培苗,温度25℃ ± 2℃,光照周期16 h/d,光照强度2000 ± 200 lux。
2.1.2. 载体与菌株
实验使用到的植物表达载体有pBI121-EGFP真核表达载体(由本实验室保存)和Cas9/gRNA基因组编辑载体(由北京唯尚立德公司购买);根癌农杆菌(Agrobacterium tumefaciens)菌株EHA105由本实验室保存。
PCR所用EasyTaq、EasyTaq Buffer、dNTPs等产品购自TaKaRa公司。
2.2. 烟草基因组DNA的提取
采用CTAB法提取烟草基因组DNA,并通过电泳检测基因组DNA的提取质量。
2.3. pBI121-EGFP载体对林烟草的遗传转化
采用冻融法将外源载体(pBI121-EGFP)转化至EHA105农杆菌感受态中,涂板后28℃培养48 h,获得单菌落进行鉴定后,扩大培养,收集菌体,弃上清后,将菌体重新用MS悬浮液进行悬浮,调整菌液OD600至0.5,准备对烟草叶片进行侵染;本实验采用的MS悬浮液以MS为基本培养基,其中蔗糖加入量为5%,另添加AS (乙酰丁香酮) 100 μM。
取林烟草无菌苗幼嫩叶片,并将其切成8 mm2大小的小块后,置于含农杆菌的MS悬浮液中侵染30 min,无菌滤纸吸干表面液体后,将叶片置于共培养板中19℃共培养48 h;
将共培养后的烟草叶片用无菌水(添加200 mg/L的羧苄青霉素)清洗5~6次后,用无菌滤纸吸干表面多余水分,并将叶片接种至烟草分化筛选培养基(添加200 mg/L的羧苄青霉素和100 mg/L的卡那霉素)中,诱导抗性再生芽;待再生芽长至1~2 cm时即可诱导生根,获得抗性再生苗。
2.4. pBI121-EGFP转基因植株PCR检测
取转化pBI121-EGFP植物表达载体的抗性植株的幼嫩叶片,采用CTAB法提取植物总DNA,并以此为模板扩增GFP基因的片段,以检测阳性植株。扩增GFP基因的引物为GFP-F:GAAACCTCCTCGGATTCCATT和GFP-R:AAGTTCACCTTGATGCCGTTC,目的片段为1020 bp。PCR反应体系为:植物总DNA (50 ng/μL) 1 μL,GFP-F (10 μM) 1 μL,GFP-R (10 μM) 1 μL,Taq DNA polymerase (5 U/μL) 0.5 μL,dNTPs (2.5 mM) 1 μL,10 × Taq PCR Buffer 1 μL,ddH2O 4.5 μL,混匀;反应程序为:预变性94℃ 2 min,变性94℃ 30 s,退火57℃ 30 s,延伸72℃ 1 min,反应循环30 次,终延伸72℃ 10 min。反应结束后进行电泳检测。
2.5. 含有GFP基因guide序列的CRISPR/Cas9基因敲除载体的构建
根据pBI121-EGFP植物表达载体中GFP基因序列,对其进行靶位点设计,选取的gRNA靶位点序列为:CAAGTTCAGCGTGTCCGGCG,添加CRISPR/Cas9表达载体的接头后,合成一对引物,GFP-gRNA-F:TTGCAAGTTCAGCGTGTCCGGCG和GFP-gRNA-R:AACCGCCGGACACGCTGAACTTG。
根据植物Cas9/gRNA质粒构建试剂盒要求,合成oligo引物二聚体:GFP-gRNA-F引物(10μM)5μL,GFP-gRNA-R引物(10 μM) 5 μL,ddH2O 15 μL,混匀,95℃反应3 min后缓慢自然冷却至25℃,再16℃反应5 min;再将合成的oligo引物二聚体插入到载体中:Cas9/gRNA载体1 μL,oligo二聚体1 μL,solution1 1 μL,solution2 1 μL (solution1和solution2均为试剂盒自带),ddH2O 6μL,混匀后16℃反应2 h;最后将连接产物通过热激法转化至DH5α大肠杆菌感受态中,涂布至含卡那霉素抗性的平板中筛选单菌落,挑单菌落测序以鉴定阳性菌株。最后,将测序正确的含有GFP基因guide序列的CRISPR/Cas9基因敲除载体经冻融法转化至EHA105农杆菌感受态中。
2.6. CRISPR/Cas9基因敲除载体的遗传转化
将含有GFP基因CRISPR/Cas9敲除载体的农杆菌转化至pBI121-EGFP转基因阳性植株,具体转化方法参照2.3所述进行,侵染、共培养与清洗后,将受体材料转接至烟草分化筛选培养基(添加200 mg/L的羧苄青霉素和20 mg/L的除草剂)中,诱导抗性再生芽;待再生芽长至1~2 cm时即可诱导生根,获得抗性再生苗,对再生苗进一步通过分子鉴定获得阳性植株。
2.7. 转基因植株的荧光观察
野生型林烟草、转化pBI121-EGFP植物表达载体和CRISPR/Cas9基因敲除载体的转基因烟草均按照下述方法检测荧光:取转基因阳性烟草植株的表皮细胞,用OLYMPUS FV1000光谱共聚焦显微镜进行观察,样品用488 nm的氩离子束激发,激发光在510 nm至580 nm间检测GFP成像,在620 nm至680 nm间检测叶绿体自发荧光,显微成像结果用OLYMPUS FLUOVIEW Ver.3.0 Viewer软件加工。
3. 结果与分析
3.1. pBI121-EGFP真核表达载体转化林烟草
野生型林烟草通过叶盘法转化后,外植体材料(幼嫩叶片)在分化筛选培养基上分化良好,约20天后可获得再生芽,将再生芽接种至生根筛选培养基上后,7天左右即可获得生根良好的抗性植株(图1)。
我们取抗性植株的幼嫩叶片进行基因组DNA的提取,并以此为模板,扩增基因GFP目的条带以鉴定林烟草转基因阳性植株(图2)。以野生型林烟草基因组DNA为阴性对照,以pBI121-EGFP质粒为阳性对照,对获得的6株抗性植株进行PCR鉴定。发现:1~5号抗性植株均可扩增出目的条带,而6号植株未扩增出目的条带。
3.2. pBI121-EGFP转基因烟草的荧光观察
取经过PCR鉴定的烟草转基因植株的表皮细胞,进行荧光观察,发现野生型林烟草的气孔内细胞器中会略微自发荧光,而转GFP基因的阳性植株中,表皮细胞的细胞壁和气孔中(细胞器及细胞壁)均有绿色荧光(图3A~图3H);说明转GFP基因的阳性植株可表达GFP蛋白,且该蛋白可能是定位在细胞壁或细胞膜中。
3.3. pBI121-EGFP转基因植株GFP蛋白编码基因的敲除
本实验对GFP目的基因设计gRNA靶序列,并将其连接至Cas9/gRNA质粒中,经测序获得GFP蛋白编码基因的CRISPR/Cas9敲除载体(图4)。
将上述CRISPR/Cas9基因敲除载体载体通过农杆菌介导的遗传转化方法对上述转基因阳性植株再次进行侵染,并获得抗性植株(图5),经分子水平鉴定后,对该阳性植株进行GFP荧光观察,发现相较于转GFP基因的转基因植株而言,通过对GFP基因的定点编辑实现了抗性植株的荧光减弱(图3E~图3L),说明本实验选取的gRNA序列的确可在林烟草中实现GFP目的基因的编辑。
4. 讨论
目前,CRISPR/Cas9系统已在多种植物中实现了基因组的定点编辑,该方法可在植物的遗传层面更

Figure 1. The transgenic plants transformed by pBI121-EGFP eukaryotic expression vector into tobacco (Nicotiana sylvestris). A: resistance screening; B: bud differentiation; C: regenerated plant; D: root growth of resistant plants
图1. pBI121-EGFP真核表达载体转化林烟草后的转基因植株。A:抗性筛选;B:芽的分化;C:再生植株;D:抗性植株根生长情况
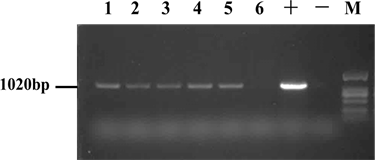
Figure 2. The result of PCR identification of tobacco resistant plants with GFP gene. 1~6: PCR detection of GFP gene in resistant plants; “+” means positive control; “−” means negative control; Lane M: D2000 DNA Marker
图2. 转GFP目的基因的烟草抗性植株PCR鉴定结果。1~6:抗性植株GFP基因PCR检测结果;“+”为阳性对照;“−”为阴性对照;“M”:D2000 DNA Marker
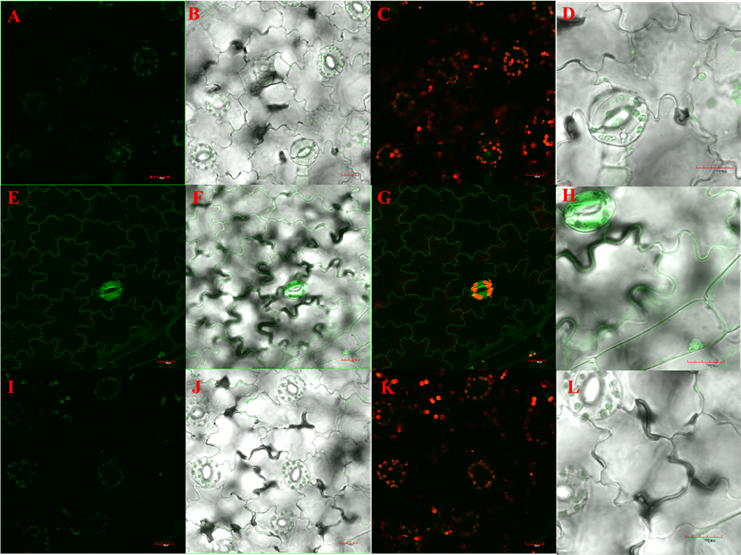
Figure 3. Fluorescence observation of transgenic tobacco plants. A~D: fluorescence observation of the wild type tobacco by confocal microscope; E~H: fluorescence observation of the tobacco with GFP gene by confocal microscope; I~L: the fluorescence observation of the confocal microscope after the knockout of the GFP gene in the tobacco. A, E, I: results of fluorescence observation; B, F, J: results of the superposition of fluorescence and white light; C, G, K: results of superposition of fluorescence and chlorophyll autofluorescence; D, H, L: magnifying results of B, F and J graphs; The magnification of the objective lens is 60 times. Bar is 20 μM
图3. 转基因烟草植株的荧光观察。A~D:野生型林烟草共聚焦显微镜荧光观察结果;E~H:转GFP基因的林烟草共聚焦显微镜荧光观察结果;I~L:转GFP基因的林烟草敲除GFP基因后的共聚焦显微镜荧光观察结果。A、E、I:荧光观察的结果;B、F、J:荧光和白光叠加的结果;C、G、K:荧光和叶绿素自发荧光叠加的结果;D、H、L:B、F、J图放大结果;放大倍数600倍,图中标尺为20 μM
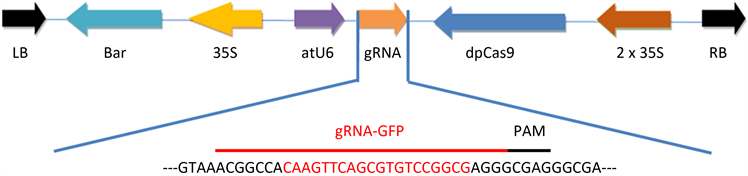
Figure 4. Schematic map of CRISPR/Cas9 gene knockout vector containing GEP gene guide sequence
图4. 含有GEP基因guide序列的CRISPR/Cas9基因敲除载体示意图
加简单直接的实现植物育种的各种需求 [14] 。烟草作为典型的双子叶模式植物,其遗传转化方法已成熟,因此,利用CRISPR/Cas9基因组编辑方法,来研究烟草及其他植物的基因功能是可行的,本实验采用

Figure 5. Genetic transformation of CRISPR/Cas9 gene knockout vectors. A: resistance screening; B: bud differentiation; C: regenerated plants; D: root growth of resistant plants
图5. CRISPR/Cas9基因敲除载体的遗传转化。A:抗性筛选;B:芽的分化;C:再生植株;D:抗性植株根生长情况
GFP基因这一典型的标记基因,通过两次遗传转化,实现了野生型林烟草从微弱的自发荧光到明显的细胞壁和细胞膜可见绿色荧光,再到细胞壁和细胞膜绿色荧光消失。从而直观的证明了CRISPR/Cas9系统应用于烟草基因组编辑的可行性。
烟草同时也是茄科植物的主要成员之一,而茄科是世界性的一个大科,茄科约80属300余种,广泛分布于全世界的热带、亚热带以及温带地区,以美洲热带、亚热带地区种类最为丰富,我国有26属107种。茄科植物资源丰富,食用作物方面番茄、茄子、辣椒等都是茄果类作物,供应季节长,产量高,世界各地普遍栽培。马铃薯是高产的一类作物,可兼做主食与蔬菜,全世界总消耗量仅次于小麦、水稻、大麦、大豆,为第五位主食作物;经济作物方面我国烤烟与香烟总产量占世界首位。药用方面,茄科植物富生物碱和类黄酮等次生物质,广泛作为医药,致幻剂、毒品以及香料;园艺方面矮牵牛以艳丽多变的花色响誉世界。特别指出的是,多数茄科植物采用农杆菌介导的遗传转化方法获得转基因植株较为容易,并且茄科植物的多数基因组已被测序,可提供清晰的基因组序列以利于基因组的编辑。因此,本研究建立的林烟草中基于CRISPR/Cas9体系的基因定点编辑系统,可为进一步在烟草等茄科植物中进行基因资源挖掘及功能分析提供新的平台。
致谢
该实验可以顺利的完成,感谢云南农业大学研究生科技创新项目的资助。
基金项目
本研究由云南农业大学研究生科技创新项目“CRISPR/Cas9系统在烟草基因组编辑中的应用”提供资助。
文章引用
张园,刘正杰,毛自朝,王戈,杨焕文. 利用CRISPR/Cas9系统对林烟草基因编辑的研究
Research of Gene Editing by CRISPR/Cas9 System in Nicotiana sylvestris[J]. 植物学研究, 2018, 07(03): 323-330. https://doi.org/10.12677/BR.2018.73041
参考文献
- 1. Baker, M. (2012) Gene-Editing Nucleases. Nature Methods, 9, 23-26. https://doi.org/10.1038/nmeth.1807
- 2. Cohen-Tannoudji, M., Robine, S., Choulika, A., et al. (1998) I-SCEI-Induced Gene Replacement at a Naturallocus in Embryonic Stem Cells. Molecular and Cellular Biology, 18, 1444-1448. https://doi.org/10.1128/MCB.18.3.1444
- 3. Mao, Y., Zhang, H., Xu, N., et al. (2013) Application of the CRISPR-Cas System for Efficient Genome Engineering in Plants. Molecular Plant, 6, 2008-2011. https://doi.org/10.1093/mp/sst121
- 4. Ishino, Y., Shinagawa, H., Makino, K., et al. (1987) Nucleotide Sequence of the iap Gene, Responsible for Alkaline Phosphatase Isozyme Conversion in Escherichia coli, and Identification of the Gene Product. Journal of Bacteriology, 169, 5429-5433. https://doi.org/10.1128/jb.169.12.5429-5433.1987
- 5. Pennisi, E. (2013) The CRISPR Craze. Science, 341, 833-836. https://doi.org/10.1126/science.341.6148.833
- 6. Bortesi, L. and Fischer, R. (2015) The CRISPR/Cas9 System for Plant Genomeediting and Beyond. Biotechnology Advances, 33, 41-52. https://doi.org/10.1016/j.biotechadv.2014.12.006
- 7. Carter, J. and Wiedenheft, B. (2015) SnapShot: CRISPR-RNA-Guided Adaptive Immune Systems. Cell, 163, 260-260e1.
- 8. Miao, J., Guo, D., Zhang, J., et al. (2013) Targeted Mutagenesis in Rice Using CRISPR-Cas System. Cell Research, 23, 1233-1236. https://doi.org/10.1038/cr.2013.123
- 9. Zhang, H., Zhang, J., Wei, P., et al. (2014) The CRISPR/Cas9 System Produces Specific and Homozygous Targeted Gene Editing in Rice in One Generation. Plant Biotechnology Journal, 12, 797-807. https://doi.org/10.1111/pbi.12200
- 10. Upadhyay, S.K., Kumar, J., Alok, A. and Tuli, R. (2013) RNA-Guided Genome Editing for Target Gene Mutationsin Wheat. G3 (Bethesda), 3, 2233-2238. https://doi.org/10.1534/g3.113.008847
- 11. Liang, Z., Zhang, K., Chen, K. and Gao, C. (2014) Targeted Mutagenesis in Zea Mays Using TALENs and the CRISPR/Cas System. Journal of Genetics and Genomics, 4, 63-68. https://doi.org/10.1016/j.jgg.2013.12.001
- 12. 杨学飞, 刘亚娟, 高原, 等. CRISPR/Cas9 系统在本氏烟草基因敲除中的应用[J]. 分子植物育种, 2017, 15(1): 30-38.
- 13. Gerstel, D. (1976) Tobacco: Nicotiana tabacum (Solanaceae). In: Simmonds, N.W., Ed., Evolution of Crop Plants, Longman, London, 273-277.
- 14. 严芳, 周焕斌. CRISPR/Cas9技术在植物基因功能研究和新种质创制中的应用与展望[J]. 中国科学: 生命科学, 2016, 46(5): 498-513.