Advances in Clinical Medicine
Vol.
13
No.
04
(
2023
), Article ID:
64153
,
12
pages
10.12677/ACM.2023.134847
3H-1,2-二硫醇-3-硫酮靶向GPX4调节铁死亡参与小鼠脓毒症所致的肠屏障损伤
黄海1*,郑磊2,高 昭1,宋蕾1,郭沛雨1,高鹏2#
1青岛大学,医学部第一临床医学院,山东 青岛
2青岛大学附属医院急诊外科,山东 青岛
收稿日期:2023年3月17日;录用日期:2023年4月13日;发布日期:2023年4月20日

摘要
目的:通过观察3H-1,2-二硫醇-3-硫酮(D3T)预处理对脓毒症小鼠的肠道屏障损伤的影响,初步探讨铁死亡参与脓毒症所致的肠屏障损伤调节的可能机制,为临床脓毒症诊治提供新思路。方法:采用盲肠结扎穿刺术(CLP)建立小鼠脓毒症模型,3H-1,2-二硫醇-3-硫酮(3H-1,2-dithiole-3-thione, D3T)间接诱导GPX4高表达。32只雄性C57BL/6J小鼠随机分为假手术组(Sham)、假手术给药组(Sham + D3T)、脓毒症组(CLP)、脓毒症给药组(D3T),每组各8只小鼠。给药组在实验前30分钟,腹腔注射D3T悬液(二甲基亚砜(DMSO)溶解,50 mg/kg),假手术组及脓毒症组同时腹腔注射等剂量的DMSO+PBS混合液,术后20小时观察小鼠生存情况,内眦静脉取血测定TNF-α、IL-6表达以评估小鼠炎症水平;部分小肠组织行苏木精-伊红(HE)染色观察小肠组织的损伤情况,Westernblotting检测肠道紧密连接蛋白ZO-1、Occludin及铁死亡相关蛋白GPX4、ACSL4及SLC7A11/xCT表达水平。结果:在72小时生存率观察实验中,CLP组小鼠生存率(33%)较Sham组相比明显降低(P < 0.01),而D3T预处理改善了脓毒症小鼠的生存情况(68%, P < 0.01);造模后20小时,CLP组小鼠脓毒症中毒症状明显,腹腔感染严重,小肠病理损伤明显加重,血清TNF-α及IL-6水平异常升高(P < 0.01),而D3T预处理改善了脓毒症中毒症状,腹腔感染及小肠病理损伤,血清炎症因子水平下降(P < 0.05);通过蛋白印迹法,我们发现脓毒症小鼠小肠组织肠道紧密连接蛋白ZO-1和Occludin、铁死亡相关蛋白GPX4和SLC7A11/xCT蛋白水平明显下降(P < 0.01),ACSL4蛋白水平异常升高(P < 0.01),而D3T预处理一定程度上调了小肠ZO-1、Occludin、GPX4及SLC7A11/xCT的表达(P < 0.01),抑制了ACSL4的表达(P < 0.01)。结论:3H-1,2-二硫醇-3-硫酮发挥其抗氧化特性,靶向GPX4抑制铁死亡,改善小鼠脓毒症所致的肠屏障损伤。
关键词
脓毒症,铁死亡,谷胱甘肽过氧化物酶4 (GPX4),3H-1,2-二硫醇-3-硫酮(D3T)

3H-1,2-Dithiol-3-Thione Targeting GPX4 Mediates Ferroptosis and Participates Sepsis-Induced Intestinal Barrier Injury in Mice
Hai Huang1*, Lei Zheng2, Zhao Gao1, Lei Song1, Peiyu Guo1, Peng Gao2#
1The First Clinical Medical College of the Medical Department, Qingdao University, Qingdao Shandong
2Department of Emergency Surgery, The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Mar. 17th, 2023; accepted: Apr. 13th, 2023; published: Apr. 20th, 2023

ABSTRACT
Objective: The research was designed to investigate the effect of pretreatment with 3H-1,2-dithiole-3-thione (D3T) on intestinal barrier injury in septic mice and explore the possible mechanism of ferroptosis in the regulation of intestinal barrier injury induced by sepsis, which may provide new strategy for clinical diagnosis and treatment of sepsis. Methods: Sepsis model was induced by cecal ligation and puncture (CLP) in mice. The expression of GPX4 was up-regulated by using 3H-1,2-dithiole-3-thione (D3T). Thirty-two male C57BL/6J mice were randomly divided into four groups, including sham operation group (Sham), sham operation treatment group (Sham + D3T), sepsis group (CLP) and sepsis treatment group (D3T), with 8 mice in each group. 30 minutes before the experiment, the mice in the treatment group were injected with D3T suspension (dissolved in dimethyl sulfoxide (DMSO), 50 mg/kg) by intraperitoneal injection, while the mice in the sham operation group and sepsis group were injected with DMSO + PBS at the same dose by intraperitoneal injection. After 20 hours, we observe the survival condition in each group and detect the contents of serum TNF-α and IL-6 to evaluate the level of inflammation in mice of each group. Partial small intestine was collected to evaluate the intestinal injury by using hematoxylinand eosin (HE) staining. The remaining small intestine was stored for detecting theexpression of intestinal tight junction proteins ZO-1, Occludin and ferroptosis relatedproteins GPX-4, ACSL-4 and SLC7A11/xCT by using Western blotting. Results: In the 72-hours survival observation experiment, the survival rate of CLP group (33%) was significantly lower than that of Sham group (P < 0.01), while D3T pretreatment improved the survival of septic mice (68%, P < 0.01). 20 hours after the establishment of the model, the CLP group shows obvious septic symptoms, including serious abdominal infection, aggravated pathological intestinal injury, and the higher levels of serum TNF-α and IL-6. However, D3T pretreatment improved the symptoms of sepsis, alleviated abdominal infection and pathological injury of small intestine, and decreased the level of serum inflammatory factors. By Western blotting, we found that the levels of intestinal tight junction proteins ZO-1 and Occludin, ferroptosis related proteins GPX4 and SLC7A11/xCT were significantly decreased, while the level of ACSL4 protein was abnormally increased in septic mice. D3T pretreatment up-regulated the expression of ZO-1, Occludin, GPX4 and SLC7A11/xCT and inhibited the expression of ACSL4 in small intestine of septic mice. Conclusion: 3H-1,2-dithiole-3-thione exerts its antioxidant properties by targeting GPX4 to inhibit ferroptosis and improve intestinal barrier injury induced by sepsis in mice.
Keywords:Sepsis, Ferroptosis, GPX4, 3H-1,2-Dithiole-3-Thione

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
脓毒症是一种由严重微生物感染引起全身炎症反应的急危重症,目前仍是全球公共卫生面临的一项重大挑战。尽管医学发展取得重大进步,但是脓毒症患者的数量仍然很惊人,全世界每年估计有1900万到4890万脓毒症患者,它仍是世界范围内的主要死亡原因 [1] [2] 。脓毒症发病机制可能与细菌感染机体后促炎因子与抗炎因子反应失衡、氧化应激以及肠道菌群移位和肠屏障损伤等有关 [3] [4] [5] 。脓毒症发病过程中常常伴随着多器官功能损伤,其中肠道处于脓毒症器官损伤的中心,是体内最早损伤的,最后恢复的器官 [6] [7] 。肠道屏障是机体重要的对抗病原体的防御体系,其构成主要包括机械屏障、化学屏障、免疫屏障与生物屏障共同构成,其中机械屏障最为重要。肠道机械屏障主要由肠粘膜上皮细胞以及上皮细胞间的紧密连接构成 [8] 。肠道菌群失调及肠道通透性增加促进致病性微生物的过度生长和肠道病原体相关分子模式(Pathogen-Associated Molecular Pat, PAMPs)的易位,削弱机体防御,加重多器官功能损伤 [9] 。一项纳入126例脓毒症患者的关于肠黏膜屏障功能损伤与病情严重程度和预后的研究表明,严重脓毒症组(休克)患者血二胺氧化酶(DAO)、D-乳酸、肠型脂肪酸结合蛋白(I-FABP)高于脓毒症组,且显著高于健康对照组,提示脓毒症患者肠黏膜屏障功能损伤能够反映病人病情严重程度,且对预后有一定预测作用 [10] 。
脓毒症病理生理相关的具体分子机制极其复杂。既往研究表明多种经典细胞死亡方式不同程度地参与了脓毒症的发病过程,其中包括细胞凋亡、自噬、焦亡及中性粒细胞死亡(NETosis) [11] 。近年来,人们越来越多地认识到铁代谢失调/铁死亡可能在脓毒症发病中起关键作用 [12] 。铁死亡是一种铁依赖性的,非凋亡性的细胞死亡方式,在细胞形态和功能方面明显区别于坏死、凋亡、自噬 [13] [14] 。铁死亡没有典型的坏死的形态学特征,细胞质和细胞器肿胀和细胞膜破裂;也没有传统的细胞凋亡的特点,如细胞萎缩,染色质凝集,凋亡小体形成和细胞骨架的解体;也不同于自噬可形成经典的封闭双层膜结构(自噬泡)。形态学上,铁死亡主要表现为线粒体明显收缩,膜密度增加,线粒体嵴减少或消失,这与其他细胞死亡方式不同 [13] [15] [16] 。生化上,细胞内谷胱甘肽(GSH)缺失,谷胱甘肽过氧化物酶4 (GPX4)活性降低,GPx4催化的还原反应不能代谢脂质过氧化物,Fe2+以芬顿反应(Fenton)的方式氧化脂质,产生大量的活性氧(ROS),促进铁死亡 [16] [17] 。现有研究表明铁死亡与脓毒症所致的多器官功能损害的发生发展密切相关。Yichun Wang等人发现AUF1通过调节NRF2和ATF3,通过抑制铁死亡,减轻脓毒症诱导的急性肺损伤 [18] 。此外Bin Zhou研究表明葛根素通过靶向调节AMPK介导的铁死亡保护脓毒症诱导的心肌损伤。但是铁死亡与脓毒症所致的肠屏障损伤的研究较少。近期Wei Liu等人发现Sestrin2可以抑制铁死亡,以缓解脓毒症所致的肠道炎症和屏障功能障碍 [19] 。
GPX4是一种含硒的磷脂过氧化酶,通过还原过氧化的脂质,保护细胞免受脂质过氧化引起的铁死亡,是已知的唯一能够完成这一关键功能的哺乳动物蛋白 [20] 。GPX4处于铁死亡的十字路口,其活性抑制或者表达下调可诱导铁死亡 [21] 。Gpx4还受上游核因子红系2相关因子2 (Nrf2)的调控 [22] 。近年来,GPX4凭借其抗脂质过氧化的特性,在脓毒症相关的研究中备受关注。Jin Wang研究发现鸢尾素靶向Nrf2/GPX4信号轴抑制铁死亡可以预防脓毒症相关脑病 [23] 。目前关于GPX4与脓毒症所致的肠屏障损伤方面的研究较少。近期Kang R等人揭示Gpx4降低脂质过氧化的能力对小鼠巨噬细胞焦亡和多菌脓毒症的致死率具有负性调节作用 [24] 。
由此我们做出猜想:人为上调GPX4表达抑制铁死亡,发挥其抗脂质过氧化能力,可以缓解脓毒症中毒症状,减轻脓毒症所致的肠屏障损伤,改善脓毒症预后。3H-1,2-二硫醇-3-硫酮(D3T)是二硫代硫酮中的一员,可在各种类型的组织和细胞中诱导内源性抗氧化/抗炎组分和第二阶段酶(即抗氧化酶)的生成 [25] [26] 。Zhu H等人通过体外细胞研究发现D3T处理会导致RAW 264.7细胞中一系列抗氧化剂的水平呈浓度依赖性增加,这些包括还原性的谷胱甘肽、谷胱甘肽过氧化物酶、谷胱甘肽还原酶等等 [27] 。本研究拟使用盲肠结扎穿刺法构建小鼠脓毒症模型 [28] ,D3T预处理作为干预措施,通过苏木精-伊红(HE)染色观察小鼠小肠组织病理损伤情况,采用酶联免疫吸附法检测小鼠静脉血炎症因子水平及应用Western Blotting测定铁死亡相关蛋白及肠道紧密连接蛋白表达情况,以初步探索铁死亡参与调节小鼠脓毒症所致的肠屏障损伤的可能机制及潜在的干预措施。
2. 材料与方法
2.1. 动物与分组
健康雄性C57BL/6J小鼠(北京维通利华,许可证号:SYXK (京) 2022-0052)共32只,体重20~25 g。实验小鼠分笼饲养,自由饮水进食,在实验前适应环境1周。动物处理符合青岛大学附属医院的相关伦理规定(伦理号:QYFY WZLL 27582)。采用随机数字表法分为假手术组(Sham)、假手术给药组(Sham + D3T组)、脓毒症组(CLP组)、脓毒症给药组(CLP + D3T组) 4组,每组8只小鼠。
2.2. 各组的处理
实验前禁饮食12小时。实验开始前30分钟,CLP + D3T组及D3T组分别腹腔注射相应剂量的D3T悬浊液 [29] (50 mg/Kg,悬浊液均用PBS稀释至0.1 ml后给药),Sham组及CLP组分别腹腔注射0.1 ml的PBS + DMSO混合液。给药后30分钟,Sham及Sham + D3T组仅开腹后找到盲肠后立即还纳逐层关腹,CLP组及CLP + D3T组按照CLP法构建脓毒症模型(结扎50%的盲肠),各组术后常规补液(颈背部肌肉注射温生理盐水1 ml),术后禁食不禁水,同时做好小鼠保温措施。
所有动物20小时后再次麻醉,内眦静脉取血0.2ml左右,离心机(1000× g, 4℃)离心15分钟后留取上清测定炎症因子水平;打开腹腔,观察小鼠腹腔感染情况,游离小肠,距离回盲部2~5 cm处留取部分小肠,4℃生理盐水冲洗小肠,去除内容物,一部分保存于4%多聚甲醛中待HE染色,剩余小肠组织保存于−80℃冰箱中备用。
2.3. 检测指标
2.3.1. 观察各组小鼠术后20小时后生存情况
观察各组小鼠术后20小时的生存状态、应激反应、神经系统功能的改变,记录各组小鼠的病死率,实验术后20 h内死亡的小鼠不纳入最终观察对象,及时补齐各组小鼠的样本量。术后20 h再次麻醉后开腹,观察小鼠腹腔感染严重程度、腹腔积液性质以及肠道坏死等情况。
2.3.2. 观察各组小鼠术后72小时死亡情况并绘制生存曲线
C57BL/6J雄性健康小鼠64只以同样的方式随机分为4组,每组16只,具体处理措施同1.2所述。动态观察(术后4 h、8 h、12 h、24 h、36 h、48 h、72 h)各组小鼠的生存情况,记录各个观察时间点小鼠的死亡情况(过程中不再补全各组小鼠),术后72小时为观察终点,最后采用过量戊巴比妥钠腹腔注射处死小鼠。
2.3.3. 小肠病理学变化观察
小肠标本离体后,用4%多聚甲醛固定48 h,然后用不同浓度(70%~100%)乙醇溶液脱水40 min。石蜡包埋后保存,供后续实验使用。蜡块被切成4毫米的切片,放置在二甲苯、无水乙醇和酒精中依次脱蜡。苏木精–伊红(HE)染色肺部标本。苏木精染色5 min,用水冲洗,恢复蓝色后,用伊红染色1~3 min。组织学照片采用光学显微镜观察(德国徕卡)。
2.3.4. 炎症因子水平测定
小鼠内眦静脉取血后,离心机1000× g离心15分钟,吸取血清样本分装保存于−20℃冰箱待检。采用酶联免疫吸附法(ELISA)法检测小鼠血清炎症因子表达水平。步骤严格按照小鼠肿瘤坏死因子α (TNF-α)试剂盒、小鼠白介素6 (IL-6)试剂盒(均购自杭州联科生物)说明书进行操作。
2.3.5. 肠道紧密连接蛋白及铁死亡相关蛋白的测定
用RIPA缓冲液从小肠组织(离体后保存于−80℃冰箱)提取裂解液,用BCA蛋白测定试剂盒(MA0082-2, meilunbio,中国)测定蛋白含量。每组35 mg的蛋白样品经10% SDS-PAGE凝胶电泳后转移至PVDF膜上。在用脱脂奶粉(5%)阻断后,这些印迹与一抗在4℃孵育一夜。本研究中使用的蛋白抗体如下:GPX4 (1:1000,BM5231,博士德生物中国武汉),ACSL4 (1:1000,R24265,正能生物中国成都),SLC7A11/xCT (1:1000,382036,正能生物中国成都),Occlduin (1:1000,BM4832,博士德生物中国武汉),ZO-1 (1:1000,PB9234,博士德生物中国武汉),β-actin (1:1000,BA2305,博士德生物中国武汉)。最后,将蛋白与二抗(1:5000,BA1054,博士德生物中国武汉)在室温下孵育1小时,用ECL试剂盒(meilunbio)检测条带,用ImageJ软件检测条带。
2.4. 数据处理
本研究中所有定量数据均以均数±标准差表示。GraphPad Prism 8和SPSS 21软件分别进行绘图和分析。采用单因素方差分析(ANOVA,三个或更多组)。当只有两组进行比较时,采用非配对t检验。P < 0.05为差异有统计学意义。
3. 结果
3.1. 各组小鼠生存情况
CLP及CLP + D3T组小鼠术后12小时开始出现精神萎靡,嗜睡,蜷缩,竖毛,少动,拒食或少食,眼角出现分泌物等症状,上述症状呈进行性加重趋势。而Sham组及D3T组下小鼠术后未出现明显脓毒症症状。在术后72小时生存率观察实验中,Sham及Sham + D3T组小鼠无死亡。CLP组小鼠死亡12只,存活率为33%,而CLP + D3T组小鼠死亡5只,存活率较CLP组明显改善,为68% (P < 0.05) (见图1)。术后20小时CLP组大鼠可观察到腹部膨隆、腹壁紧张,开腹后可闻及恶臭,见大量褐色也液体流出,结扎盲肠远端坏死发黑,与腹腔肠管网膜广泛粘连并局部包裹成团,形成少部分可见与腹壁粘连,近端回肠充血水肿,部分结肠可见扩张,D3T + CLP组小鼠腹腔感染、肠道水肿坏死情况较CLP组明显改善。
3.2. 各组小鼠小肠组织病理学变化
CLP术后20小时,Sham及Sham + D3T组小鼠小肠组织结构正常,显微镜下(200×)可见小肠上皮细胞正常排列,无水肿及炎症细胞浸润,绒毛完整丰富。CLP组小肠上皮紧密连接消失,局部炎症细胞浸润,小肠绒毛水肿,可见较多断裂,绒毛完整性消失,小肠Chiu’s评分显著升高(P < 0.01)。CLP + D3T组与CLP组比较,小肠上皮较为完整,绒毛结构尚可辨别,绒毛轻度水肿,部分断裂,较CLP组有明显改善,Chiu’s评分较CLP组相比明显降低(P < 0.0001) (见图2)。
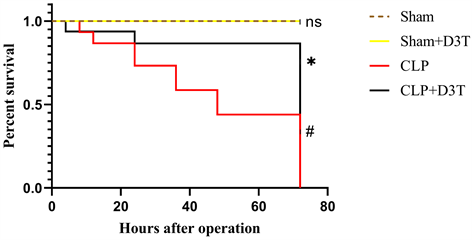 #vs. Sham p < 0.05, *vs. CLP p < 0.05, n = 16.
#vs. Sham p < 0.05, *vs. CLP p < 0.05, n = 16.
Figure 1. 72-hour survival rate of mice in each group
图1. 小鼠72小时生存率

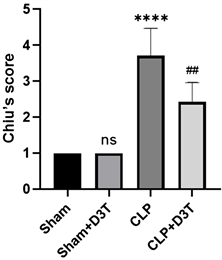 ##vs. Sham p < 0.01, ****vs. CLP p < 0.0001, n = 6.
##vs. Sham p < 0.01, ****vs. CLP p < 0.0001, n = 6.
Figure 2. Histopathological changes (200×) and Chiu’s score of small intestine in mice of each group
图2. 各组小鼠小肠组织病理学变化(200×)及小鼠小肠Chiu’s评分
3.3. 各组小鼠血清炎症水平的测定
采用酶联免疫吸附法测定小鼠血清TNF-α及IL-6的表达水平。Sham组与Sham + D3T组相比,血清炎症因子水平变化无统计学意义。与Sham组相比,CLP组血清TNF-α及IL-6水平明显升高(P < 0.01),而CLP + D3T组较CLP组相比,血清TNF-α及IL-6水平有所下降(P < 0.05) (见图3)。
3.4. 各组小鼠小肠肠道紧密连接蛋白的表达情况
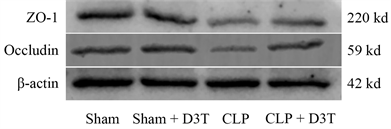
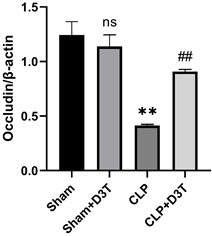
与Sham组相比,CLP组肠道紧密连接蛋白Occludin、ZO-1表达水平明显降低(P < 0.01)。CLP + D3T组较CLP组相比,肠道紧密连接蛋白Occludin、ZO-1表达水平升高(P < 0.01) (见图4)。
 (a)
(a)
 (b)##vs. Sham p < 0.01, ####vs. Sham p < 0.01, *vs. CLP p < 0.05, **vs. CLP p < 0.01, n = 3.
(b)##vs. Sham p < 0.01, ####vs. Sham p < 0.01, *vs. CLP p < 0.05, **vs. CLP p < 0.01, n = 3.
Figure 3. The expression level of serum inflammatory factors in mice of each group by ELISA
图3. ELISA法检测各组小鼠血清炎症因子表达水平
 (a)
(a)
 (b)
(b)
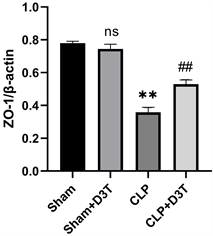 (c)**vs. Sham p < 0.01, ##vs. CLP p < 0.01, n = 3.
(c)**vs. Sham p < 0.01, ##vs. CLP p < 0.01, n = 3.
Figure 4. The expression of ZO-1 and Occludin protein of small intestine in mice of each group by Western Blot
图4. Western Blot检测各组小鼠小肠ZO-1、Occludin蛋白表达水平变化
3.5. 各组小鼠小肠肠道铁死亡相关蛋白的表达情况
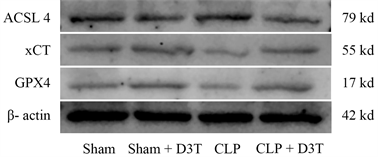
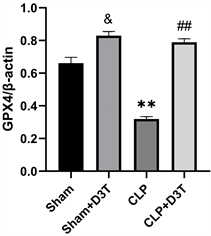
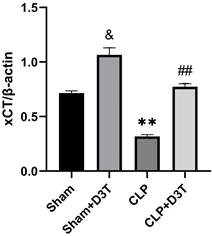
CLP组GPX4和SLC7A11/xCT蛋白水平明显下降(P < 0.01),ACSL4蛋白水平异常升高(P < 0.01)。而CLP + D3T组较CLP组相比,GPX4及SLC7A11/xCT的表达水平有所升高(P < 0.01),ACSL4表达水平下降(P < 0.01) (见图5)。
 (a)
(a)
 (b)
(b)
 (c)
(c)
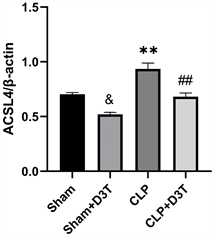 (d)**vs. Sham p < 0.01, ##vs. CLP p < 0.01, &vs. Sham p < 0.05, n = 3.
(d)**vs. Sham p < 0.01, ##vs. CLP p < 0.01, &vs. Sham p < 0.05, n = 3.
Figure 5. The expression of GPX4, xCT and ACSL4 protein of small intestine in mice of each group by Western Blot
图5. Western Blot检测各组小鼠小肠组织GPX4、xCT及ACSL4蛋白表达水平变化
4. 讨论
脓毒症是感染引起的全身炎症反应综合征,进一步发展可导致全身多器官功能障碍,甚至全身多脏器功能衰竭,病情进展迅速,预后差,病死率极高。目前脓毒症领域相关的研究已经取得了一定性的进展,但脓毒症的病死率仍处于较高水平 [30] 。近些年来肠源性脓毒症受到了越来越多的关注,肠道作为人体内最大的细菌及毒素储存库,病理生理情况下,肠道黏膜屏障受损,肠道细菌及毒素移位诱发内源性感染,感染进一步加重肠粘膜屏障损伤,形成恶性循环 [31] 。本实验通过盲肠结扎穿刺法建立小鼠脓毒症模型,模拟病理情况下的肠穿孔、肠坏死引起的腹腔感染。结合本实验,CLP造模(结扎50%盲肠) 6小时后,小鼠不同程度地出现脓毒症中毒症状,出现精神萎靡,嗜睡,蜷缩,竖毛,少动等症状,术后12小时上述症状进行性加重,部分小鼠出现死亡,这符合既往脓毒症体外模型的研究结果 [32] 。在我们的实验中,CLP及CLP + D3T组小鼠在术后20小时开腹时可闻及恶臭味,小鼠腹腔中可见不同程度浑浊液体渗出,结扎盲肠远端坏死,部分小肠、结肠出现充血水肿及充气征。CLP + D3T组小鼠腹腔感染情况较CLP组相比整体有所减轻。
在哺乳动物细胞和组织中,铁死亡被报道参与了神经变性、急性肾功能衰竭和心肌病等疾病 [33] 。近期研究还发现铁死亡还与细菌感染引起的宿主细胞、组织损伤有关 [34] 。Jin Wang等人发现TMEM43通过抑制铁死亡抑制小鼠脓毒症诱导的心脏损伤 [35] 。谷胱甘肽过氧化物酶4 (GPX4)是铁死亡的核心调控子,它是含硒GPX家族的第四位成员,其催化活性及抗氧化活性,可以削弱脂质过氧化物毒性,维持膜脂质双分子层稳态,进而抑制铁死亡的发生 [36] 。谷胱甘肽(GSH)的生物合成和GPX4的正常功能是控制铁死亡的关键,抑制GPX4可提高细胞对铁死亡的敏感性 [20] [37] 。细胞铁超载会产生特定的磷脂氢过氧化物,通过系统Xc/GSH/GPX4轴内源性抵消。胱氨酸被系统Xc吸收后,会被还原成半胱氨酸合成GSH,GSH维持了GPX4的活性 [38] [39] 。如果这一过程中的任何一步被打断,GPX4的活性就会下降,导致细胞内过氧化物的积累,从而导致铁死亡。有研究表明GPX4敲除处理可以诱导小鼠发生病理性铁死亡,加用铁死亡调节剂利普司他汀-1,可以有效的抑制细胞铁死亡,提供实质性的保护作用 [17] 。3H-1,2-二硫醇-3-硫酮(D3T)是二硫代硫酮中的一员,被报道在体内/体外可以诱导抗氧化组分的高表达 [27] 。在本实验中,实验开始前30分钟,CLP + D3T及Sham + D3T组小鼠腹腔预注射一定剂量的D3T,通过Western Blotting发现,CLP组小鼠小肠组织中GPX4水平明显下降,而CLP + D3T组在术前给予D3T可以显著提高小鼠小肠组织中的GPX4表达水平,并长时间维持较高水平,可能在小鼠脓毒症所致的肠屏障损伤中起对抗脂质过氧化毒性的重要作用。为了进一步验证铁死亡是否参与了脓毒症所致的肠屏障损伤的病理过程。我们进一步应用Western Blotting检测了各组小鼠小肠组织的铁死亡相关蛋白ACSL4及XCT的表达变化。
酰基辅酶A合成酶长链家族成员4 (ACSL4)是脂质过氧化所需的一种脂质代谢酶,介导了不饱和脂肪酸(PUFA)的活化,后续氧化过程中生成诸多脂质过氧化中间产物,并通过溶血磷脂酰胆碱酰基转移酶3 (LPCAT3)的转运在生物膜中逐渐积累,改变了生物膜结构的,使得细胞更易发生铁死亡 [40] 。近期有研究表明ACSL4还积极参与正反馈循环以执行铁死亡:PKCβII磷酸化ACSL4以放大脂质过氧化以诱导铁死亡 [41] 。此外Jiao Wu等人还发现E-钙粘蛋白通过Merlin-Hippo-YAP通路调节ACSL4的表达以响应细胞间接触来调控细胞对铁死亡的敏感性 [42] 。因此,ACSL4可能更类似于细胞凋亡的刽子手Caspase-3,它是细胞死亡的执行者,而不是管家蛋白。我们通过Western Blotting发现CLP组小鼠小肠组织ACSL4异常高表达,而CLP + D3T组中我们观察到术前D3T预处理下调了ACSL4的表达,抑制铁死亡从而减轻了小鼠脓毒症所致的肠道损伤。
溶质载体家族成员SLC7A11 (又名xCT)是溶质转运第7家族的第11个成员,属于胱氨酸/谷氨酸逆向转运蛋白,是胱氨酸/谷氨酸转运体系统(Xc-系统)的功能亚基,主要参与胱氨酸的胞外摄取和谷氨酸释放,促进谷胱甘肽(GSH)的合成,保护细胞免受氧化应激损伤,从而阻止细胞因脂质过氧化而导致的细胞死亡。既往大量研究揭示了xCT是铁死亡的最关键的上游调节因子之一,其可以驱动铁死亡抗性,在肿瘤等疾病中发挥调控作用 [43] 。Zhen Chen等人发现TMEM43可以通过抑制p53,上调GPX4和SLC7A11表达,从而抑制小鼠铁死亡来预防脓毒症引起的心脏损伤 [35] 。SLC7A11在癌症及炎症相关疾病中,作为铁死亡重要的上游靶标,发挥着重要作用。本实验中Western Blotting提示在CLP组小鼠中SLC7A11表达异常降低,在CLP + D3T组中术前给予D3T预处理上调了脓毒症小鼠体内SLC7A11的表达,通过启动铁死亡抗性,改善了小鼠脓毒症所致的肠道损伤。有趣的是,Sham + D3T组小鼠小肠组织中SLC7A11表达水平也明显升高,这可能与D3T具有提升抗氧化剂水平的特性有关 [27] 。就此我们得出初步结论,D3T或通过靶向上调GPX4表达,进一步上调SLC7A11及下调ACSL4表达水平,抑制了铁死亡,减轻了小鼠脓毒症所致的肠道损伤。接下来,我们为进一步探索D3T对脓毒症小鼠肠屏障的具体保护作用,我们测定了小鼠血上清的炎症水平变化、小肠组织肠道紧密连接蛋白表达水平以及通过HE染色评估小鼠肠道损伤情况。
我们通过酶联免疫吸附法测定了小鼠血清炎症水平情况,发现CLP组小鼠血清TNF-α及IL-6水平明显升高,而CLP + D3T组结果提示D3T预处理改善了脓毒症小鼠血清炎症水平,但仍明显高于假手术组,说明D3T预处理能够一定程度上改善脓毒症小鼠的炎症水平。后续我们通过Western Blotting发现CLP组小鼠肠道紧密连接蛋白ZO-1及Occludin表达水平明显下降,而在CLP + D3T组中我们观察到小鼠肠道紧密连接蛋白的表达水平较CLP组相比有所升高,表明D3T预处理减轻了小鼠脓毒症所致的肠屏障损伤。为了更直观的观察各组小鼠肠道损伤情况,我们对各组小鼠的小肠组织进行了HE染色。HE结果提示Sham及Sham + D3T组小肠组织结构正常,而CLP组小鼠小肠组织上皮紧密连接消失,小肠绒毛水肿,可见断裂,局部炎症细胞浸润,伴有出血。较CLP组相比,CLP + D3T组小肠组织上皮尚完整,小肠绒毛结构尚可辨别,轻度水肿,可见少量断裂,炎症细胞浸润及出血情况有所减轻,上述病理改变与小鼠炎症水平及肠道屏障蛋白表达情况相照应,说明D3T预处理可以减轻脓毒症小鼠的炎症反应,改善小鼠脓毒症所致的肠屏障损伤。
5. 结论
综上所述,3H-1,2-二硫醇-3-硫酮可能靶向GPX4,通过上调其表达水平,发挥抗氧化特性,减轻了脓毒症小鼠的全身炎症水平,改善了小鼠脓毒症所致的肠道屏障损伤。本研究具有一定局限性,3H-1,2-二硫醇-3-硫酮是GPX4的间接激动剂,不同于靶向GPX4的铁死亡抑制剂及相关基因位点的敲除,且本研究缺乏体外实验,进一步完善可以更加深入准确阐明铁死亡参与调节小鼠脓毒症所致的肠屏障损伤的机制,为临床脓毒症的诊治提供新思路。
文章引用
黄 海,郑 磊,高 昭,宋 蕾,郭沛雨,高 鹏. 3H-1,2-二硫醇-3-硫酮靶向GPX4调节铁死亡参与小鼠脓毒症所致的肠屏障损伤
3H-1,2-Dithiol-3-Thione Targeting GPX4 Me-diates Ferroptosis and Participates Sepsis-Induced Intestinal Barrier Injury in Mice[J]. 临床医学进展, 2023, 13(04): 6000-6011. https://doi.org/10.12677/ACM.2023.134847
参考文献
- 1. Rudd, K.E., et al. (2020) Global, Regional, and National Sepsis Incidence and Mortality, 1990-2017: Analysis for the Global Burden of Disease Study. Lancet (London, England), 395, 200-211. https://doi.org/10.1016/S0140-6736(19)32989-7
- 2. Fleischmann-Struzek, C., et al. (2020) Incidence and Mortal-ity of Hospital- and ICU-Treated Sepsis: Results from an Updated and Expanded Systematic Review and Meta-Analysis. Intensive Care Medicine, 46, 1552-1562. https://doi.org/10.1007/s00134-020-06151-x
- 3. Sheth, M., Benedum, C.M., Celi, L.A., Mark, R.G. and Markuzon, N. (2019) The Association between Autoimmune Disease and 30-Day Mortality among Sepsis ICU Patients: A Cohort Study. Critical Care (London, England), 23, 93. https://doi.org/10.1186/s13054-019-2357-1
- 4. Rajendrakumar, S.K., et al. (2018) Peroxidase-Mimicking Nano-assembly Mitigates Lipopolysaccharide-Induced Endotoxemia and Cognitive Damage in the Brain by Impeding Inflam-matory Signaling in Macrophages. Nano Letters, 18, 6417-6426. https://doi.org/10.1021/acs.nanolett.8b02785
- 5. Zhang, X., Liu, H., Hashimoto, K., Yuan, S. and Zhang, J. (2022) The Gut-Liver Axis in Sepsis: Interaction Mechanisms and Therapeutic Potential. Critical Care (London, England), 26, 213. https://doi.org/10.1186/s13054-022-04090-1
- 6. Evans, T. (2018) Diagnosis and Management of Sepsis. Clinical Medicine (London, England), 18, 146-149. https://doi.org/10.7861/clinmedicine.18-2-146
- 7. Napolitano, L.M. (2018) Sepsis 2018: Definitions and Guide-line Changes. Surgical Infections, 19, 117-125. https://doi.org/10.1089/sur.2017.278
- 8. Gustafsson, J.K. and Johansson, M.E.V. (2022) The Role of Goblet Cells and Mucus in Intestinal Homeostasis. Nature Reviews. Gastroenterology & Hepatology, 19, 785-803. https://doi.org/10.1038/s41575-022-00675-x
- 9. Beyaert, R. and Libert, C. (2018) How Good Roommates Can Protect against Microbial Sepsis. Cell Host & Microbe, 23, 283-285. https://doi.org/10.1016/j.chom.2018.02.007
- 10. 李青, 杨明, 田雪. 脓毒症病人肠黏膜屏障功能损伤与病情严重程度和预后的相关性研究[J]. 安徽医药, 2022, 26(10): 2072-2076.
- 11. Zhu, C.L., et al. (2022) Dysregulation of Neutrophil Death in Sepsis. Frontiers in Immunology, 13, Article ID: 963955. https://doi.org/10.3389/fimmu.2022.963955
- 12. Weis, S., et al. (2017) Metabolic Adaptation Establishes Disease Tolerance to Sepsis. Cell, 169, 1263-1275.e1214. https://doi.org/10.1016/j.cell.2017.05.031
- 13. Dixon, S.J., et al. (2012) Ferroptosis: An Iron-Dependent Form of Nonapoptotic Cell Death. Cell, 149, 1060-1072. https://doi.org/10.1016/j.cell.2012.03.042
- 14. Xie, Y., et al. (2016) Ferroptosis: Process and Function. Cell Death and Differentiation, 23, 369-379. https://doi.org/10.1038/cdd.2015.158
- 15. Yagoda, N., et al. (2007) RAS-RAF-MEK-Dependent Oxidative Cell Death Involving Voltage-Dependent Anion Channels. Nature, 447, 864-868. https://doi.org/10.1038/nature05859
- 16. Yang, W.S. and Stockwell, B.R. (2008) Synthetic Lethal Screening Iden-tifies Compounds Activating Iron-Dependent, Nonapoptotic Cell Death in Oncogenic-RAS-Harboring Cancer Cells. Chemistry & Biology, 15, 234-245. https://doi.org/10.1016/j.chembiol.2008.02.010
- 17. Friedmann Angeli, J.P., et al. (2014) Inactivation of the Fer-roptosis Regulator Gpx4 Triggers Acute Renal Failure in Mice. Nature Cell Biology, 16, 1180-1191. https://doi.org/10.1038/ncb3064
- 18. Wang, Y., et al. (2022) AUF1 Protects against Ferroptosis to Alleviate Sep-sis-Induced Acute Lung Injury by Regulating NRF2 and ATF3. Cellular and Molecular Life Sciences: CMLS, 79, 228. https://doi.org/10.1007/s00018-022-04248-8
- 19. Liu, W., Xu, C., Zou, Z., Weng, Q. and Xiao, Y. (2022) Sestrin2 Suppresses Ferroptosis to Alleviate Septic Intestinal Inflammation and Barrier Dysfunction. Immunopharmacology and Immunotoxicology, 45, 123-132. https://doi.org/10.1080/08923973.2021.1988103
- 20. Yang, W.S., et al. (2014) Regulation of Ferroptotic Cancer Cell Death by GPX4. Cell, 156, 317-331. https://doi.org/10.1016/j.cell.2013.12.010
- 21. Chen, X., Kang, R., Kroemer, G. and Tang, D. (2021) Broadening Horizons: The Role of Ferroptosis in Cancer. Nature Reviews. Clinical Oncology, 18, 280-296. https://doi.org/10.1038/s41571-020-00462-0
- 22. Wu, K.C., Cui, J.Y. and Klaassen, C.D. (2011) Beneficial Role of Nrf2 in Regulating NADPH Generation and Consumption. Toxicological Science: An Official Journal of the Society of Toxicology, 123, 590-600. https://doi.org/10.1093/toxsci/kfr183
- 23. Wang, J., et al. (2022) Irisin Protects against Sepsis-Associated Enceph-alopathy by Suppressing Ferroptosis via Activation of the Nrf2/GPX4 Signal Axis. Free Radical Biology and Medicine, 187, 171-184. https://doi.org/10.1016/j.freeradbiomed.2022.05.023
- 24. Kang, R., et al. (2018) Lipid Peroxidation Drives Gasdermin D-Mediated Pyroptosis in Lethal Polymicrobial Sepsis. Cell Host & Microbe, 24, 97-108.e104. https://doi.org/10.1016/j.chom.2018.05.009
- 25. Kwak, M.K., et al. (2001) Role of Phase 2 Enzyme Induction in Chemoprotection by Dithiolethiones. Mutation Research, 480-481, 305-315. https://doi.org/10.1016/S0027-5107(01)00190-7
- 26. Kwak, M.K., et al. (2003) Modulation of Gene Expression by Cancer Chemopreventive Dithiolethiones through the Keap1-Nrf2 Pathway. Identification of Novel Gene Clusters for Cell Survival. The Journal of Biological Chemistry, 278, 8135-8145. https://doi.org/10.1074/jbc.M211898200
- 27. Zhu, H., Bui, A., Santo, A. and Li, Y.R. (2022) 3H-1,2-dithiole-3-thione Suppresses LPS-Induced Proinflammatory Responses in Macrophages: Potential Involvement of Antioxidant Induction, NF-κB, and Nrf2. Molecular and Cellular Biochemistry, 477, 1499-1506. https://doi.org/10.1007/s11010-021-04331-x
- 28. Wichterman, K.A., Baue, A.E. and Chaudry, I.H. (1980) Sepsis and Septic Shock—A Review of Laboratory Models and a Proposal. The Journal of Surgical Research, 29, 189-201. https://doi.org/10.1016/0022-4804(80)90037-2
- 29. Kuo, P.C., et al. (2017) 3H-1,2-Dithiole-3-Thione as a Novel Therapeutic Agent for the Treatment of Ischemic Stroke through Nrf2 Defense Pathway. Brain, Behavior, and Immunity, 62, 180-192. https://doi.org/10.1016/j.bbi.2017.01.018
- 30. Perner, A., et al. (2016) Sepsis: Frontiers in Diagnosis, Resuscitation and Antibiotic Therapy. Intensive Care Medicine, 42, 1958-1969. https://doi.org/10.1007/s00134-016-4577-z
- 31. Mittal, R. & Coopersmith, C.M. (2014) Redefining the Gut as the Motor of Critical Illness. Trends in Molecular Medicine, 20, 214-223. https://doi.org/10.1016/j.molmed.2013.08.004
- 32. 李晗, 田李均, 韩旭东. 脓毒症体内外模型研究进展[J]. 中国感染与化疗杂志, 2020, 20(1): 102-106.
- 33. Li, J., et al. (2020) Ferroptosis: Past, Present and Future. Cell Death & Disease, 11, 88. https://doi.org/10.1038/s41419-020-2298-2
- 34. Gao, J., et al. (2022) When Ferroptosis Meets Pathogenic Infec-tions. Trends in Microbiology. https://doi.org/10.1016/j.tim.2022.11.006
- 35. Chen, Z., et al. (2022) TMEM43 Protects against Sepsis-Induced Cardiac Injury via Inhibiting Ferroptosis in Mice. Cells, 11, 2992. https://doi.org/10.3390/cells11192992
- 36. Forcina, G.C. and Dixon, S.J. (2019) GPX4 at the Crossroads of Lipid Homeostasis and Ferroptosis. Proteomics, 19, e1800311. https://doi.org/10.1002/pmic.201800311
- 37. Ingold, I., et al. (2018) Selenium Utilization by GPX4 Is Required to Prevent Hydroperoxide-Induced Ferroptosis. Cell, 172, 409-422.e421. https://doi.org/10.1016/j.cell.2017.11.048
- 38. Badgley, M.A., et al. (2020) Cysteine Depletion In-duces Pancreatic Tumor Ferroptosis in Mice. Science (New York, N.Y.), 368, 85-89. https://doi.org/10.1126/science.aaw9872
- 39. Chen, X., Yu, C., Kang, R., Kroemer, G. and Tang, D. (2021) Cellu-lar Degradation Systems in Ferroptosis. Cell Death and Differentiation, 28, 1135-1148. https://doi.org/10.1038/s41418-020-00728-1
- 40. Doll, S., et al. (2017) ACSL4 Dictates Ferroptosis Sensitivity by Shaping Cellular Lipid Composition. Nature Chemical Biology, 13, 91-98. https://doi.org/10.1038/nchembio.2239
- 41. Zhang, H.L., et al. (2022) PKCβII Phosphorylates ACSL4 to Amplify Lipid Peroxidation to Induce Ferroptosis. Nature Cell Biology, 24, 88-98. https://doi.org/10.1038/s41556-021-00818-3
- 42. Wu, J., et al. (2019) Intercellular Interaction Dictates Cancer Cell Ferroptosis via NF2-YAP Signalling. Nature, 572, 402-406. https://doi.org/10.1038/s41586-019-1426-6
- 43. He, J., Wang, X., Chen, K., Zhang, M. and Wang, J. (2022) The Amino Acid Transporter SLC7A11-Mediated Crosstalk Im-plicated in Cancer Therapy and the Tumor Microenvironment. Biochemical Pharmacology, 205, Article ID: 115241. https://doi.org/10.1016/j.bcp.2022.115241
NOTES
*第一作者。
#通讯作者Email: 18661807323@163.com