Material Sciences
Vol.08 No.04(2018), Article ID:24578,9
pages
10.12677/MS.2018.84039
Preparation and Evaluation of Biocompatibility of Acellular Dermal Matrix of Basa Fish (Pangasius bocourti)
Yuekun Wang, Hu Hou, Kai Zhang, Han Liu, Leilei Si, Bafang Li*
College of Food Science and Engineering, Ocean University of China, Qingdao Shandong

Received: Mar. 28th, 2018; accepted: Apr. 19th, 2018; published: Apr. 26th, 2018

ABSTRACT
The low-immunogenic GA-BADM was derived from Basa fish (Pangasius bocourti) and prepared by declorization, degreasing, decellularization and cross-linking. The microstructure of GA-BADM was evaluated by SEM. The biocompatibility of GA-BADM was investigated by blood compatibility, systemic acute toxicity, hypodermic implantation and cell compatibility according to the standards of Biological Evaluation of Medical Devices (GB/T 16886). The results showed that the GA-BADM was made up of double layers with one dense layer and another loose layer. The hemolysis rate of GA-BADM was far less than 5%, which implied high safety performance. After injection of GA-BADM extract, the weight of rats was increased, which meant no acute systemic toxicity. The samples with good histocompatibility, were gradually degraded after implanting in vivo. The samples had no cytotoxicity and could promote cell proliferation, which proved good cell compatibility. This study indicated that the GA-BADM materials had good biocompatibility, which provided a theoretical basis and technical guidance for the study of the acellular dermal matrix of aquatic organisms.
Keywords:Basa Fish Skin, Acellular Dermal Matrix, Biocompatibility, Biomedical Materials
巴沙鱼皮脱细胞真皮基质的制备及 生物相容性评价
王月坤,侯 虎,张 凯,刘 晗,司磊磊,李八方*
中国海洋大学食品科学与工程学院,山东 青岛

收稿日期:2018年3月28日;录用日期:2018年4月19日;发布日期:2018年4月26日

摘 要
本研究以巴沙鱼皮为原料,通过脱色、脱脂、脱细胞和交联的方法,制备得到低免疫原性的巴沙鱼皮脱细胞真皮基质(GA-BADM)。通过扫描电镜探究GA-BADM的结构,通过GB/T 16886 医疗器械生物学评价标准规定的血液相容性试验、全身急性毒性试验、皮下植入试验以及细胞相容性试验探究GA-BADM的生物相容性。结果表明:样品呈双层膜结构,一侧疏松多孔,一侧致密光滑;材料溶血率远小于5%,安全性能高;GA-BADM浸提液注射后,大鼠体重呈现增加的现象,无全身急性毒性;材料植入体内,逐渐被降解吸收,具有良好的组织相容性;材料没有细胞毒性,且可以促进细胞增殖生长,具有良好的细胞相容性。本研究证实了GA-BADM材料具有良好的生物相容性,为开展水生生物脱细胞真皮基质的研究提供了理论基础以及技术指导。
关键词 :巴沙鱼皮,脱细胞真皮基质,生物相容性,生物医用材料

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
脱细胞真皮基质是一种由动物或人类皮肤制成的无细胞组织薄片。它去除了皮肤的全层表皮及真皮层中的全部细胞成分,保留了真皮的胶原成分和组织基本结构,同时也保留了基底膜成分,是一种较为理想的真皮替代物 [1] 。目前,脱细胞真皮基质的主要来源是猪皮和牛皮,而由于口蹄疫、疯牛病等疾病的传播和宗教信仰的限制,从水生生物中寻找替代来源变得越来越重要 [2] 。
巴沙鱼(Pangasius bocourti)是东南亚一带的重要经济鱼类,年产量100万吨以上,其加工食品远销世界150多个国家和地区。研究已经证实巴沙鱼皮可以被提取利用,具有制备生物材料的潜能。由于水生生物脱细胞真皮基质具有机械性能较差,热稳定性差,抗降解能力弱等缺点,这极大地限制了其在医用材料上的进一步发展 [3] [4] 。然而,随着改性技术的发展,水生生物脱细胞真皮基质的性能可以通过交联提升。戊二醛是一种传统交联剂,被广泛用于生物材料改性。
生物材料在临床使用过程中,需要与人的皮肤、血液等接触,有些医用材料甚至会长期的埋植于人体内,对临床使用阶段的医用材料必须要有严格的生物安全要求。因此,生物相容性是生物材料研究中需要考虑的首要问题 [5] 。根据医疗器械生物学评价GB/T 16886系列标准,进行生物材料的生物功能性试验,可以反映生物材料在体内外对实验对象的影响 [6] 。通过评价生物材料的生物相容性,有助于生物材料的研发和改进,为其临床应用提供可靠的参考依据。
近年来,脱细胞真皮基质膜成为研究的热点,但用鱼皮制备脱细胞真皮基质膜迄今未见有过报道。本研究以巴沙鱼皮为原料制备脱细胞真皮基质,通过戊二醛交联提升其理化性能,并根据GB/T 16886系列标准的方法对其生物相容性进行研究,为开展水生生物脱细胞真皮基质的研究提供理论基础。
2. 材料与方法
2.1. 材料与仪器
2.1.1. 实验材料
巴沙鱼,青岛市市北区沃尔玛超市;SPF级雄性Wista大鼠,青岛鲁抗实验动物技术有限公司;戊二醛,天津市瑞金特化学品有限公司;L929成纤维细胞,MTT (噻唑蓝),CCK-8细胞计数试剂盒,上海信裕生物工程有限公司;其它试剂均为分析纯。
2.1.2. 实验仪器
FD-1A-50真空冷冻干燥机,西安太康生物科技有限公司;JSM-840扫描电子显微镜,日本JEOL公司;HHS21-4电热恒温水浴锅,北京长安科学仪器厂;电子精密天平,奥豪斯国际贸易(上海)有限公司;722s可见分光光度计,上海精密科学仪器有限公司;Power Wave XS2酶标仪,基因有限公司;AE2000倒置显微镜,广州市明美光电技术有限公司。
2.2. 实验方法
2.2.1. BADM的制备
取新鲜鱼皮刮去残肉,用自来水清洗干净并沥干。将鱼皮用0.1% (w/v)新洁尔灭溶液清洗消毒,然后浸泡在1% (w/v)的NaOH溶液中24 h,每6 h换液一次,脱去鱼皮中的脂肪。将脱脂后鱼皮浸泡在1% (w/v)的高锰酸钾溶液脱色处理30 min,然后将鱼皮浸泡在2% (w/v)的亚硫酸氢钠溶液脱色处理1 h,重复循环至鱼皮褐色褪去。将鱼皮置于4% (w/v)的NaOH溶液内消蚀处理18 h,间歇超声。经强碱消蚀处理的鱼皮清洗干净,置于冰箱梯度冻融,第一次冻结温度为−20℃,第二次冻结温度为−40℃,第三次冻结温度为−80℃,解冻温度均为常温,冻融间隔时间为4 h。将脱细胞后的鱼皮置于0.25% (w/v)戊二醛溶液中,37℃持续搅拌10 min [7] 。最后在冻干机中进行冻干,得到改性巴沙鱼皮脱细胞真皮基质(GA-BADM)。
2.2.2. SEM观察
取将冻干的GA-BADM样品在真空下喷金,用SEM观察其表面及断面,加速电压15 kV [8] 。
2.2.3. 血液相容性
参照国标GB/T16886.4-2011医疗器械生物学评价中与血液接触安全要求,采用腹主动脉取血法对SD大鼠取新鲜抗凝血。向4 mL新鲜抗凝血中加入5 mL的生理盐水稀释待用。GA-BADM材料裁剪成0.5 cm × 2.5 cm的小条,称样3份,每份5 g。每份材料加入50 mL生理盐水浸泡24 h,倒去浸泡液,加入10 mL生理盐水,超纯水为阳性对照,生理盐水为阴性对照。各组置于37℃下恒温水浴30 min,然后向各种分别加入稀释后的抗凝血0.2 mL,混和均匀,在37℃下水浴1 h。然后各组在2000 rpm条件下离心5 min后得上清液,用722s型可见分光光度计于545 nm波长处测定各组的吸光度 [9] 。溶血率公式为:溶血率(%) = (样品吸光度 − 阴性对照吸光度)/(阳性对照吸光度 − 阴性对照吸光度) × 100%。
2.2.4. 全身急性毒性
参照国标GB/T 16886.11医疗器械生物学评价全身急性毒性要求,我们对GA-BADM样品进行全身急性毒性实验。以GA-BADM浸提液为样品组,生理盐水为阴性对照,苯酚为阳性对照,并通过腹腔注射上述液体。大鼠单笼单只饲养,饲料按照5 g/100g体重的固定量添加,注射24 h、48 h和72 h后观察并记录大鼠的反应状况和体重变化 [10] 。
2.2.5. 皮下植入
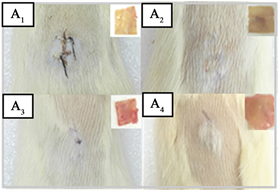
将雄性Wista大鼠麻醉后固定于鼠架台上,背部消毒,沿脊背中线开0.8~1.0 cm的切口。然后将复水软化的GA-BADM样品埋植其中,缝合包扎(图1)。于术后7、14、21、28天取出GA-BADM样品,固定在10% (v/v)福尔马林进行H & E染色 [11] [12] 。
2.2.6. 细胞毒性试验
L929成纤维细胞(1 × 104个/孔)接种于96孔板,常规培养24 h后换液。实验组加GA-BADM样品浸提液,空白对照组加培养液,阳性对照组加苯酚溶液。继续培养24 h后,每孔加入200 μL MTT溶液,培养4 h。随后,加入DMSO溶液(100 μL每孔)震荡10 min。最后,用酶标仪测定其在570 nm处的吸光度。根据上述方法,调整细胞密度为3 × 104个/孔,培养第三天用倒置显微镜观察细胞形态。
2.2.7. 细胞增殖试验
CCK-8细胞计数试剂盒用来评估细胞在GA-BADM样品上的增殖生长能力。L929成纤维细胞(1 × 105个/孔)接种于含GA-BADM样品和不含GA-BADM样品的48孔培养板中。分别于1,3,5天拿出一块培养板,加入CCK-8试剂培养3 h,用酶标仪测定其在450 nm处的吸光度。
2.3. 数据处理
运用Origin 9.0数据处理软件对实验结果进行处理,所有数据均为6次重复实验的平均值。采用SPSS 11.0 软件进行单因素方差分析(p < 0.05为差异显著)。
3. 结果与讨论
3.1. 外观形态特征及微观结构
制备的GA-BADM样品呈白色,表面平整,冻干前质地柔软,易折叠,冻干后质地较硬,不易折叠。扫描电镜结果表明,GA-BADM样品呈不规则的立体网状多孔结构(见图2(A)),孔径范围为10 μm到200 μm。CM Murphy [13] 等研究发现,多孔结构有利于细胞的黏附和增殖。图2(B)和图2(C)可以看出,GA-BADM样品具有双层结构,一面致密光滑,一面疏松多孔,有利于生物材料的应用 [14] 。

Figure 1. The implantation process of GA-BADM
图1. GA-BADM的植入图

Figure 2. SEM photographs of GA-BADM ((A): Section; (B): Rough surface; (C): Smooth surface)
图2. GA-BADM的电镜图((A):断面,(B):粗糙面,(C):光滑面)
3.2. 溶血率
溶血率是血液相容性的一项重要指标,可以验证GA-BADM与血细胞之间是否具有相容性 [15] 。GA-BADM与红细胞相接触后,红细胞破裂释放出的血红素物质可被分光光度计在545 nm处检测出,以此评定受试物的溶血程度,溶血率越高,表明受试物对血细胞的破坏程度越大。参照国标GB/T 16886.4,溶血率范围小于5%,则符合医用材料溶血率要求的;溶血率大于5%,则判定医用材料对红细胞有破坏作用 [16] 。GA-BADM的溶血率为1.76% ± 0.43%,远低于医用材料的国家标准,结果表明GA-BADM样品在国家生物材料的溶血性安全评价范围内。
3.3. 全身急性毒性
全身急性毒性实验可作为验证生物材料与动物个体是否具有生理相容性的一项重要指标 [17] 。表1所示为注射24 h、48 h和72 h后,不同组别大鼠平均体重变化情况。可以看出实验组与生理盐水组相比,没有出现体重明显减轻的情况,均出现体重增加的现象,注射后72 h内均未出现任何毒性症状。说明GA-BADM样品在国家生物材料全身急性毒性的安全评价范围内。
3.4. 皮下植入
本研究,GA-BADM样品植入后,术后大鼠背部伤口逐渐愈合,未见组织坏死(图3(A))。另外,GA-BADM植入物术后各周,均可看出原来形状。4周后,样品被含有血管的薄纤维状组织完全包裹,与大鼠结缔组织紧密结合。图3(B)为不同时间段植入物的显微照片,可以看出样品被大鼠成纤维细胞、巨噬细胞逐渐侵入。4周之后,GA-BADM样品中胶原纤维仍可见,未见淋巴细胞浸润带。Helenius G等 [18] 研究发现,4周后植入物没有引起任何异物反应,与大鼠结缔组织紧密结合,说明了植入物具有良好的组织相容性。本研究结果与Helenius G等人的研究结果相似,表明GA-BADM材料具有良好的组织相容性。
3.5. 细胞毒性
细胞毒性实验主要通过MTT比色法检测材料浸提液对L929成纤维细胞生长活性的影响,评价材料的生物毒性 [19] 。如图4所示,GA-BADM浸提液组与空白对照组的OD值没有显著性差异(p > 0.05),且均显著高于阳性对照组(p < 0.05)。细胞培养三天后,在倒置显微镜下观察样品组、空白对照组和阳性对照组的细胞生长状态(图5),发现样品组和空白对照组细胞生长状态良好,细胞呈梭形,贴壁成片生长,而阳性对照组的细胞变圆,皱缩死亡。结果表明,细胞在GA-BADM浸提液中生长良好,没有出现细胞毒性。
 (A)
(A)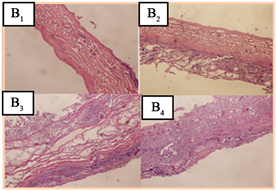 (B)
(B)
Figure 3. Subcutaneous immunoreaction of GA-BADM implants. (A) Recovery of rat's back around implanted GA-BADM and the GA-BADM implants at different time point; (B): Photomicrographs of the GA-BADM at different time point. A1、B1,A2、B2,A3、B3,A4、B4 mean 1, 2, 3, 4 weeks
图3. GA-BADM样品在皮下的免疫反应。(A) 不同植入时间的大鼠背部恢复情况和GA-BADM样品;(B) 不同植入时间,GA-BADM样品的显微照片。A1、B1,A2、B2,A3、B3,A4、B4分别代表1,2,3,4周
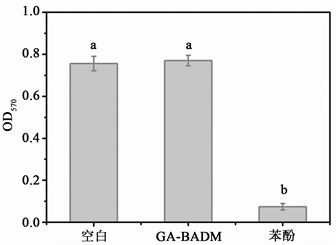
Figure 4. Cytotoxicity for L929 fibroblasts of extract from GA-BADM samples
图4. GA-BADM浸提液L929成纤维细胞毒性结果

Figure 5. The growing status of cells of samples, negative control and positive control on the third day ((A) Negative control; (B) GA-BADM samples; (C) Positive control)
图5. 样品组、空白对照组、阳性对照组的细胞在第三天的生长状态((A) 空白对照组;(B) 样品组;(C) 阳性对照组)
3.6. 细胞增殖
细胞能否在材料表面增殖生长是决定材料是否适用于组织工程领域应用的重要指标 [20] 。L929成纤维细胞在样品上的增殖情况如图6所示,细胞在GA-BADM材料表面和空白对照表面均出现了良好的增殖趋势,差异不明显(p > 0.05)。结果表明,L929成纤维细胞可以在GA-BADM材料上增殖生长。研究表明,脱细胞真皮基质的主要成分是胶原蛋白 [21] 。张其清等 [22] 人在另外的研究中发现胶原蛋白具有低免疫原性、生物相容性、可生物降解性等生物学性能。C. Röhlecke等 [23] 人在前期研究中报道,胶原蛋白制备的生物材料对细胞的黏附和生长活性有良好的促进作用。结果表明,本研究制备的GA-BADM材料具有良好的生物相容性和促细胞增殖能力,可以应用于医用材料领域。
4. 结论
本研究制备了改性巴沙鱼皮脱细胞真皮基质(GA-BADM),通过SEM观察,材料内部疏松多孔,且具有双层结构,有利于细胞的生长和黏附。本研究进一步从血液相容性、全身急性毒性、皮下植入以及细胞相容性对其生物相容性进行了研究,结果表明GA-BADM材料无溶血性,无全身急性毒性,具有良好的组织相容性和细胞相容性,为进一步探究鱼皮源脱细胞真皮基质的应用奠定了良好的理论基础。

Figure 6. Cell proliferation for L929 fibroblasts on GA-BADM samples
图6. GA-BADM材料促进L929成纤维细胞增殖结果
Table 1. The average body weight of rats (g) (n = 6)
表1. 各组大鼠的平均体重(g) (n = 6)
致谢
感谢国家自然科学基金资助项目(31471606);青岛海洋生物医药研究院资助项目(M17F02)对本研究工作的支持。
声明
本研究所用动物在无病原体环境中饲养,涉及动物及其护理的程序符合美国国立卫生研究院指南,且已被中国海洋大学伦理委员会批准。
文章引用
王月坤,侯 虎,张 凯,刘 晗,司磊磊,李八方. 巴沙鱼皮脱细胞真皮基质的制备及生物相容性评价
Preparation and Evaluation of Biocompatibility of Acellular Dermal Matrix of Basa Fish (Pangasius bocourti)[J]. 材料科学, 2018, 08(04): 346-354. https://doi.org/10.12677/MS.2018.84039
参考文献
- 1. 史新立, 谭芳奕, 陈冰. 脱细胞真皮基质材料的研究及应用[J]. 透析与人工器官, 2009, 20(2): 34-40.
- 2. 赵利敏, 张庆泉, 孙岩, 等. 异种脱细胞真皮基质在鼻中隔缺损修复中的应用[J]. 山东大学耳鼻喉眼学报, 2009(5): 31-32.
- 3. 龚明. 巴沙鱼皮胶原蛋白的理化性质及其止血应用研究[D]: [硕士学位论文]. 南昌: 江西师范大学, 2015. 竺可桢. 物理学[M]. 北京: 科学出版社, 1973: 1-3.
- 4. 宋金红. 巴沙鱼皮明胶生产工艺研究及工厂设计[D]: [硕士学位论文]. 青岛: 中国海洋大学, 2012.
- 5. 周辉, 梁瑜. 多种生物材料细胞生物相容性及其安全性的系统评价[J]. 中国组织工程研究, 2009, 13(38): 7559-7562.
- 6. 邓乐君, 樊鸿浩, 李伟达, 等. 可吸收止血材料的生物相容性研究进展[J]. 中国生物医学工程学报, 2016, 35(2): 241-246.
- 7. Umashankar, P.R., Arun, T. and Kumari, T.V. (2011) Short Duration Gluteraldehyde Cross Linking of Decellularized Bovine Pericardium Improves Biological Response. Journal of Biomedical Materials Research Part A, 97A, 311-320.
https://doi.org/10.1002/jbm.a.33061 - 8. 陈博. 新生小牛与成人皮肤组织学及生物力学性能的比较和牛脱细胞真皮基质的制备[D]: [硕士学位论文]. 重庆: 第三军医大学, 2012.
- 9. 张伶俐, 朱蔚精, 谭言飞, 等. 生物材料溶血性标准化评价方法比较: 溶血率法和氰化高铁血红蛋白法[J]. 生物医学工程学杂志, 2004, 21(1): 111-114.
- 10. 刘良明, 田昆仑, 范小青, 等. 异丁基壳聚糖多功能敷料的生物安全性[J]. 中国海洋药物, 2005, 24(5): 39-42.
- 11. Shin, Y.N. (2007) An in Vivo Study of the Host Tissue Response to Subcutaneous Implantation of Plga- and/or Porcine Small Intestinal Submucosa-Based Scaffolds. Biomaterials, 28, 5137.
https://doi.org/10.1016/j.biomaterials.2007.08.014 - 12. 冯玉萍. 胎牛皮脱细胞真皮基质在组织工程中的应用[D]: [博士学位论文]. 兰州: 甘肃农业大学, 2014.
- 13. Murphy, C.M., Haugh, M.G. and O’Brien, F.J. (2010) The Effect of Mean Pore Size on Cell Attachment, Proliferation and Migration in Collagen-Glycosaminoglycan Scaffolds for Bone Tissue Engineering. Biomaterials, 31, 461.
https://doi.org/10.1016/j.biomaterials.2009.09.063 - 14. 但年华, 但卫华, 曾睿, 等. 碳化二亚胺改性脱细胞猪真皮基质的性能研究[J]. 功能材料, 2007, 38(8): 1389-1392.
- 15. 李鸿, 李玉宝, 严永刚, 等. 纳米羟基磷灰石/聚酰胺66多孔材料制备和生物安全性初步评价[J]. 生物医学工程学杂志, 2008, 25(5): 1126-1129.
- 16. 许乾慰, 肖世英. 脂肪族聚氨酯弹性体肝素化的血液相容性[J]. 中国组织工程研究, 2007, 11(13): 2415-2419.
- 17. 王春仁, 姜华, 曹宏英, 等. 止血防粘连生物纸的生物相容性研究[J]. 中国生物医学工程学报, 2007, 26(2): 293-295.
- 18. Helenius, G., Backdahl, H.A., Nannmark, U., Gatenholm, P. and Risberg, B. (2006) In Vivo, Biocom-patibility of Bacterial Cellulose. Journal of Biomedical Materials Research Part A, 76, 431-438.
https://doi.org/10.1002/jbm.a.30570 - 19. 王昕, 施嬿萍, 朱雪涛, 等. MTT法评价医用高分子材料的细胞毒性[J]. 生物医学工程研究, 2003, 22(1): 46-47.
- 20. 金丹, 裴国献, 王前. 骨髓基质细胞与生物活性玻璃陶瓷和聚乳酸生物相容性的实验研究[J]. 中国修复重建外科杂志, 2000, 14(1): 39-43.
- 21. Wei, P., Laurell, L., Geivelis, M., Lingen, M.W. and Maddalozzo, D. (2000) Acellular Dermal Matrix Allografts to Achieve Increased Attached Gingiva. Part 1. A Clinical Study. Journal of Periodontology, 71, 1297-1305.
https://doi.org/10.1902/jop.2000.71.8.1297 - 22. 张其清, 王淳. 胶原蛋白-合成高分子复合材料的研究现状和发展方向[J]. 中国科学基金, 1995(4): 14-18.
- 23. Roehlecke, C., Witt, M., Kasper, M., Schulze, E., Wolf, C., Hofer, A., et al. (2000) Synergistic Effect of Titanium Alloy and Collagen Type I on Cell Adhesion, Proliferation and Differ-entiation of Osteoblast-Like Cells. Cells Tissues Organs, 168, 178.
https://doi.org/10.1159/000047833
NOTES
*通讯作者。
