Material Sciences
Vol.
09
No.
01
(
2019
), Article ID:
28659
,
11
pages
10.12677/MS.2019.91013
The Study on the Drug Delivery of Galactosylated Histidine Chitosan Nanoparticles
Shujie Miao
Department of Genetics and Genetic Engineering, School of Life Science, Fudan University, Shanghai

Received: Jan. 2nd, 2019; accepted: Jan. 21st, 2019; published: Jan. 28th, 2019

ABSTRACT
Galactose modified chitosan-histidine conjugate (GCH) was developed in this study as cationic vector for the delivery of vascular endothelial growth factor (VEGF) siRNA (siVEGF). The physicochemical properties, profile of siRNA release and cytotoxicity of copolymers were characterized. The nanoparticles were proved to be stable with low cytotoxicity and expected to be applied to gene drug delivery.
Keywords:Chitosan, Histidine, Galactose, siRNA Delivery
半乳糖修饰组氨酸壳聚糖衍生物靶向给药系统研究
苗淑杰
复旦大学生命科学学院遗传学和遗传工程系,上海

收稿日期:2019年1月2日;录用日期:2019年1月21日;发布日期:2019年1月28日

摘 要
本文以半乳糖基化壳聚糖–组氨酸衍生物经离子交联法包载VEGF干扰RNA (siRNA)制备纳米粒(NP),研究其理化性质,体外释放特性及细胞毒性,研究表明功能基团修饰NP递送载体稳定性好、细胞毒性低,有望应用于基因药物递送。
关键词 :壳聚糖,组氨酸,半乳糖,siRNA递送

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
癌症是人类健康的头号杀手,复发率和死亡率较高。手术切除、化学药物治疗、放射治疗作为常见的基础疗法,对癌细胞有一定的杀伤、抑制作用,但同时也摧毁了正常的免疫系统。肿瘤具有转移性强、复发率高的特性,在缺乏有效治疗手段的情况下,难以彻底根除 [1] [2] 。基因治疗是利用分子生物学方法将外源基因导入人体靶细胞或组织中,以纠正基因的缺陷或者发挥治疗作用 [3] 。基因药物特异性强、药理活性强 [4] [5] [6] ,但其易被酶解、摄取效率低、透膜吸收差 [7] ,因此需要借助安全且高效的递送载体才能充分发挥治疗功效。
壳聚糖为天然阳离子聚合物,生物相容,生物可降解,广泛用作药物和基因的递送载体。但壳聚糖溶解性差,作为递送载体时缺乏靶向性,体内应用受限。氨基酸侧链携带多种功能基团,可改善递送载体的理化性质,提高递送效率。Zheng等 [8] 分别合成了组氨酸(His)、精氨酸(Arg)和半胱氨酸(Cys)修饰的壳聚糖衍生物,可显著增加质粒DNA (pDNA)的稳定性,促进细胞摄取,提高pDNA的体内外转染效率和功效。肿瘤细胞代谢异常,细胞表面过量表达多种与细胞生长密切相关受体,如叶酸受体、去唾液酸糖蛋白受体等。半乳糖可特异性识别去唾液酸糖蛋白受体,促进纳米粒(nanoparticle, NP)经受体介导的内吞入胞。Han等 [9] 制备了乳糖酸修饰壳聚糖衍生物NP,包载pDNA和siRNA,可显著增强NP的靶向性,提高细胞摄取效率,介导高效的体内外基因沉默功效。
本文以酰胺化反应制备了乳糖酸和组氨酸双修饰壳聚糖衍生物(GCH),考察其理化性质和细胞毒性。以siRNA为模型基因,小分子化合物三聚磷酸钠(TPP)为阴离子交联剂,考察不同聚合物/TPP质量比对NP粒径和Zeta电势的影响,测定NP的稳定性和siRNA体外释放。
2. 实验部分
2.1. 主要材料和试剂
壳聚糖(脱乙酰度:85%,相对分子量:50 kDa,浙江金壳药业有限公司);Boc-组氨酸(Boc-His,上海迈瑞尔化学技术有限公司);1-(3-二甲氨基丙基)3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS) (上海源叶生物科技有限公司);VEGF siRNA及FAM标记NC siRNA (上海吉玛制药技术有限公司);GelSafe核酸染料(原平皓(天津)生物技术有限公司);核糖核酸酶A(RNase A, Worthington,美国);琼脂糖(Biowest,法国);噻唑蓝(MTT,MP,美国);三聚磷酸钠(TPP) (上海实验试剂有限公司);透析袋(MWCO:3,500 Da,上海绿鸟科技发展有限公司);实验用水为二次蒸馏水。
2.2. 主要仪器
AVANCE DMX600型核磁共振仪(Bruker,德国);ZetaNanoSizer型电位及粒度测定仪(Malvern,英国);FR-180B电泳槽、FR-200A型凝胶成像仪(上海复日科技有限公司);VARioSKAN Flash荧光多功能酶标仪(Thermo Fisher,美国)。
2.3. 聚合物的合成与表征
2.3.1. 聚合物的合成及表征
参考文献 [10] 合成His修饰壳聚糖。称取0.1 g Boc-His,加10 mL水溶解,加入两倍His摩尔质量的EDC和NHS,1 mol/L HCl调节pH至4.8,室温搅拌反应2 h;称取0.2 g壳聚糖,加20 mL 1%醋酸溶液溶解,1 mol/L氢氧化钠溶液调节pH至6.0;混合上述两种溶液,1 mol/L HCl调节pH至4.8,室温、避光搅拌反应72 h,水透析3天(MWCO:3,500 Da),冷冻干燥,制得壳聚糖–组氨酸共聚物(CH),−20℃保存。
合成半乳糖基化组氨酸–壳聚糖(GCH)。称取0.1 g乳糖酸,加5 mL 10 mmol/L TEMED/HCL溶液(pH 5.0)溶解,加入两倍乳糖酸摩尔质量的EDC和NHS,室温反应2 h;称取0.1 g CH,加入5 mL 10 mmol/L TEMED/HCL溶液(pH 5.0)搅拌溶解;混合上述溶液,1 mol/L HCL调节pH至5.0;室温、避光搅拌反应72 h,水透析3天(MWCO:3,500 Da),冷冻干燥,制得半乳糖基化壳聚糖–组氨酸共聚物(GCH),−20℃保存。同样方法合成半乳糖化壳聚糖共聚物(GC)。
以氘水和氘代盐酸混合溶液为CS的溶剂,氘水为CH、GC和GCH的溶剂,四甲基硅烷(TMS)为内标,测定样品的1H NMR图谱。KBr压片测定CS、CH、GC和GCH的傅立叶变换红外光谱(FTIR)图谱。
2.3.2. His修饰度测定
标准曲线:
精密称取100 mg His,置100 mL量瓶中,加水溶解并定容至刻度,得1 mg/mL贮备液;分别精密量取0.5 mL、1 mL、2 mL、4 mL、5 mL贮备液,置10 mL量瓶中,加水定容至刻度,得浓度分别为50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL、500 μg/mL的工作液;分别量取2 mL工作液,加0.5 mL 0.2 mol/L PBS (pH 8.0)和0.5 mL 2% (w/v)茚三酮溶液(以无水乙醇配制),沸水浴15 min,冰浴10 min;以水为对照,测定570 nm处的吸光值。以浓度C (μg/mL)对吸光值(A)进行线性回归,制备标准曲线。
样品测定:
量取2 mL 2 mg/mL CH和GCH水溶液,加0.5 mL 0.2 mol/L PBS (pH 8.0)和0.5 mL 2% (w/v)茚三酮溶液(以无水乙醇配制),沸水浴15 min,冰浴10 min;以水为对照,测定570 nm处的吸光值。由标准曲线计算His浓度。
2.3.3. 酸碱滴定
称取2 mg CS、CH、GC和GCH,分别加10 mL水溶解,0.1 mol/L HCl调节pH至3.0;搅拌下逐滴加入0.1 mol/L NaOH,至pH 7.0时停止滴加,记录滴定体积和相应的溶液pH值。
2.3.4. MTT试验
以1 × 104细胞/孔的密度接种QGY-7703细胞至96孔板,37℃、5% CO2培养24 h,每6孔为一组,每组分别加入浓度为0.01 mg/mL、0.05 mg/mL、0.1 mg/mL、0.2 mg/mL、0.4 mg/mL、0.8 mg/mL、1 mg/mL、2 mg/mL的CH、GC和GCH溶液,以0.2 mol/L PBS (pH7.4)的孔为对照,37℃、5% CO2培养24 h,吸弃孔中上清液,每孔加200 μL新鲜DMEM和20 μL MTT溶液(5 mg/mL,以0.2 mol/L PBS (pH 7.4)配制),37℃、5% CO2培养3 h,吸弃孔中上清液,每孔加200 μL DMSO,37℃、100 rpm振荡孵育30 min以使甲瓒晶体完全溶解,酶标仪测定570 nm处的吸光值。对照组的吸光值记为100%,计算各试验组的相对细胞存活率(%)。
2.4. NP的制备与表征
以DEPC处理水配制2 mg/mLCH、GC和GCH溶液、0.2 mg/mL TPP溶液及0.2 mg/mL VEGF siRNA溶液;以1%醋酸溶液配制2 mg/mL的CS溶液,1 mol/L NaOH调节pH至6.0;TPP溶液与VEGF siRNA溶液按质量比10:1混匀,聚合物溶液与TPP溶液分别按质量比8:1、10:1、12:1、15:1、18:1和20:1混匀,滴加一定体积的siRNA溶液至聚合物和TPP的混合溶液中,涡旋混匀,37℃温育30 min,制得各NP,分别命名为CSNP、CHNP、GCNP和GCHNP,测定粒径和Zeta电势。
2.5. 凝胶阻滞
按2.4项下方法制备不同聚合物/TPP质量比的CSNP、CHNP、GCNP和GCHNP溶液,取一定体积(含100 ng siRNA)加至4%琼脂糖凝胶的上样孔中,50 V电泳1 h,GelSafe核酸染料显色,凝胶成像仪观察siRNA条带并拍照。
2.6. NP的稳定性
2.6.1. 核酶稳定性
按2.4项下方法制备聚合物/TPP质量比为15:1的CSNP、CHNP、GCNP和GCHNP(以下试验无特殊说明外均用该聚合物/TPP质量比),加入RNase A溶液(5 U),37℃、100 rpm振荡孵育6 h,加2.5 μL 0.2mol/L EDTA溶液,80℃水浴 5 min以终止酶活反应,加肝素钠溶液(5 mg/mL),室温静置2 h,样品溶液加至4% (w/v)琼脂糖凝胶上样孔中,50 V电泳1 h,GelSafe核酸染料显色,凝胶成像仪观察siRNA条带并拍照。以未加RNase A溶液的siRNA溶液为阴性对照,以加等体积RNase A溶液的siRNA溶液为阳性对照。
2.6.2. 肝素钠解离
量取一定体积的NP溶液,加入终浓度分别为0.1 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、1 mg/mL的肝素钠溶液,室温静置2 h后加至4% (w/v)琼脂糖凝胶上样孔中,50 V电泳1 h,GelSafe核酸染料显色,以裸siRNA溶液为对照,凝胶成像仪观察siRNA条带并拍照。
2.6.3. 抗稀释和离子强度稳定性
按2.4项下方法制备聚合物/TPP质量比为15:1的CSNP、CHNP、GCNP和GCHNP,分别以水和0.2 mol/L PBS (pH 7.4)稀释100倍,测定NP的粒径和Zeta电势。
2.7. 体外释放
标准曲线的制作:精密量取0.5 mL 0.2 mg/mL FAM-NC siRNA溶液,置10 mL量瓶中,加DEPC处理水稀释至刻度,制得10 μg/mL FAM-NC siRNA贮备液;分别精密量取0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL至10 mL量瓶中,加DEPC处理水稀释至刻度,制得0.1 μg/m、0.2 μg/m、0.3 μg/m、0.4 μg/m、0.5 μg/mL FAM-NC siRNA标准溶液,酶标仪测定溶液的荧光强度(λex = 545 nm, λem = 575 nm)。以浓度C (μg/mL)对荧光强度(I)进行线性回归。
按2.4项下方法制备载FAM-NC siRNA的NP,量取一定体积NP溶液(含1μg FAM-NC siRNA),加1mL 0.2 mol/L PBS (pH 7.4)分散NP,37℃、100 rpm振荡温育。分别于0.5 h、1 h、2 h、4 h、6 h、8 h、12 h 13300 rpm离心10 min,精密量取上清液200 μL,酶标仪测定FAM-NC siRNA荧光强度(λex = 545 nm,λem = 575 nm),每次取样后补加200 μL 0.2mol/L PBS (pH 7.4),分散沉淀,继续温育。由标准曲线计算FAM-NC siRNA含量,计算累积释放量(%)。
3. 结果与分析
3.1. 聚合物的制备和表征
图1为GCH的合成路线图。在EDC/NHS催化作用下,壳聚糖的氨基与组氨酸的羧基发生酰胺化反应,得到CH。经EDC/NHS催化乳糖酸共价接枝至CH制得GCH。

Figure 1. The synthetic scheme of GCH conjugate
图1. GCH的合成路线图
图2为CS、GC、CH和GCH的1H NMR图谱。2.0 ppm处信号峰为壳聚糖乙酰基上甲基质子峰,3.1 ppm处为壳聚糖骨架的质子峰。CH和GCH的1H NMR图谱中,7.4 ppm处出现新的质子峰,为His中咪唑环的特征氢峰 [11] [12] [13] [14] ,表明His成功接枝至CS和GC。茚三酮显色法测得CH和GCH中His的接枝度分别为17.3 ± 1.7%和20.9 ± 0.3%。GC和GCH的1H NMR图谱中位于4.5 ppm处的信号峰为乳糖酸的次甲基氢峰 [15] ,表明乳糖酸成功接枝至CS及CH。计算半乳糖环次甲基氢峰与壳聚糖乙酰基甲基氢峰的峰面积比值,得GC和GCH的半乳糖修饰度分别为12.3%和13.1%。

Figure 2. 1H NMR spectra of CS, CH, GC and GCH
图2. CS、CH、GC和GCH的1H NMR图谱
3.2. 聚合物缓冲能力
图3为CS、CH、GC和GCH的缓冲能力测定结果,可见在pH 3.0至7.0范围内,CH和GCH的缓冲能力明显强于CS。这是由于CH和GCH中的咪唑基团的pKa为6.0,可在酸性条件下吸附大量质子 [16] ,因此缓冲能力较强。
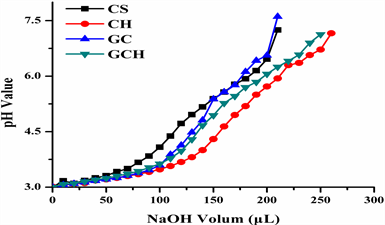
Figure 3. Acid-base titration curves of polymers
图3. 聚合物的酸碱滴定曲线
3.3. NP的制备与表征
荷负电的阴离子TPP可交联阳离子聚合物成稳定的NP,常作为小分子交联剂用于基因递送。VEGF siRNA经TPP交联与阳离子聚合物形成NP,表1所示为聚合物/TPP质量比为15:1时NC的粒径和Zeta电势,可见NP的粒径为160 nm~220 nm,多分散性指数(PDI)接近于0.3,粒径分布均匀,Zeta电势为21 mV~23 mV。
Table 1. Particle sizes and Zeta potentials of nanocomplexes at polymer/TPP weight ratio of 15
表1. 聚合物/TPP质量比为15:1时NP的粒径和Zeta电势
注:括号中的值表示多分散性指数(PDI)的值。各组值为平均值±SD值(n = 3)。
图4所示为CS、CH、GC和GCH在不同聚合物/TPP质量比时形成NP的粒径和Zeta电势,可见聚合物/TPP质量比为8:1至20:1时,各聚合物均可形成纳米尺度颗粒,且多分散性良好(PDI均小于0.3)。NP的Zeta电势随着聚合物/TPP质量比增加而上升,这是由于随着聚合物/TPP质量比的增加,NP表面正电荷量也随之增加。
 (a)
(a)  (b)
(b)
Figure 4. Particle sizes (a) and Zeta potentials, (b) of NP at different polymer/TPP ratio
图4. 不同聚合物/TPP质量比时NP的粒径(a)和Zeta电势(b)
3.4. 凝胶阻滞
荷负电的siRNA在电场作用下向正极迁移,产生明显的电泳条带,经阳离子聚合物缩合形成NP后可经静电吸附和物理缠绕包载siRNA于NP内部,使siRNA滞留在加样孔中无法移动,阻碍siRNA的电泳迁移。故以琼脂糖凝胶电泳试验定性考察阳离子聚合物与siRNA的结合能力。图5(a)所示为凝胶阻滞试验结果,GCHNP在聚合物/TPP质量比为8:1至20:1的范围内,均能有效阻滞siRNA的电泳迁移。图5(b)所示为聚合物/TPP质量比为15:1时各NP的凝胶阻滞试验结果,可见裸siRNA有明显的电泳条带,而各NP组均被阻滞在上样孔中,表明当聚合物/TPP质量比为15:1时,CSNP、CHNP、GCNP和GCHNP均可有效缩合siRNA,完全阻滞siRNA的电泳行为。
 (a)
(a)  (b)
(b)
Figure 5. (a) Agarose gel retardation assay of siRNA loaded GCHNP at different Polymer/TPP weight ratio, (b) Qualitative analysis of association efficacies of various NP towards siRNA by gel retardation assay. Lane 1-5 represented naked siRNA, CSNP, CHNP, GCNP and GCHNP at Polymer/TPP weight ratio of 15, respectively
图5. (a) 不同GCH/TPP质量比时GCHNP的凝胶阻滞图,(b) 聚合物/TPP质量比为15:1时,各NP组的凝胶阻滞图。1~5分别代表裸siRNA、CSNP、CHNP、GCNP和GCHNP
3.5. NP的稳定性
3.5.1. 核酶稳定性
NP在递送过程中需要抵抗核酶对siRNA的破坏,以保证siRNA在到达肿瘤细胞时结构完整,因此需借助合适的递送载体。图6所示为NP与核酶共孵育后的琼脂糖凝胶电泳图,可见裸siRNA经RNase A处理后无电泳条带,而CSNP、CHNP、GCNP和GCHNP组可见清晰电泳条带,表明CS、CH、GC和GCH均可有效保护siRNA免遭核酶降解。

Figure 6. Agarose gel electrophoresis of siRNA loaded NP after incubation with RNase A。Lane 1 represented naked siRNA and lane 2 - 6 represented naked siRNA, CSNP, CHNP, GCNP and GCHNP incubated with RNase A, respectively.
图6. 载siRNA聚合物NP分别与RNase A共孵育后的琼脂糖凝胶电泳图。1代表未经RNaseA处理的裸siRNA。2~6分别代表经RNase A处理后的裸siRNA、CSNP、CHNP、GCNP和GCHNP
3.5.2. 肝素钠解离
肝素纳可模拟体内荷负电物质对NP的解离作用,抵抗高浓度肝素钠解离一定程度可说明聚合物NP在体内可抵抗荷负电物质的解离作用。图7所示为NP经不同浓度肝素钠处理后的凝胶电泳图,可见CSNP、CHNP、GCNP和GCHNP肝素钠完全解离浓度分别为1 mg/mL、0.4 mg/mL、0.4 mg/mL和0.4 mg/mL,表明siRNA与壳聚糖衍生物的结合力较壳聚糖减弱,可能是由于壳聚糖上的氨基被取代引起的。

Figure 7. Agarose gel electrophoresis of siRNA loaded NP after incubation with different concentration of heparin
图7. 载siRNANP经肝素钠解离后琼脂糖凝胶电泳图
3.5.3. 抗稀释和离子强度稳定性
NP在递送过程中需要对抗体液稀释和高强度离子变化对NP结构的破坏,为保证siRNA在到达肿瘤细胞时结构完整,因此需借助合适的递送载体。以水和PBS分别稀释NP100倍,测定NP的粒径和Zeta电势,考察NP的稳定性。表2所示为水和PBS稀释后NP的粒径和Zeta电势,可见稀释后CSNP、CHNP、GCNP和GCHNP粒径稍增加,Zeta电势降低,这是由于高离子强度的稀释介质可产生“静电屏蔽效应”,减弱阳离子聚合物与siRNA间的结合力,使NP粒径增大、Zeta电势降低 [17] [18] 。
Table 2. Particle sizes and Zeta potentials of nanoparticles after dilution by water and PBS
表2. NP经水和PBS稀释100倍后的粒径和电势
3.6. 细胞毒性
基因递送载体应具备良好的安全性,以MTT试验考察聚合物细胞毒性。图8所示为不同浓度聚合物与QGY-7703细胞共培养24 h后的MTT试验结果,可见聚合物浓度为0.01 mg/mL~2 mg/mL时,各组细胞存活率均超过90%,表明聚合物的细胞毒性较小,安全性较好。

Figure 8. Relative cell viabilities following exposure to different polymers at the concentration of 0.01, 0.05, 0.1, 0.2, 0.4, 0.8, 1and 2 mg/mL for 24 h. Indicated values were mean ± SD (n = 6)
图8.在聚合物浓度为0.01,0.05,0.1,0.2,0.4,0.8,1和2 mg/mL溶液中细胞暴露24 h后的相对存活率
3.7. 体外释放
siRNA释放的标准曲线为:I = 36.601C – 0.5733,r = 0.997,表明在0.1 μg/mL~0.5 μg/mL范围内荧光强度(I)与FAM-NC siRNA浓度(C, μg/mL)线性关系良好。图9所示为NP在0.2 mol/L PBS(pH 7.4)中的siRNA释放曲线,可见CSNP、CHNP、GCNP、GCHNP的12h累积释放量分别为20.9%、84.6%、75.9%和69.3%,表明各NP均可有效释放siRNA,且CHNP、GCNP和GCHNP的siRNA的释放快于CSNP,这可能是由于壳聚糖与siRNA的结合力较强所致,与肝素钠解离试验结果一致。

Figure 9. In vitro release profiles of FAM-siRNA from CSNP, CHNP, GCNP and GCHNP in 0.2 mol/L PBS (pH 7.4) at 37˚C. Indicated values were mean ± SD (n = 3)
图9. 浓度为0.2 mol/L的PBS (pH 7.4)在37℃时,溶液中CSNP、CHNP、GCNP、GCHNP的siRNA释放曲线
4. 小结
壳聚糖分别经His和乳糖酸修饰制备CH、GC和GCH。经测定CH和GCH中His的修饰度分别为17.3 ± 1.7%和20.9 ± 0.3%,GC和GCH的半乳糖修饰度分别为12.3%和13.1%。以TPP为交联剂制备载siRNANP,当聚合物/TPP比为15:1时,NP的粒径为160 nm~220 nm,Zeta电势为21 mV~23 mV,NP的稳定性较好,可有效保护siRNA免于核酶降解,体外条件下可有效释放siRNA,为siRNA的体内外递送提供指导。
文章引用
苗淑杰. 半乳糖修饰组氨酸壳聚糖衍生物靶向给药系统研究
The Study on the Drug Delivery of Galactosylated Histidine Chitosan Nanoparticles[J]. 材料科学, 2019, 09(01): 93-103. https://doi.org/10.12677/MS.2019.91013
参考文献
- 1. Pichon, C., Billiet, L. and Midoux, P. (2010) Chemical Vectors for Gene Delivery: Uptake and Intracellular Trafficking. Current Opinion in Biotechnology, 21, 640-645. https://doi.org/10.1016/j.copbio.2010.07.003
- 2. Brannon-Peppas, L. and Blanchette, J. (2012) Nanoparticle and Targeted Systems for Cancer Therapy. Advanced Drug Delivery Reviews, 64, 206-212.
- 3. 李燕, 阳俊, 刘桂英, 张欣. 基因治疗药物输递系统的研究现状及发展趋势[J]. 生物化学与生物物理进展, 2013, 40(10): 998-1007.
- 4. Prosen, L., Markelc, B., Dolinsek, T., Music, B., Cemazar, M. and Sersa, G. (2014) Mcam Silencing with RNA Interference using Magnetofectionhas Antitumor Effect in Murine Melaneoma. Molecular Therapy - Nucleic Acids, 3, e205.
- 5. Xiao, B., Zhang, M., Viennois, E., Zhang, Y., Wei, N., Baker, M., et al. (2015) Inhibition of MDR1 Gene Expression and Enhancing Celluar Uptake for Effective Colon Cancer Treatment Using Du-al-Surface-Functionalized Nanoparticles. Biomaerials, 48, 147-160. https://doi.org/10.1016/j.biomaterials.2015.01.014
- 6. Juliano, R., Bauman, J., Kang, H. and Ming, X. (2009) Biological Barriers to Therapy with Antisense and siRNA Oligonucleotides. Molecular Pharmaceutics, 6, 686-695. https://doi.org/10.1021/mp900093r
- 7. Liang, S., Yang, X., Wang, H., Li, H., Liu, W., et al. (2015) Optimizing the Size of Micellar Nanoparticles for Efficient siRNA Delivery. Advanced Functional Materials, 25, 4778-4787. https://doi.org/10.1002/adfm.201501548
- 8. Zheng, H., Tang, C. and Yin, C. (2015) Oral Delivery of shRNA Based on Amino Acid Modified Chitosan for Improved Antitumor Efficacy. Biomaterials, 70, 126-137. https://doi.org/10.1016/j.biomaterials.2015.08.024
- 9. Han, L., Tang, C. and Yin, C. (2015) Dual-Targeting and pH/Redox-Responsive Multi-Layered Nanocomplexes for Smart Co-Delivery of Doxorubicin and siRNA. Biomaterials, 60, 42-52. https://doi.org/10.1016/j.biomaterials.2015.05.001
- 10. Zheng, H., Tang, C. and Yin, C. (2015) Exploring Ad-vantages/Disadvantages and Improvements in Overcoming Gene Delivery Barriers of Amino Acid Modified Tri-methylated Chitosan. Pharmaceutical Research, 32, 2038-2050. https://doi.org/10.1007/s11095-014-1597-7
- 11. Qiu, Y., Ma, Z.w., Zhao, Y.m., Zhang, J.c., Guo, Q., Gou, Z.r. and Gao, C.y. (2012) Polycaprolactone Scaffold Modifiedwith Galactosylated Chitosan for Hepatocyte Culture. Mac-romolecular Research, 20, 283-291. https://doi.org/10.1007/s13233-012-0056-8
- 12. Ding, J., He, R., Zhou, G., Tang, C. and Yin, C. (2012) Multi-layered Mucoadhesive Hydrogel Films Based on Thiolatedhyaluronic Acid and Polyvinylalcohol for Insulin Delivery. Acta Biomaterialia, 8, 3643-3651. https://doi.org/10.1016/j.actbio.2012.06.027
- 13. Azari, F., Sandros, M. and Tabrizian, M. (2011) Self-Assembled Multifunctional Nanoplexes for Gene Inhibitory Therapy. Nanomedicine-UK, 6, 669-680. https://doi.org/10.2217/nnm.11.23
- 14. Jiang, H.L., Kwon, J.T., Kim, Y.K., Kim, E.M., Arote, R., Jeong, H.J., Nah, J.W., Choi, Y.J., Akaike, T., Cho, M.H. and Cho, C.S. (2007) Galactosylated Chitosan-Graft-Polyethylenimine as a Gene Carrier for Hepatocyte Targeting. Gene Therapy, 14, 1389-1398. https://doi.org/10.1038/sj.gt.3302997
- 15. Li, Y.Y., Zhang, S.S., Meng, X.J., et al. (2011) The Preparation and Characterization of a Novel Amphiphiliccleoyl-Carboxymethyl Chitosan Self-Assembled Nanoparticles. Carbohydrate Polymers, 83, 130-136. https://doi.org/10.1016/j.carbpol.2010.07.030
- 16. Katas, H. and Alpar, H. (2006) Development and Characteri-zation of Chitosan Nanoparticles for siRNA Delivery. Journal of Controlled Release, 115, 216-225. https://doi.org/10.1016/j.jconrel.2006.07.021
- 17. Ren, Y., Jiang, X., Pan, D. and Mao, H. (2010) Charge Density and Molecular Weight of Polyphosphoramidate Gene Carrier Are Key Parameters Influencing Its DNA Compaction Ability and Transfection Efficiency. Biomacromolecules, 11, 3432-3439. https://doi.org/10.1021/bm1009574
- 18. Chowdhury, D.K., Sarker, H. and Schwartz, P. (2018) Regulaatory Notes on Impact of Excipient on Drug Products and the Maillard Reaction. AAPS PharmSciTech, 19, 965-969. https://doi.org/10.1208/s12249-017-0878-y
