Advances in Clinical Medicine
Vol.
11
No.
10
(
2021
), Article ID:
45745
,
8
pages
10.12677/ACM.2021.1110650
SIRT-1和SUMO-1在I型子宫内膜癌中的表达及意义
刘絮影,邹存华,朱瑞森,赵淑萍*
青岛大学附属青岛妇女儿童医院,山东 青岛
收稿日期:2021年9月11日;录用日期:2021年10月2日;发布日期:2021年10月14日

摘要
目的:探讨沉默信息调节因子相关酶-1 (silent information regulator 1, SIRT-1)及小泛素相关修饰分子-1 (small ubiquitin-related modifier, SUMO-1)在子宫内膜不典型增生及子宫内膜癌中的表达及意义。方法:选取异常子宫内膜组织标本73例作为研究对象,包括I型子宫内膜癌45例、不典型增生28例,选取同期因子宫肌瘤行子宫全切手术正常子宫内膜组织30例作为对照。采用免疫组化方法检测各组中SIRT-1及SUMO-1的表达情况,并分析其与子宫内膜癌不同临床病理特征的关系。结果:1) SIRT-1及其SUMO化修饰蛋白SUMO-1在正常子宫内膜、子宫内膜不典型增生、子宫内膜癌组织中阳性表达率呈递增趋势,且两者在子宫内膜癌中的表达明显高于其他组织,差异有统计学意义(P < 0.05)。2) 不同分化程度、临床分期及淋巴结转移的子宫内膜癌组织中SIRT1蛋白及SUMO-1蛋白的表达阳性率比较,差异均有统计学意义(P < 0.05)。3) 子宫内膜癌组织中SIRT-1与SUMO-1蛋白表达呈正相关(Rs = 0.31, P < 0.05)。结论:I型子宫内膜癌组织中SIRT-1与SUMO-1的表达高于正常及不典型增生子宫内膜组织,且两者在子宫内膜增生癌变过程中存在一定相互作用;SIRT-1有望成为子宫内膜癌基因治疗的新途径。
关键词
I型子宫内膜癌,沉默信息调节因子相关酶-1,小泛素相关修饰分子1,免疫组织化学

The Expression and Significance of SIRT-1 and SUMO-1 in Type I Endometrial Carcinoma
Xuying Liu, Cunhua Zou, Ruisen Zhu, Shuping Zhao*
Qingdao Women and Children’s Hospital Affiliated to Qingdao University, Qingdao Shandong
Received: Sep. 11th, 2021; accepted: Oct. 2nd, 2021; published: Oct. 14th, 2021

ABSTRACT
Objective: To examine the expression of silent information regulator 1 (SIRT-1) and small ubiquitin-related modifier1 (SUMO-1) in abnormal endometrial tissues, and investigate the correlation among their expression, clinicopathological parameters and clinical significance. Methods: The specimens of 75 patients with endometrial lesions were selected as the subjects, including 45 cases of type I endometrial adenocarcinoma, and 28 cases of endometrial hyperplasia; 30 cases of normal endometrial tissues from patients undergoing total hysterectomy due to uterine fibroids during the same period were selected as the control group. The expression of SIRT-1 and SUMO-1 in different endometrial tissues was detected by immunohistochemistry. Results: 1) SIRT-1 and its sumo-modified protein sumo-1 showed an increased expression level in normal endometrial, endometrial dysplasia, and endometrial carcinoma tissues, and their expression in endometrial carcinoma was significantly higher than that in other tissues, with statistically significant difference (P < 0.05). 2) The positive rates of SIRT1 and SUMO-1 in endometrial carcinoma tissues with different differentiation degrees, clinical stages and lymph node metastasis were significantly different (all P < 0.05). 3) SIRT-1 and SUMO-1 expressions were positively correlated in endometrial carcinoma tissues (R = 0.31, P < 0.05). Conclusion: The expression of SIRT-1 and SUMO-1 in type I endometrial carcinoma tissues is higher than that in normal and endometrial dysplasia tissues, and they may be involved in the process of endometrial hyperplasia and carcinogenesis. SIRT-1 is expected to be a new approach for gene therapy of endometrial carcinoma.
Keywords:Type I Endometrial Carcinoma, Silent Information Regulator 1, Small Ubiquitin-Related Modifier 1, Immunohistochemistry

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
子宫内膜癌(Endometrial carcinoma, EC)占女性恶性肿瘤的7%,生殖道恶性肿瘤的20%~30%,近年来发病率呈明显增高和低龄化趋势 [1] [2],全球每年约14.2万新增病例,4.2万人死亡。EC可分为激素依赖型(I型)子宫内膜癌和非激素依赖型(II型)子宫内膜癌,其中I型患者占大多数(80%),均为子宫内膜样腺癌,通常由子宫内膜不典型增生发展而来 [3]。对早期诊断的I型子宫内膜癌患者采取以手术为主,辅以放化疗的综合治疗可获得较高存活率,但仍有部分淋巴结转移患者联合治疗效果欠佳,治疗后复发风险较高。目前子宫内膜癌发生、发展的分子机制仍不完全清楚,缺乏有效的筛查及病情监测手段。因此,探索与子宫内膜癌发生、发展及转移相关的分子对寻找其早期诊断的分子标志物以及新的潜在治疗靶点尤为重要。
沉默信息调节因子相关酶1 (silent information regulator 1, SIRT1)为Sirtuin蛋白家族成员,能够通过去乙酰化组蛋白和非组蛋白靶点参与基因调控、细胞凋亡、自噬、衰老、增殖和肿瘤生成等过程 [4]。通过靶向肿瘤抑制因子和致癌蛋白,SIRT1对肿瘤的影响具有双重作用:其通过促进DNA修复、增加基因组稳定性和抑制癌前阶段炎症的功能来抑制肿瘤发生,SIRT-1还可通过其在抗细胞凋亡、促肿瘤代谢和抗肿瘤免疫中的作用来增强肿瘤增殖、存活和耐药性 [5]。这种矛盾作用具有组织差异性,研究表明SIRT-1的表达水平在前列腺癌、白血病、结肠癌中显著提高,然而,在乳腺癌、肝细胞癌中,SIRT-1的表达下调 [6]。
小泛素相关修饰分子(small ubiquitin-related modifier, SUMO)是近来新发现的类似于泛素化修饰的另一种新型蛋白质翻译后修饰,SUMO可与多种蛋白质结合发挥相应的功能,其中也包括III型去乙酰化酶SIRT1蛋白分子。SUMO化能快速调节转录调控、DNA修复、核质转运、细胞生长、凋亡等细胞过程 [7]。SUMO化修饰可以广泛地提高复杂信号通路的稳定性和坚固性,但SUMO化被无限或无序地激活可对细胞产生严重后果。
目前有关SIRT-1及SUMO-1在子宫内膜癌中作用的研究尚少,本研究旨在通过检测不同病变程度的子宫内膜组织中SIRT-1及SUMO-1的表达及其与I型子宫内膜癌患者临床病理特征之间的关系,探讨其在I型子宫内膜癌发生、发展、转移中的作用,为子宫内膜癌诊断及治疗提供新的理论依据。
2. 资料与方法
2.1. 资料来源
1) 研究对象:收集2015年10月1日至2017年07月01日青岛大学附属医院妇科及青岛市妇女儿童医院妇科手术切除经病理确诊73例异常子宫内膜组织,其中子宫内膜样腺癌45例、子宫内膜不典型增生组织28例,选取同期因子宫肌瘤行全子宫切除患者分泌期子宫内膜组织30例作为对照组。登记并保存患者的各项临床资料,45例子宫内膜癌患者平均年龄 52.85 ± 8.41岁(35~73岁);参照WHO2014诊断标准 [8] 分型:均为I型,子宫内膜样腺癌;参照国际妇产科联盟(Federation International of Gynecology and Obstetrics, FIGO)分期:I期~II期20例、III期25例;组织分化程度:高分化18例、中低分化27例;盆腔淋巴结转移情况:淋巴结转移阳性23例、阴性22例。病理诊断经两位有经验病理科医生确诊,患者资料完整。本研究经青岛大学医学院附属医院及附属妇女儿童医院医学伦理会批准,患者均签署知情同意书。
2) 纳入及排除标准:纳入标准:为首次入院治疗,术前或活检确诊前未行预处理(化疗、放疗、内分泌治疗等);附有明确的病理诊断报告。排除标准:凝血功能障碍者;既往有腹部手术史者;合并其他恶性肿瘤者;严重精神障碍者;依从性差者。
3) 主要试剂:兔抗人SUMO-1单克隆抗体及兔抗人SIRT-1单克隆抗体购自英国Abcam公司,抗兔β-actin抗体、免疫组化试剂盒及DAB显色剂购自北京中杉金桥生物技术有限公司。
2.2. 方法
1) 免疫组织化学(SP)法检测SIRT-1及SUMO-1在不同子宫内膜组织中的表达:所有标本均于手术室取样,并制作常规石蜡标本,按照免疫组化试剂盒说明书步骤进行实验。将不同子宫内膜组织的石蜡切块连续切成厚度为4 um的切片,经烤片、脱蜡、水化后高压抗原修复,室温下自然冷却,磷酸盐缓冲液(PBS)冲洗,滴加一抗并用PBS缓冲液代替抗体做阴性对照,4℃孵育过夜,PBS冲洗,滴加二抗(过氧化物酶标记的抗鼠聚合物),37℃水浴箱孵育30 min,PBS冲洗,按试剂盒说明用DAB显色,显微镜下观察显色反应以及时中止,再经苏木素复染、流水水洗返蓝、梯度乙醇脱水干燥、二甲苯透明,中性树胶封片固定。
2) 结果判定:由经验丰富病理科专家判定,根据染色强度强弱与阳性细胞所占所有肿瘤细胞比例进行评分。SIRT-1的表达:以细胞核出现黄色染色者为SIRT-1阳性细胞。SUMO-1的表达:以细胞质出现黄色染色者为SUMO-1阳性细胞。染色强度的计分标准:无着色、淡黄色、黄色、棕黄色、依次记为0、1、2、3分;阳性细胞百分率计分标准:<5%、5%~25%、26%~50%、51%~75%、76%~100%依次记为0、1、2、3、4分。最后两项之积为总评分,总评分 < 3分、4~5分、6~8分、9~12分依次记为阴性(−)、弱阳性(+)、中度阳性(++)、强阳性(+++),最后将−~+判定为阴性表达,++~+++判定为阳性表达,并计算阳性表达率。
2.3. 统计学方法
利用SPSS 22.0软件进行统计学分析,计数资料用频数表示,组间的比较用χ2检验,强度相关性用spearman等级相关分析,以P < 0.05为差异有统计学意义。
3. 结果
3.1. 不同子宫内膜组织中SIRT-1及SUMO-1的表达与比较
免疫组化SP法检测显示SIRT-1及SUMO-1各自于正常子宫内膜、不典型增生内膜、内膜癌内膜中表达程度逐渐增高(见图1)。在正常子宫内膜组织、子宫内膜不典型增生组织中SIRT-1的阳性表达率分别为6.67% (2/30)、42.9% (12/28)、62.2% (28/45);组间比较,差异有统计学意义(χ2 = 11.174, P = 0.00375)。SUMO-1的阳性表达率分别为6.67% (2/30)、32.1% (9/28)、55.6% (25/45);组间比较,差异有统计学意义(χ2 = 9.999, P = 0.00674)。SIRT1与SUMO-1的共同阳性表达率分别为0% (0/30)、25.0% (7/28)、42.2% (19/45),组间比较,差异有统计学意义(χ2 = 11.187, P = 0.00372)。
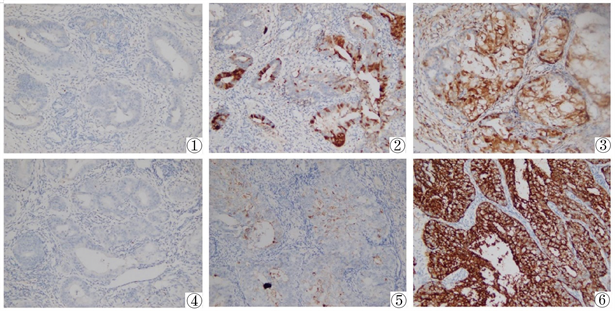 ①:SIRT-1在正常子宫内膜表达情况;②:SIRT-1在子宫内膜不典型表达情况;③:SIRT-1在子宫内膜腺癌表达情况;④:SUMO-1在正常子宫内膜表达情况;⑤:SUMO-1在子宫内膜不典型表达情况;⑥:SUMO-1在子宫内膜腺癌表达情况
①:SIRT-1在正常子宫内膜表达情况;②:SIRT-1在子宫内膜不典型表达情况;③:SIRT-1在子宫内膜腺癌表达情况;④:SUMO-1在正常子宫内膜表达情况;⑤:SUMO-1在子宫内膜不典型表达情况;⑥:SUMO-1在子宫内膜腺癌表达情况
Figure 1. The expression of SIRT-1 and SUMO-1 indifferent endometrial tissues (SP ×400)
图1. SIRT-1和SUMO-1在不同子宫内膜组织中表达情况(SP ×400)
对不同分组中SIRT1及SUMO-1的阳性表达程度进行对比检验,分别与正常内膜组织比较,不典型增生内膜组织及内膜癌组织中SIRT1与SUMO-1的阳性表达率差异均具有统计学意义(P < 0.05),而不典型增生内膜组织与内膜癌组织比较,差异无统计学意义(P > 0.05)。SIRT1与SUMO-1的共同阳性表达率,正常内膜组织与不典型增生内膜组织及内膜癌组织比较,差异均有统计学意义(P < 0.05);而不典型增生内膜与内膜癌组织比较,差异无统计学意义(P > 0.05)。见表1。
Table 1. Comparison of the positive expression of SIRT-1 and SUMO-1 in different endometrial tissues
表1. 不同子宫内膜组织中SIRT-1与SUMO-1阳性表达的比较
3.2. 不同临床病理特征的子宫内膜癌组织中SIRT-1及SUMO-1阳性表达的比较
SIRT-1及SUMO-1的表达与子宫内膜癌组织学分化程度、淋巴结转移及FIGO临床分期有关,而与内膜癌患者的年龄无关。晚期、分化差、FIG0分期为Ⅲ期者阳性表达率高于早期、分化好及FIGO分期为I、II期者,有淋巴结转移者高于无淋巴结转移者,分别比较,差异均有统计学意义(P < 0.05)。见表2。
Table 2. Comparison of the expression of SIRT-1 and SUMO-1 in endometrial adenocarcinoma tissues with different clinicopathological characteristics
表2. 不同临床病理特征的子宫内膜癌组织中SIRT-1及SUMO-1阳性表达的比较
3.3. 子宫内膜癌组织中SIRT-1与SUMO-1表达的相关性
SIRT-1与SUMO-1的表达在子宫内膜癌组织中呈正相关(r = 0.31, P = 0.033),SIRT-1阳性病例中SUMO-1的阳性率为67.9% (19/28),SIRT-1阴性病例中SUMO-1的阳性率为35.3% (6/17),两者比较,差异具有统计学意义(P < 0.05)。见表3。
Table 3. The correlation between the expression of SIRT-1 and SUMO-1 in endometrial adenocarcinoma
表3. 子宫内膜癌组织中SIRT-1与SUMO-1表达的相关性
4. 讨论
SIRT-1为Sirtuin蛋白家族成员,是一种NAD+依赖性去乙酰化酶,第363位的组氨酸是其去乙酰化活性的必需基团,通过对组蛋白和非组蛋白的赖氨酸残基去乙酰化发生作用,并与染色质、多种转录及转录调节因子相互作用,从表观遗传角度影响基因表达,参与调控染色质结构、基因转录、细胞生长、能量代谢、增殖和衰老等多种病理生理过程 [9]。如前所述,SIRT-1对肿瘤的作用具有组织差异性,Singh等 [10] 研究发现相较于正常组织,鳞状上皮内病变的宫颈上皮增殖层细胞质和细胞核中SIRT-1的表达增加,并且在向宫颈鳞状细胞癌进展过程中SIRT1的表达逐渐增加。关于SIRT-1促进肿瘤发生、发展机制的假设有很多,如SIRT-1将抑癌基因p53去乙酰化失活,从而阻止DNA损伤细胞的凋亡 [11],如SIRT-1可以作用于FOXO家族,使其诱导细胞凋亡能力减弱 [12],SIRT-1还可以同P53,FOXO,DBC1等多种抑癌基因形成复合物以复合物形式发生去乙酞化作用等,调节抑癌基因的表达,发挥着促癌的作用 [13]。
SUMO是类泛素蛋白家族的重要成员之一,它在结构上与泛素分子相似,是一类由98个氨基酸残基组成的多肽,广泛存在于真核生物中,SUMO化修饰的生化过程可概括为经SUMO活化酶E1、SUMO结合酶E2、SUMO连接酶E3,将SUMO分子结合到底物蛋白的赖氨酸残基上 [14] [15]。SUMO可与多种蛋白质结合进而调节分子定位、基因转录、信号转导和细胞分裂等多种细胞功能,其中也包括SIRT-1蛋白分子。研究发现通过对SIRT-1第734位的赖氨酸进行SUMO化修饰,可以增加SIRT-1的去乙酰化活性 [16]。此外,在遗传毒性物质或者氧化应激条件下,SIRT-1可以被SENP1 (Sentrin-specificprotease-1)去SUMO化,由此导致SIRT1的活性降低 [17]。SUMO化途径还可能与癌症转移和恶化密切相关,Katayama等 [18] 证明SUMO-1的过表达与口腔鳞状细胞癌的恶化有较强的相关性。Kessler等 [19] 报道在myc高表达的乳腺癌肿瘤患者中,SUMO化途径相关基因表达与患者的生存率成负相关。
虽然SIRT-1与SUMO-1的关系密切,但至今还未有同时观测两者在子宫内膜癌中表达及功能特点的相关报道。本研究发现SIRT-1及SUMO-1在正常子宫内膜、不典型增生内膜、内膜癌组织中阳性表达率逐渐升高,提示两者参与了I型子宫内膜癌及其癌前病变的发生、发展过程,并且与病变程度呈正相关。这一结果与袁俐等 [20] 人研究结果相符合。并且通过相关性分析,发现SIRT-1与SUMO-1在子宫内膜癌组织中的表达呈正相关关系。由于时间关系本研究尚不能证明SIRT-1是否通过SUMO化修饰影响子宫内膜癌的发展进程,但初步的结果提示两者的共表达可能在子宫内膜癌的发生发展中有某种协同作用,或者说SIRT-1蛋白发挥相应的调节功能伴随着SUMO-1的参与调节。后续可通过设计合成其一因子的抑制剂,如针对SIRT-1基因的慢病毒将其沉默,进而检测另一因子的表达变化,进而从分子层面探究其内在联系。
本研究中,发生淋巴结转移患者SIRT-1及SUMO-1蛋白表达程度高,此结果与前人对于胃癌中SIRT-1的表达与淋巴结转移情况关系等相关研究结果一致 [21]。盆腔淋巴结是子宫内膜癌常见的转移区域,同时也是评估患者预后及指导术后是否进行放疗、化疗的重要因素。未来能否将SIRT-1作为一种预测指标有待于进一步证实,这将对指导手术范围、减少手术并发症,提高患者的生活质量具有重要意义。
5. 结论
综上所述,随着子宫内膜由正常组织到癌变的发展过程,SIRT-1和SUMO-1蛋白的表达程度逐渐升高,并与I型子宫内膜癌的组织学分化程度、病理学分期、淋巴转移程度有一定的正相关关系,提示两者在I型子宫内膜癌发展过程中似乎存在着共表达关系,若能通过后续实验证明两者的作用机制及其在子宫内膜癌发病机制中的作用,将有望成为子宫内膜癌的诊断及治疗的生物学指标,为子宫内膜癌的早期筛查及治疗提供新的靶点和途径。
基金项目
山东省自然科学基金(ZR2015HM035)。
文章引用
刘絮影,邹存华,朱瑞森,赵淑萍. SIRT-1和SUMO-1在I型子宫内膜癌中的表达及意义
The Expression and Significance of SIRT-1 and SUMO-1 in Type I Endometrial Carcinoma[J]. 临床医学进展, 2021, 11(10): 4437-4444. https://doi.org/10.12677/ACM.2021.1110650
参考文献
- 1. Chen, W. (2015) Cancer Statistics: Updated Cancer Burden in China. Chinese Journal of Cancer Research, 27, 1.
- 2. Siegel, R.L., Miller, K.D. and Jemal, A. (2017) Cancer Statistics, 2017. CA: A Cancer Journal for Clinicians, 67, 7-30. https://doi.org/10.3322/caac.21387
- 3. Sanderson, P.A., Critchley, H.O., Williams, A.R., Arends, M.J., Saunders, P.T.K. (2017) New Concepts for an Old Problem: The Diagnosis of Endometrial Hyperplasia. Human Reproduction Update, 23, 232-254. https://doi.org/10.1093/humupd/dmw042
- 4. Knight, J.R. and Milner, J. (2012) SIRT1, Metabolism and Cancer. Current Opinion in Oncology, 24, 68-75. https://doi.org/10.1097/CCO.0b013e32834d813b
- 5. Garcia-Peterson, L.M. and Li, X. (2021) Trending Topics of SIRT1 in Tumorigenicity. Biochimica et Biophysica Acta (BBA): General Subjects, 865, Article ID: 129952. https://doi.org/10.1016/j.bbagen.2021.129952
- 6. Alves-Fernandes, D.K. and Jasiulionis, M.G. (2019) The Role of SIRT1 on DNA Damage Response and Epigenetic Alterations in Cancer. International Journal of Molecular Sciences, 20, Article No. 3153. https://doi.org/10.3390/ijms20133153
- 7. Chang, H.M. and Yeh, E.T.H. (2020) SUMO: From Bench to Bedside. Physiological Reviews, 100, 1599-1619. https://doi.org/10.1152/physrev.00025.2019
- 8. Zaino, R., Matias-Guiu, X., Carinelli, S.G., et al. (2014) Turnouts of the Uterine Corpus. Epithelial Tumours and Precursors. In: Kurman, R.J., Carcan-giu, M.L., Herrington, C.S., et al., Eds., WHO Classification of Tumor of Femalereproductive Organs, 4th Edition, IARC Press, Lyon, 125-135.
- 9. Sapna, S., Uday Kumar, P., Thakur, S., Kiran, S., Sen, B., Sharma, S., Rao, V.V., et al. (2015) Expression/Localization Patterns of Sirtuins (SIRT1, SIRT2, and SIRT7) During Progression of Cervical Cancer and Effects of Sirtuin Inhibitors on Growth of Cervical Cancer Cells. Tumor Biology, 36, 6159-6171. https://doi.org/10.1007/s13277-015-3300-y
- 10. Rahman, S. and Islam, R. (2011) Mammalian. Sirt1: Insights Onitsbiological Functions. Cell Communication and Signaling, 9, Article No. 11. https://doi.org/10.1186/1478-811X-9-11
- 11. Farcas, M., Gavrea, A.A., Gulei, D., Ionescu, C., Irimie, A., Catana, C.S., et al. (2019) SIRT1 in the Development and Treatment of Hepatocellular Carcinoma. Frontiers in Nutrition, 6, Article No. 148. https://doi.org/10.3389/fnut.2019.00148
- 12. 刘亭亭, 柴荣飞, 郑兆娣, 李国荣. SIRT1介导的K-Ras、FoxOs和DLC1的表达及翻译后修饰调控癌细胞的增殖和凋亡[J]. 生命科学, 2018, 30(1): 74-81.
- 13. Guarani, V., Deflorian, G., Franco, C.A., Krüger, M., Phng, L.-K., Katie, B., et al. (2011) Acetylation-Dependent Regulation of Endothelial Notch Signaling by the SIRT-1 Deacetylase. Nature, 473, 234-238. https://doi.org/10.1038/nature09917
- 14. Bialik, P. and Woźniak, K. (2017) SUMO Proteases as Potential Targets for Cancer Therapy. Postepy higieny i medycyny doswiadczalnej, 71, 997-1004. https://doi.org/10.5604/01.3001.0010.6667
- 15. Zhao, X. (2018) SUMO-Mediated Regulation of Nuclear Functions and Signaling Processes. Molecular Cell, 71, 409-418. https://doi.org/10.1016/j.molcel.2018.07.027
- 16. Firestein, R., Blander, G., Michan, S., Oberdoerffer, P., Ogino, S., Campbell, J., et al. (2008) The SIRT-1 Deacetylase Suppresses Intestinaltumorigenesis and Colon Cancer Growth. PLoS ONE, 3, e2020. https://doi.org/10.1371/journal.pone.0002020
- 17. Tan, F., Dong, W., Lei, X., Liu, X., Li, Q., Kang, L., et al. (2018) Attenuated SUMOylation of Sirtuin 1 in Premature Neonates with Bronchopulmonary Dysplasia. Molecular Medicine Reports, 17, 1283-1288. https://doi.org/10.3892/mmr.2017.8012
- 18. Katayama, A., Ogino, T., Bandoh, N., Takahara, M., Kishibe, K., Nonaka, S., et al. (2007) Overexpression of Small Ubiquitin-Related Modifier-1 and Sumoylated Mdm2 in Oral Squamous Cell Carcinoma: Possible Involvement in Tumor Proliferation and Prognosis. International Journal of Oncology, 31, 517-524. https://doi.org/10.3892/ijo.31.3.517
- 19. Kessler, J.D., Kahle, K.T., Sun, T., Meerbrey, K.L., Schlabach, M.R., Schmitt, E.M., et al. (2012) A SUMOylation-Dependent Transcriptional Subprogram Is Required for Myc-Driven Tumorigenesis. Science, 335, 348-353. https://doi.org/10.1126/science.1212728
- 20. 袁俐, 袁梦岚, 陈旭红, 姜忠敏, 李艳霞, 马晓芳, 等. SUMO-1及ERα在子宫内膜癌中的表达及相关性研究[J]. 国际妇产科学杂志, 2015(4): 470-472, 483.
- 21. 王鑫鑫, 彭正, 李杨, 王华, 王立生, 陈凛. SIRT-1在胃癌组织、细胞中的表达及意义[J]. 山东医药, 2014, 54(12): 1-4, 7, 后插2.
NOTES
*通讯作者。
