Pharmacy Information
Vol.
10
No.
03
(
2021
), Article ID:
42787
,
14
pages
10.12677/PI.2021.103022
基于网络药理学探讨苓甘五味姜辛汤 治疗慢性阻塞性肺疾病有效成分及 分子机制
杨雯钧1*,黄 蓉1,王略力1,肖 创1,方 雁1,李 鲜1,王新华2,张荣平3, 武鸿翔1#,杨为民1#
1昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明
2广州医科大学,广东 广州
3云南中医药大学,云南 昆明
收稿日期:2021年4月26日;录用日期:2021年5月21日;发布日期:2021年5月28日

摘要
目的:运用网络药理学方法探讨苓甘五味姜辛汤治疗慢性阻塞性肺疾病的有效成分及潜在分子机制。方法:通过TCMSP检索苓甘五味姜辛汤的活性成分得到各成分的作用靶点;通过OMIM和GeneCards疾病数据库检索慢性阻塞性肺疾病的相关靶点;将上述得到的药物和疾病靶点导入UNIPROT数据库进行基因的标准化处理,以Venn图展示药物与疾病的交集靶点。运用Cytoscape3.7.2软件构建“药物–成分–靶点–疾病”网络图;利用STRING在线平台构建PPI网络图,根据Degree值筛选核心靶点。利用DAVID在线数据库平台进行GO生物过程和KEGG通路富集分析。筛选得到苓甘五味姜辛汤活性成分130个,预测得到靶点143个,慢性阻塞性肺疾病相关靶点4717个,药物与疾病交集靶点122个。其中核心靶点包括VEGFA、CCL2、TP53、MAPK8、PTGS2、IL1B、IL6等。利用DAVID富集分析得到GO生物条目68条,KEGG通路15条(P < 0.05, FDR < 0.05),其中生物过程(biological process, BP) 47条,分子功能(molecular function, MF) 13条,细胞组分(cell composition, CC) 8条,主要涉及对药物的反应、酶结合和药物结合过程等;主要涉及癌症通路、钙离子信号通路、肿瘤坏死因子信号通路、非小细胞肺癌等信号通路。结论:苓甘五味姜辛汤中的活性成分可以作用于VEGFA、CCL2、TP53、MAPK8、PTGS2、IL1B、IL6等关键靶点,通过调控钙离子信号通路、肿瘤坏死因子信号通路等参与治疗慢性阻塞性肺疾病。
关键词
网络药理学,苓甘五味姜辛汤,慢性阻塞性肺疾病,分子机制
Discussion on Effective Components and Molecular Mechanism of LingganWuweiJiangxin Decoction in Treating Chronic Obstructive Pulmonary Disease Based on Network Pharmacology
Wenjun Yang1*, Rong Huang1, Lueli Wang1, Chuang Xiao1, Yan Fang1, Xian Li1, Xinhua Wang2, Rongping Zhang3, Hongxiang Wu1#, Weimin Yang1#
1School of Pharmaceutical Science and Yunnan Key Laboratory of Pharmacology for Natural Products, Kunming Medical University, Kunming Yunnan
2Guangzhou Medical University, Guangzhou Guangdong
3Yunnan University of Traditional Chinese Medicine, Kunming Yunnan

Received: Apr. 26th, 2021; accepted: May 21st, 2021; published: May 28th, 2021

ABSTRACT
Objective: To explore the effective components and potential molecular mechanism of LingganWuweiJiangxin Decoction in treating chronic obstructive pulmonary disease by network pharmacology. Methods: The active components of LingganWuweiJiangxin Decoction were searched by TCMSP and the action targets of each component were searched by this database. Search the related targets of chronic obstructive pulmonary disease through OMIM and GeneCards disease database; Import the drug and disease targets obtained above into UNIPROT database for gene standardization, and show the intersection target of drug and disease by Venn diagram. The network diagram of “drug-component-target-disease” was constructed by using Cytoscape3.7.2 software. PPI network diagram is constructed by using STRING online platform, and core targets are screened according to Degree value. Enrichment analysis of GO biological process and KEGG pathway using DAVID online database platform. Results: Through TCMSP screening, 130 active ingredients of LingganWuweiJiangxin Decoction and 143 predicted targets, 4717 targets related to chronic obstructive pulmonary disease and 122 targets mapped by drugs and diseases were obtained. Among them, vascular endothelial growth factor A (VEGFA), C-C motif chemokine ligand 2 (CCL2), tumor protein P53 (TP53), mitogen-activated protein kinase 8 (MAPK8), prostaglandin-endoperoxide synthase 2 (PTGS2), interleukin 1 beta (IL1B), interleukin 6 (IL6), tumor necrosis factoe (TNF), mitogen-activated protein kinase 1 (MAPK1) and other nodes have higher degree values, which may be the core targets of drug treatment. According to DAVID enrichment analysis, there are 68 GO biological items (P < 0.05, FDR < 0.05), including 47 biological processes (BP), 13 molecular functions (MF), and 8 cell compositions (CC), which mainly involve the reaction to drugs, positive regulation of cell proliferation, extracellular space, etc. Fifteen KEGG pathways (P < 0.05, FDR < 0.05) were obtained by the same method, mainly involving cancer pathway, calcium signaling pathway, neuroactive ligand-receptor interaction, tumor necrosis factor signaling pathway, hypoxia necrosis factor signaling pathway, non-small cell lung cancer and other signaling pathways. The active components in LingganWuweiJiangxin decoction can act on key targets such as VEGFA, CCL2, TP53, MAPK8, PTGS2, IL1B, IL6, etc., and participate in the treatment of chronic obstructive pulmonary disease by regulating calcium signal pathway, tumor necrosis factor signal pathway and hypoxia necrosis factor signal pathway.
Keywords:Network Pharmacology, LingganWuweiJiangxin Decoction, Chronic Obstructive Pulmonary Disease, Molecular Mechanism

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是由于呼吸气流不能完全逆转、慢性炎症失调和肺气肿性破坏而导致的一种常见的疾病 [1]。COPD是全球发病率、死亡率和医疗保健支出的主要原因 [2],且发病率和死亡率呈逐年上升的趋势。目前临床中多采用气管扩张剂和激素疗法治疗COPD,能在一定程度上缓解患者的临床症状 [3],然而长期使用,也会导致不良反应随之出现。苓甘五味姜辛汤出自《金匾要略》,由茯苓、甘草、干姜、细辛、五味子组成。具有祛痰、止咳、平喘的作用,可以刺激呼吸中枢,扩张支气管,并且可以增强机体免疫力,降低炎症反应 [4]。但苓甘五味姜辛汤治疗COPD的分子机制尚不明确。
网络药理学是基于细胞或表型网络的背景下,有助于我们转变我们传统的“一种药物、一种疾病”的思维模式 [5],有助于我们了解药物多种作用机制。网络药理学构建了“药物–成分–靶点–通路–疾病”之间相互作用关系,对于更好地理解化合物在分子水平上的作用机制和优化治疗效果至关重要。因此本研究运用网络药理学方法分析苓甘五味姜辛汤的活性成分及潜在靶点,为临床应用治疗COPD和后续实验验证提供理论支持。
2. 资料与方法
2.1. 中药成分的获取及靶点预测
通过检索中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP, http://tcmspw.com/tcmsp.php)获取苓甘五味姜辛汤中所有药物的活性成分,在TCMSP数据库中输入苓甘五味姜辛汤的组方药物名称,查询相关药物并在数据库中以口服生物利用度(oral bioavailability, OB) ≥ 30%和药物类似性(drug-likeness, DL) ≥ 0.18为筛选标准,筛选得到苓甘五味姜辛汤的所有活性成分。通过TCMSP预测得到所有活性成分的潜在靶点,将靶点导入Uniport数据库(https://www.uniprot.org/)进行基因的标准化处理。
2.2. COPD疾病靶点的获取
以“chronic obstructive pulmonary disease”为关键词在GeneCards (http://www.genecards.org/)和OMIM (http://www.omim.org/)数据库检索得到COPD相关靶点,对两个数据库合并删除重复值后得到COPD疾病的最终靶点。
2.3. Venn图构建
将苓甘五味姜辛汤的药物靶点映射到COPD疾病靶点中,得到苓甘五味姜辛汤治疗COPD的交集靶点,并以Venn图展示。
2.4. 药物–成分–靶点–疾病网络图构建
将苓甘五味姜辛汤中的活性成分及靶点,以及药物–疾病交集靶点数据导入到Cytoscape3.7.2软件中,构建“药物–成分–靶点–疾病”网络图,利用“Network Analyzer”功能进行分析,其中节点代表苓甘五味姜辛汤中的药物及其活性成分、疾病、靶点,边代表苓甘五味姜辛汤中药物与成分、成分与靶点、疾病与靶点之间的相互作用关系。
2.5. PPI网络图及核心靶点网络图构建
将药物与疾病的交集靶点导入STRING数据库(http://string-db.org),选择物种为“Homo sapiens”,得到药物与疾病交集靶点的蛋白互作关系。将在STRING数据库下载的TSV格式数据导入Cytoscape3.7.2软件中,以Degree值大于平均值为筛选条件,筛选苓甘五味姜辛汤治疗COPD的核心靶点,并以核心靶点网络图展示。
2.6. GO功能和KEGG通路富集分析
将药物与疾病的交集靶点导入DAVID数据库(https://david.ncifcrf.gov/),选择“official gene symbol”,物种选择为“Homo sapiens”,并以P < 0.05和FDR < 0.05为筛选标准,富集得到苓甘五味姜辛汤治疗COPD的生物学过程和通路。其中将GO生物过程数据导入Omicshare在线数据库平台,制成条形图展示;KEGG通路以表格形式展示。
3. 结果
3.1. 苓甘五味姜辛汤成分及靶点获取
通过检索TCMSP得到苓甘五味姜辛汤活性成分785个,以OB ≥ 30%和DL ≥ 0.18为筛选标准,筛选得到130个有效活性成分,其中茯苓15个,甘草93个,干姜5个,细辛8个,五味子9个,预测得到靶点346个,删除重复值后得到143个靶点,见表1。
Table 1. Active ingredients of LingganWuweiJiangxin Decoction
表1. 苓甘五味姜辛汤活性成分表
3.2. 药物与疾病交集靶点Venn图
通过检索OMIM和GeneCards数据库共获得4875个疾病靶点,合并数据库删除重复值后得到4717个疾病靶点。将药物靶点映射到疾病靶点中,获得122个交集靶点,制成Venn图,见图1。说明以上靶点是苓甘五味姜辛汤治疗COPD的潜在靶点。

Figure 1. Venn diagram of intersection target of drug and disease
图1. 药物与疾病交集靶点Venn图
3.3. 药物–成分–靶点–疾病网络图构建
运用Cytoscape3.7.2软件构建“药物–成分–靶点–疾病”网络图,图2所示,图中共有285个节点(疾病1个,药物5个,靶点152个,成分127个),2746条边。其中黄色代表甘草活性成分,紫色代表茯苓活性成分,红色代表五味子活性成分,蓝色代表细辛活性成分,绿色代表干姜活性成分,三角形代表“药物–成分–疾病”共同作用靶点。苓甘五味姜辛汤中的活性成分如来源于细辛的山奈酚、来源于甘草的槲皮素、来源于干姜的β-谷甾醇等节点的度值分别为112、88、52,说明以上成分在苓甘五味姜辛汤治疗COPD疾病中参与度较高。
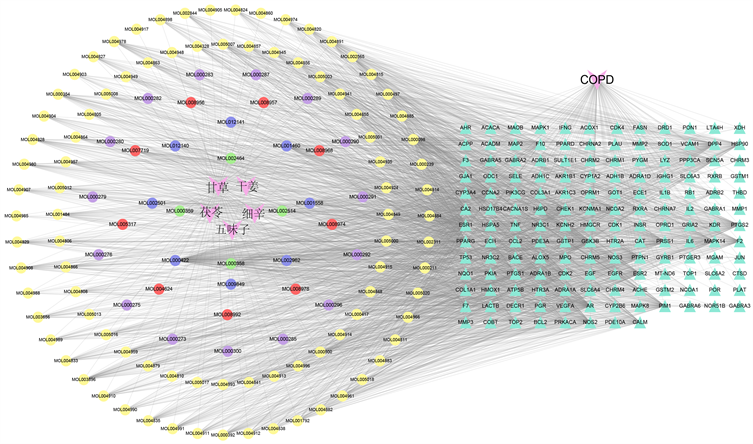
Figure 2. Network of drug component target and disease
图2. 药物–成分–靶点–疾病网络图
3.4. PPI网络图及核心靶点网络图构建
将药物与疾病的交集靶点导入STING数据库,得到映射靶点之间的蛋白互作网络图,见图3。图中共有122个节点,1294条边,平均节点数为21.2。节点代表靶蛋白,节点值越高证明该靶点在药物治疗疾病中越处于核心地位,边代表靶蛋白之间的相互作用关系。将STRING数据库得到的数据以TSV格式导入Cytoscape3.7.2软件筛选核心靶点,以Degree > 22为筛选标准筛选得到苓甘五味姜辛汤治疗COPD的核心靶点(见图4)。通过比较Degree值大小,预测VEGFA、PTGS2、TNF、IL6、MAPK1、MAPK8等靶点与苓甘五味姜辛汤治疗COPD的关系紧密。
3.5. GO功能富集分析
对苓甘五味姜辛汤治疗COPD的潜在靶点进行GO生物功能分析,以P < 0.05和FDR < 0.05为筛选标准,得到GO生物条目(P < 0.05,FDR < 0.05) 68条,其中生物过程(biological process, BP) 47条,分子功能(molecular function, MF) 13条,细胞组分(cellular component, CC) 8条,其中BP主要涉及对药物的反应(response to drug)、细胞增殖的正调控(positive regulation of cell proliferation)、对乙醇的反应(response to ethanol)等,CC主要涉及细胞外空间(extracellular space)、质膜(plasma membrane)等,MF主要包括酶结合(enzyme binding)、药物结合(drug binding)、类固醇激素受体活性(steroid hormone receptor activity)等。说明苓甘五味姜辛汤的活性成分可能通过以上生物过程参与治疗COPD。按P值降序排列,分别选取前8条制成柱状图展示,见图5。

Figure 3. Protein interaction network of lingganWuweiJiangxin Decoction in the treatment of COPD
图3. 苓甘五味姜辛汤治疗COPD蛋白互作网络图

Figure 4. Core target network of lingganWuweiJiangxin Decoction in the treatment of COPD
图4. 苓甘五味姜辛汤治疗COPD核心靶点网络图
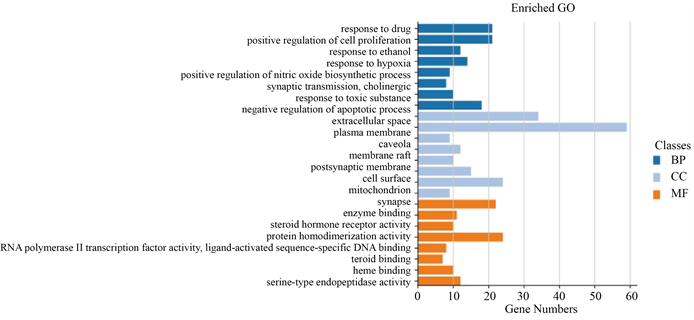
Figure 5. Enrichment analysis results of GO
图5. GO功能富集分析结果
3.6. KEGG通路富集分析
对苓甘五味姜辛汤治疗COPD的潜在靶点进行KEGG通路富集分析,以P < 0.05和FDR < 0.05为筛选标准,富集分析得到15条KEGG通路(P < 0.05, FDR < 0.05),靶基因主要富集在癌症信号通路、钙离子信号通路、TNF信号通路、HIF-1信号通路、非小细胞肺癌信号通路、小细胞肺癌、PI3K-Akt信号通路等信号通路中,说明苓甘五味姜辛汤中的潜在靶点可能通过调控以上通路参与治疗COPD。按P值降序排列,将筛选出的前15条信号通路信息制成三线表展示,见表2。
Table 2. Enrichment analysis results of KEGG
表2. KEGG富集分析结果
4. 讨论
传统中医学中并无“慢性阻塞性肺疾病”病名,传统医学将其归属于“肺胀”“咳嗽病”范畴 [3],中医学认为其基本病机为肺脾两虚,病位在肺,久而伤脾。
古人云:“脾为生痰之源,肺为贮痰之器”,是指脾脏功能下降,不能运化水湿,痰液停聚于肺而导致咳嗽。苓甘五味姜辛汤具有健脾渗湿、温肺化饮的功效 [6],能够补脾益肺,促进脾肺功能恢复正常,现代研究表明,苓甘五味姜辛汤可以通过调控相关基因的表达参与调节气道液体的分泌 [7],从而控制肺部感染 [8]。余白桦等 [9] 观察苓甘五味姜辛汤治疗80例慢性阻塞性患者,临床有效率97.5%,说明苓甘五味姜辛汤可以有效缓解患者临床症状,改善肺功能,减缓患者COPD的进程。以上证实苓甘五味姜辛汤能够有效改善COPD患者的临床症状,减轻炎症反应,但是其治疗COPD的分子机制尚不明确,因此本研究运用网络药理学的方法探讨苓甘五味姜辛汤治疗COPD的分子机制,以期更好地应用到临床。
通过“药物–成分–靶点–疾病”网络图中可以看出,苓甘五味姜辛汤的活性成分度值较高的包括山奈酚、槲皮素、β-谷甾醇、7-甲氧基-2-甲基异黄酮等。慢性阻塞性肺疾病的炎症反应会损伤气道,山奈酚具有抗炎、镇咳的功效 [10],山奈酚可以降低气道炎症反应,从而减缓COPD的进程,并且其镇咳功效可以缓解临床中的咳嗽症状。研究证明,山奈酚可抑制STAT3的激活调控Tyk-STAT信号通路的表达,从而抑制炎症的发展进程 [11],因此山奈酚能够减轻COPD的炎症反应。肺部和气道炎症、氧化和抗氧化失调是COPD的主要发病机制 [12],槲皮素通过提高NO和T-AOC水平来进行抗氧化作用,保护血管内皮细胞免受炎症因子破坏 [13],从而增强细胞的抗损伤能力。同时槲皮素可以通过调控IL-1R、Ccl8、IKK和STAT3等相关炎症因子的表达降低炎症反应 [14],改善COPD疾病的气道和肺部炎症。
苓甘五味姜辛汤治疗COPD的核心靶点涉及VEGFA、PTGS2、TNF、IL6、MAPK1、MAPK8等,说明以上靶点在苓甘五味姜辛汤治疗COPD的过程中处于核心地位。COPD重要的生理特征是气道重塑 [15],VEGFA参与COPD气道重塑,VEGFA的高表达会促进血管内皮细胞增殖和迁移,诱导气道血管增殖,加重气道纤维化 [16],进而导致气道内壁增厚,导致气流受限。因此,抑制COPD的VEGFA表达水平,能够抑制气道重塑进而改善COPD [15]。MAPK系列因子与呼吸系统疾病关系密切,MAPK1和MAPK8等系列因子活化参与COPD气道重塑 [17],因此抑制COPD患者中MAPK系列因子的活化,可以有效抑制气道平滑肌细胞增生,进而减缓COPD进程。COPD患者血液和气道中炎症细胞TNF和IL6显著升高 [18],因此抑制TNF和IL6相关炎症因子的表达可以减轻COPD患者的炎症反应。
富集分析得到苓甘五味姜辛汤治疗COPD的生物学过程主要涉及对药物的反应、细胞增殖的正调控、对乙醇的反应、细胞外空间、质膜等,MF主要包括酶结合、药物结合、类固醇激素受体活性等,说明苓甘五味姜辛汤通过细胞增殖、炎症反应等参与调控治疗COPD。通过对KEGG通路富集分析发现,发现COPD与15条信号通路关系密切,因此认为苓甘五味姜辛汤可能通过以上通路调控治疗COPD。钙离子信号通路的激活会导致细胞内钙离子浓度的增加,钙离子浓度的增加会加速炎症反应的发生 [19],从而加快COPD疾病的发生和发展。TNF信号通路中的炎症因子早期会释放大量促炎因子,进而诱导IL-1、IL-6炎症因子的产生 [20],加重COPD的炎症反应 [21]。PI3K-Akt信号通路中的PI3K因子可以调控气道平滑肌细胞的增殖,干预TH2细胞、B细胞及嗜酸性粒细胞的炎症反应过程 [22],从而干预COPD的进程。PI3K-Akt通路在调解树突状细胞和巨噬细胞表达抗炎和促炎因子方面发挥着关键作用 [23],因此调控PI3K-Akt通路可以减轻COPD的炎症反应。进一步证实苓甘五味姜辛汤可以通过多成分、多靶点、多通路参与治疗COPD [24]。
综上所述,苓甘五味姜辛汤中的130个有效成分作用于143个靶点,15条信号通路,主要通过抗炎、抗氧化改善气道重塑和肺部炎症,多成分、多靶点、多通路参与治疗COPD,为深入研究苓甘五味姜辛汤治疗COPD分子机制提供理论依据。
基金项目
国家自然科学基金(81870037,81760869),云南省科技厅项目(2018HC007,2019HC008,202005AF150043,2019FD020),广州医科大学呼吸疾病国家重点实验室开放课题(SKLRD-OP-201917)。
文章引用
杨雯钧,黄 蓉,王略力,肖 创,方 雁,李 鲜,王新华,张荣平,武鸿翔,杨为民. 基于网络药理学探讨苓甘五味姜辛汤治疗慢性阻塞性肺疾病有效成分及分子机制
Discussion on Effective Components and Molecular Mechanism of LingganWuweiJiangxin Decoction in Treating Chronic Obstructive Pulmonary Disease Based on Network Pharmacology[J]. 药物资讯, 2021, 10(03): 158-171. https://doi.org/10.12677/PI.2021.103022
参考文献
- 1. Bagdonas, E., Raudoniute, J., Bruzauskaite, I. and Aldonyte, R. (2015) Novel Aspects of Pathogenesis and Regeneration Mechanisms in COPD. International Journal of Chronic Obstructive Pulmonary Disease, 10, 995-1013. https://doi.org/10.2147/copd.s82518
- 2. Soriano, J.B. (2017) An Epidemiological Overview of Chronic Obstruc-tive Pulmonary Disease: What Can Real-Life Data Tell Us about Disease Management? COPD: Journal of Chronic Ob-structive Pulmonary Disease, 14, S3-S7. https://doi.org/10.1080/15412555.2017.1286165
- 3. 崔磊. 平喘养肺汤联合布地奈德治疗COPD稳定期患者的疗效与安全性研究[J]. 世界中医药, 2020, 15(14): 2097-2100.
- 4. 张军, 郑武熙. 苓甘五味姜辛汤对慢性阻塞性肺疾病患者的效果探讨[J]. 中医临床研究, 2020, 12(12): 20-21.
- 5. Baptiste, B., Karine, A., Pierre, D. and Taboureau, O. (2017) Network-Based Approaches in Pharmacology. Molecular Informatics, 36, Article ID: 1700048. https://doi.org/10.1002/minf.201700048
- 6. 范杰, 王鹏东, 谢宇平. 苓甘五味姜辛汤治疗慢性阻塞性肺疾病思路[J]. 亚太传统医药, 2019, 15(10): 116-117.
- 7. 李荣科, 李岩, 安耀荣, 王燕, 朱向东. 苓甘五味姜辛汤对哮喘大鼠中p-CREB、MUC5ACmRNA的表达和蛋白相对表达量的影响[J]. 时珍国医国药, 2016, 27(9): 2126-2129.
- 8. 邓秀娟, 谭宇军. 苓甘五味姜辛汤联合三子养亲汤治疗哮喘-慢阻肺重叠综合征的临床观察[J]. 中国社区医师, 2020, 36(16): 88-89.
- 9. 余白桦, 张丹芳, 陈瑞发. 苓甘五味姜辛汤加味治疗慢性阻塞性肺疾病临床研究[J]. 河南中医, 2016, 36(5): 768-770.
- 10. Zhu, J.X., Wen, L., Zhong, W.J., Xiong, L., Liang, J. and Wang, H.‐L. (2018) Quercetin, Kaempferol and Isorhamnetin in Elaeagnus pungens THUNB. Leaf: Pharmacological Activities and Quantitative Determination Studies. Chemistry & Biodiversity, 15, e1800129. https://doi.org/10.1002/cbdv.201800129
- 11. Gong, J.-H., Shin, D., Han, S.-Y., Park, S.-H., Kang, M.-K., Kim, J.-L., et al. (2013) Blockade of Airway Inflammation by Kaempferol via Disturbing Tyk-STAT Signaling in Airway Ep-ithelial Cells and in Asthmatic Mice. Evidence-Based Complementary and Alternative Medicine, 2013, Article ID: 250725. https://doi.org/10.1155/2013/250725
- 12. Mirza, S., Clay, R.D., Koslow, M.A. and Scanlon, P.D. (2018) COPD Guidelines: A Review of the 2018 GOLD Report. Mayo Clinic Proceedings, 93, 1488-1502. https://doi.org/10.1016/j.mayocp.2018.05.026
- 13. 杨颖, 王芸芸, 蒋琦辰. 槲皮素药理作用的研究进展[J]. 特种经济动植物, 2020, 23(5): 24-28.
- 14. Robert, K., Lars, V., Martine, M., Zadelaar, S., van Erk, M.J., Wielinga, P.Y., et al. (2011) Anti-Inflammatory, Anti-Proliferative and Anti-Atherosclerotic Effects of Quercetin in Human in Vitro and in Vivo Models. Atherosclerosis, 218, 44-52. https://doi.org/10.1016/j.atherosclerosis.2011.04.023
- 15. 童卫泉, 杨宏宽, 夏婷婷, 刘贤忠, 陈彬, 陈芳. 雷帕霉素对慢性阻塞性肺疾病大鼠气道重塑中血管内皮生长因子表达作用的研究[J]. 中国全科医学, 2016, 19(36): 4484-4488+4494.
- 16. Aguilera, A., Yáñez-Mo, M., Selgas, R., Sánchez-Madrid, F. and López-Cabrera, M. (2005) Epithelial to Mesenchymal Transition as a Triggering Factor of Peri-toneal Membrane Fibrosis and Angiogenesis in Peritoneal Dialysis Patients. Current Opinion in Investigational Drugs, 6, 262-268.
- 17. 李丹丹, 任卫英, 朱蕾. p38丝裂原活化蛋白激酶在肺部疾病中的研究进展[J]. 复旦学报(医学版), 2018, 45(3): 413-417.
- 18. Zheng, X., Zhang, L., Chen, J., Gu, Y., Xu, J. and Ouyang, Y. (2018) Dendritic Cells and Th17/Treg Ratio Play Critical Roles in Pathogenic Process of Chronic Obstructive Pulmonary Disease. Biomedicine & Pharmacotherapy, 108, 1141-1151. https://doi.org/10.1016/j.biopha.2018.09.113
- 19. 王丽萍, 谢栓栓, 王昌惠. PM2.5对呼吸系统疾病的影响及其相关机制[J]. 临床肺科杂志, 2019, 24(1): 148-151.
- 20. 徐炎, 孔一卜, 韩晶, 等. 基于网络药理学的麻黄治疗肺炎的作用机制研究[J/OL]. 中华中医药学刊: 1-14. [2020-08-05]
- 21. Haugen, J., Chandyo, R.K., Brokstad, K.A., Mathisen, M., Ulak, M., Basnet, S., et al. (2015) Cytokine Concentrations in Plasma from Children with Severe and Non-Severe Community Acquired Pneumonia. PLoS ONE, 10, e0138978. https://doi.org/10.1371/journal.pone.0138978
- 22. Patel, .K. and Mohan, C. (2005) PI3K/AKT Signaling and Sys-temic Autoimmunity. Immunologic Research, 31, 47-55. https://doi.org/10.1385/IR:31:1:47
- 23. 吴盈盈, 胥文春, 尹一兵, 杨平, 张刘丽, 万红, 等. NF-κB和PI3K-Akt通路调节肺炎链球菌HSP40诱导小鼠巨噬细胞免疫应答[J]. 免疫学杂志, 2017, 33(1): 18-22.
- 24. 岳勤霏, 陈叶青, 范欣生. 基于网络药理学的金水六君煎治疗慢性阻塞性肺疾病作用机制研究[J]. 南京中医药大学学报, 2020, 36(3): 358-364.
NOTES
*第一作者。
#通讯作者。
