Open Journal of Nature Science
Vol.06 No.03(2018), Article ID:25242,9
pages
10.12677/OJNS.2018.63034
Preparation and Application of Antibodies against Antigen VP1-Unique of Human Bocavirus 1
Duo Xu, Wenkuan Liu*, Aiping You, Zhichao Zhou, Shuyan Qiu, Chi Li, Shujun Gu, Rong Zhou
State Key Laboratory of Respiratory Diseases, National Clinical Research Center for Respiratory Disease, Guangzhou Institute of Respiratory Health, The First Affiliated Hospital of Guangzhou Medical University, Guangzhou Medical University, Guangzhou Guangdong

Received: May 10th, 2018; accepted: May 24th, 2018; published: May 31st, 2018

ABSTRACT
Human bocavirus 1 (HBoV1) is an important respiratory virus in the world, and its research is still in its early stages. In this study, the antigen VP1-unique (VP1u) of HBoV1 was expressed and purified using prokaryotic expression. The antibody was successfully obtained from immunized mice, and then evaluated by ELISA against the corresponding protein and clinical HBoV1-positive samples. The A450 value had 4-fold higher in the positive antibody than the negative control against clinical HBoV1-positve samples at 1:50 dilution. The antibody was successfully used in the immunofluorescence study of VP1u of HBoV1 Guangzhou strain (GU338055) reverse genetic system. In this study, we successfully prepared and evaluated antibody against antigen VP1u of HBoV1. The study provided an important tool for the further study of HBoV1.
Keywords:Human Bocavirus 1, VP1u, Antibody, Immunofluorescence
人博卡病毒1型独特区VP1u抗体制备及应用
许多,刘文宽*,游爱萍,周志超,邱淑燕,李炽,辜淑君,周荣
呼吸疾病国家重点实验室,国家呼吸系统疾病临床医学研究中心,广州呼吸健康研究院,广州医科大学附属第一医院,广州医科大学,广东 广州

收稿日期:2018年5月10日;录用日期:2018年5月24日;发布日期:2018年5月31日

摘 要
人博卡病毒1型(human bocavirus 1, HBoV1)是全球流行的重要呼吸道病毒,对其的研究尚处于初期阶段。本研究针对HBoV1的VP1独特区(VP1u)通过原核表达的方式进行蛋白表达,并通过纯化、免疫小鼠成功获得了蛋白的抗体血清,通过ELISA评价了抗体对相应蛋白及临床病毒阳性样品的效价,并在后者发现制备抗体在1:50稀释时A450对阴性对照有4倍升高。利用所制备的抗体成功用于HBoV1广州株(GU338055)反向遗传系统的VP1u的免疫荧光研究中。本研究成功制备了HBoV1抗原VP1u抗体并应用,为HBoV1后续深入研究提供了重要的工具,具有重要意义。
关键词 :人博卡病毒1型,VP1u,抗体,免疫荧光

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
人博卡病毒1型(Human bocavirus 1, HBoV1),是Allander等人于2005年首次发现,归属于细小病毒科,细小病毒亚科,博卡病毒属 [1] 。HBoV1后被证实是一种全球流行的重要呼吸道病原体,感染呼吸道可引起上、下呼吸道感染,并常与其他病原体产生共感染 [2] [3] [4] 。HBoV1本身是一种体积较小、具有二十面体衣壳、无包膜的单链线性DNA病毒,病毒粒子直径约为26 nm。目前仅有一例HBoV1完整基因组被测序,其长度为5543 nt (JQ923422),其基因组序列、转录谱和表达谱分析表明,其至少表达两种衣壳蛋白:VP1和VP2;两种非结构蛋白NS1和NP1。其中VP1、VP2分别有672aa、542aa,具有典型的基因重叠区,其中VP1-N端为非重叠区,长度为129aa,即VP1独特区(VP1-unique, VP1u)、后面为两个衣壳蛋白的重叠区(VP1/2),长度542aa,序列完全相同 [1] [5] [6] 。HBoV1由于其感染具有很强组织特异性,有文献报道其与AAV2/HBoV1形成的嵌合病毒有作为肺囊性纤维化(cysticfibrosis, CF)基因治疗载体的潜质 [7] [8] 。研究表明HBoV1的VP2可独立形成病毒样颗粒(Virus-like particles, VLP) [9] ,而HBoV1的VP1u区有磷脂酶A2样活性(Phospholipase A2-like activity),可以破坏细胞紧密连接 [10] [11] ,可见VP1u在HBoV1的感染和组织特异性方面可能都起到重要的作用。
为进一步对HBoV1进行深入研究,本研究针对VP1u区进行原核表达、纯化并通过免疫小鼠获得其抗体,为后续HBoV1感染研究奠定基础。
2. 材料与方法
2.1. HBoV广州株VP1u片段扩增
1) 主要抗原片段PCR引物设计
本研究针对前期获得的来源于60岁女性肺炎患者的HBoV1广州株(Access number: GU338055)进行抗原VP1u (aa 1–129)片段PCR引物设计,产物长度390 bp。
其中正向引物VP1u-gst-SalIF为5’-AAAGTCGACATGCCTCCAATTAAGAGACAGCCTA-3’;
反向引物VP1u-gst-NotIR为5’-AAAGCGGCCGCTTATGAGGTTCCTGGTTTAGGTTCACTC-3’。
2) 扩增条件:使用HBoV1广州株(Access number: GU338055)构建的反向遗传系统全长质粒(pHBoV-S2)作为模板,使用PrimeSTAR® Max DNA Polymerase 25 μl体系(Takara)对VP1u目标片段进行扩增反应
反应条件如下:预变性94˚C 5 min;循环条件(30×):98˚C 10 sec、55˚C 15 sec、72˚C 30 sec;延伸温度72˚C 5 min。1%琼脂糖凝胶电泳检测2 μl扩增产物。
3) 扩增产物纯化:使用Axygen® AxyPrep™ DNA Gel Extraction Kit(爱思进生物技术(杭州)有限公司)进行目标DNA的凝胶回收及纯化。
2.2. 原核表达载体构建、蛋白表达及纯化
2.2.1. 利用pGEX-4T-3质粒构建HBoV1 VP1u原核表达载体pGEX-VP1u。
1) 质粒与纯化的扩增片段酶切
使用Sal I和Not I(NEB)对pGEX-4T-3及PCR扩增的VP1u片段进行双酶切,50 μl酶切条件如下:
至37˚C水浴中2 h后,使用Axygen® AxyPrep™ DNA Gel Extraction Kit进行目标DNA的凝胶回收及纯化。
2) 连接
使用T4 DNA ligase (NEB)连接酶切的pGEX-4T-3与VP1u的双酶切产物,构建原核表达载体pGEX-VP1u。10μl连接条件如下:
至于16˚C中2 h。
3) 转化
使用E. coli TOP10感受态细胞(天根生化科技(北京)有限公司)转化连接产物,步骤如下:冰上融化感受态细胞,吸取连接产物至感受态中,冰浴30 min,42˚C热激45 sec,迅速转至冰浴2 min,加入无抗性LB培养基 500 μl至37˚C摇床中250 rpm 1 h,取200μl涂布氨苄青霉素LB固体平板(LB-Amp+平板),37˚C培养箱中倒置过夜培养。
4) 挑取单菌落并验证
挑取平板上的单菌落至含0.8 ml LB-Amp+液体培养基的1.5 ml离心管中,37˚C摇床中250 rpm培养4~5 h,使用菌落PCR进行阳性克隆筛选,即使用前述VP1u扩增引物VP1u-gst-SalIF/VP1u-gst-NotIR1中各片段扩增引物进行分别验证。菌落PCR条件如下:
反应条件:预变性95˚C 5 min;循环条件(30×):94˚C 30 sec、55˚C 30 sec、72˚C 30 sec;延伸温度72˚C 5 min。1%琼脂糖凝胶电泳检测扩增片段。挑选2例测序验证。
5) 使用AxyPrep质粒DNA小量试剂盒(Axygen)提取最终确认正确的pGEX-VP1u。使用0.5 μl提取质粒转化E. coli BL21感受态细胞(天根生化科技(北京)有限公司),方法同前述。
2.2.2. 蛋白表达及纯化
1) 蛋白表达
使用IPTG (Sigma)诱导蛋白表达,为获得可溶性蛋白,调整IPTG浓度、诱导时间、诱导温度,但最终目标蛋白未能获得可溶性目标蛋白,使用KCL染色切胶回收目标蛋白。步骤如下:挑取pGEX-VP1u阳性E. coli BL21接种至10 ml LB-Amp+液体培养基,37˚C摇床中220 rpm培养过夜;将培养物接种至100 ml LB-Amp+液体培养基中,37˚C摇床中220 rpm培养1~2 h,加入IPTG进行蛋白诱导表达;诱导条件为:IPTG终浓度0.8 mM、37˚C 220 rpm诱导5 h。
2) 蛋白纯化
5000 rpm 4˚C离心15 min收集菌体,加入10 ml PBS重悬细菌,使用冰上超声破碎细菌(20 sec开、5 sec停、70%功率、10~20 min)至菌液变青色。10,000 rpm 4˚C离心30 min弃上清。沉淀中加入8 ml PBS重悬沉淀,加入2 ml 5 × SDS上样缓冲液,100˚C变性5 min,10,000 rpm 4˚C离心30 min获得上清。使用上清进行SDS-PAGE,用经过预冷的0.25M KCL对蛋白胶进行染色(目标条带呈白色)。用干净的刀片切下目标条带,在蒸馏水中润洗脱盐,取出至干净的管中。剪碎凝胶,加入过量PBS,放入4˚C冰箱中过夜。第二天收集浸泡液(吸之前振荡),再加入PBS 4˚C过夜浸泡收集一次。使用10KD超滤管(Millipore)浓缩目标蛋白;12% SDS-PAGE检测目标蛋白,Bradford法检测蛋白浓度。
2.3. 小鼠免疫及效价检测
1) 目标蛋白使用100 μl完全弗氏佐剂(Sigma)与100 μl含50 μg目标蛋白充分乳化,腹腔注射BALB/c 六周龄小鼠,总计4次免疫。免疫后取血清。
2) 使用制备的抗原及临床HBoV1阳性样品分别进行ELISA抗体评价。将所用抗原用包被液稀释到2.5 μg/ml(制备的蛋白抗原)或使用确认的临床病毒阳性样品,酶标板每孔加入100 μl, 置4˚C,24 h包被;弃去孔中液体,使用150 μl封闭液37˚C封闭2 h;弃去孔中液体并洗涤5次,每次3 min;加入不同稀释梯度的血清样品进行检测,使用未免疫小鼠血清作为阴性对照,置于37˚C,30 min。用洗涤液满孔洗涤5遍,每遍3 min;加入酶标抗体(HRP-羊抗鼠)37˚C,30 min之间;洗涤5次后使用TMB-过氧化氢尿素溶液底物反应(Millipore),37˚C避光放置3~5 min,加入终止液显色,测A450。
2.4. 抗体在HBoV1免疫荧光实验中的应用
使用所制备的VP1u抗体血清对转染HBoV1反向遗传系统全长质粒pHBoV-S2的AD293细胞进行免疫荧光实验。
1) 提前一天于24孔板中接种AD293细胞,使用Lipofectamine 3000化转试剂转染质粒至细胞,转染后在37˚C 5% CO2培养箱中培养72 h。
2) 使用所制备抗体进行VP1u的免疫荧光检测。步骤如下:24孔板中细胞PBS浸洗3次,每次3 min;用4%的多聚甲醛固定15~30 min,PBS浸洗孔3次,每次3 min;0.5% Triton X-100 (PBS配制)室温通透20 min;PBS浸洗孔3次,每次3 min,吸干PBS,在孔中加正常10%山羊血清,室温封闭30 min;吸掉封闭液,每孔加足够量的稀释好的所制备的一抗血清(1:50),并使用阴性小鼠血清作为阴性对照,放入湿盒,37˚C 1 h;PBST浸洗孔3~6次,每次3 min,吸干孔中多余液体后滴加稀释好的荧光二抗(FITC-羊抗鼠) (联科生物),湿盒中37˚C孵育1 h,PBST浸洗孔3次,每次3 min;(注意:从加荧光二抗起,后面所有操作步骤都尽量在较暗处进行)。吸干孔中的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
3. 实验与结果
3.1. HBoV1 VP1u片段原核表达载体构建
实验通过PCR获得了VP1u的目标片段(图1),并利用pGEX-4T-3构建了原核表达载体pGEX-VP1u(图2),并最终通过测序验证正确。
3.2. 蛋白表达与纯化
通过KCL染色切胶回收,获得VP1u目标蛋白(GST-VP1u融合蛋白分子量为40.2KD) (图3),浓度
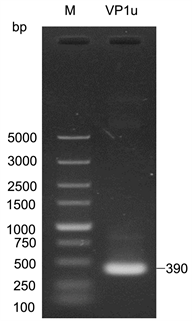
Figure 1. The DNA fragments of HBoV1 antigen VP1u; M: DNA marker
图1. HBoV1抗原VP1u DNA扩增产物;M:DNA marker

Figure 2. Construction of prokaryotic expression plasmids for HBoV1 antigen VP1u; M: DNA marker; 1: pGEX-VP1u; 2: pGEX-4T-3
图2. HBoV1 VP1u原核表达载体构建;M:DNA marker;1:pGEX-VP1u;2:pGEX-4T-3

Figure 3. SDS-PAGE test for proteins of HBoV1 VP1u; M: Protein marker; 1: GST-VP1u fusion protein; 2: IPTG-induced E.coli BL21-VP1u; 3:Non-IPTG-induced E.coli BL21-VP1u
图3. HBoV1 VP1u蛋白SDS-PAGE;M: Protein marker;1:GST-VP1u融合蛋白;2:IPTG诱导菌;3:IPTG未诱导菌
为1.055 μg/μl。
3.3. 免疫与抗体效价
通过免疫BALB/c小鼠,获得一批免疫血清,分别使用蛋白抗原和阳性临床标本对其进行评价(表1) (表2)。与阴性小鼠血清对比2倍以上升高的稀释度起始于1:1,000,000;使用阳性样品进行的评价表明,其在1:50情况下约有4倍升高。
3.4. 抗体在HBoV1免疫荧光实验中的应用
使用制备的抗体,对利用反向遗产系统制备的HBoV1进行主免疫荧光检测(图4)。实验结果显示VP1u在细胞中的分布。
4. 讨论
HBoV1是全球流行的重要呼吸道病原体,由于其很难获得纯培养病毒,对其的研究还处于初始阶段,更无相应的动物模型建立,所以对其感染及致病的机制还需更多的研究。目前体外研究表明感染HBoV1后可导致分化的组织样支气管上皮细胞(HAE)的纤毛减少、紧密连接遭到破坏、细胞肥大,这些特点与肺损伤的组织变化非常相似 [5] ,在一定程度上解释了HBoV1的致病机制,而研究表明VP1u的磷脂酶A2样活性(Phospholipase A2-like activity)具有损坏紧密连接的作用 [10] [11] ,说明了VP1u在病毒致病中
Table 1. A450 values at different serum dilutions in ELISA using protein antigen
表1. 蛋白抗原ELISA检测不同血清稀释度下的A450值
注:实验设置3个平行复孔,数据为A450值Mean ± SD。Note: The experiment set three parallel tests, the data for the A450 value Mean ± SD.
Table 2. A450 values at different serum dilutions in ELISA using clinical HBoV1-positive sample antigen
表2. 临床HBoV1阳性样品ELISA验证不同血清稀释度下的A450值
注:实验设置3个平行复孔,数据为A450值Mean ± SD。Note: The experiment set three parallel tests, the data for the A450 value Mean ± SD.

Figure 4. Immunofluorescence detection of HBoV1 antigen VP1u using antibody preparation. Note: Using 1:50 dilution of the preparation antibody as primary antibody, using negative mouse serum as a primary control, using FITC-goat anti-mouse antibody as secondary antibody.
图4. 利用制备抗体对HBoV1抗原VP1u进行免疫荧光检测。注:使用1:50稀释的制备抗体作为一抗,使用阴性小鼠血清作为一抗对照,使用FITC-羊抗鼠抗体作为二抗。
的重要作用。HBoV1的感染对气道上皮细胞的纤毛和紧密连接的破坏,可能导致人体防御外来侵害的第一道防线遭到破坏,可能导致人体对外部病原体更加易感,也一定程度上解释了HBoV1存在的高共感染率。这些证据表明HBoV1感染的影响可能不仅仅局限于自身导致疾病的产生,同时也在于导致其他病原体易感。
本研究针对HBoV1 VP1u进行抗体制备。研究利用pGEX-4T-3质粒成功构建了pGEX-VP1u表达载体(图1、图2),并通过诱导表达获得目标蛋白(图3)。实验通过腹腔免疫小鼠获得抗体血清,并分别利用目标蛋白和临床阳性标本评价抗体效价(表1、表2)。在利用阳性标本进行的评价中,三种血清1:50稀释后,A450均可获有4倍提升(表2),说明所制备的抗体可以满足用于后续的实验应用。为进一步验证抗体的效果,实验针对HBoV1广州株反向遗传系统转染制备的病毒进行免疫荧光检测(图4),获得了良好的效果,证明了其具有良好的应用效果。
本研究针对HBoV1 VP1u抗原进行了抗体制备,实验证明所制备抗体具有良好的效果,为HBoV1的研究提供了重要的工具,为其后续研究奠定重要的基础。
基金项目
国家自然科学基金-青年基金项目(31500143);国家“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项(2018ZX10102001, 2017ZX10103011)。
文章引用
许 多,刘文宽,游爱萍,周志超,邱淑燕,李 炽,辜淑君,周 荣. 人博卡病毒1型独特区VP1u抗体制备及应用
Preparation and Application of Antibodies against Antigen VP1-Unique of Human Bocavirus 1[J]. 自然科学, 2018, 06(03): 237-245. https://doi.org/10.12677/OJNS.2018.63034
参考文献
- 1. Allander, T., Tammi, M.T., Eriksson, M., Bjerkner, A., Tiveljung-Lindell, A. and Andersson, B. (2005) Cloning of a Human Parvovirus by Molecular Screening of Respiratory Tract Samples. Proceedings of the National Academy of Sciences of the United States of America, 102, 12891-12896. https://doi.org/10.1073/pnas.0504666102
- 2. Schlaberg, R., Ampofo, K., Tardif, K.D., Stockmann, C., Simmon, K.E., Hymas, W., Flygare, S., Kennedy, B., Blaschke, A., Eilbeck, K., Yandell, M., McCullers, J.A., Williams, D.J., Edwards, K., Arnold, S.R., Bramley, A., Jain, S. and Pavia, A.T. (2017) Human Bocavirus Capsid Messenger RNA Detection in Children with Pneumonia. The Journal of Infectious Diseases, 216, 688-696. https://doi.org/10.1093/infdis/jix352
- 3. Nascimento-Carvalho, A.C., Vilas-Boas, A.L., Fontoura, M.H., Xu, M., Vuorinen, T., Soderlund-Venermo, M., Ruuskanen, O. and Nascimento-Carvalho, C.M. (2018) Serologically Diagnosed Acute Human Bocavirus 1 Infection in Childhood Community-Acquired Pneumonia. Pediatric Pulmonology, 53, 88-94. https://doi.org/10.1002/ppul.23891
- 4. Pinana, J.L., Madrid, S., Perez, A., Hernandez-Boluda, J.C., Gimenez, E., Terol, M.J., Calabuig, M., Navarro, D. and Solano, C. (2017) Epidemiologic and Clinical Characteristics of Coronavirus and Bocavirus Respiratory Infections after Allogeneic Stem Cell Transplantation: A Prospective Single-Center Study. Biology of Blood and Marrow Transplantation, 24, 563-570. https://doi.org/10.1016/j.bbmt.2017.11.001
- 5. Huang, Q., Deng, X., Yan, Z., Cheng, F., Luo, Y., Shen, W., Lei-Butters, D.C., Chen, A.Y., Li, Y., Tang, L., Soderlund-Venermo, M., Engelhardt, J.F. and Qiu, J. (2012) Establishment of a Reverse Genetics System for Studying Human Bocavirus in Human Airway Epithelia. PLoS Pathogens, 8, e1002899. https://doi.org/10.1371/journal.ppat.1002899
- 6. Babkin, I.V., Tyumentsev, A.I., Tikunov, A.Y., Zhirakovskaia, E.V., Netesov, S.V. and Tikunova, N.V. (2015) A Study of the Human Bocavirus Replicative Genome Structures. Virus Research, 195, 196-202. https://doi.org/10.1016/j.virusres.2014.10.019
- 7. Yan, Z., Keiser, N.W., Song, Y., Deng, X., Cheng, F., Qiu, J. and Engelhardt, J.F. (2013) A Novel Chimeric Adenoassociated Virus 2/Human Bocavirus 1 Parvovirus Vector Efficiently Transduces Human Airway Epithelia. Molecular Therapy, 21, 2181-2194. https://doi.org/10.1038/mt.2013.92
- 8. Flotte, T.R. (2017) Adeno-Associated Virus-Human Bocavirus 1 Chimeric Vectors: Ferreting Out Their Role in Airway Gene Therapy. Human Gene Therapy, 28, 611. https://doi.org/10.1089/hum.2017.29047.trf
- 9. Lindner, J., Karalar, L., Zehentmeier, S., Plentz, A., Pfister, H., Struff, W., Kertai, M., Segerer, H. and Modrow, S. (2008) Humoral Immune Response against Human Bocavirus VP2 Virus-Like Particles. Viral Immunology, 21, 443-449. https://doi.org/10.1089/vim.2008.0045
- 10. Chiu, C.C., Shi, Y.F., Yang, J.J., Hsiao, Y.C., Tzang, B.S. and Hsu, T.C. (2014) Effects of Human Parvovirus B19 and Bocavirus VP1 Unique Region on Tight Junction of Human Airway Epithelial A549 Cells. PLoS One, 9, e107970. https://doi.org/10.1371/journal.pone.0107970
- 11. Qu, X.W., Liu, W.P., Qi, Z.Y., Duan, Z.J., Zheng, L.S., Kuang, Z.Z., Zhang, W.J. and Hou, Y.D. (2008) Phospholipase A2-Like Activity of Human Bocavirus VP1 Unique Region. Biochemical and Biophysical Research Communications, 365, 158-163. https://doi.org/10.1016/j.bbrc.2007.10.164
NOTES
*通讯作者。
