Advances in Clinical Medicine
Vol.
12
No.
11
(
2022
), Article ID:
58306
,
5
pages
10.12677/ACM.2022.12111535
小淋巴细胞淋巴瘤伴EBV阳性弥漫大B细胞淋巴瘤老年病例分析并文献复习
马育硕,赵霞,卞海艳*
青岛大学附属医院,山东 青岛
收稿日期:2022年10月21日;录用日期:2022年11月17日;发布日期:2022年11月24日

摘要
RS综合征在亚洲发病罕见,预后极差,中位生存期短。本文报告1例小淋巴细胞淋巴瘤向伴EBV阳性弥漫大B细胞淋巴瘤转化的老年病例临床资料,并结合相关文献复习分析其诊治经验。
关键词
淋巴瘤,Richter综合征,诊断,治疗

Small Lymphocytic Lymphoma with EBV Positive Diffuse Large B-Cell Lymphoma in Elderly Patients and Literature Review: A Case Report and Literature Review
Yushuo Ma, Xia Zhao, Haiyan Bian*
Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Oct. 21st, 2022; accepted: Nov. 17th, 2022; published: Nov. 24th, 2022

ABSTRACT
RS syndrome is rare in Asia, with poor prognosis and short median survival. This article reports the clinical data of a case of small lymphocytic lymphoma transformed into an EBV positive diffuse large B cell lymphoma in the elderly and analyzes its diagnosis and treatment experience in conjunction with relevant literature review.
Keywords:Lymphoma, Richter Syndrome, Diagnosis, Treatment

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
Richter综合征(Richter syndrome, RS)是一类淋巴造血系统非常罕见的疾病,由Richter于1928年首次报道慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)并发组织肉瘤而得名。目前RS严格意义上是指既往组织学诊断为慢性淋巴细胞白血病(CLL)/小细胞淋巴瘤(SLL)的患者在临床随访或治疗过程中发生向侵袭性的淋巴瘤转化 [1],RS发病较为罕见,CLL/SLL患者向RS转化的发生率为2.2%~8.0% [2],预后极差,确诊后的中位生存期为8~12个月 [3]。本文报告1例小淋巴细胞淋巴瘤向伴EBV阳性弥漫大B细胞淋巴瘤转化的老年病例临床资料,并复习相关文献。
2. 病历资料
患者女,79岁,ECOG:1分,因“发现腹股沟肿物5月余,确诊淋巴瘤20余天”于2020-09-15入院。患者5月余前无意中发现双侧腹股沟肿物,后出现颈部及腋窝肿物,且呈逐渐增大趋势,不伴疼痛,无发热、盗汗,体重无明显变化。查体:双侧颈部、腋窝及腹股沟可扪及肿大淋巴结,最大者在右侧腋窝,约4 cm × 2 cm,质硬,无压痛,活动性差,咽淋巴环(-),心肺腹(-),双下肢无水肿。既往:6年前曾行左侧髂血管支架术。入院后左侧腹股沟淋巴结活检,病理符合小淋巴细胞淋巴瘤/慢性淋巴细胞白血病,部分区域肿瘤细胞弥漫成片,核增大,可见核仁,结合组化,考虑向伴有EB病毒感染的弥漫大B细胞淋巴瘤转化,IHC:CD3(+),CD20(+),CD10(-),CD21示残存FDC网,CD23(+),CD30(-),Bcl-2(+),Bcl-6(-),CD5(+),CD45RA(+),CyclinD1(-),c-myc(-),MUM1(部分+),CD138(-),p53(-,5%),ALK(SP8)(-),Pax-5(+),EBER(原位杂交)(+),Ki-67(+)25%,CKpan(-),详见图1。增强CT:双侧髂血管旁和腹膜后淋巴结肿大,见图2(a)。超声:双侧颈部、腋窝、腹股沟淋巴结肿大,见表1。骨髓活检及流式检测均未见明显异常。外周血:β2-MG:3.25 mg/L,IgG,轻链轻度升高,LDH正常为170 U/L。EB病毒早期抗原IgG、衣壳抗原IgG、核抗原IgG检测强阳性,EB病毒DNA定量为8.96E+02拷贝/mL。血常规、肝肾功等未见明显异常。入院诊断为小淋巴细胞淋巴瘤伴弥漫大B细胞淋巴瘤转化III期A IPI评分2分中低危,累及横膈上下多处淋巴结。在治疗上考虑患者为高龄患者,不能耐受标准化疗,2020年9月7日起给予R-ZPEL方案治疗,具体用药为R (rituximab利妥昔单抗):600 mg + Z (Zanubrutini,泽布替尼):160 mg qd + E (Etoposide Capsules依托泊苷):100 mg d1-5 + L (Lenalidomide,来那度胺):10 mg d1-14 + P (泼尼松):100 mg d1-5。第1周期用药期间患者感头晕不适,遂第2周期调整治疗方案为R:600 mg + Z:80 mg bid + E:50 mg d1-5 + L:5 mg d1-14 + P:100 mg d1-5。鉴于患者高龄,自第3周期改为无化疗方案:R:600 mg + Z:80 mg bid + L:5 mg qod。3周期后疗效评估为PR。增强CT结果示:双侧髂血管旁和腹膜后淋巴结肿大较前明显缩小,见图2(b),浅表淋巴结最大短径小于1 cm,见表1。且患者一般情况明显好转,后患者继续应用以上方案治疗3周期,6周期治疗后未见腹腔及腹膜后淋巴结肿大,给予Z:80 mg bid维持治疗,患者目前病情稳定,生活可以自理,近期化疗血常规、肝肾功生化均未见明显异常。
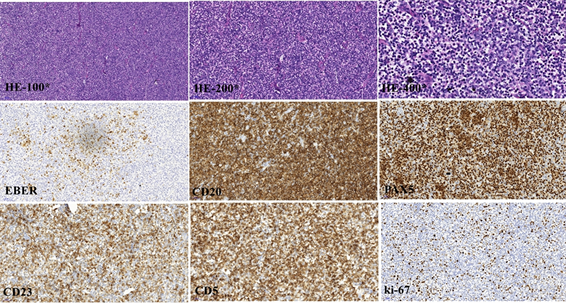
图注:HE-100*:低倍观淋巴结正常结构消失,以小淋巴样异型细胞为主的肿瘤细胞弥漫浸润,深染的小淋巴样细胞之间可见大小形态不规则、边界不清的浅染区;HE-200*:中倍观部分区域在小淋巴样细胞间可见中等或较大的片状聚集异型细胞;HE-400*:高倍观小淋巴样细胞胞质稀少,核圆形、深染,这一区域可见片状聚集的大的异型淋巴样细胞,胞质略嗜碱性,核圆形或卵圆形,可见中位的单个核仁,这些细胞EBER阳性见图中EBER;CD20:免疫组化CD20染色肿瘤细胞弥漫阳性;PAX5:免疫组化PAX5染色肿瘤细胞弥漫阳性;CD23:免疫组化CD23染色肿瘤细胞弥漫阳性;CD5:免疫组化CD5染色肿瘤细胞弥漫阳性;Ki67:免疫组化Ki67增值指数20%左右
图1. 腹股沟淋巴结病理HE染色及免疫组织化学染色
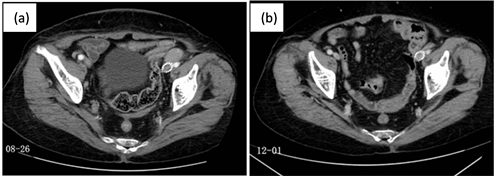 图注:2020-12-01增强CT结果示:双侧髂血管旁和腹膜后淋巴结肿大较2020-08-26明显缩小
图注:2020-12-01增强CT结果示:双侧髂血管旁和腹膜后淋巴结肿大较2020-08-26明显缩小
Figure 2. Contrast with enhanced CT before and after treatment
图2. 治疗前后增强CT对比
Table 1. Changes of lymph node size at different sites during chemotherapy
表1. 化疗期间各部位淋巴结大小(cm)变化
3. 讨论
Richter综合征主要包括弥漫大B细胞淋巴瘤及霍奇金淋巴瘤两种变异型,其中以转化为弥漫大B细胞淋巴瘤最为常见,并被称为经典型Richter综合征 [3] [4]。目前RS发生的确切机制尚不明确。主要认为TP53基因丢失或突变、CDKN2A缺失、NOTCH1突变、c-MYC基因的激活是CLL发生转化的主要驱动因素 [4] [5] [6]。另外,有报道认为CLL的既往治疗在转化中起到一定的驱动作用 [7],但也有研究认为90% RS转化和CLL的治疗无关,而是其在接受CLL治疗前已经发生转化 [8]。正如我们报道这个患者发现时即伴有DLBCL转化。
Richter综合征的常见临床特点有发热、消瘦、盗汗;进行性淋巴结肿大;单克隆球蛋白升高;乳酸脱氢酶(Lactate Dehydrogenase, LDH)升高;出现贫血、血小板减少以及结外病变等。CLL发生Richter转化的情况可以先、后发生,也可以在患者就诊时被同时发现,由于其转化过程隐匿,对于CLL患者发病过程中出现上述症状,要特别注意病情进展为Richter综合征可能。然而对于本例患者来说并无发热、盗汗、消瘦等体征变化,血常规未见明显异常,乳酸脱氢酶也处于正常水平,因此组织病理学诊断(对可疑转化部位的活检)以及免疫组化便显得至关重要。
RS的典型特征是表现出侵袭性,对化疗耐药,存活率非常低,可在CLL病程早期出现,中位发生时间为诊断CLL后23个月,有时也与CLL同时诊断 [9] [10]。本例患者便属于后者。目前临床上暂无标准治疗方案,《中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2018年版)》推荐对于Richter综合征患者,需根据转化的组织学类型以及是否为克隆相关决定治疗方案 [11] [12]。对于非克隆相关患者的治疗及预后同原发初治的DLBCL,R-CHOP为一线治疗方案。而对于克隆相关性的患者目前治疗尚未统一,可选用R-CHOP、R-DA-EPOCH、R-HyperCVAD(A方案)等方案,如取得缓解,则尽可能进行造血干细胞移植来巩固治疗。然而,RS为原发性难治性疾病,恶性程度高,且常见于老年患者,合并症多、身体各项机能差,目前联合化疗仍是RS的首选治疗。相关资料显示,多数该弥漫大B细胞的肿瘤克隆来源于慢性淋巴细胞白血病细胞,但还有少数病例的淋巴瘤细胞与慢性淋巴细胞白血病细胞非同源,而是与EB病毒感染有关 [12] [13]。本例患者伴有EB病毒阳性且未行免疫球蛋白重链可变区(IgHV)基因序列测定,因此不排除两者非同源性可能。另外,一项Meta分析结果显示R-CHOP化疗方案治疗EBV阳性弥漫大B细胞淋巴瘤的疗效欠佳,EBV阳性是患者的主要不良预后因素 [14]。综合以上因素考虑患者高龄,不能耐受标准化疗,故创新性给予R-ZPEL方案治疗。
泽布替尼作为迄今为止第一款完全由我国企业自主研发、在美国获准上市的抗癌新药,是继依鲁替尼和阿卡替尼之后FDA批准的第三个BTK抑制剂。目前正作为单药或与其他疗法联合使用,在多种淋巴瘤治疗中开展临床试验。相比上一代BTK抑制剂泽布替尼具有靶点占有率更高、选择性更强、抑制更持久等特点 [15]。泽布替尼在治疗复发性、难治性套细胞淋巴瘤(Mantle-Cell Lymphomas, MCL)患者的过程中,总缓解率(Overall Response Rate, ORR)可达到84% [16]。且有进一步研究表明泽布替尼在治疗复发/难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的过程中,总缓解率可达84.6% [17]。
结合以上临床及基础研究,给予患者泽布替尼联合化疗以期在减低药物不良反应的同时,保证临床治疗效果。目前本例患者除第1周期化疗后感头晕不适外,第2周期减量后,未有其他不适出现,患者第3周期治疗后疗效评估为PR,全身肿大淋巴结持续缩小,未见明显治疗相关不良反应。6周期治疗后继续泽布替尼维持治疗,近期一般情况好,血常规、肝肾功生化均未见明显异常,仍持续密切随访中。本例患者治疗过程提示,以利妥昔单抗和泽布替尼为基础的减低强度剂量的治疗方案甚至无化疗方案在治疗老年患者Richter综合征中极具有价值性,值得临床及基础进一步研究。
文章引用
马育硕,赵 霞,卞海艳. 小淋巴细胞淋巴瘤伴EBV阳性弥漫大B细胞淋巴瘤老年病例分析并文献复习
Small Lymphocytic Lymphoma with EBV Positive Diffuse Large B-Cell Lymphoma in Elderly Patients and Literature Review: A Case Report and Literature Review[J]. 临床医学进展, 2022, 12(11): 10663-10667. https://doi.org/10.12677/ACM.2022.12111535
参考文献
- 1. Swerdlow, S.H. (2008) WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. International Agency for Research on Cancer, Lyon.
- 2. Tsimberidou, A.M. and Keating, M.J. (2005) Richter Syndrome: Biology, Incidence, and Therapeutic Strategies. Cancer, 103, 216-228. https://doi.org/10.1002/cncr.20773
- 3. Wang, Y., Tschautscher, M.A., Rabe, K.G., et al. (2020) Clinical Characteristics and Outcomes of Richter Transformation: Experience of 204 Pa-tients from a Single Center. Haematologica, 105, 765-773. https://doi.org/10.3324/haematol.2019.224121
- 4. Tamar, T., Lev, S., Neta, G., et al. (2014) Hodgkin’s Variant of Richter Transformation in Chronic Lymphocytic Leukemia: A Retrospective Study from the Israeli CLL Study Group. Anticancer Research, 34, 785-790.
- 5. Ekaterina, C., Andrea, R., Ivo, K., et al. (2013) Two Main Genetic Pathways Lead to the Transformation of Chronic Lymphocytic Leukemia to Richter Syndrome. Blood, 122, 2673-2682. https://doi.org/10.1182/blood-2013-03-489518
- 6. Parikh, S.A., Kay, N.E. and Shanafelt, T.D. (2014) How We Treat Richter Syndrome. Blood, 123, 1647-1657. https://doi.org/10.1182/blood-2013-11-516229
- 7. Eyre, T.A. and Schuh, A. (2017) An Update for Richter Syn-drome—New Directions and Developments. British Journal of Haematology, 178, 508-520. https://doi.org/10.1111/bjh.14700
- 8. Maddocks-Christianson, K., Slager, S.L., Zent, C.S., et al. (2007) Risk Factors for Development of a Second Lymphoid Malignancy in Patients with Chronic Lymphocytic Leukaemia. British Journal of Haematology, 139, 398-404. https://doi.org/10.1111/j.1365-2141.2007.06801.x
- 9. Apostolia-Maria, T., O’Brien, S., Khouri, I., et al. (2006) Clinical Outcomes and Prognostic Factors in Patients with Richter’s Syndrome Treated with Chemotherapy or Chemo-immunotherapy with or without Stem-Cell Transplantation. Journal of Clinical Oncology, 24, 2343-2351. https://doi.org/10.1200/JCO.2005.05.0187
- 10. Rossi, D., Cerri, M., Capello, D., et al. (2008) Biological and Clinical Risk Factors of Chronic Lymphocytic Leukaemia Transformation to Richter Syndrome. British Journal of Hae-matology, 142, 202-215. https://doi.org/10.1111/j.1365-2141.2008.07166.x
- 11. De Paoli, F., et al. (2011) Predictive Markers and Driving Factors behind Richter Syndrome Development. Expert Review of Anticancer Therapy, 11, 433-442. https://doi.org/10.1586/era.10.237
- 12. Ding, W., LaPlant, B.R., Call, T.G., et al. (2017) Pembrolizumab in Patients with CLL and Richter Transformation or with Relapsed CLL. Blood, 129, 3419-3427. https://doi.org/10.1182/blood-2017-02-765685
- 13. 佚名. 中国淋巴瘤合并HBV感染患者管理专家共识[J]. 中华血液学杂志, 2013, 34(11): 988-993.
- 14. Thornton, P.D., et al. (2005) Richter’s Transformation of Chronic Lymphocytic Leukemia: The Possible Role of Fludarabine and the Epstein-Barr Virus in Its Pathogenesis. Leukemia Re-search, 29, 389-395. https://doi.org/10.1016/j.leukres.2004.09.008
- 15. 魏华萍. EB病毒感染对R-CHOP治疗弥漫大B细胞淋巴瘤影响的Meta分析[J]. 中国临床新医学, 2018, 11(9): 884-888.
- 16. 张洪涛. 中国第一个获得美国FDA“突破性疗法”认证的抗癌新药, 到底好在哪?[J]. 科技导报, 2019, 37(11): 6-8.
- 17. Song, Y., Zhou, K., Zou, D., et al. (2018) Safety and Activity of the Investigational Bruton Tyrosine Kinase Inhibitor Zanubrutinib (BGB-3111) in Patients with Mantle Cell Lymphoma from a Phase 2 Trial. Blood, 132, Article No. 148. https://doi.org/10.1182/blood-2018-99-117956
NOTES
*通讯作者Email: 1623276903@qq.com
