Open Journal of Nature Science
Vol.05 No.02(2017), Article ID:20735,8
pages
10.12677/OJNS.2017.52027
Identification and Sequence Analysis of a Calmodulin-Binding Protein Gene from Citrus Grandis var. Shatinyu Hort
Qiong Luo, Hongni Tan, Shili Huang, Huaying Liu, Xinmin Qin*
College of Life Science, Guangxi Normal University, Guilin Guangxi

Received: May 6th, 2017; accepted: May 20th, 2017; published: May 27th, 2017

ABSTRACT
In this paper, the transcriptome of the self-pollinated style and cross-pollinated style of Citrus grandis var. Shatinyu Hort were sequenced by high-throughput sequencing technology. A calmodulin-binding protein gene sequence of Citrus grandis var. Shatinyu Hort was obtained though differential analysis method, and some characters of the calmodulin-binding protein were analyzed and predicted by bioinformatics method, including the composition of amino acid sequence, physicochemical parameters, hydrophobicity, transmembrane domain, secondary structure and function of protein etc. The results showed that the calmodulin-binding protein gene was 1616 bp in length with an open reading frame (ORF) of 1368 bp, encoding 455 amino acids with deduced molecular weight of 50.11 KDa, and theoretical pI value of 5.33, and contained a calmodulin-binding proteins domain. Bioinformatics analysis showed that the calmodulin-binding protein was a hydrophobic and unstable protein. The homology analysis of amino acid sequence indicated that the calmodulin-binding protein shared high homology with calmodulin-binding protein of Citrus clementina (98%). This work provides a systemic sequence analysis of the calmodulin-binding protein of Citrus grandis var. Shatinyu Hort. It will provide the useful reference for further investigation of its structure and function.
Keywords:Citrus Grandis var. Shatinyu Hort, Calmodulin-Binding Protein Gene, Sequence Analysis
沙田柚钙调素结合蛋白(CaMBP)基因的鉴定 与序列分析
罗琼,谭鸿妮,黄仕莉,刘华英,秦新民*
广西师范大学生命科学学院,广西 桂林

收稿日期:2017年5月6日;录用日期:2017年5月20日;发布日期:2017年5月27日

摘 要
利用高通量测序对沙田柚自交和异交花柱进行转录组测序,通过差异分析得到了沙田柚钙调素结合蛋白(CaMBP)基因序列。采用生物信息学方法,对其编码的蛋白质从序列特征、理化性质、跨膜结构域、高级结构以及功能域等方面进行了预测和分析。结果表明该基因全长为1616 bp,开放阅读框(ORF)全长为1368 bp,编码455个氨基酸,编码蛋白质的分子量为50.11 KDa,理论等电点为5.33。该蛋白质含有一个与钙调素结合蛋白相同的保守结构域。氨基酸序列比对结果显示,其编码的蛋白质与克莱门柚(Citrus clementina)的钙调结合蛋白相似性较高,相似度约为98%。这些分析结果可为今后深入研究该蛋白的结构特征和功能提供参考。
关键词 :沙田柚,钙调素结合蛋白基因,序列分析

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
自交不亲和性(self-incompatibility, SI)广泛存在于被子植物中。所谓自交不亲和性是植物雌蕊的柱头或花柱可以识别自体或异体花粉,并抑制自体花粉萌发或生长的一种特性,在被子植物的有性生殖过程中自交不亲和性对于避免近亲繁殖有很重要的作用 [1] 。因此对自交不亲和性的研究在植物生殖学和杂交优势利用等方面具有重要的理论和应用价值。
沙田柚为广西特产水果之一,属配子体高度自交不亲和果树。目前,关于沙田柚自交不亲和的研究取得了一定进展:薛妙男等 [2] 确定了沙田柚自交不亲和性类型,发现沙田柚自交花粉管在花柱中生长的受阻部位为花柱的1/2部位;杨继华等 [3] [4] 采用IEF/SDS-PAGE双向电泳鉴定出沙田柚花柱特异蛋白,并测定了该蛋白的分子量、等电点和N-末端氨基酸序列;秦新民等 [5] 沙田柚花粉管特异蛋白得到了分离和鉴定。同时,沙田柚花柱通道细胞中特异蛋白 [6] 和花粉管中特异蛋白的产生的部位及分布也得到确定 [7] [8] 。但有关沙田柚配子体自交不亲和相关基因表达和鉴定方面的研究不多。
为了进一步探讨沙田柚自交不亲和的机理,我们对自交和异交花柱进行了转录组测序,通过自交与异交花柱差异基因的比对,获得了一个沙田柚钙调素结合蛋白基因,并对该基因编码的蛋白质进行了生物化学特征分析,旨在为沙田柚自交不亲和分子机理的深入研究提供帮助。
2. 材料与方法
2.1. 材料
沙田柚实验材料采自广西灵川县潮田乡大山口村果园十年生结果树。在盛花期对沙田柚样树进行人工自交(沙田柚 × 沙田柚)授粉和异交授粉(酸柚 × 沙田柚),分别收集自交和异交1~3 d的授粉花柱以及当天未开花的花柱,立即放入液氮中保存,并放入−80℃超低温冰箱备用。
2.2. 方法
2.2.1. RNA的提取、建库和测序
总RNA的提取按改良Trizol法进行 [9] ,建库和测序同参考文献 [10] 。
2.2.2. 序列分析方法
采用生物信息学分析方法。利用NCBI网站上的NCBI ORF Finder寻找基因的开放阅读框(Open Reading Frame, ORF),用DNAMAN预测该基因编码的蛋白质的氨基酸序列;蛋白质的理化性质包括分子量、各氨基酸数目、等电点、不稳定性系数等利用ProtParam分析输出;疏水性利用DNAMAN构图和数据输出进行分析;蛋白质的保守结构域运用NCBI网站上的Conserved Domains进行预测;磷酸化位点用Netpho在线程序进行预测;利用在线分析软件PHD对蛋白质的二级结构进行预测,蛋白质的三级结构模式图则利用SWISS-MODEL输出。
3. 结果
3.1. 基因的生物信息学分析
沙田柚柚钙调素结合蛋白基因(Unigene33533_All)的全长序列为1616 bp (GenBank登录号:KY563017),NCBI ORF Finder和生物信息学软件DNAman进行分析,该序列包含有一个1368 bp的开放阅读框(ORF: 74-1441 bp),编码455个氨基酸(图1)。
3.2. 编码蛋白质的分析及疏水性的预测
通过在线软件protparam分析(http://www.expasy.org/tools/protparam.html),该基因编码的蛋白质的相对分子质量(Mr)为50.11 kDa,等电点pI为5.33,分子是为分子式为C2140H3439N633O764S9;在组成该蛋白质的20种氨基酸中,Glu和Ser所占比例最高,都为11.6%,Met所占比例最低,仅有0.7%;带负电荷氨基酸总数为89,带正电的氨基酸总数为72,不稳定指数为55.47(> 40),为不稳定蛋白。
蛋白质序列的疏水性分析见图2。从图中可以看出所编码的肽链中疏水性最大值2.51,位于第397位氨基酸;亲水性最小值为−3.63,位于第294位氨基酸。综合表明该蛋白质疏水性平均值为−1.19,为亲水性蛋白。
3.3. 功能结构域的分析
将编码的氨基酸序列用NCBI的Conserved Domain Architecture Retrieval Tool分析,发现该蛋白具有一个与CaM binding蛋白(钙调结合蛋白)相同保守结构域,保守结构域位于330~450位氨基酸之间。属于CaM binding超级族(图3)。
3.4. 跨膜结构的预测
运用跨膜蛋白数据库TMHMM (http://genome.cbs.dtu.dk/services/TMHMM-2.0)预测,发现该蛋白没有跨膜结构(图4)。
3.5. 蛋白质磷酸化预测
通过在线蛋白磷酸化位点预测分析软件NetPhos 2.0 Server对钙调素结合基因所编译的蛋白进行预测,

Figure 1. Nucleotide sequence and amino acid sequence of the calmodulin-binding protein gene
图1. 钙调素结合蛋白基因序列和推测氨基酸序列
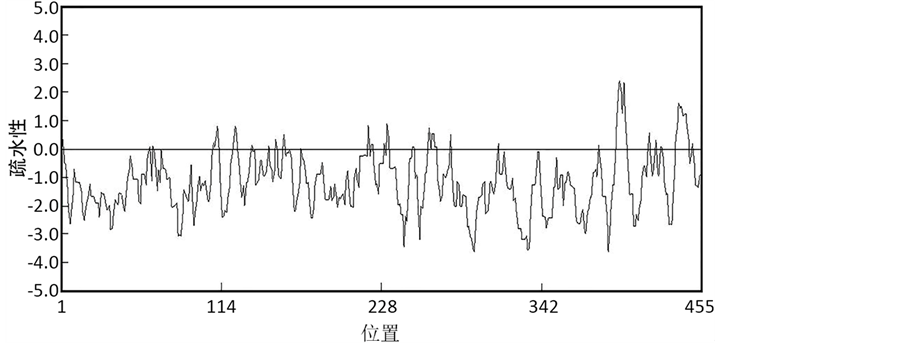
Figure 2. Nucleotide sequence and amino acid sequence of the calmodulin-binding protein gene
图2. 钙调素结合蛋白基因序列和推测氨基酸序列
结果表明基因编码的蛋白质可能的磷酸化位点共有16个,其中Ser磷酸化位点多达45个,分别位于肽链的20、22、24、29、33、34、47、48、67、95、101、103、112、121、137、138、139、172、180、
181、位;Thr磷酸化位点17个,分别位于肽链第3、4、5、7、19、42、53、134、144、146、147、148、152、166、171、179、位;Tyr磷酸化位点共有4个,分别位于肽链第60、183、和245位。表明该蛋白的磷酸化以Ser磷酸化为主,兼有Thr和Tyr磷酸化(图5)。
3.6. 蛋白质二级以及三级结构的预测
运用在线分析软件Predict Protein (http://www.predictprotein.org/)对钙调素结合蛋白进行预测,结果表明该蛋白二级结构包含的α-螺旋、β-折叠和无规则卷曲所占比例分别为6.13%、46.57%、47.30%。用SISSMODDLE对该蛋白质的三级结构进行预测,得出该蛋白质的三级结构(图6)。
3.7. 同源性分析
将沙田柚钙调素结合蛋白的氨基酸序列与从GenBank数据库中下载其他11种植物钙调素结合基因编码的氨基酸序列进行比对,结果表明沙田柚钙调素结合蛋白基因编码的氨基酸与克莱门柚(Citrus clementina, XP_006450175.1)钙调素结合蛋白的同源性为98%。利用DNAMan构建系统发育树,结果表明沙田柚钙调素结合蛋白基因编码的蛋白质与芸香科的克莱门柚(Citrus clementina)有很近的亲缘关系,属于同一个进化分支(图7)。
4. 结论与讨论
在植物生长发育中,钙离子作为第二信使扮演着重要的角色,在植物对外界刺激的应答反应机制中
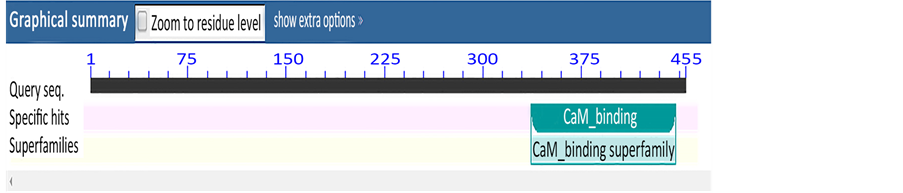
Figure 3. Conserved domains of the calmodulin-binding protein
图3. 钙调素结合蛋白保守结构域
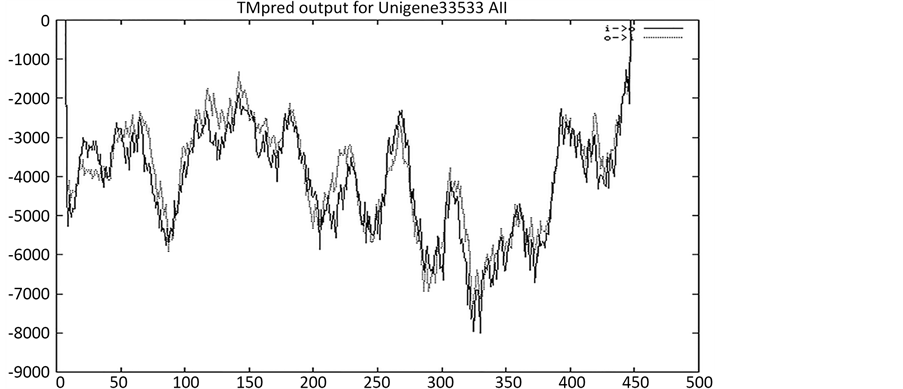
Figure 4. Result of TMpred Prediction of the calmodulin-binding protein
图4. 钙调素结合蛋白跨膜区预测

Figure 5. Phosphorylation site analysis of the calmodulin-binding protein
图5. 钙调素结合蛋白的磷酸化位点分析

Figure 6. The tertiary structure of the calmodulin-binding protein
图6. 钙调素结合蛋白的三级结构
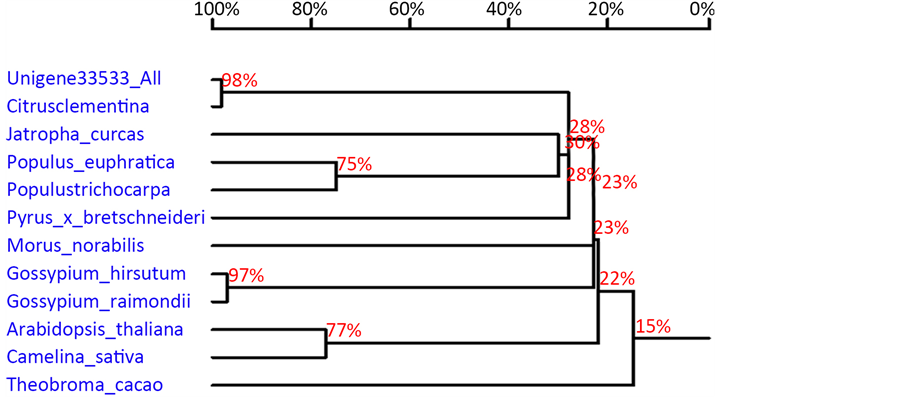
Figure 7. Phylogenetic tree based on amino acid sequences of the calmodulin-binding protein
图7. 基于氨基酸序列的钙调素结合蛋白系统发育树
也起着非常重要的作用 [11] 。钙调素(calmodulin, CaM)是目前研究得最多的一种Ca2+受体蛋白,自身没有酶活性,只有与Ca2+结合后形成Ca2+/CaM复合物,通过调节其下游钙调素结合蛋白(calmodulin binding protein, CaMBP)而参与不同的生物学反应,如基因调控、翻译以及翻译后修饰、细胞分裂和伸长、细胞骨架构成、胞内运输、离子运输、疾病抗性、生物胁迫耐受力、热激和盐耐受力、光响应、ATP运输、Ca2+内环境稳定、氮代谢和生长发育、花粉管的发育、脂肪酸代谢、光合作用、胞质流动和运输、激素调节、蛋白折叠、蛋白磷酸化和去磷酸化等 [12] [13] 。
近年来的研究表明植物自交不亲和性是一个复杂的、多基因、多种因子相互协同作用的结果,除了S决定因子的基因外,一些非S因子也可能参与自交不亲和反应 [14] 。一些研究证明Ca2+参与了植物的自交不亲和反应。如在罂粟属植物的自交不亲和(self-incompatibility, SI)反应中,细胞胞质中游离的Ca2+浓度增加,为适应这种变化,肌动蛋白发生重排导致肌动蛋白大量解聚,从而使花粉管尖端生长受到抑制。Thomas等 [15] 研究罂粟属SI过程发现肌动蛋白的解聚启动了下游细胞程序性死亡(programmed cell death, PCD)信号的传递过程。Poulter等 [16] 也证实在SI诱导的PCD上游需要微丝和微管的信号整合。因此,罂粟花粉SI反应触发PCD,从而使花粉管发生不可逆性的停止生长 [17] 。Geitmann等在Papaver rhoeas自交不亲和的花粉管中,发现细胞骨架发生改变和依赖Ca2+信号网络启动细胞程序性死亡,最终抑制花粉管的生长。花粉受体蛋白与柱头S蛋白特异性的相互作用,结果花粉管基部Ca2+浓度迅速增加,而花粉管顶端的Ca2+浓度快速的降低,Ca2+作为第二信使诱导细胞内信号的级联反应,启动细胞程序性死亡,最终抑制花粉管的生长 [18] 。
最近柑橘属植物的自交不亲和研究结果表明,柑橘属植物中的RNase 基因,Skp1-like基因,F-box基因,以及3个不同的富含天冬氨酸蛋白基因可能在自我花粉的识别过程中调控钙离子的稳态 [19] [20] [21] 。钙离子的水平在花粉和雌蕊的识别过程中起着非常重要的作用 [22] ,在花粉管生长的过程中,Ca2+-CaM对磷酸化作用,胼胝质的合成和囊泡的融合都有影响。高水平的Ca2+可能会打乱花粉管的生长。因此,CaMBP的分离鉴定及其结构功能、理化性质的研究对阐明Ca2+/CaM在生物体内介导的复杂信号途径具有重要意义。本文鉴定的沙田柚钙调素结合蛋白基因在沙田柚自交1d与异交1d花柱中存在差异表达(log2(RPKM ratio) = −2.723),但该基因在沙田柚自交不亲和反应中的功能尚待深入研究。
基金项目
国家自然科学基金(31360477);广西教育厅项目(2013YB036)。
文章引用
罗 琼,谭鸿妮,黄仕莉,刘华英,秦新民. 沙田柚钙调素结合蛋白(CaMBP)基因的鉴定与序列分析
Identification and Sequence Analysis of a Calmodulin-Binding Protein Gene from Citrus Grandis var. Shatinyu Hort[J]. 自然科学, 2017, 05(02): 203-210. http://dx.doi.org/10.12677/OJNS.2017.52027
参考文献 (References)
- 1. Takayama, S. and Isogai, A. (2005) Self-Incompatibility in Plants. Annual Review of Plant Biology, 56, 467-489.
- 2. 薛妙男, 陈腾土, 杨继华. 沙田柚自交和异交亲和性观察[J]. 园艺学报, 1995, 22(2): 127-132.
- 3. 杨继华, 李红艳, 薛妙男. 沙田柚花柱S-糖蛋白分离及鉴定[J]. 广西师范大学学报, 2000, 18(4): 66-70.
- 4. 杨继华, 尧桂荣, 薛妙男. 沙田柚花柱S-糖蛋白的纯化和N-端序列测定[J]. 广西师范大学学报, 2001, 19(1): 72-79.
- 5. 秦新民, 李惠敏, 薛妙男, 等. 沙田柚自交, 异交花粉管蛋白的双向电泳分析[J]. 广西植物, 2004, 24(6): 566-569.
- 6. 薛妙男, 杨继华. 沙田柚花粉管在花柱中的生长途径及其识别[J]. 广西师范大学学报, 2001, 19(2): 60-66.
- 7. 秦新民, 莫花浓, 万珊, 等. 沙田柚花粉管特异蛋白的免疫细胞化学研究[J]. 广西师范大学学报, 2008, 26(4): 113-115.
- 8. 秦新民, 莫花浓, 石菁萍, 等. 沙田柚花粉管S1-RNase免疫胶体金定位研究[J]. 广西农业科学, 2009, 40(5): 483-485.
- 9. Bariola, P.A., Howard, C.J., Taylor, C.B., et al. (1994) The Arabidopsis Ribonuclease Gene RNS1 Is Tightly Controlled in Response to Phosphate Limitation. The Plant Journal, 6, 673-685. https://doi.org/10.1046/j.1365-313X.1994.6050673.x
- 10. 秦新民, 张渝, 刘玉洁, 等. 沙田柚S-RNase基因的克隆及序列分析[J]. 广西师范大学学报(自然科学版), 2015, 33(1): 139-145.
- 11. Yang, T., Chaudhuri, S., Yang, L., Chen, Y. and Poovaiah, B.W. (2004) Calcium/Calmodulin Up-Regulates a Cytoplasmic Receptor-Like Kinase in Plants. Journal of Biological Chemistry, 279, 42552-42559. https://doi.org/10.1074/jbc.M402830200
- 12. Reddy, V.S., Aligs, G.S. and Reddy, A.S. (2002) Genes Encoding Calmodu-lin-Binding Proteins in the Arabidopsis Genome. Journal of Biological Chemistry, 277, 9840-9852. https://doi.org/10.1074/jbc.M111626200
- 13. Bouché, N., Yellin, A., Snedden, W.A. and Fromm, H. (2005) Plant-Specific Calmodulin Binding Proteins. Annual Review of Plant Biology, 56, 435-466. https://doi.org/10.1146/annurev.arplant.56.032604.144224
- 14. Distefano, G., Caruso, M., Malfa, S.L., Gentile, A. and Tribulato, E. (2009) Histological and Molecular Analysis of Pollen-Pistil Interaction in Clementine. Plant Cell Reports, 28, 1439-1451. https://doi.org/10.1007/s00299-009-0744-9
- 15. Thomas, S.G., Huang, S., Li, S., Staiger, C.J. and Franklintong, V.E. (2006) Actin Depolymerization Is Sufficient to Induce Programmed Cell Death in Self-Incompatible Pollen. The Journal of Cell Biology, 174, 221-229. https://doi.org/10.1083/jcb.200604011
- 16. Poultet, N.S., Vatovec, S. and Franklin-Tong, V.E. (2008) Microtubules Are a Target for Self-Incompatibility Signaling in Papaver Pollen. Plant Physiology, 146, 1358-1367. https://doi.org/10.1104/pp.107.107052
- 17. Bosch, M. and Franklin-Tong, V.E. (2008) Self-Incompatibility in Papaver: Signalling to Trigger PCD in Incompatible Pollen. Journal of Experimental Botany, 59, 481-490. https://doi.org/10.1093/jxb/erm195
- 18. Geitmann, A., Snowman, B.N., Emons, A.M.C. and Franklintong, V.E. (2000) Alterations in the Actin Cytoskeleton of Pollen Tubes Are Induced by the Self-Incompatibility Reaction in Papaver rhoeas. The Plant Cell, 12, 1239-1251. https://doi.org/10.1105/tpc.12.7.1239
- 19. Sandro, D.A., Duca, S.D., Verderio, E., Hargreaves, A.J., Scarpellini, A., Cai, G., Cresti, M., Faleri, C., Iorio, R.A., Hirose, S., Furutani, Y., Coutts, I.G.C., Griffin, M., Bonner, P.L.R. and Serafini-Fracassini, D. (2010) An Extracellular Transglutaminase Is Required for Apple Pollen Tube Growth. Biochemical Journal, 429, 261-271. https://doi.org/10.1042/BJ20100291
- 20. Chai, L., Ge, X., Biswas, M.K., Xu, Q. and Deng, X. (2011) Self-Sterility in the Mutant “Zigui shatian” Pummelo (Citrus grandis Osbeck) Is Due to Abnormal Post-Zygotic Embryo Development and Not Self-Incompatibility. Plant Cell, Tissue and Organ Culture (PCTOC), 104, 1-11. https://doi.org/10.1007/s11240-010-9793-6
- 21. Miao, H.X., Qin, Y.H., da Silva, J.A.T., Ye, Z.X. and Hu, G.B. (2011) Cloning and Expression Analysis of S-RNase Homologous Gene in Citrus reticulata Blanco cv. Wuzishatangju. Plant Science, 180, 358-367.
- 22. Ge, L.L., Tian, H.Q. and Russell, S.D. (2007) Calcium Function and Distribution during Fertilization in Angiosperms. American Journal of Botany, 94, 1046-1060. https://doi.org/10.3732/ajb.94.6.1046