Advances in Clinical Medicine
Vol.
13
No.
05
(
2023
), Article ID:
65574
,
8
pages
10.12677/ACM.2023.1351128
小鼠AAN激活Wnt/β-Catenin信号通路及诱导肾脏纤维化的观察性研究
王一凡1,2,刘爽1,2,黄春华1,2,3,汪思齐1,2,3,李茂娟2,3,汤海明1,2,3,楼迪栋1,2,3*
1贵州中医药大学基础医学院法医学教研室,贵州 贵阳
2贵州省法医中药毒理学特色重点实验室,贵州 贵阳
3贵州中医药大学司法鉴定中心,贵州 贵阳
收稿日期:2023年4月17日;录用日期:2023年5月9日;发布日期:2023年5月22日

摘要
目的:观察慢性AAN的肾损伤病理改变以及β-catenin和α-SMA蛋白的表达改变,探索Wnt/β-catenin信号通路与AAN纤维化之间的关系。方法:雄性KM小鼠随机分为3组,对照组灌胃给药0.4% CMC 0.2 mL/kg/2d,AAI组小鼠灌胃给药AAI 5 mg/kg/2d,青木香组灌胃给药青木香悬浊液5 mg/kg/2d。分别于4周和8周处死,HE染色观察肾组织病理变化,Masson染色观察纤维化情况,免疫组化染色观察β-catenin和α-SMA两种蛋白的组织定位和蛋白表达量。结果:AAI和青木香对小鼠的肾脏有毒性作用,小鼠长期暴露于AAI和青木香后肾小管上皮细胞出现水肿、坏死和脱落。β-catenin免疫组化结果显示,与对照组相比,肾小管上皮细胞中的β-catenin表达增高,免疫组化平均光密度值明显增高(P < 0.05)。Masson染色结果显示小鼠暴露于AAI后肾脏出现纤维化,与对照组相比,胶原纤维溶剂分数明显增加(P < 0.05)。α-SMA的免疫组化结果显示,与对照组相比,α-SMA的表达也明显升高,免疫组化平均光密度值显著增加(P < 0.05)。结论:慢性AAN主要损伤肾脏近曲小管上皮细胞,表现为细胞水肿、坏死和脱落;β-catenin的表达增加,胶原纤维和α-SMA的表达增多。AAN肾脏纤维化的发生可能与Wnt/β-catenin信号通路有关。
关键词
AAI,青木香,Wnt/β-Catenin信号通路,纤维化

Observational Study of Wnt/β-Catenin Signaling Pathway Activation and Induction of Renal Fibrosis in Mice by AAN
Yifan Wang1,2, Shuang Liu1,2, Chunhua Huang1,2,3, Siqi Wang1,2,3, Maojuan Li2,3, Haiming Tang1,2,3, Didong Lou1,2,3*
1Department of Forensic Medicine, School of Basic Medicine, Guizhou University of Traditional Chinese Medicine, Guiyang Guizhou
2Key Laboratory of Traditional Chinese Medicine Toxicology in Forensic Medicine, Guiyang Guizhou
3Judicial Appraisal Center, Guizhou University of Traditional Chinese Medicine, Guiyang Guizhou
Received: Apr. 17th, 2023; accepted: May 9th, 2023; published: May 22nd, 2023

ABSTRACT
Objective: The pathological changes of kidney injury and the expression of β-catenin and α-SMA protein in mice poisoned with AAN were observed to explore the relationship between Wnt/β-catenin signaling pathway and AAN fibrosis. Methods: Male KM mice were randomly divided into three groups: the control group was given 0.4% CMC 0.2 mL/kg/2d by gavage, the AAI group was given AAI 5 mg/kg/2d by gavage, and the Aristolochia debilis Sieb. et Zucc group was given Aristolochia debilis Sieb. et Zucc suspension 5 mg/kg/2d by gavage. Mice were executed at 4 and 8 weeks, respectively. HE staining was used to observe the histopathological changes of kidney, Masson staining was used to observe the fibrosis, and immunohistochemical staining was used to observe the tissue localization and protein expression of both β-catenin and α-SMA proteins. Results: AAI and cyanophyllum had toxic effects on the kidneys of mice. Mice showed edema, necrosis and detachment of renal tubular epithelial cells after long-term exposure to AAI and cyanophyllum. The results of β-catenin immunohistochemistry showed an increased expression of β-catenin in renal tubular epithelial cells and significantly higher immunohistochemical mean optical density values compared with the control group (P < 0.05). Masson staining results showed increased renal fibrosis in mice exposed to AAI, with a significant increase in the collagen fibril solvent fraction compared to controls (P < 0.05). The immunohistochemical results of α-SMA showed that the expression of α-SMA was also significantly higher compared with the control group, and the mean optical density value of immunohistochemistry was significantly increased (P < 0.05). Conclusion: Chronic AAN mainly damages the epithelial cells of the proximal tubule of the kidney, manifesting as cell edema, necrosis and detachment. The expression of β-catenin protein was increased, as was the number of collagen fibers and the expression of α-SMA protein.
Keywords:AAI, Aristolochia debilis Sieb. et Zucc, Wnt/β-Catenin Signaling Pathway, Fibrosis

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
马兜铃属植物因其普遍含有马兜铃酸(Aristolochic Acids, AAs)而得名,作为中草药广泛参与临床疾病的治疗 [1] 。常见的马兜铃属中草药有马兜铃、细辛、关木通、广防己等 [2] 。AAs是一类硝基菲羧酸类化合物,也是马兜铃属中草药的主要活性成分,其占比最多的是马兜铃酸I (aristolochic acid I)和AAII (aristolochic acid II) [3] 。通过对马兜铃属中草药临床应用的研究,发现其对肾脏有广泛的毒性作用,1964年我国吴松寒就已发现大量服用木通会导致急性肾损伤;90年代初,比利时出现了百余名妇女的中毒事件,调查显示其“罪魁祸首”是服用了含有广防己的减肥方;1990年我国也出现了服用含有关木通的龙胆泻肝丸的群体性药害事件 [4] [5] [6] 。研究表明,单次摄入或多次摄入AAs均会导致以进展性肾纤维化和肾衰竭为特征的马兜铃酸肾病(Aristolochic Acid Nephropathy, AAN) [7] 。没有及时地停用药物,进行干预治疗,会引起肾脏的不可逆性损伤,发展成为慢性肾脏病,晚期只能通过透析、肾移植等肾脏替代治疗维持生命,采用这类治疗方法的患者治疗费用高,生活质量差,给病人带来极大的痛苦 [8] 。
Wnt/β-catenin信号通路是一类进化过程中高度保守的信号通路,参与发育和疾病过程,目前在哺乳动物体内发现了19种Wnt配体和15种受体及共受体 [9] 。Wnt/β-catenin信号通路在体内的传导过程是通过Wnt蛋白与受体Frizzled家族蛋白和LRP5/6受体结合,导致GSK3β的失活并阻止破坏复合体的组装,抑制β-catenin在胞质内的降解,引起β-catenin在胞质内积累并转运到细胞核,在核内β-catenin与T细胞因子(TCF)和淋巴增强因子(LEF)结合并启动以SNAIL1和ZEB1为代表的Wnt靶基因的表达 [10] 。本研究通过观察青木香与AAI造成的慢性AAN以及发展过程中Wnt/β-catenin信号通路的变化,探讨慢性AAN的病理变化和Wnt/β-catenin信号通路在AAN纤维化发展过程中的作用机制,为阐明AAN纤维化的机制和发展其临床治疗手段提供了参考。
2. 材料与方法
2.1. 药物、试剂及仪器
将AAI标准品(纯度96%,批号:211109M,四川维克奇生物),溶于二甲基亚砜(批号:814O036,北京索莱宝科技)与0.4%的羧甲基纤维素钠(Carboxymethylcellulose Sodium, CMC-Na) (批号:20201203,上海展云化工)中,制成2 mg/mL的AAI悬浊液。青木香(购自亳州中药材批发市场)用甲醇萃取、旋蒸,用0.4%的羧甲基纤维素钠进行复溶,得到AAI含量为2 mg/mL的青木香悬浊液。HE染色液(批号:20201104,北京索莱宝);Masson染色试剂盒(批号:20210428,北京索莱宝);β-连环蛋白(β-catenin)鼠多克隆抗体(批号:00100092,武汉三鹰生物);α平滑肌肌动蛋白(α-Smooth Muscle Actin, α-SMA)兔多克隆抗体(批号:PA1-26204,Thermo Fisher scientific公司);免疫组化(Immunohistochemistry, IHC) SP试剂盒(批号:2222B301,北京中杉金桥);DAB显色试剂盒(批号:20220718,北京兰杰柯科技有限公司) DMIL LED DFC425c型显微镜(徕卡)。
2.2. 实验动物
8周龄的雄性KM小鼠36只,体重(32 ± 5) g,在贵州中医药大学基础医学院实验动物中心饲养,常温环境,自由摄食、饮水。实验过程严格按照《实验动物福利伦理审查指南(GB/T35922018)》要求执行。
2.3. 动物分组及给药
将36只小鼠于笼中适应性喂养一周,自由进食水。随机分为3组,对照组、AAI组和青木香组,每组12只。对照组小鼠灌胃给药0.4% CMC 0.2 mL/2d,AAI组小鼠灌胃给药5 mg/kg/2d,青木香组小鼠灌胃给药青木香悬浊液5 mg/kg/2d。
2.4. 样本采集
用药开始后将对照组和模型组的小鼠分别于第4周和第8周各随机取6只,戊巴比妥钠腹腔注射麻醉,摘眼球取血后,颈椎脱臼处死,用PBS进行灌注,取出肾组织样本,沿矢状面分为两份,PBS冲洗后浸入4%多聚甲醛固定。
2.5. 组织病理学染色
将固定过的肾脏组织经乙醇梯度脱水、二甲苯透明、浸蜡、包埋后切片(厚度3 µm),进行苏木精–伊红(HE)与Masson染色,在光学显微镜下观察肾脏组织病理变化。
2.6. 免疫组化染色
将玻片放入60℃烤箱2个小时融化切片表面石蜡,放入二甲苯I、II、III各10 min,再用梯度乙醇进行脱水,置于PBS缓冲液中浸洗。用柠檬酸钠抗原修复液高温修复,滴加内源性过氧化物酶阻断剂(3% H2O2),室温孵育10 min,用PBS缓冲液浸洗3次。滴加100 μL山羊血清封闭液,室温孵育15 min,β-catenin抗体(1:200),α-SMA抗体(1:200)稀释,滴加100 μL,放入免疫组化孵育盒,4℃过夜,用PBS缓冲液浸洗。滴加100 μL生物素标记山羊抗小鼠/兔IgG抗体,室温孵育15 min,用PBS缓冲液浸洗。滴加100 μL辣根酶标记链霉卵白素工作液,室温孵育15 min,用PBS缓冲液浸洗。滴加新鲜配制的DAB显色液,室温孵育1~3 min,在镜下观察到阳性反应立即终止反应。用自来水冲洗玻片。苏木素复染。梯度脱水,依次放入二甲苯I、二甲苯II 5 min,中性树脂胶封片,光学显微镜下观察蛋白表达情况。
2.7. 数据分析与处理
免疫组化和Masson染色的图像使用ImageJ软件对阳性染色部位进行统计 [11] ,实验结果以SPSS 24.0软件进行统计分析,数据均以 ± s表示,多组间统计学差异(方差齐性检验后)采用单因素方差分析(one-way-AVOVA)比较;P < 0.05表示差异有统计学意义。
3. 结果
3.1. 青木香与AAI对小鼠肾脏的毒性
通过HE染色观察慢性AAN的病理改变。结果显示与对照组相比,小鼠暴露于AAI和青木香4周后肾皮质形态结构紊乱,可见肾小管管腔扩张,部分肾小管上皮细胞出现刷状缘消失、细胞坏死脱落等改变,另外有少量肾小管上皮细胞表现为胞质浓染、细胞核增大等表现,肾小球未出现明显改变;暴露于AAI和青木香8周后肾小管管腔扩张数量较4周比增多,肾小管上皮细胞也出现了水肿、坏死和脱落,同时也出现了犬牙状分布的胞质浓染、细胞核增大的肾小管上皮细胞(见图1)。
 小鼠暴露于AAI与青木香4周与8周后肾脏病理改变的代表性图片。暴露于AAI与青木香后肾近曲小管上皮细胞出现水肿、脱落坏死,部分上皮细胞胞质浓染,呈犬牙状分布。
小鼠暴露于AAI与青木香4周与8周后肾脏病理改变的代表性图片。暴露于AAI与青木香后肾近曲小管上皮细胞出现水肿、脱落坏死,部分上皮细胞胞质浓染,呈犬牙状分布。
Figure 1. Kidney changes in mice exposed to AAI and cyanobacteria for 4 and 8 weeks after HE staining
图1. HE染色观察小鼠暴露于AAI与青木香4周与8周后肾脏的变化
3.2. 慢性AAN过程中Wnt/β-Catenin信号通路的改变
通过免疫组化观察小鼠暴露于AAI和青木香后肾脏中的β-catenin蛋白表达情况。结果显示,对照组的β-catenin蛋白免疫组化平均光密度值在4周和8周时变化不大。与对照组相比,小鼠暴露于AAI和青木香4周后肾小管中β-catenin表达增高,为对照组的1.2倍,主要聚集在肾小管上皮细胞的细胞质和细胞核内;与对照组相比,小鼠暴露于AAI和青木香8周后,β-catenin蛋白的表达进一步增高,为对照组的1.4倍,大量聚集在肾小管上皮细胞的细胞核内(见图2)。
 小鼠暴露于AAI与青木香4周与8周后肾脏β-catenin蛋白表达的代表性图片。对照组未出现明显的β-catenin蛋白的表达,暴露于AAI与青木香4周后肾近曲小管上皮细胞胞质和细胞核内出现β-catenin蛋白的表达,8周后β-catenin蛋白的表达进一步聚集于细胞核内;β-catenin免疫组化平均光密度值与对照组相比有明显升高。n = 5,*P < 0.05,**P < 0.01,***P < 0.005。
小鼠暴露于AAI与青木香4周与8周后肾脏β-catenin蛋白表达的代表性图片。对照组未出现明显的β-catenin蛋白的表达,暴露于AAI与青木香4周后肾近曲小管上皮细胞胞质和细胞核内出现β-catenin蛋白的表达,8周后β-catenin蛋白的表达进一步聚集于细胞核内;β-catenin免疫组化平均光密度值与对照组相比有明显升高。n = 5,*P < 0.05,**P < 0.01,***P < 0.005。
Figure 2. Changes in renal β-catenin protein expression in mice exposed to AAI and cyanobacteria for 4 and 8 weeks after immunohistochemical staining
图2. 免疫组化染色观察小鼠暴露于AAI与青木香4周与8周后肾脏β-catenin蛋白的表达变化
3.3. Wnt/β-Catenin信号通路与肾纤维化
通过Masson染色观察小鼠暴露于AAI和青木香后肾脏胶原纤维的改变。结果显示,与对照组相比,小鼠暴露于AAI和青木香4周后蓝染的胶原纤维数量和面积明显增多,通过对染色结果的胶原纤维容积分数进行统计分析后发现,AAI组和青木香组的胶原纤维容积分数显著增加;与对照组相比,小鼠暴露于AAI和青木香8周后肾皮质中的纤维数量和胶原纤维容积分数也出现了显著增加(见图3)。
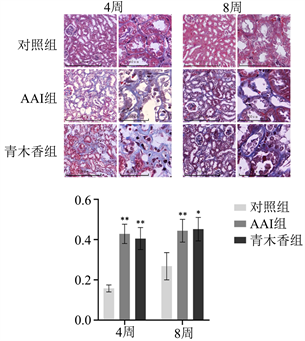 小鼠暴露于AAI与青木香4周与8周后肾皮质Masson染色的代表性图片。暴露于AAI与青木香4周和8周后,肾皮质胶原纤维的表达增多;与对照相比,胶原纤维容积分数出现了显著增高。n = 5,*P < 0.05;**P < 0.01。
小鼠暴露于AAI与青木香4周与8周后肾皮质Masson染色的代表性图片。暴露于AAI与青木香4周和8周后,肾皮质胶原纤维的表达增多;与对照相比,胶原纤维容积分数出现了显著增高。n = 5,*P < 0.05;**P < 0.01。
Figure 3. Change in collagen fiber expression in renal cortex of mice exposed to AAI and cyanobacteria for 4 and 8 weeks after Masson staining
图3. Masson染色观察小鼠暴露于AAI与青木香4周与8周后肾皮质胶原纤维的表达变化
通过免疫组化对暴露于AAI和青木香小鼠肾脏的α-SMA蛋白表达进行观察,结果显示,小鼠暴露于AAI和青木香4周后,与对照组相比,α-SMA蛋白的表达明显增高,聚集在犬牙状细胞内,为对照组的1.4倍以上;与对照组相比,小鼠暴露于AAI和青木香8周后,AAI组的α-SMA蛋白的表达超过对照组的1.6倍,青木香组也较对照组有明显的升高(见图4)。
 小鼠暴露于AAI与青木香4周与8周后肾脏α-SMA蛋白表达的代表性图片。对照组没有明显的α-SMA蛋白表达,暴露于AAI与青木香后肾近曲小管上皮细胞表达α-SMA蛋白;β-catenin免疫组化平均光密度值与对照组相比有明显升高。n = 5,*P < 0.05;**P < 0.01;***P < 0.005。
小鼠暴露于AAI与青木香4周与8周后肾脏α-SMA蛋白表达的代表性图片。对照组没有明显的α-SMA蛋白表达,暴露于AAI与青木香后肾近曲小管上皮细胞表达α-SMA蛋白;β-catenin免疫组化平均光密度值与对照组相比有明显升高。n = 5,*P < 0.05;**P < 0.01;***P < 0.005。
Figure 4. Changes in renal α-SMA protein expression in mice exposed to AAI and cyanobacteria for 4 and 8 weeks after immunohistochemical staining
图4. 免疫组化染色观察小鼠暴露于AAI与青木香4周与8周后肾脏α-SMA蛋白的表达变化
4. 讨论
青木香作为马兜铃属植物,在我国分布广泛,曾作为中草药和民族药入药 [1] 。研究表明,马兜铃属植物的毒性大部分源于其富含的AAI,主要损伤肾脏的肾小管尤其是肾近端小管,会引起近端小管上皮细胞坏死、脱落,进一步诱导肾小管上皮细胞纤维化 [12] 。因此,明确AAN过程中纤维化的改变和与Wnt/β-catenin信号通路之间的关系对于AAN的诊断和治疗有重要意义。
小鼠暴露于AAI与青木香4周以及8周后,大量肾小管管腔扩张,肾小管上皮细胞出现不同程度的损伤,细胞核固缩,还出现了部分另一种形态的肾小管上皮细胞,细胞呈犬牙状突起,胞质浓染,细胞核增大,与损伤后新生的肾小管上皮细胞形态一致 [13] 。说明AAI对肾脏有毒性作用,主要损伤肾小管上皮细胞,在慢性AAN的发展过程中,受损的肾小管上皮细胞出现自我修复,会有新生的肾小管上皮细胞的出现。而暴露于AAI和暴露于青木香后小鼠的病理改变表现相同,证明了AAI是引发AAN的主要毒性成分。
研究表明,慢性期的AAN会诱发肾小管尤其是近端肾小管上皮细胞坏死、脱落,并诱发肾小管上皮细胞EMT进而引发纤维化,也是马兜铃酸肾病预后不佳的重要原因,其引发纤维化的机制尚不明确 [14] 。而Wnt/β-catenin信号通路被发现参与了肾脏的疾病过程,在不同层面上干扰Wnt通路,如在输尿管阻塞小鼠肾间质纤维化模型中注射Ddk1 (一种Wnt拮抗剂)载体可以减少β-catenin的积聚和纤维化 [15] ;另一种Wnt拮抗剂Dapper3的缺失会导致输尿管梗阻肾纤维化动物模型β-catenin的紊乱、Wnt靶向的促纤维化基因的激活和纤维化表型的恶化 [16] 。这些结果都表明,Wnt信号通路与肾间质纤维化关系密切,在肾间质纤维化过程中发挥着重要作用。我们通过对Wnt/β-catenin信号通路的核心蛋白β-catenin的免疫组化研究发现,在慢性AAN发展的过程中,β-catenin的表达与对照组相比明显升高,4周时多聚集在胞质和细胞核内。当小鼠暴露于AAI8周时,β-catenin多聚集在细胞核内。当Wnt/β-catenin信号通路被激活后,胞质内的破坏复合体不能降解β-catenin,在胞质内过度堆积的β-catenin转移至细胞核内,引发T细胞因子的转录从而激活β-catenin/EMT途径 [17] 。结果表明,在AAN的发展过程中,也出现了Wnt/β-catenin信号通路的激活。我们通过Masson染色以及α-SMA免疫组化染色对小鼠暴露于AAI 4周和8周后的纤维化程度的观察,结果表明,小鼠暴露于AAI后其纤维化程度逐渐加重,最严重时达到对照组的2.7倍以上;α-SMA的免疫组化结果也显示小鼠暴露于AAI 4周和8周后α-SMA的表达显著升高,大量聚集与新生的犬牙状细胞内。因此,我们认为AAN的发展过程中会激活Wnt/β-catenin信号通路,促进肾小管上皮细胞EMT,参与了肾纤维化的过程。而新生的肾小管上皮细胞,这些细胞不仅参与了损伤肾小管的修复,也有少量细胞表达α-SMA蛋白,说明其也可能参与了AAN肾脏纤维化的过程。
综上所述,机体摄入AAI和青木香均可引起AAN的发生,两种药物引起的AAN病理改变相同。在慢性AAN的发展过程中,能够观察到Wnt/β-catenin信号通路的激活,该通路促进肾小管上皮细胞发生EMT转化,促进AAN纤维化的发展,但对于是哪一种Wnt通路的配体所激活的Wnt/β-catenin信号通路以及该信号通路与肾纤维化之间的关系还有待研究。
项目基金
省教育厅特色重点实验室(黔教合KY字[2021] 004);贵州省基础研究计划(黔科合基础-ZK [2022]一般465);2020省科技支撑(黔教合支撑[2020] 4Y209)。
文章引用
王一凡,刘 爽,黄春华,汪思齐,李茂娟,汤海明,楼迪栋. 小鼠AAN激活Wnt/β-Catenin信号通路及诱导肾脏纤维化的观察性研究
Observational Study of Wnt/β-Catenin Signaling Pathway Activation and Induction of Renal Fibrosis in Mice by AAN[J]. 临床医学进展, 2023, 13(05): 8055-8062. https://doi.org/10.12677/ACM.2023.1351128
参考文献
- 1. Zhang, H.M., Zhao, X.H., Sun, Z.H., et al. (2019) Recognition of the Toxicity of Aristolochic Acid. Journal of Clinical Pharmacy and Therapeutics, 44, 157-162. https://doi.org/10.1111/jcpt.12789
- 2. 黄春华, 向微, 汪思齐, 等. 含马兜铃酸中药的毒性与毒理学研究进展[J]. 中国司法鉴定, 2022(4): 33-41.
- 3. Ge, Y., Guo, P., Xu, X., et al. (2017) Selective Analysis of Aristolochic Acid I in Herbal Medicines by Dummy Molecularly Imprinted Solid-Phase Extraction and HPLC. Journal of Separation Science, 40, 2791-2799. https://doi.org/10.1002/jssc.201700116
- 4. 侯改灵, 黄岩杰, 杨晓青, 等. 从临床表现和致病机制再认识马兜铃酸类中药的肾毒性[J]. 中药药理与临床, 2019, 35(2): 162-166.
- 5. Gökmen, M.R., Cosyns, J.P., Arlt, V.M., et al. (2013) The Epidemiology, Diagnosis, and Management of Aristolochic Acid Nephropathy: A Narrative Review. Annals of Internal Medicine, 158, 469-477. https://doi.org/10.7326/0003-4819-158-6-201303190-00006
- 6. Yang, L., Su, T., Li, X., et al. (2012) Aris-tolochic Acid Nephropathy: Variation in Presentation and Prognosis. Nephrology Dialysis Transplantation, 27, 292-298. https://doi.org/10.1093/ndt/gfr291
- 7. Anger, E.E., Yu, F. and Li, J. (2020) Aristolochic Acid-Induced Ne-phrotoxicity: Molecular Mechanisms and Potential Protective Approaches. International Journal of Molecular Sciences, 21, 1157. https://doi.org/10.3390/ijms21031157
- 8. Luciano, R.L. and Perazella, M.A. (2015) Aristolochic Acid Nephropathy: Epidemiology, Clinical Presentation, and Treatment. Drug Safety, 38, 55-64. https://doi.org/10.1007/s40264-014-0244-x
- 9. Nusse, R. and Clevers, H. (2017) Wnt/β-Catenin Signaling, Dis-ease, and Emerging Therapeutic Modalities. Cell, 169, 985-999. https://doi.org/10.1016/j.cell.2017.05.016
- 10. Huang, P., Yan, R., Zhang, X., et al. (2019) Activating Wnt/β-Catenin Signaling Pathway for Disease Therapy: Challenges and Opportunities. Pharmacology & Therapeutics, 196, 79-90. https://doi.org/10.1016/j.pharmthera.2018.11.008
- 11. Deshpande, P., Gogia, N., Chimata, A.V., et al. (2021) Un-biased Automated Quantitation of ROS Signals in Live Retinal Neurons of Drosophila Using Fiji/ImageJ. BioTechniques, 71, 416-424. https://doi.org/10.2144/btn-2021-0006
- 12. Man, Y.L., Rui, H.L., Chen, Y.P., et al. (2017) Aris-tolochic Acid-Induced Autophagy Promotes Epithelial-to-Myofibroblast Transition in Human Renal Proximal Tubule Ep-ithelial Cells. Evidence-Based Complementary and Alternative Medicine, 2017, Article ID: 9596256. https://doi.org/10.1155/2017/9596256
- 13. 王会玲, 李芮, 刘楠梅, 等. 缺血-再灌注急性肾损伤后原位成人干/祖细胞参与肾小管上皮细胞再生[J]. 中华临床医师杂志(电子版), 2017, 11(6): 945-951.
- 14. Zhao, H., Jiang, N., Han, Y., et al. (2020) Aristolochic Acid Induces Renal Fibrosis by Arresting Proximal Tubular Cells in G2/M Phase Mediated by HIF-1α. FASEB Journal, 34, 12599-12614. https://doi.org/10.1096/fj.202000949R
- 15. He, W., Dai, C., Li, Y., et al. (2009) Wnt/beta-Catenin Signaling Promotes Renal Interstitial Fibrosis. Journal of the American Society of Nephrology, 20, 765-776. https://doi.org/10.1681/ASN.2008060566
- 16. Xue, H., Xiao, Z., Zhang, J., et al. (2013) Disruption of the Dapper3 Gene Aggravates Ureteral Obstruction-Mediated Renal Fibrosis by Amplifying Wnt/beta-Catenin Signaling. Journal of Biological Chemistry, 288, 15006-15014. https://doi.org/10.1074/jbc.M113.458448
- 17. Halt, K. and Vainio, S. (2014) Coordination of Kidney Organogene-sis by Wnt Signaling. Pediatric Nephrology, 29, 737-744. https://doi.org/10.1007/s00467-013-2733-z
NOTES
*通讯作者。