Advances in Clinical Medicine
Vol.
13
No.
04
(
2023
), Article ID:
64294
,
12
pages
10.12677/ACM.2023.134865
CTSV是一种可能的肿瘤标志物并与肾上腺 皮质癌的免疫浸润密切相关
孙振鹏1*,王荃2,穆垚名3,高健刚1#
1青岛大学附属青岛市市立医院泌尿外科,山东 青岛
2青岛大学附属青岛市市立医院麻醉手术科,山东 青岛
3大连医科大学附属青岛市市立医院泌尿外科,山东 青岛
收稿日期:2023年3月19日;录用日期:2023年4月15日;发布日期:2023年4月23日

摘要
目的:组织蛋白酶V (cathepsin V, CTSV)最近被认为是一种致癌调节剂,在肿瘤细胞的生长增殖中发挥关键作用。然而,CTSV和肾上腺皮质癌之间的关联仍然未知。本研究通过生物信息学的方法探究其在肾上腺皮质癌中的表达情况及与预后间的关系,并通过功能分析和免疫浸润分析解释其关联。方法:运用R语言提取TCGA、GTEx和GEO数据库中肾上腺皮质癌与正常肾上腺皮质相关信息,分析CTSV在其中的表达差异,采用单/多因素Cox分析其与预后间的关系;通过GO、KEGG和GSEA富集分析研究其可能的机制;最后运用ssGSEA富集分析与TIMER2.0数据库研究CTSV在肾上腺皮质癌中与免疫浸润之间的联系。结果:CTSV在肾上腺皮质癌中表达水平显著升高(P < 0.001)。CTSV表达水平与N分期、M分期、预后分期和切缘肿瘤阳性显著正相关,CTSV高表达是肾上腺皮质癌预后的独立危险因素。此外,CTSV可能通过免疫反应调节、免疫反应激活、靶向E2F和细胞有丝分裂等多个信号通路参与肾上腺皮质癌的发生发展过程,与肾上腺皮质癌中的免疫浸润细胞均存在显著相关性。结论:CTSV在肾上腺皮质癌中显著高表达与预后不良密切相关,是肾上腺皮质癌患者的重要生物标志物,并参与肿瘤局部免疫反应的调节影响免疫细胞浸润水平,具有肾上腺皮质癌药物靶点的潜能。
关键词
肾上腺皮质癌,CTSV,生物标志物,生物信息学,TCGA,GEO,TIMER2.0

CTSV Is a Possible Tumor Marker and Is Closely Related to Immune Invasion of Adrenal Cortical Carcinoma
Zhenpeng Sun1*, Quan Wang2, Yaoming Mu3, Jiangang Gao1#
1Department of Urology, Qingdao Municipal Hospital Affiliated to Qingdao University, Qingdao Shandong
2Department of Anesthesia and Surgery, Qingdao Municipal Hospital Affiliated to Qingdao University, Qingdao Shandong
3Department of Urology, Qingdao Municipal Hospital Affiliated to Dalian Medical University, Qingdao Shandong
Received: Mar. 19th, 2023; accepted: Apr. 15th, 2023; published: Apr. 23rd, 2023

ABSTRACT
Objective: Cathepsin V (CTSV) has recently been recognized as an oncogenic modulator and plays a key role in the growth and proliferation of tumor cells. However, the association between CTSV and adrenal cortical carcinoma remains unknown. In this study, the expression and relationship between adrenal cortical carcinoma and prognosis were explored by bioinformatics, and the association was explained by functional analysis and immune invasion analysis. Methods: The R language was used to extract the relevant information of adrenal cortex carcinoma and normal adrenal cortex in TCGA, GTEx and GEO databases, analyze the expression difference of CTSV therein, and analyze the relationship between it and prognosis by single/multivariate Cox. The possible mechanisms of GO, KEGG, and GSEA enrichment analysis were investigated. Finally, ssGSEA enrichment analysis and TIMER2.0 database were used to study the relationship between CTSV and immune invasion in adrenal cortical carcinoma. Results: The expression level of CTSV in adrenal cortical carcinoma was significantly increased (P < 0.001). CTSV expression levels were positively correlated with N stage, M stage, prognostic stage and positive resection margin tumor, and high CTSV expression was an independent risk factor for the prognosis of adrenal cortex carcinoma. In addition, CTSV may be involved in the development and development of adrenal cortical carcinoma through multiple signaling pathways such as immune response regulation, immune response activation, targeting of E2F and cell mitosis, which is significantly correlated with immune-infiltrating cell cleavage in adrenal cortical carcinoma. Conclusion: The significantly high expression of CTSV in adrenal cortex carcinoma is closely related to poor prognosis, and is an important biomarker for patients with adrenocortical carcinoma, and participates in the regulation of local immune response of tumors and affects the level of immune cell infiltration, which has the potential of drug targets for adrenocortical carcinoma.
Keywords:Adrenal Cortical Carcinoma, CTSV, Biomarkers, Bioinformatics, TCGA, GEO, TIMER2.0

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肾上腺皮质癌(Adrenocortical Carcinoma, ACC)是一种较为罕见而具有极强侵袭性的泌尿系统恶性肿瘤,其年发病率约为每百万人0.5~2例 [1] 。临床上,ACC可分为有内分泌功能型和无内分泌功能型。有分泌功能的ACC因其分泌激素的不同,常表现出不同的临床症状(如分泌皮质醇,可表现为库欣综合征:满月脸、水牛背等;如分泌性激素,可表现为性征异常:多毛、痤疮、男性化等)。而无内分泌功能的ACC起病常较为隐匿,其临床表现与肿瘤局部进展相关(如腹部胀痛、腹部肿块等)。目前早期的筛查主要通过影像学检查和激素水平的检测,在对于肾上腺肿块的鉴别诊断中,计算机断层扫描(CT)和磁共振成像(MRI)都表现出不错的诊断效能,正电子发射计算机断层显像(PET-CT)也能为肿块的良恶性判断提供有力的依据;而在怀疑ACC的病例中,则需要进行广泛的类固醇激素检查包括糖、矿物质、性激素和前体类固醇等以对肾上腺功能进行系统的评估 [2] [3] [4] [5] 。因穿刺病理活检常伴随着癌组织溢出的风险,临床上常不将其作为早期诊断的手段,其确诊主要依靠手术后组织标本的病例诊断。现阶段,手术是ACC治疗的主要方案,切缘是否伴有癌细胞阳性是ACC患者预后的主要风险因素。因此,当具备完整切除条件时,腔镜或开放手术下完全切除是所有局部早期(I-II期)和局部晚期(III期)ACC患者的标准治疗方法 [6] [7] 。术后的辅助治疗主要依靠米托坦和化疗,然而米托坦为患者带来的获益依然存在着争议。在一项200余人的随机对照实验中,辅助米托坦的患者表现出了更差的无复发生存率 [8] ,使得传统的诊疗模式受到挑战。随着分子生物学的发展,越来越多的肿瘤标志物被发现,在癌症的诊断、检测和治疗中发挥不同程度的影响,而在ACC中,依然缺乏一种有效地细胞因子为临床的诊疗工作提供指导。
组织蛋白酶V (cathepsin V, CTSV)属于半胱氨酸蛋白酶肽链端解酶,与组织蛋白酶L (CTSL)有78%的同源性,所以又称为组织蛋白酶L2 (CTSL2),其编码基因具有8813个碱基对,内含8个外显子和7个内含子,位于9q22.2染色体。CTSV是一种多功能内肽酶,主要聚集于溶酶体中,参与抗原肽的释放和MHC II类分子的成熟,并参与弹性蛋白原纤维的翻转以及细胞内和细胞外基质的裂解,多在角膜、胸腺、心脏、大脑和皮肤中表达 [9] 。Skrzypczak等人发现,CTSV的表达与参与细胞周期和增殖调节的蛋白质的表达呈正相关,如细胞周期蛋白依赖性激酶抑制剂p21/WAF、细胞周期蛋白B1、MYB原癌基因样2或人表皮生长因子受体2 (HER2)酪氨酸激酶,具备成为预测子宫内膜癌生存率和严重程度假定标志物的潜能 [10] ;Sereesongsaeng等人发现,CTSV可以通过蛋白酶体促进ER阳性乳腺癌中的GATA3表达,其高表达与ER阳性乳腺癌的不良预后显著正相关 [11] ;Xia等人发现,CTSV的过表达能够触发膀胱癌中的炎症信号通路,通过上调NF-κB途径促进癌细胞的增殖 [12] 。上述研究表明,CTSV可在肿瘤发生进展的多个阶段中发挥重要作用。而CTSV与ACC间的关系目前仍不明确。本研究通过生物信息学方法,分析了TCGA、GTEx、GEO和TIMER2.0等数据库以探究CTSVmRNA在ACC中的表达特点及其与ACC预后的联系;并通过功能富集分析与免疫浸润分析等以探究CTSV在ACC发生发展过程中的作用。
2. 资料和方法
2.1. 数据来源
GDC数据库(https://portal.gdc.cancer.gov/)下载TCGA-BLCA数据集的RNA-Seq数据及其对应的临床数据。剔除其中的重复样本,将样本的RNA-Seq数据与样本对应的临床信息进行一一整合,最终获得肾上腺皮质癌组织样本77例。GTEx (https://www.huaplusmd.com/)获取正常肾上腺皮质组织样本128例;通过NCBI数据库(https://www.ncbi.nlm.nih.gov/)下载GEO数据库GSE33371数据集的RNA表达矩阵;TIMER2.0数据库(http://timer.comp-genomics.org/)用于对TCGA数据库数据进行mRNA免疫浸润相关的分析。
2.2. CTSV在ACC和正常肾上腺皮质组织中的mRNA表达
分析CTSV在TCGA-ACC肾上腺皮质癌样本中与GTEx正常肾上腺皮质样本中表达水平间的差异,并分析CTSV在GSE33371数据集中肾上腺皮质癌与正常肾上腺皮质间的表达差异。
2.3. CTSV与ACC临床病理参数的相关性
提取TCGA-ACC数据集中表达矩阵及对应临床信息,分析CTSV表达水平在各临床病理参数内的组间差异,并分析其与各临床病理参数间的相关性。
2.4. CTSV在ACC中的生存预后分析
取TCGA-ACC癌组织样本中CTSV表达水平的中位数,将其分为两组,绘制Kaplan-Meier生存曲线以分析CTSV的高低表达水平与ACC患者生存期的相关性。分析CTSV表达水平和临床信息与预后间关系,探究其中的独立危险因素,并据此构建预测模型,绘制Calibration曲线验证模型价值。
2.5. CTSV相关分子的功能富集分析
取TCGA-ACC中CTSV表达水平的中位数,将其分为两组,设定“|log2FC| > 1, P.adj < 0.05”获得其间的差异基因(DEGs)作为CTSV的共表达基因,对DEGs进行GO、KEGG以及GSEA富集分析,探究其在ACC中参与的可能的信号通路和机制
2.6. CTSV在ACC中与免疫浸润的相关性
通过ssGSEA和TIMER2.0数据库分析在ACC中CTSV的表达水平与免疫浸润细胞间的相关性。
2.7. 统计学方法
上述数据分析过程在R通过R 3.6.3软件进行分析,用Wilcoxen秩和检验分析CTSV在ACC与正常肾上腺皮质间表达差异;采用多重假设检验(Dunn’s test)分析CTSV表达水平在各临床信息中的组间差异,以Logistics回归分析CTSV表达水平与临床信息间联系;ROC曲线下面积愈趋近于1表明灵敏度愈高;单/多因素Cox回归分析CTSV表达水平和临床信息与预后间关系;对DEGs的三种功能复习通过Clusprofile包实现。P < 0.05时,代表差异有统计学意义。
3. 结果
3.1. CTSVmRNA在ACC中显著高表达
在TCGA-ACC与GTEx联合数据以及GEO数据中,CTSV在肾上腺皮质癌中的表达水平均显著高于正常肾上腺皮质水平,CTSV可能是肾上腺皮质癌中的癌基因(见图1)。
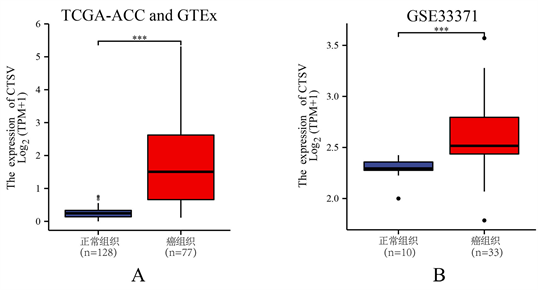 (A) TCGA-ACC与GTEx数据集中CTSV在肾上腺皮质癌组织与正常组织中的表达情况;(B) GSE33371数据集中CTSV在肾上腺皮质癌和正常组织中的表达情况。(注:*,P < 0.05;**,P < 0.01;***,P < 0.001)
(A) TCGA-ACC与GTEx数据集中CTSV在肾上腺皮质癌组织与正常组织中的表达情况;(B) GSE33371数据集中CTSV在肾上腺皮质癌和正常组织中的表达情况。(注:*,P < 0.05;**,P < 0.01;***,P < 0.001)
Figure 1. Expression level of CTSV in ACC
图1. CTSV在ACC中的表达水平
3.2. CTSV与ACC患者的不良临床指标相关
在多重假设检验(Dunn’s test)分析中发现,CTSV往往在较差的临床病理参数组别中高表达(见图2),Logistics回归分析表明,CTSV与患者的淋巴结转移、远处转移、不良预后分期和手术标本切缘阳性呈显著正相关(见表1),表明CTSV在ACC的肿瘤侵袭和迁移中发挥重要作用。
 (A)~(H) CTSV在ACC中的表达水平与年龄、性别、WEISS评分、T分期、N分期、M分期、预后分期、切缘肿瘤阳性的差异表达分析。(注:*,P < 0.05;**,P < 0.01;***,P < 0.001)
(A)~(H) CTSV在ACC中的表达水平与年龄、性别、WEISS评分、T分期、N分期、M分期、预后分期、切缘肿瘤阳性的差异表达分析。(注:*,P < 0.05;**,P < 0.01;***,P < 0.001)
Figure 2. Analysis of correlation between CTSV and clinicopathologic data subgroups
图2. CTSV与临床病理资料亚组的相关性分析
Table 1. Relationship between CTSV expression levels of ACC tissues and clinical information in the TCGA-ACC dataset
表1. TCGA-ACC数据集中CTSV的表达水平与临床信息间的关系
3.3. CTSV介导ACC患者的不良预后
Kaplan-Meier生存曲线结果表明CTSV高表达与患者不良总生存率及不良疾病特异性生存率显著相关(见图3(A)、图3(B)),在患者的不同性别、不同年龄段均表现出上述关联(见图3(C)~(F)),ROC曲线显示CTSV对于预测患者的总体生存率具有一定的灵敏度(见图4)。此外,单/多因素Cox回归结果显示,ACC的T分期、切缘癌细胞阳性以及CTSV的高低水平表达是ACC患者预后不良的独立风险因素(见表2),Calibration图表明,基于多因素Cox回归分析结果构建的预测模型预测价值尚可(见图5)。
3.4. CTSV可能通过参与ACC中的免疫应答过程调节ACC癌细胞的增殖和迁移
GO与KEGG功能富集分析显示,CTSV相关基因主要在免疫识别、免疫细胞增殖等基因集中富集(见图6)。GSEA基因富集分析显示出CTSV相关基因主要在免疫反应调节、免疫反应的激活等基因集中富集,富集部分主要集中在下调部分(见图7(A)、图7(B));并在细胞有丝分裂和靶向E2F等基因集中富集,且富集部分主要集中在上调部分(见图7(C)、图7(D))。CTSV可能在抑制ACC肿瘤微环境的免疫调节中发挥重要作用。
3.5. CTSV与ACC肿瘤微环境中的多种免疫细胞浸润水平显著相关
ssGSEA结果显示ACC中CTSV与CD4+Th2细胞呈显著正相关,与肥大细胞(Mast)、CD8+T细胞等15种免疫细胞浸润水平呈显著负相关(见图8(A))。TIMER2.0分析表明,ACC中CTSV与肿瘤纯度、CD4+Th2细胞和髓源性抑制细胞(MDSC)呈显著正相关(见图8(B)、图8(C)、图8(F)),与CD8+T细胞、自然杀伤(NK)细胞、Mast细胞、M2型巨噬细胞和髓系树突状细胞呈显著负相关(见图8(D)、图8(E)、图8(G)~(I))。
4. 讨论
肾上腺皮质癌(Adrenocortical Carcinoma, ACC)是临床上一种较为罕见的泌尿系统恶性肿瘤,其发病率约在0.5~2/百万 [1] ,年龄上以青少年为主且以女性多发 [13] 。其中,近一半的患者表现为皮质醇、性激素等激素过量的症状和体征 [14] [15] [16] ;三分之一的患者表现为肿瘤生长引起的局部症状,如腹部或胁部疼痛、腹部胀满或早期饱腹感 [15] [16] ;约六分之一的患者无明显临床表现,因为无关的疾病通过影像学检查偶然发现 [13] 。目前,ACC的标准治疗方法是完全切除肿瘤,辅助治疗旨在减少复发的几率,而对于不可切除或转移性的ACC目前尚无有效地靶向治疗药物 [17] 。
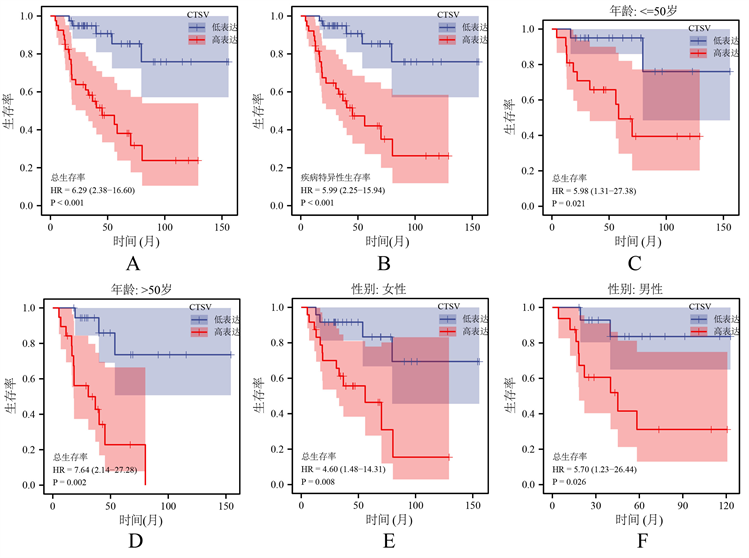 (A) CTSV表达水平与ACC患者的总体生存率的关系;(B) CTSV表达水平与ACC患者的疾病特异性生存率的关系;(C) (D) CTSV表达水平与不同年龄段ACC患者的总体生存率的关系;(E) (F) CTSV表达水平与不同性别ACC患者的总体生存率的关系
(A) CTSV表达水平与ACC患者的总体生存率的关系;(B) CTSV表达水平与ACC患者的疾病特异性生存率的关系;(C) (D) CTSV表达水平与不同年龄段ACC患者的总体生存率的关系;(E) (F) CTSV表达水平与不同性别ACC患者的总体生存率的关系
Figure 3. Prognostic analysis of CTSV in ACC
图3. CTSV在ACC中的预后分析
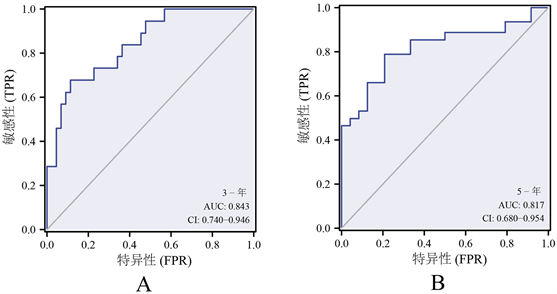 (A) CTSV在预测ACC患者3年总体生存率的灵敏度;(B) CTSV在预测ACC患者5年总体生存率的灵敏度
(A) CTSV在预测ACC患者3年总体生存率的灵敏度;(B) CTSV在预测ACC患者5年总体生存率的灵敏度
Figure 4. Sensitivity of CTSV in ACC prognostic analysis
图4. CTSV在ACC预后分析中的灵敏度
Table 2. Univariate and multivariate Cox regression analysis correlates overall survival in ACC patients with CTSV expression
表2. 单因素和多因素Cox回归分析ACC患者总体生存率与CTSV表达的相关性
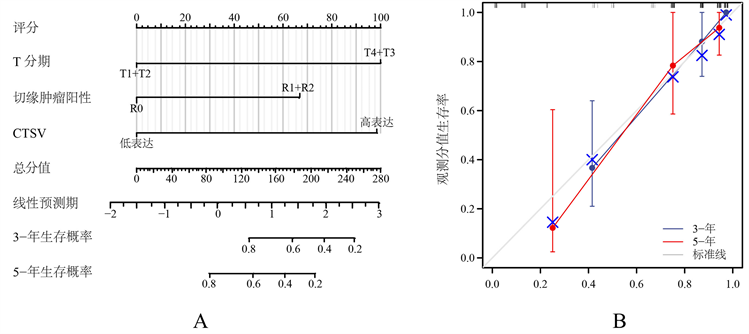 (A) 基于多因素Cox回归结果的预测模型;(B) 基于预测模型的Calibration校验图
(A) 基于多因素Cox回归结果的预测模型;(B) 基于预测模型的Calibration校验图
Figure 5. Construction of predictive models for ACC prognosis
图5. ACC预后的预测模型构建
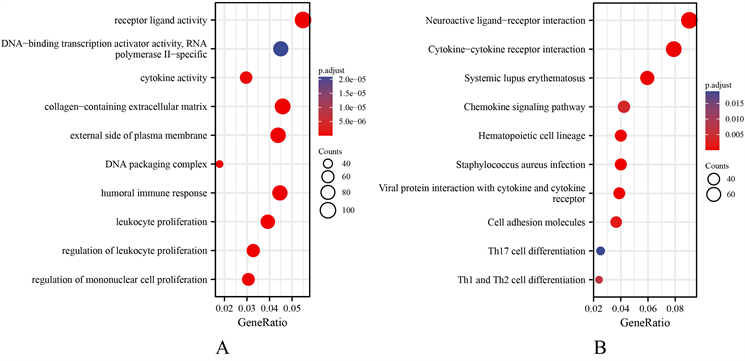 (A) CTSV相关基因GO富集结果;(B) CTSV相关基因KEGG富集结果
(A) CTSV相关基因GO富集结果;(B) CTSV相关基因KEGG富集结果
Figure 6. GO and KEGG functional enrichment analysis of CTSV co-expressed genes
图6. CTSV共表达基因的GO及KEGG功能富集分析
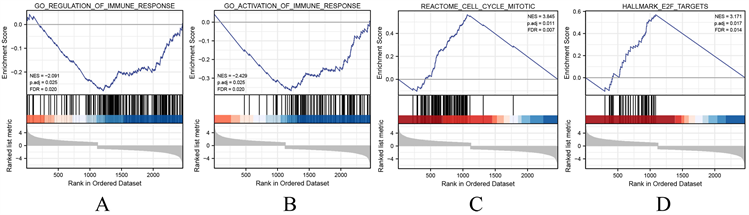 (A) 在免疫反应调节通路中富集,以下调组基因为主;(B) 在免疫反应的激活通路中富集,以下调组基因为主;(C)在细胞有丝分裂通路中富集,以上调组基因为主;(D) 在靶向E2F通路中富集,以上调组基因为主。
(A) 在免疫反应调节通路中富集,以下调组基因为主;(B) 在免疫反应的激活通路中富集,以下调组基因为主;(C)在细胞有丝分裂通路中富集,以上调组基因为主;(D) 在靶向E2F通路中富集,以上调组基因为主。
Figure 7. GSEA enrichment analysis of CTSV co-expressed genes
图7. CTSV共表达基因的GSEA富集分析
组织蛋白酶V (cathepsin V,即CTSV,又称CTSL2)为一种半胱氨酸蛋白酶,主要存在于溶酶体中,可在肿瘤发生发展的多个阶段发挥重要作用。Michael Toss等人在乳腺导管原位癌(DCIS)中观察到高CTSV表达,并与DCIS体积、粉刺型坏死和高增殖指数密切相关,是保乳手术治疗患者侵袭性复发的独立风险因素 [18] ;Junnian Song等人在肺腺癌中观察到CTSV的显著高表达,并与肺腺癌患者的不良总生存率密切相关,CTSV缺陷的A549细胞系也表现出了较差的增殖和迁移能力 [19] ;Chia-Liang Lin等人更发现Praeruptorin B抑制EGFR-MEK-ERK信号通路并随后下调CTSC和CTSV可以降低肾细胞癌的迁移和侵袭 [20] 。在国内外的研究中,CTSV被发现与乳腺癌、肺腺癌、膀胱癌、肾细胞癌等恶性肿瘤存在着密切的联系,然而其在ACC中的表达水平及相关性仍未明确。
我们通过提取TCGA、GTEx、GEO和TIMER2.0数据库数据,对CTSVmRNA与ACC之间的关联进行了分析。结果显示:CTSV在ACC中的表达水平显著高于非癌组织,CTSV的高水平表达与患者的淋巴结转移、远处转移、预后分期及切缘阳性等呈显著正相关。生存分析中,CTSV高表达表现出ACC不良预后的独立预测价值,基于多因素Cox回归结果构建的预测模型也展现出一定的预测能力。结果表明,CTSV参与ACC的进展和迁移过程,具有作为评估ACC预后的肿瘤标志物的潜能。
 (A) ssGSEA富集分析检测肾上腺皮质癌中CTSV与各种免疫细胞浸润水平间相关性;TIMER2.0数据库肾上腺皮质癌中CTSV与免疫细胞浸润水平的相关性:(B) 与肿瘤纯度呈正相关;(C) 与CD4+Th2细胞呈正相关;(D) 与CD8+T细胞呈负相关;(E) 与NK细胞呈负相关;(F) 与MDSC细胞呈正相关;(G) 与Mast细胞呈负相关;(H) 与M2型巨噬细胞呈负相关;(I) 与髓样树突状细胞呈负相关。(注:*,P < 0.05;**,P < 0.01;***,P < 0.001)
(A) ssGSEA富集分析检测肾上腺皮质癌中CTSV与各种免疫细胞浸润水平间相关性;TIMER2.0数据库肾上腺皮质癌中CTSV与免疫细胞浸润水平的相关性:(B) 与肿瘤纯度呈正相关;(C) 与CD4+Th2细胞呈正相关;(D) 与CD8+T细胞呈负相关;(E) 与NK细胞呈负相关;(F) 与MDSC细胞呈正相关;(G) 与Mast细胞呈负相关;(H) 与M2型巨噬细胞呈负相关;(I) 与髓样树突状细胞呈负相关。(注:*,P < 0.05;**,P < 0.01;***,P < 0.001)
Figure 8. The expression levels of CTSV correlated with the level of infiltration of tumor immune cells in ACC
图8. CTSV的表达水平与ACC中肿瘤免疫细胞浸润水平相关
为了进一步探究CTSV在ACC中可能发挥的功能,我们进一步分析了CTSV共表达基因的功能富集情况。结果显示,在GO和KEGG富集分析中,CTSV相关基因在免疫识别、免疫细胞增殖中显著富集;而在GSEA富集分析中,其不仅在免疫调节和免疫调节的激活中显著富集,并在靶向E2F和有丝分裂周期中富集,前者主要富集在基因下调部,后者主要富集在基因上调部。其中,E2F蛋白家族能够上调细胞周期蛋白D1 (CCND1)、泛素样蛋白以及环指域蛋白1 (UHRF1)的表达水平,促进肿瘤的形成,E2F阳性调节因子(MYC或CCND1)也可以降低促进细胞周期进入所需的丝裂原刺激量,令原本保持静止的细胞可以通过E2F转录程序的致癌激活被推动增殖 [21] 。
为了进一步探究CTSV在ACC局部免疫反应中发挥的作用,通过ssGSEA与TIMER2.0分析CTSV在局部肿瘤微环境中与免疫细胞浸润水平间的关联。结果显示,CTSV与髓源性抑制细胞(MDSC)和Th2细胞呈显著正相关,与CD8+T细胞、自然杀伤(NK)细胞及髓样树突状细胞呈显著负相关。以往的研究表明,CD8+T细胞能够通过肿瘤细胞表面的PD-L1、PD-L2、CD80和CD86等加以识别,分泌颗粒酶、穿孔素、组织蛋白酶C和颗粒溶素等与靶细胞膜融合进而诱导肿瘤细胞的凋亡 [22] ;NK细胞可在树突状细胞的激活下转化为淋巴因子激活的杀伤(LAK)细胞,分泌粘附分子、NKp44、穿孔素和颗粒酶等细胞因子,这种新的蛋白质表达模式增强了其粘附和识别靶细胞的能力,表现出对肿瘤细胞的更广泛的杀伤活性 [23] 。而MDSC可以在硝化T细胞受体直接抑制T细胞的同时诱导抗原特异性T细胞耐受来抑制T细胞的抗肿瘤免疫反应 [24] ,MDSC的细胞膜又能通过结合TGF-β减少NK细胞NKG2D和IFN-γ的表达,进而发挥削弱NK细胞毒性的能力。以上结果表明,CTSV可能对ACC的肿瘤微环境中免疫细胞的浸润起到重要的调节作用,进而促进ACC局部的抗肿瘤免疫逃逸过程。
5. 结论
综上所述,CTSV可能是ACC潜在的肿瘤标志物,与患者较差的临床病理参数有关,介导患者的不良预后,其可能通过促进肿瘤细胞的有丝分裂过程、抑制ACC局部的抗肿瘤免疫反应等发挥对ACC发生和发展的促进作用,具有成为ACC药物治疗靶点的潜能。然而,我们的研究具有一定的局限性,以上结果和讨论均依赖于生物信息学分析,缺乏具体实验的支持,仍然需要更多的实验和数据加以阐明CTSV在ACC中的具体功能和真正生物学意义。
文章引用
孙振鹏,王 荃,穆垚名,高健刚. CTSV是一种可能的肿瘤标志物并与肾上腺皮质癌的免疫浸润密切相关
CTSV Is a Possible Tumor Marker and Is Closely Related to Immune Invasion of Ad-renal Cortical Carcinoma[J]. 临床医学进展, 2023, 13(04): 6138-6149. https://doi.org/10.12677/ACM.2023.134865
参考文献
- 1. Kerkhofs, T.M., Verhoeven, R.H., Van der Zwan, J.M., et al. (2014) Adrenocortical Carcinoma: A Population-Based Study on Incidence and Survival in the Netherlands since 1993. European Journal of Cancer, 49, 2579-2586.
- 2. Arlt, W., Biehl, M., Taylor, A.E., et al. (2011) Urine Steroid Metabolomics as a Biomarker Tool for Detecting Malignancy in Adrenal Tumors. The Journal of Clinical Endocrinology & Metabolism, 96, 3775-3784. https://doi.org/10.1210/jc.2011-1565
- 3. Taylor, D.R., Ghataore, L., Couchman, L., et al. (2017) A 13-Steroid Serum Panel Based on LC-MS/MS: Use in Detection of Adrenocortical Carcinoma. Clinical Chemistry, 63, 1836-1846. https://doi.org/10.1373/clinchem.2017.277624
- 4. Hines, J.M., Bancos, I., Bancos, C., et al. (2017) High-Resolution, Accurate-Mass (HRAM) Mass Spectrometry Urine Steroid Profiling in the Diagnosis of Adrenal Disorders. Clinical Chemistry, 63, 1824-1835. https://doi.org/10.1373/clinchem.2017.271106
- 5. Schweitzer, S., Kunz, M., Kurlbaum, M., et al. (2019) Plasma Steroid Metabolome Profiling for the Diagnosis of Adrenocortical Carcinoma. European Journal of Endocrinology, 180, 117-125. https://doi.org/10.1530/EJE-18-0782
- 6. Fassnacht, M., Dekkers, O.M., Else, T., et al. (2018) European Society of Endocrinology Clinical Practice Guidelines on the Management of Adrenocortical Carcinoma in Adults, in Collaboration with the European Network for the Study of Adrenal Tumors. European Journal of Endocrinology, 179, G1-G46. https://doi.org/10.1530/EJE-18-0608
- 7. Gaujoux, S., Mihai, R., et al. (2017) European Society of Endocrine Surgeons (ESES) and European Network for the Study of Adrenal Tumours (ENSAT) Recommendations for the Surgical Management of Adrenocortical Carcinoma. British Journal of Surgery, 104, 358-376. https://doi.org/10.1002/bjs.10414
- 8. Postlewait, L.M., Ethun, C.G., Tran, T.B., et al. (2016) Outcomes of Ad-juvant Mitotane after Resection of Adrenocortical Carcinoma: A 13-Institution Study by the US Adrenocortical Carci-noma Group. Journal of the American College of Surgeons, 222, 480-490. https://doi.org/10.1016/j.jamcollsurg.2015.12.013
- 9. Lecaille, F., Chazeirat, T., Saidi, A. and Lalmanach, G. (2022) Cathepsin V: Molecular Characteristics and Significance in Health and Disease. Molecular Aspects of Medicine, 88, Article ID: 101086. https://doi.org/10.1016/j.mam.2022.101086
- 10. Skrzypczak, M., Springwald, A., Lattrich, C., et al. (2012) Ex-pression of Cysteine Protease Cathepsin L IS Increased in Endometrial Cancer and Correlates with Expression of Growth Regulatory Genes. Cancer Investigation, 30, 398-403. https://doi.org/10.3109/07357907.2012.672608
- 11. Sereesongsaeng, N., McDowell, S.H., Burrows, J.F., Scott, C.J. and Burden, R.E. (2020) Cathepsin V Suppresses GATA3 Protein Expression in Luminal A Breast Cancer. Breast Cancer Research, 22, Article No. 139. https://doi.org/10.1186/s13058-020-01376-6
- 12. Xia, Y., Ge, M., Xia, L., Shan, G. and Qian, H. (2022) CTSV (Cathepsin V) Promotes Bladder Cancer Progression by Increasing NF-κB Activity. Bioengineered, 13, 10180-10190. https://doi.org/10.1080/21655979.2022.2061278
- 13. Else, T., Kim, A.C., Sabolch, A., et al. (2014) Adrenocortical Carcinoma. Endocrine Reviews, 35, 282-326. https://doi.org/10.1210/er.2013-1029
- 14. Allolio, B. and Fassnacht, M. (2006) Adrenocortical Carcinoma: Clinical Update. The Journal of Clinical Endocrinology & Metabolism, 91, 2027-2037. https://doi.org/10.1210/jc.2005-2639
- 15. Luton, J.-P., Cerdas, S., Billaud, L., et al. (1990) Clinical Features of Adrenocortical Carcinoma, Prognostic Factors, and the Effect of Mitotane Therapy. New England Journal of Medicine, 322, 1195-1201. https://doi.org/10.1056/NEJM199004263221705
- 16. Fassnacht, M. and Allolio, B. (2009) Clinical Management of Adrenocortical Carcinoma. Best Practice & Research Clinical Endocrinology & Metabolism, 23, 273-289. https://doi.org/10.1016/j.beem.2008.10.008
- 17. Fassnacht, M., Assie, G., Baudin, E., et al. (2020) Adrenocortical Carcinomas and Malignant Phaeochromocytomas: ESMO-EURACAN Clinical Practice Guidelines for Diagnosis, Treatment and Follow-up. Annals of Oncology, 31, 1476-1490.
- 18. Toss, M., Miligy, I., Gorringe, K., et al. (2020) Prognostic Significance of Cathepsin V (CTSV/CTSL2) in Breast Ductal Carcinoma in Situ. Journal of Clinical Pa-thology, 73, 76-82. https://doi.org/10.1136/jclinpath-2019-205939
- 19. Song, J., Jiang, J., Wei, N., et al. (2021) High CTSL2 Expression Predicts Poor Prognosis in Patients with Lung Adenocarcinoma. Aging, 13, 22315-22331. https://doi.org/10.18632/aging.203540
- 20. Lin, C.-L., Hung, T.-W., Ying, T.-H., et al. (2020) Praeruptorin B Mitigates the Metastatic Ability of Human Renal Carcinoma Cells through Targeting CTSC and CTSV Expression. International Journal of Molecular Sciences, 21, Article No. 2919. https://doi.org/10.3390/ijms21082919
- 21. Kent, L.N. and Leone, G. (2019) The Broken Cycle: E2F Dysfunction in Cancer. Nature Reviews Cancer, 19, 326-338. https://doi.org/10.1038/s41568-019-0143-7
- 22. Raskov, H., Orhan, A., Christensen, J.P. and Gögenur, I. (2021) Cytotoxic CD8+ T Cells in Cancer and Cancer Immunotherapy. British Journal of Cancer, 124, 359-367. https://doi.org/10.1038/s41416-020-01048-4
- 23. Zamai, L., Ponti, C., Mirandola, P., et al. (2007) NK Cells and Cancer. The Journal of Immunology, 178, 4011-4016. https://doi.org/10.4049/jimmunol.178.7.4011
- 24. Weber, R., Groth, C., Lasser, S., et al. (2021) IL-6 as a Major Regulator of MDSC Activity and Possible Target for Cancer Immunotherapy. Cellular Immunology, 359, Article ID: 104254. https://doi.org/10.1016/j.cellimm.2020.104254
NOTES
*第一作者。
#通讯作者。
