Advances in Clinical Medicine
Vol.
13
No.
02
(
2023
), Article ID:
61074
,
8
pages
10.12677/ACM.2023.132175
瑞马唑仑通过Keap1/Nrf2信号通路减轻大鼠 神经元氧糖剥夺–复氧复糖损伤
仇伯珏1,李玲玉2,张恩惠2,孙晓丽1,段梅1,王士雷2*
1青岛大学,山东 青岛
2青岛大学附属医院麻醉科,山东 青岛
收稿日期:2023年1月3日;录用日期:2023年1月28日;发布日期:2023年2月6日

摘要
目的:探讨瑞马唑仑是否通过激活Keap1/Nrf2通路减轻海马神经元氧糖剥夺–复氧复糖损伤的功能。方法:取SD大鼠乳鼠海马神经元培养至第8天,采用随机数字表法分为5组:对照组(C组)、模型组(M组)、氧糖剥夺–复氧复糖+瑞马唑仑组(R组)、氧糖剥夺–复氧复糖 + 瑞马唑仑 + 二甲基亚砜组(V组)、氧糖剥夺–复氧复糖 + 瑞马唑仑 + 鸦胆子苦醇组(B组),缺氧6 h后复氧20 h建立缺氧复氧模型,瑞马唑仑于复氧时加入,终浓度100 μM,鸦胆子苦醇及二甲基亚砜在缺氧前4 h加入,鸦胆子苦醇终浓度为500 nM,二甲基亚砜浓度<0.1%。复氧结束后检测CCK8细胞活性,细胞凋亡率,ROS水平,Nrf2、Keap1、Bcl2、Bax蛋白水平,免疫荧光检测Nrf2核转位及线粒体形态。结果:与C组比较,M组细胞活力降低,凋亡率及ROS活性升高,Bax蛋白水平升高,Nrf2、Keap1、Bcl2蛋白水平降低,Nrf2核转位增加,线粒体碎片化程度加重;与M组比较,R组的细胞活力升高,细胞凋亡率及ROS活性降低,Bax蛋白水平降低,Nrf2、Keap1、Bcl2蛋白水平升高,Nrf2核转位增加,线粒体碎片化程度减轻;V组与R组间无统计学差异;与V组比较,B组细胞活力降低,凋亡率及ROS活性升高,Bax蛋白水平升高,Nrf2、Keap1、Bcl2蛋白水平降低,Nrf2核转位减少,线粒体碎片化程度加重。结论:瑞马唑仑可激活Keap1/Nrf2通路,减少ROS蓄积及线粒体损伤,进而减少细胞凋亡,减轻大鼠海马神经元氧糖剥夺–复氧复糖损伤。
关键词
Nrf2,瑞马唑仑,氧糖剥夺–复氧复糖损伤,脑保护

Remimazolam Alleviates Neuronal Oxygen Glucose Deprivation/Re-Oxygenation Injury in Rats by Keap1/Nrf2 Signaling Pathway
Bojue Qiu1, Lingyu Li2, Enhui Zhang2, Xiaoli Sun1, Mei Duan1, Shilei Wang2*
1Qingdao University, Qingdao Shandong
2Department of Anesthesiology, The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Jan. 3rd, 2023; accepted: Jan. 28th, 2023; published: Feb. 6th, 2023

ABSTRACT
Objective: To investigate the activation effect of Remimazolam on Keap1/Nrf2 pathway and its function in reducing Oxygen glucose deprivation/re-oxygenation injury of hippocampal neurons. Methods: Rat hippocampal neurons were cultured to the 8th day, and were divided into 5 groups by random number table method: control group (group C), oxygen glucose deprivation/re-oxygenation group (group M), oxygen glucose deprivation/re-oxygenation + Remimazolam group (group R), oxygen glucose deprivation/re-oxygenation + Remimazolam + dimethyl sulfoxide group (group V), oxygen glucose deprivation/re-oxygenation + Remimazolam + brusatol group (group B). The oxygen glucose deprivation/re-oxygenation model was established by the method of reoxygenation for 20 h after 6 h of oxygen. Remimazolam was added during reoxygenation at a final concentration of 100 μM, bruscoxol and dimethyl sulfoxide were added 4 h before hypoxia, and bruscoxol was added at the end of hypoxia. The concentration was 500 nM, and the dimethyl sulfoxide concentration was <0.1%. After reoxygenation, CCK8 cell activity, apoptosis rate, ROS level, Nrf2, Keap1, Bcl2, Bax protein levels were detected. Mitochondrial morphology and Nrf2 nuclear translocation was detected by immunofluorescence. Results: Compared with the C group, the M group had decreased cell viability, increased apoptosis rate and ROS activity, increased Bax protein level, decreased Nrf2, Keap1, Bcl2 protein levels, increased mitochondrial fragmentation and increased Nrf2 nuclear translocation; Compared with the M group, the cell viability in the R group increased, the apoptosis rate and ROS activity decreased, the Bax protein level decreased, the Nrf2, Keap1, Bcl2 protein levels increased, and the nuclear translocation of Nrf2 increased and the degree of mitochondrial fragmentation decreased; There was no statistical difference between group V and group R; compared with group V, group B had decreased cell viability, increased apoptosis rate and ROS activity, increased Bax protein level, and decreased Nrf2, Keap1, Bcl2 protein levels, reduced Nrf2 nuclear translocation and increased mitochondrial fragmentation. Conclusion: Remimazolam can activate the Keap1/Nrf2 pathway, reduce the accumulation of ROS and mitochondrial damage, reducing apoptosis and reducing the damage of oxygen sugar deprivation-rehydrosaccharide in rat hippocampal neurons.
Keywords:Nrf2, Remimazolam, Oxygen Glucose Deprivation/Re-Oxygenation Injury, Brain Protection

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
缺血器官与组织的再灌注对于生存非常重要,但再灌注往往带来更严重的损伤,被称为缺血再灌注损伤。ROS积累带来的氧化应激是其主要病理过程 [1],Kelch样环氧氯丙烷相关蛋白-1 (Keap1)/核因子E2相关因子2 (Nrf2)作为抗氧化应激的经典通路可保护脑缺血再灌注损伤。目前已有研究显示丙泊酚、咪达唑仑均可激活Keap1/Nrf2信号通路 [2] [3] [4],Lu等人及Sun等人的研究认为丙泊酚可激活Nrf2减轻心肌损伤及小胶质细胞的损伤,而任等人的研究则显示,同为苯二氮卓类药物的咪达唑仑则激活Nrf2并降低了HK-2细胞的缺氧/复氧损伤。
作为苯二氮卓类药物的新成员,瑞马唑仑有着广阔的应用前景,并已展现其器官保护的功能。采用原代海马神经元建立氧糖剥夺–复氧复糖模型,评价瑞马唑仑是否通过激活Keap1/Nrf2信号通路减轻脑缺血再灌注损伤。
2. 材料与方法
海马神经元分离与培养本研究所涉及动物实验已取得青岛大学动物实验伦理委员会批准。取出生一天的SD大鼠乳鼠,于冰上断头取脑,钝性分离海马,剪碎后置于37℃的胰酶中消化20 min,中止消化后离心,使用80% DMEM/F12 (BI公司,以色列)及20% FBS (普诺赛公司,中国)配制的种植液重悬细胞,按1 × 106每孔种植在六孔板中,6 h后使用PBS冲洗并换成由95% Neurobasal-A (GIBCO公司,美国)、2% B27、1%丙酮酸钠、1% L-谷氨酰胺配制而成的神经元培养液。此后3天换一次液,至7~8天细胞突触生长旺盛,胞体圆润时进行处理。
分组与处理将培养成熟的海马神经元分为5组:对照组(C组)、氧糖剥夺–复氧复糖组(OGD/R组)、氧糖剥夺–复氧复糖 + 瑞马唑仑组(R组)、氧糖剥夺–复氧复糖 + 瑞马唑仑 + 二甲基亚砜组(V组)、氧糖剥夺–复氧复糖 + 瑞玛唑仑 + 鸦胆子苦醇组(B组)。C组不做特殊处理;OGD/R组于R组将培养液弃掉,PBS冲洗后加入无糖EBSS缓冲液,置于三气培养箱中处理6 h,再次更换为神经元培养液,在常规二氧化碳培养箱中进行20 h的复氧,R组在复氧后在培养液中加入瑞马唑仑(终浓度100 μM);V组在缺氧前于培养液中加入DMSO (终浓度 < 0.1%)预处理4 h,其余处理同R组;B组则于培养液中加入Nrf2的抑制剂鸦胆子苦醇(MCE公司,美国) (终浓度500 nM)进行4 h的预处理.,其余处理同R组。
CCK-8检测细胞活力将海马神经元按1 × 104每孔的密度接种于96孔板内,培养至第8天,按分组处理后每孔加入100 μl的Neurobasal-A + 10 μl的CCK-8溶液,于37℃避光孵育90 min。使用酶标仪测定各孔于450 nm的OD值,细胞活力 = (OD目的 − OD空白)/OD对照 × 100%。
Western Blot法检测Nrf2、Keap1、Bcl2、Bax蛋白表达水平PBS冲洗细胞,用含1% PMSF的RIPA裂解液于冰上裂解细胞30 min,收集后12000 g低温离心15 min,使用BCA法测定蛋白浓度,并加入5×蛋白上样缓冲液100℃加热5 min,使蛋白充分变性。上样至10% SDS-PAGE胶电泳并转印至0.45PVDF膜上,使用无蛋白快速封闭液封闭后,清洗并加入Nrf2一抗(1:3000,proteintech公司,美国)、Keap1一抗(1:8000,proteintech公司,美国)、Bcl2一抗(1:1000,Abcam公司,美国)、Bax一抗(1:2000,Abacm公司,美国) 4℃孵育过夜,TBST冲洗后加入辣根过氧化酶标记二抗(1:8000,武汉伊莱瑞特生物科技股份有限公司,中国)室温孵育1 h,使用ECL发光液显影,使用β-actin (1:2000,武汉伊莱瑞特生物科技股份有限公司,中国)作为内参,并使用ImageJ量化条带灰度。
免疫荧光检测Nrf2核转位多聚赖氨酸包被无菌细胞爬片,置入12孔板并接种海马神经元悬液,培养7天后随机分组并按上述分组方法处理,处理结束后使用PBS冲洗细胞,加入4%多聚甲醛室温15 min固定,再次冲洗后使用0.1%曲拉通 × 100室温孵育10 min通透细胞膜。5%正常山羊血清室温封闭1 h,加入Nrf2一抗(1:100,proteintech,美国) 4℃孵育过夜。结束孵育前复温45 min,冲洗后加入CY3荧光二抗(1:100,武汉伊莱瑞特生物科技股份有限公司,中国),室温孵育1 h,pbs冲洗后使用含DAPI的抗荧光淬灭封片液封片。使用共聚焦显微镜观察拍照。
免疫荧光标记TOM20检测线粒体形态多聚赖氨酸包被无菌细胞爬片,植入12孔板并接种海马神经元悬液,培养7天后随机分组并按照上述分组方法处理,后使用PBS冲洗细胞,加入4%多聚甲醛室温15 min固定,再次冲洗后使用0.1%曲拉通 × 100室温孵育10 min通透细胞膜。5%正常山羊血清室温封闭1 h,加入TOM20一抗(1:100,proteintech,美国) 4℃孵育过夜,复温45 min后结束孵育,冲洗后加入FITC荧光二抗(1:00,武汉伊莱瑞特生物科技股份有限公司,中国),室温孵育1 h,pbs冲洗后使用含DAPI的抗荧光淬灭封片液封片。使用共聚焦显微镜观察拍照。
流式细胞术检测细胞凋亡细胞培养至第8天,PBS冲洗细胞,消化,使用PBS重悬后计数3~5 × 105细胞,再次离心将其悬浮于100 μl的流式试剂盒1×buffer中,加入染料,室温避光15 min,后加入400 μl的1×buffer终止反应,冰上避光静置等待上机。使用flowjo V10软件进行分析。
DCFH-DA法检测ROS活性细胞培养至第8天,处理结束后,使用培养液以1:1000稀释DCFH-DA至10 μM,替换原有培养液,37℃避光孵育20 min,PBS冲洗两次后再次更换为普通神经元培养液。使用共聚焦显微镜观察并拍照。
统计与分析使用SPSS 25.0进行数据分析,正态分布数据使用均值 ± 标准差( ± s)表示,组间比较采用单因素方差分析。P < 0.05时有统计学意义。
3. 结果
与C组比较M组细胞活力下降,细胞凋亡率增加(p < 0.05);与M组比较,R组的细胞活力升高,细胞凋亡率降低(p < 0.05);V组相对于R组变化无统计学意义;与V组相比较,B组细胞活力降低,细胞凋亡率升高(p < 0.05)。见图1、表1。
Table 1. Comparison of cell viability (n = 6, ) and apoptosis rate (n = 3, ) in five groups of rat hippocampal neurons
表1. 五组大鼠海马神经元细胞活力(n = 6, ± s)与细胞凋亡率比较(n = 3, ± s)
注:与C组进行比较,ap < 0.05,与M组进行比较,bp < 0.05,与V组进行比较,cp < 0.05。
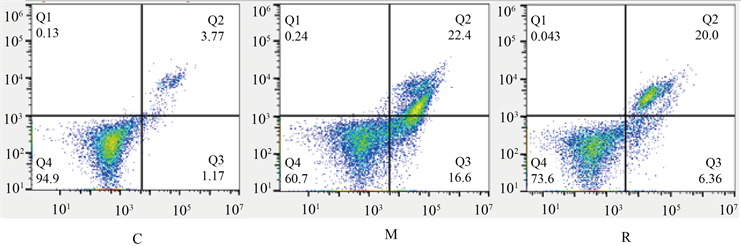
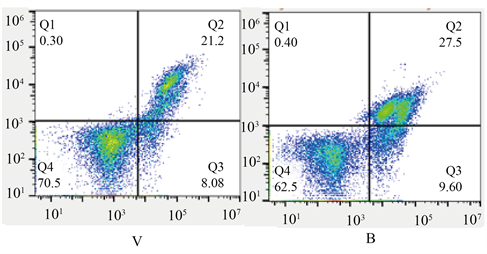
Figure 1. Apoptosis rate of hippocampal neurons in each group; Q2 is late apoptosis, Q3 is early apoptosis, and combined is the total apoptosis rate
图1. 各组海马神经元凋亡率,Q2为晚期凋亡,Q3为早期凋亡,合为总凋亡率
与C组比较,OGD/R组Nrf2、Keap1、Bcl2蛋白水平下降,Bax蛋白水平升高(p < 0.05);与M组比较,M组Nrf2、Keap1、Bcl2蛋白水平升高,Bax蛋白水平降低(p < 0.05);V组与R组无统计学差异;与V组比较,B组Nrf2、Keap1、Bcl2蛋白水平下降,Bax蛋白水平升高(p < 0.05)。见图2。
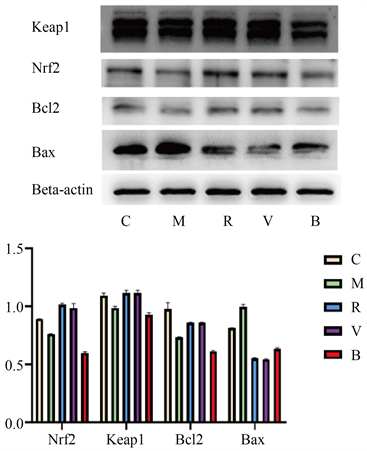
Figure 2. WB bands and their relative gray levels of Nrf2, Keap1, Bcl2, and Bax in each group
图2. 各组Nrf2、Keap1、Bcl2及Bax的WB条带及其相对灰度
C组的ROS染色荧光适中,M组荧光显著增强,R组与V组的ROS荧光较M组减弱,B组ROS荧光强度较R、V组增强。见图3。
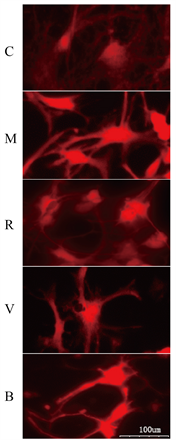
Figure 3. ROS activity of neurons in five groups (DCFH-DA method). Note: Red fluorescence intensity reflects the level of ROS activity in each group
图3. 五组神经元ROS活性(DCFH-DA法)。注:红色荧光强度反映各组细胞内ROS活性高低
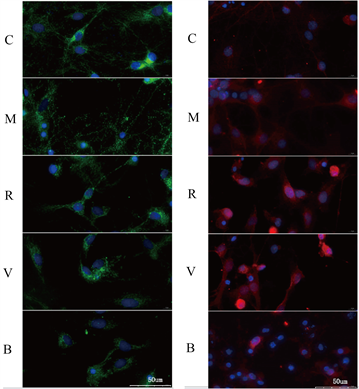 注:蓝色区域为着色细胞核,绿色为线粒体外膜,核内红点为发生核转位的Nrf2,蓝色区域内的红色密度反映Nrf2核转位水平
注:蓝色区域为着色细胞核,绿色为线粒体外膜,核内红点为发生核转位的Nrf2,蓝色区域内的红色密度反映Nrf2核转位水平
Figure 4. Confocal observation of mitochondrial morphology and nuclear translocation of Nrf2 in neurons of each group
图4. 共聚焦观察各组神经元线粒体形态及Nrf2核转位情况
各组可见蓝染的细胞核,使用绿色标记的TOM20作为线粒体外膜转运蛋白,其数量及分布显示线粒体的数量及碎片化程度,何健相对于C,M组线粒体数量减少,碎片化增多;相对于M组,R组线粒体数量增多,碎片化程度减轻,V组较R组无显著变化,B组较V组,线粒体数量减少,碎片化程度加剧。见图4。
各组可见蓝染细胞核及红色标记的Nrf2,C组核内红染颗粒较少,示Nrf2核转位少,M组中Nrf2核转位增加;而相较于M组,R组与V组的Nrf2核转位增加,B组细胞的Nrf2核转位较V组降低。见图4。
4. 讨论
本研究参照相关文献 [5],将培养至第8天的海马神经元置于无糖EBSS环境中,三气培养箱培养6 h,更换回正常培养液,在二氧化碳培养箱中进行20 h复氧复糖的方法制备海马神经元氧糖剥夺–复氧复糖损伤模型。结果表明,与C组比较,M组的细胞活力降低,凋亡率及活性氧水平升高,提示模型制备成功。
已有研究表明瑞马唑仑在浓度为约100 μM时即表现出其激活苯二氮卓受体及保护器官损伤的功能 [6] [7]。为探究瑞马唑仑对Keap1/Nrf2通路的作用,本研究使用鸦胆子苦醇作为抑制剂 [8],以鸦胆子苦醇500 nM浓度预处理4 h,瑞马唑仑100 μM的终浓度于复氧复糖时加入的方法,与M组比较,R组细胞活力升高,凋亡率及活性氧水平降低,提示瑞马唑仑的后处理减轻了海马神经元的氧糖剥夺–复氧复糖损伤,同时,相较R组,B组细胞Nrf2水平降低,活力降低,凋亡率及活性氧水平升高,提示瑞马唑仑激活Keap1/Nrf2通路,而鸦胆子苦醇成功抑制Keap1/Nrf2通路水平。
脑缺血再灌注损伤指在脑中断的血流恢复时,脑会受到比缺血时更严重的损伤。已有研究显示,该过程涉及到活性氧、钙超载等诸多机制 [9]。尤其ROS引起的氧化应激损伤在缺血再灌注损伤中发挥重要作用 [10],Heiko Bugger等人认为,ROS通过诱导mPTP长时间开放的方式导致ROS的进一步爆发,不仅造成线粒体的肿胀破裂,也引起核酸、蛋白质的广泛损伤,同时,ROS的爆发还可以在线粒体之间传递。
Keap1/Nrf2是经典的抗氧化应激通路,在氧化应激损伤的应对中占据中心地位,Keap1承担着氧化应激感受器的任务,和Nrf2结合并锚定于细胞骨架中,并通过泛素化Nrf2调控着下游保护性基因表达的平衡 [11]。当受到ROS蓄积或其他刺激时,Nrf2与Keap1解离,Nrf2发生核转位,进而调控相关基因表达。Bcl2蛋白家族在组织稳态的维持中发挥重要的作用,在凋亡过程中,Bcl2作为重要的抗凋亡蛋白受到抑制,同时Bax、Caspase-3的表达明显增强,而Bax线粒体低聚体形成导致细胞不可逆的死亡 [12] [13]。本研究结果显示,与M组比较,R组Nrf2及Bcl2表达增加,而Bax表达降低,而使用的鸦胆子苦醇的B组,Nrf2表达水平降低,同时瑞马唑仑的保护作用也受到一定程度的抵消,提示瑞玛唑仑通过激活Keap1/Nrf2通路发挥了减轻氧糖剥夺–复氧复糖损伤的作用。
线粒体作为细胞重要的代谢场所,其状态与细胞命运密切相关。线粒体位于不断地分裂与融合中,成为线粒体动力学。然而,线粒体的过度分裂乃至碎片化被认为是细胞凋亡的早期信号,该过程可能与能量供应不足有关,线粒体的碎片化还会导致细胞色素C被释放进入胞质,引发凋亡。
尽管本研究通过构建神经元氧糖剥夺–复氧复糖模型探究了瑞马唑仑的保护效果及相关机制,但需要注意的是,本研究未使用动物模型,对于生理状态下的处理效果的探究有所欠缺,同时未涉及不同浓度下瑞马唑仑处理效果的探究,这些均为本研究的局限性。
综上所述,瑞马唑仑可激活Keap1/Nrf2通路,减少ROS蓄积及线粒体损伤,进而减少细胞凋亡,减轻大鼠海马神经元氧糖剥夺–复氧复糖损伤。
基金项目
国家自然科学基金(81771415)。
文章引用
仇伯珏,李玲玉,张恩惠,孙晓丽,段 梅,王士雷. 瑞马唑仑通过Keap1/Nrf2信号通路减轻大鼠神经元氧糖剥夺–复氧复糖损伤
Remimazolam Alleviates Neuronal Oxygen Glucose Deprivation/Re-Oxygenation Injury in Rats by Keap1/Nrf2 Signaling Pathway[J]. 临床医学进展, 2023, 13(02): 1267-1274. https://doi.org/10.12677/ACM.2023.132175
参考文献
- 1. Xiang, M., Lu, Y., Xin, L., et al. (2021) Role of Oxidative Stress in Reperfusion Following Myocardial Ischemia and Its Treatments. Oxidative Medicine and Cellular Longevity, 2021, Article ID: 6614009. https://doi.org/10.1155/2021/6614009
- 2. Lu, Z., Liu, Z. and Fang, B. (2022) Propofol Protects Cardiomyocytes from Doxorubicin-Induced Toxic Injury by Activating the Nuclear Factor Erythroid 2-Related Factor 2/Glutathione Pe-roxidase 4 Signaling Pathways. Bioengineered, 13, 9145-9155. https://doi.org/10.1080/21655979.2022.2036895
- 3. Sun, X., Yin, Y., Kong, L., et al. (2019) The Effect of Propofol on Hypoxia-Modulated Expression of Heat Shock Proteins: Potential Mechanism in Modulating Blood-Brain Barrier Permeability. Molecular and Cellular Biochemistry, 462, 85-96. https://doi.org/10.1007/s11010-019-03612-w
- 4. 任帅帅, 孙倩, 刘春华. 咪达唑仑对低氧/复氧诱导的HK-2细胞凋亡及Nrf2/HO-1通路的影响[J]. 中国药师, 2021, 24(12): 2171-2175. https://doi.org/10.19962/j.cnki.issn1008-049X.2021.12.006
- 5. 万晓燕, 于文刚, 赵芹, 等. Keap1/Nrf2信号通路在丙泊酚减轻大鼠神经元氧糖剥夺-复氧复糖损伤中的作用[J].中华麻醉学杂志, 2020, 40(11): 1353-1357.
- 6. Liu, X., Lin, S., Zhong, Y., et al. (2021) Remimazolam Protects against LPS-Induced Endotoxicity Im-proving Survival of Endotoxemia Mice. Frontiers in Pharmacology, 12, Article ID: 739603. https://doi.org/10.3389/fphar.2021.739603
- 7. Fang, H., Zhang, Y., Wang, J., et al. (2021) Remimazolam Re-duces Sepsis-Associated Acute Liver Injury by Activation of Peripheral Benzodiazepine Receptors and p38 Inhibition of Macrophages. International Immunopharmacology, 101, Article ID: 108331. https://doi.org/10.1016/j.intimp.2021.108331
- 8. Zhang, D.D. and Chapman, E. (2020) The Role of Natural Products in Revealing NRF2 Function. Natural Product Reports, 37, 797-826. https://doi.org/10.1039/c9np00061e
- 9. Shen, L., Gan, Q., Yang, Y., et al. (2021) Mitophagy in Cerebral Ische-mia and Ischemia/Reperfusion Injury. Frontiers in Aging Neuroscience, 13, Article ID: 687246. https://doi.org/10.3389/fnagi.2021.687246
- 10. Bugger, H. and Pfeil, K. (2020) Mitochondrial ROS in Myocardial Ischemia Reperfusion and Remodeling. Biochimica et Biophysica Acta - Molecular Basis of Disease, 1866, Article ID: 165768. https://doi.org/10.1016/j.bbadis.2020.165768
- 11. Baird, L. and Yamamoto, M. (2020) The Molecular Mecha-nisms Regulating the KEAP1-NRF2 Pathway. Molecular and Cellular Biology, 40, e00099-20. https://doi.org/10.1128/MCB.00099-20
- 12. Korshunova, A.Y., Blagonravov, M.L., Neborak, E.V., et al. (2021) BCL2-Regulated Apoptotic Process in Myocardial Ischemia-Reperfusion Injury (Review). International Journal of Mo-lecular Medicine, 47, 23-36. https://doi.org/10.3892/ijmm.2020.4781
- 13. Spitz, A.Z. and Gavathiotis, E. (2022) Physiological and Pharma-cological Modulation of BAX. Trends in Pharmacological Sciences, 43, 206-220. https://doi.org/10.1016/j.tips.2021.11.001
NOTES
*通讯作者Email: wshlei@aliyun.com
