Open Journal of Nature Science
Vol.
07
No.
03
(
2019
), Article ID:
30332
,
6
pages
10.12677/OJNS.2019.73027
Preliminary Study on Intestinal Cytotoxicity of Microcystin-LR
Kamegniboukem Robert, Cong Wen, Shuilin Zheng, Yawmassey Isaac, Linghui Cao*
Xiangya School of Public Health, Central South University, Changsha Hunan

Received: May 1st, 2019; accepted: May 15th, 2019; published: May 22nd, 2019

ABSTRACT
The rapid development of industries and agriculture, has led to the increasing discharge of wastewater containing nitrogen and phosphorus into freshwater, rivers and lakes. This activity results to eutrophication and development of cyanobacteria bloom. The monocyclic heptapeptidemicrocystin (MC) is the secondary product of cyanobacteria metabolism and most harmful cyanotoxin found in water. More than 100 isomers of MCs have been reported, with MC-LR being the most widely distributed, abundant and toxic. The aim of this study was to investigate the intestinal toxicity caused by MC-LR. NCM460 and HT29 cell models were used to explore the intestinal toxicity of MC-LR. Intestinal cells were treated with different doses (0 μM, 5 μM and 10 μM) of MC-LR, and the number and morphology of the cells were observed. Fluorescence probe DCFH-DA was used to detect reactive oxygen species (ROS). In addition, the toxic mechanism of MC-LR on intestinal cells was performed via comet assay. Data indicated that there was no change in the number and morphology of the cells between the test and control groups. Both NCM460 and HT29 cells showed a significant (5 μM, HT29, p = 0.03, NCM460, p = 0.0003; 10 μM, HT29, p = 0.003, NCM460, p = 0.02) increase in ROS level after MC-LR exposure, and revealed a dose/time-effect relationship. The DNA tail-trailing phenomenon in 5 μM dose group was significantly lower than that in 10 μM dose group, indicating a dose-dependent relationship between DNA damage and MC-LR concentration. Hence, our data suggested MC-LR has the potential of intestine toxicity. The results of this study provide a reference for further understanding of the intestinal toxicity induced by MC-LR, prevention, diagnosis and treatment of intestinal diseases induced by MC-LR.
Keywords:Microcysitin-LR, NCM460 Cell Line, HT29 Cell Line, ROS Assay, Comet Assay
MC-LR致肠细胞毒性的初步研究
Kamegniboukem Robert,文聪,郑水林,Yawmassey Isaac,曹灵慧*
中南大学湘雅公共卫生学院,湖南 长沙

收稿日期:2019年5月1日;录用日期:2019年5月15日;发布日期:2019年5月22日

摘 要
随着工农业的发展,越来越多含氮磷的污水排放至淡水河流湖泊当中,导致水体富营养化,进而导致蓝藻爆发。藻毒素是蓝藻细菌代谢的次级产物,是水体中含量最多、危害最大的一类藻毒素。藻毒素是一种环状7肽毒素,目前已经被报道的有100多种异构体,其中微囊藻毒素-LR (Microcystin-LR, MC-LR)是分布最广泛、毒性最强的一种。本研究利用正常结直肠上皮细胞NCM460及结直肠癌细胞HT29为模型初步探究了MC-LR致肠毒性。我们通过对肠道细胞不同剂量(0 µM、5 µM及10 µM) MC-LR染毒,结果表明在处理的两个剂量组中,细胞数量及形态均无变化;利用荧光探针DCFH-DA法检测活性氧,结果表明不管是NCM460细胞还是HT29细胞,在染毒之后活性氧水平都显著增加(5 µM, HT29, p = 0.03, NCM460, p = 0.0003; 10 µM, HT29, p = 0.003, NCM460, p = 0.02),并且呈剂量依赖效应;通过彗星实验,初步探讨了MC-LR对肠道细胞的毒性机制。研究结果表明,在5 µM和10 µM剂量组中,出现明显的DNA拖尾现象,且5 µM剂量组拖尾现象的发生明显低于10 µM剂量组,说明DNA损伤与MC-LR浓度存在剂量依赖关系。因此,本研究结果初步证明了MC-LR能致肠细胞毒性,为进一步了解微囊藻毒素致肠毒性的研究,以及预防、诊断和治疗微囊藻毒素引起的肠道疾病提供一定的参考。
关键词 :藻毒素,NCM460细胞,HT29细胞,ROS含量测定,彗星实验

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着工农业的发展,越来越多含氮磷污水排放至淡水河流湖泊中,导致水体富营养化,进而导致蓝藻爆发。藻毒素是蓝藻细菌代谢的次级产物,是水体中含量最多、危害最大的一类藻毒素。藻毒素是一种环状7肽毒素,目前已经被报道的有100多种异构体,其中微囊藻毒素-LR (Microcystin-LR, MC-LR)是分布最广泛、毒性最强的一种 [1] 。目前,已有相当一部分的研究证实MC-LR对能危害植物,进一步通过食物链积累和传递危及动物甚至是人类的健康。人类接触暴露藻毒素主要是通过饮水、饮食和娱乐途径 [2] 。早在1998年世界卫生组织(WHO)就规定饮水中的藻毒素异构体MC-LR含量不能超过1 μg/L。全世界范围内,因藻毒素污染水源而导致野生动物、家畜和人类患病或死亡的情况时有发生Frazier K [3] 等人报道,引用被藻毒素污染的水会导致牛、羊急性肝病变甚至是死亡。巴西医院肾透析用水受藻毒素污染,造成60人死亡,几乎所有病人都出现急性神经中毒和急性肝中毒症状 [4] 。此外,藻毒素还可以损伤神经系统。Caban-Holt [5] 等人报道藻毒素可能与阿兹海默症(Alzheimer’s dementia, AD)和帕金森(Parkinson’s disease, PD)神经系统疾病有关。虽然关于藻毒素对人体器官毒性的研究日益增多,但是关于藻毒素致肠毒性的研究还比较少。因此,本研究以肠道细胞为研究对象,探究藻毒素致肠毒性,为藻毒素对肠毒性的研究提供参考。
2. 材料与方法
2.1. 实验材料
人正常结肠上皮细胞NCM460和人结肠癌细胞HT29细胞由湘雅三医院王晓艳教授提供。
2.2. 主要仪器及试剂
酶标仪(芬兰wenScnaMK公司);荧光显微镜(Invitrogen EVOS FL Atuo 2.0 Image System, Thermo Fisher Scientific);DCFH-DA活性氧ROS荧光探针试剂盒(碧云天、S0033);1640培养基(Gibco公司);胎牛血清(Gibco公司);抗生素(Gibco公司);藻毒素标准品(Alexis公司)。
2.3. 方法
细胞培养:正常人结肠上皮细胞NCM460和结肠癌上皮细胞HT29细胞均培养于含100 mL/L FBS的RPM1640培养基,置于5%,37℃的恒温培养箱中培养。细胞融合至70%~80%时,进行染毒处理:通过梯度稀释方法用DMSO配置好不同浓度梯度的MC-LR与培养基的混合溶液(10 µM和5 µM),对照组加相同体积的DMSO,染毒24 h后收集细胞做下一步试验。
活性氧实验:DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光就可以知道细胞内活性氧的水平。活性氧的具体实验步骤参照碧云天DCFH-DA 活性氧ROS荧光探针试剂盒使用说明书。
彗星实验:当细胞接受辐射刺激或者DNA损伤诱导剂时,DNA发生断裂,超螺旋结构被破坏,在裂解液的作用下,细胞膜和核膜被破坏,用高浓度的盐溶液提取蛋白和RNA,DNA由于分子量太大,留在原处,形成类核。当细胞DNA有损伤时,在碱处理和碱性电泳液的作用下DNA解螺旋,使DNA的断链从严密的超螺旋结构中释放出来,由于这些DNA断链分子量较小且碱变性为单链,所以在电泳电场中就可以离开核DNA 在凝胶分子筛中向阳极移动,经荧光染色后,在荧光显微镜下,阳极方向可见形似彗星的特征图像,故又称“彗星实验(comet assay)”。其具体操作步骤参见参考文献 [6] 。
3. 结果与分析
本研究从ATCC细胞库中购买人正常结肠上皮细胞NCM460和人结肠癌细胞HT29两株细胞,标准条件下培养。待细胞融合至80%时进行藻毒素染毒,染毒后24 h观察HT29细胞及NCM460细胞分别暴露于0 µM、5 µM及10 µM剂量藻毒素的数量与形态。如图1所示。研究结果表明,HT29细胞及NCM460细胞暴露于上述三组剂量藻毒素中,数量和形态均无明显的变化。Yoshida T等藻毒素对肝毒性的研究表明,藻毒素可诱导细胞凋亡 [7] 。那么,藻毒素是否也引起肠细胞的凋亡呢?因此,本研究利用荧光探针DCFH-DA法检测ROS含量。按照说明书以1:1000的比例用无血清培养液稀释DCFH-DA,使终浓度为10 μM/L。细胞收集后悬浮于稀释好的DCFH-DA中,细胞浓度为一百万至二千万/毫升,37℃细胞培养箱内孵育20分钟。每隔3~5分钟颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的DCFH-DA。把细胞等分成三份后,分别用不同剂量的藻毒素刺激细胞,刺激细胞。20~30min之后,用酶标仪检测活性氧水平。结果如图2所示。研究结果表明,不管是NCM460细胞还是HT29细胞,在染毒之后活性氧水平都显著增加,并且呈剂量依赖性。

Figure 1. Morphology of HT29 cells and NCM460 cells exposed to 0 µM, 5 µM and 10 µM MC-LR for 24 h
图1. HT29细胞及NCM460细胞暴露于0 µM、5 µM及10 µM MC-LR 24 h后的形态
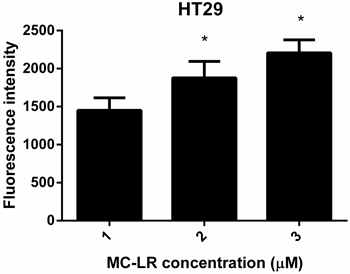
 横轴表示MC-LR的浓度,纵轴表示荧光强度,结果表明,与对照组相比,5 µM和10 µM染毒组的细胞活性氧水平显著升高,且呈剂量依赖性关系,*P < 0.05。
横轴表示MC-LR的浓度,纵轴表示荧光强度,结果表明,与对照组相比,5 µM和10 µM染毒组的细胞活性氧水平显著升高,且呈剂量依赖性关系,*P < 0.05。
Figure 2. Changes of ROS after exposure to 0 µM, 5 µM, and 10 µM MC-LR at HT29 and NCM460
图2. HT29及NCM460暴露于0 µM、5 µM及10 µM MC-LR 24 h后ROS的含量变化
本实验室早期的研究结果表明,藻毒素可诱发正常肝HL7702细胞的DNA损伤 [8] ,那么,藻毒素是不是也诱发肠细胞的DNA损伤呢?因此,本研究利用彗星实验检测了DNA损伤情况。细胞在染毒24 h后,如方法中所述进行彗星实验。结果如图3所示。研究表明,对照组中,细胞核呈圆形或椭圆形,在5 μM和10 μM剂量组中,出现明显的DNA拖尾现象,且5 μM剂量组发生的拖尾现象明显低于10 μM剂量组,说明DNA损伤与藻毒素浓度存在剂量依赖关系。
4. 讨论
肠道在人体正常的消化吸收、排泄、免疫等功能的发挥起着无可替代的作用。目前,越来越多关于藻毒素对人体器官组织毒性的研究报道 [9] ,但是关于肠道毒性的研究还比较少。本文利用肠道细胞初探了藻毒素对肠道的毒性。本文的研究过结果表明,0 µM、5 µM及10 µM剂量的MC-LR对肠道细胞数量

Figure 3. DNA damage of HT29 and NCM460 exposed to 0 µM, 5 µM, and 10 µM MC-LR for 24 h were detected by comet assay
图3. 彗星实验检测HT29及NCM460暴露于0 µM、5 µM及10 µM MC-LR 24 h后DNA损伤
形态的影响不是很大,这可能是因为染毒时间或是染毒剂量不足以使细胞的数量形态发生变化。然而,我们通过荧光探针DCFH-DA法检测活性氧实验进一步发现,藻毒素处理之后,正常结肠上皮细胞和结肠癌细胞的活性氧显著增加,且5 µM剂量组的活性氧增加要低于10 µM剂量组。这就说明藻毒素诱导的活性氧增加呈时间/剂量–效应关系。这与Kujbida,P等人用藻毒素对白细胞进行的研究结果一致 [10] 。有较多的研究已经表明藻毒素能诱导体内外DNA损伤 [11] ,DNA损伤是复制过程发生核苷酸序列永久性的改变,并导致遗传特征改变的现象。一些生物化学因子和物理因素可诱导DNA损伤,当DNA损伤不能及时被修复时,DNA的复制过程发生错乱,从而可能导致基因突变,激活癌基因或抑制癌基因活性,进而导致细胞生长分化周期紊乱,引发肿瘤 [12] [13] 。因此我们推测DNA损伤可能是藻毒素诱发肿瘤的机制之一。但是其中的机制有待进一步的研究。
文章引用
KamegniboukemRobert,文聪,郑水林, Yawmassey Isaac,曹灵慧. MC-LR致肠细胞毒性的初步研究
Preliminary Study on Intestinal Cytotoxicity of Microcystin-LR[J]. 自然科学, 2019, 07(03): 186-191. https://doi.org/10.12677/OJNS.2019.73027
参考文献
- 1. Yang, F., et al. (2014) Biodegradation of Microcystin-LR and -RR by a Novel Microcystin-Degrading Bacterium Iso-lated from Lake Taihu. Biodegradation, 25, 447-457. https://doi.org/10.1007/s10532-013-9673-y
- 2. Li, X., et al. (2015) Effects of Chronic Exposure to Microcystin-LR on Hepatocyte Mitochondrial DNA Replication in Mice. Environmental Science & Technology, 49, 4665-4672. https://doi.org/10.1021/es5059132
- 3. Frazier, K., et al. (1998) Microcystin Toxicosis in Cattle Due to Overgrowth of Blue-Green Algae. Veterinary and Human Toxicology, 40, 23-24.
- 4. Azevedo, S.M., et al. (2002) Human Intoxication by Microcystins during Renal Dialysis Treatment in Caruaru-Brazil. Toxicology, 181-182, 441-446. https://doi.org/10.1016/S0300-483X(02)00491-2
- 5. Caban-Holt, A., et al. (2005) Neurodegenerative Memory Disorders: A Potential Role of Environmental Toxins. Neurologic Clinics, 23, 485-521. https://doi.org/10.1016/j.ncl.2004.12.005
- 6. 赖金龙, 付任莎, 吴国, 陶宗娅, 张红, 罗学刚. 检测细胞DNA断裂损伤效应的彗星实验法的改良[J]. 生态毒理学报, 2015, 10(4): 195-202.
- 7. Yoshida, T., et al. (1997) Acute Oral Toxicity of Microcystin-LR, a Cyanobacterial Hepatotoxin, in Mice. Natural Toxins, 5, 91-95. https://doi.org/10.1002/nt.1
- 8. Chen, L., et al. (2019) Regulation of Microcystin-LR-Induced DNA Damage by miR-451a in HL7702 Cells. Toxins (Basel), 11, 164. https://doi.org/10.3390/toxins11030164
- 9. 谢平. 微囊藻毒素对人类健康影响相关研究的回顾[J]. 湖泊科学, 2009, 21(5): 603-613.
- 10. Kujbida, P., et al. (2006) Effects of Microcystins on Human Polymorphonuclear Leukocytes. Biochemical and Biophysical Research Communications, 341, 273-277. https://doi.org/10.1016/j.bbrc.2005.12.177
- 11. Zhao, Y., Xie, P. and Fan, H. (2012) Genomic Profiling of microRNAs and Proteomics Reveals an Early Molecular Alteration Associated with Tumorigenesis Induced by MC-LR in Mice. Environmental Science & Technology, 46, 34-41. https://doi.org/10.1021/es201514h
- 12. Brzuzan, P., et al. (2016) Illumina Sequencing Reveals Aberrant Expression of MicroRNAs and Their Variants in Whitefish (Coregonus lavaretus) Liver after Exposure to Microcystin-LR. PLoS ONE, 11, e0158899. https://doi.org/10.1371/journal.pone.0158899
- 13. Brzuzan, P., et al. (2012) Expression Profiling in Vivo Demonstrates Rapid Changes in Liver microRNA Levels of Whitefish (Coregonus lavaretus) Following Microcystin-LR Exposure. Aquatic Toxicology, 122-123, 188-196. https://doi.org/10.1016/j.aquatox.2012.07.001
NOTES
*通讯作者。