Advances in Clinical Medicine
Vol.
13
No.
05
(
2023
), Article ID:
65657
,
11
pages
10.12677/ACM.2023.1351140
CXCR5+ CD8+ T细胞在儿童传染性单核细胞 增多症中的反应特点及临床价值
薛健1*,王建勇1*,张晓录2,谷钰峰2,邢海燕3,辛毅1,王晓莉1,李爱敏1#
1青岛大学附属烟台毓璜顶医院儿科,山东 烟台
2青岛大学附属烟台毓璜顶医院检验中心,山东 烟台
3青岛大学附属烟台毓璜顶医院变态反应科,山东 烟台
收稿日期:2023年4月22日;录用日期:2023年5月15日;发布日期:2023年5月23日

摘要
目的:本研究旨在探讨C-X-C趋化因子受体5型(CXCR5) CD8+ T细胞在儿童EBV相关传染性单核细胞增多症(IM)中的反应特点及临床价值。方法:采用流式细胞术及EB病毒(EBV)病原学检查分析入组儿童的外周血,同时收集临床资料进行统计分析。结果:EBV感染急性期CXCR5+ CD8+ T细胞绝对值计数显著增加,CXCR5+ CD8+ T/CD8+ T细胞比值、CD19+ B细胞的绝对值计数及CD19+ B细胞/LYM比值显著降低。CXCR5+ CD8+ T细胞绝对值计数与EBV DNA病毒载量、CD19+ B细胞绝对值计数呈负相关与肝损伤指标呈正相关。将EBV相关性IM急性期患儿以CXCR5+ CD8+ T细胞绝对值计数中位值分为高、低表达两组,高表达组中出现淋巴结肿大、肝脾肿大的几率明显高于低表达组。ROC曲线分析显示CXCR5+ CD8+ T细胞对儿童IM具有诊断价值,对于EBV相关肝损伤具有预测价值。结论:CXCR5+ CD8+ T细胞在EBV的急性感染中发挥了抗病毒作用,而其过度反应可能导致组织器官损伤。此外,CXCR5+ CD8+ T细胞可作为EBV相关IM诊断的诊断指标及EBV相关性肝损伤的预测指标。
关键词
CXCR5+ CD8+ T细胞,EBV相关性IM,流式细胞术,EBV相关性肝损伤

Responding Characteristics and Clinical Value of CXCR5+ CD8+ T Cells in Children with Infectious Mononucleosis
Jian Xue1*, Jianyong Wang1*, Xiaolu Zhang2, Yufeng Gu2, Haiyan Xing3, Yi Xin1, Xiaoli Wang1, Aimin Li1#
1Department of Pediatrics, The Affiliated Yantai Yuhuangding Hospital of Qingdao University, Yantai Shandong
2Center of Clinical Laboratory, The Affiliated Yantai Yuhuangding Hospital of Qingdao University, Yantai Shandong
3Department of Allergy, The Affiliated Yantai Yuhuangding Hospital of Qingdao University, Yantai Shandong
Received: Apr. 22nd, 2023; accepted: May 15th, 2023; published: May 23rd, 2023

ABSTRACT
Objective: To investigate the response characteristics and clinical value of C-X-C chemokine receptor type 5 (CXCR5) CD8+ T cells in children with EBV-associated infectious mononucleosis (IM). Methods: Peripheral blood of the enrolled children was analyzed by flow cytometry and Epstein-Barr virus (EBV) etiology, and clinical data were collected for statistical analysis. Results: The absolute number of CXCR5+ CD8+ T cells increased significantly, the CXCR5+ CD8+ T/CD8+ T cell ratio, the absolute number of CD19+ B cells and the CD19+ B cell/LYM ratio decreased significantly in the acute stage of EBV infection. The absolute number of CXCR5+ CD8+ T cells was negatively correlated with EBV DNA load and absolute number of CD19+ B cells, and positively correlated with liver injury index. The children in the acute stage of EBV-associated IM were divided into high and low expression groups according to the median value of CXCR5+ CD8+ T cells absolute number. The probability of lymphadenectasis, hepatosplenomegaly in the high expression group was significantly higher than that in the low expression group. ROC curve analysis showed that CXCR5+ CD8+ T cells had diagnostic value in EBV-associated IM, and had predictive value in EBV-related liver injury. Conclusion: CXCR5+ CD8+ T cells act as an antiviral role in acute infection of EBV, and their overreaction may lead to tissue and organ damage. In addition, CXCR5+ CD8+ T cells can be used as diagnostic indicators of EBV-associated IM and predictive indicators of EBV-associated liver injury.
Keywords:CXCR5+ CD8+ T Cells, EBV-Associated IM, Flow Cytometry, EBV-Associated Liver Injury

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
爱泼斯坦–巴尔病毒(Epstein-Barr virus, EBV)相关传染性单核细胞增多症(infectious mononucleosis, IM)是一种主要由EBV感染引起的以咽峡炎、脾肝肿大、颈部淋巴结肿大、乏力、发热为主要临床表现的一种急性自限性疾病。EBV是疱疹病毒家族的一员,它感染了世界上至少90%的人口 [1] ,它主要的侵犯对象为儿童和青少年,主要通过唾液传播,经口咽上皮细胞进入人体迅速感染外周血中的B细胞并开始大量的病毒复制,同时激活大量的CD3+ CD8+ T细胞针对EBV的免疫应答反应 [2] ,因此,IM患儿为研究EBV感染的免疫应答提供了一个极好的模型。
随着医学免疫学的发展,淋巴滤泡中表达C-X-C趋化因子受体5型(CXCR5) CD8+ T细胞作为一个新发现的淋巴细胞亚群,被广泛证实参与了抗病毒免疫反应。通过对不同确诊时间的登革热患者进行分析发现CXCR5+ CD8+ T细胞具有强烈的细胞毒性功能,从而发挥病毒清除作用 [3] 。除了强细胞毒性外,CXCR5+ CD8+ T细胞的富集还可以提供代偿性B细胞辅助参与慢性乙型肝炎患者的抗病毒免疫应答 [4] 。HIV和SIV可特异性进入淋巴滤泡,感染CD19+ B细胞和Tfh细胞,形成“病毒池”,实现免疫逃逸 [5] [6] 。截至目前,研究发现CXCR5+ CD8+ T细胞能够特异性进入,有助于杀灭被病毒感染的CD19+ B细胞及Tfh细胞,这对于开发更有效的策略来控制HIV或SIV的感染具有深远的意义 [7] 。此外,相较于CXCR5+ CD8+ T细胞,CXCR5+ CD8+ T细胞表现出较低的“衰竭”状态并具有协同治疗潜力,其细胞表面具有较低的抑制性受体表达,包括T淋巴细胞免疫球蛋白黏蛋白3 (T cell immunoglobulin domain and mucin domain-3, Tim-3)和细胞毒T淋巴细胞相关抗原4 (cytotoxic T lymphocyte-associated antigen-4, CTLA-4) [8] [9] 。此外,CXCR5+ CD8+ T细胞具有促炎特性,除了可以直接导致细胞裂解外,还可以通过改变和促进生发中心(Germinal Center, GC)反应发挥致炎作用 [10] 。重要的是,最近的研究也表明,IM的大多数症状和体征不仅由病毒感染本身导致,更与T细胞的免疫激活相关 [11] [12] 。然而,目前鲜有关于CXCR5+ CD8+ T细胞炎症特性对IM患儿疾病进展影响的相关研究,为了进一步探讨CXCR5+ CD8+ T细胞在儿童EBV相关IM急性期的免疫应答特性和临床意义,我们检测了CXCR5+ CD8+ T细胞的变化情况,分析了CXCR5+ CD8+ T细胞与EBV DNA载量、CD19+ B细胞亚群和IM相关并发症之间的关系。此外,在急性原发性EBV感染期间,利用受试者工作特征曲线(receiver operating characteristic curve, ROC)确定其对IM的诊断价值和对肝损害的预测价值。
2. 方法
2.1. 一般资料
本研究将2020年9月至2022年2月青岛大学附属烟台毓璜顶医院收治的63例EBV相关IM患儿纳入实验组,同期来院健康查体30例健康儿童纳入对照组,实验组所有受试者均符合IM的诊断标准 [1] 。血清学检查确认EBV感染,排除其他病毒或细菌感染,包括单纯疱疹病毒2型、风疹病毒、巨细胞病毒、轮状病毒、弓形虫、柯萨奇病毒、支原体、衣原体、甲肝、乙肝、丙肝、丁肝病毒等。存在恶性肿瘤和自身免疫性疾病的患儿也被排除在本研究之外。所有的研究对象及其监护人均知晓本项研究,并签署了知情同意书,该研究符合赫尔辛基宣言并得到了青岛大学附属烟台毓璜顶医院伦理委员会的批准。
2.2. 数据的收集
记录入组儿童的基本信息,包括姓名、性别、年龄等,症状包括肝脾肿大和淋巴结肿大。实验室检查包括血常规、谷丙转氨酶(ALT)、谷草转氨酶(AST),IM患儿和健康对照组(HC)的临床特征如表1所示。
Table 1. Clinical characteristics of IM patients and healthy individuals
表1. IM患而与健康对照儿童的临床特征
分析卡方检验、Mann-Whitney U检验。P < 0.05为差异有统计学意义。
2.3. EBV DNA定量检测
取静脉血标本2 ml,置于含乙二胺四乙酸(EDTA)的无菌抗凝采集管中,密封待检。ABI 7500 Real-Time PCR System
2.4. 流式细胞术分析
在儿童发热后第3天至第5天采集外周血标本,采集2 mL静脉血样本,置于EDTA抗凝管中,并在6小时内检测。接下来,每种单克隆抗体各20 µL加入到每个100 µL的测试样本中,充分混匀,并在黑暗中孵育15分钟。使用以下单克隆抗体进行免疫分型分析:PerCP anti-human CD45 (clone HI30, Biolegend, USA), APC/Cyanine7 anti-human CD3 (clone HIT3a, AAT Bioquest, USA), PE/Cyanine7 anti-human CD8 (Clone SK1, Biolegend, USA), Pacific Blue™ anti-human CD19 (Clone SJ25C1, Biolegend, USA), and PE anti-human CD185 (CXCR5) (Clone J252D4, Biolegend, USA)。随后,加入2 mL溶血素溶解红细胞,并将试管置于室温下黑暗中静置5分钟,再以1000 r/min离心5分钟,弃上清。最后,用磷酸盐缓冲盐水(phosphate buffer solution, PBS)清洗细胞两次,并重新悬浮上机检测。使用FACSAria II流式细胞仪(Becton Dickinson)和FACSDiva软件(BD Biosciences, USA)分析染色细胞,所有步骤均采用同型匹配的抗体对照。CXCR5+ CD8+ T细胞亚群的门控策略见图1。

Figure 1. Application of gating strategy to identify CXCR5+ CD8+ T cells
图1. CXCR5+ CD8+ T细胞的设门策略
2.5. 统计分析
采用GraphPad Prism 8.3.0软件进行统计分析,各组间比较采用Mann Whitney U检验及χ2检验。变量间的相关性采用Spearman秩相关进行评估。ROC曲线分析最佳截断值、计算曲线下面积,评估IM的预测价值,定量数据以中位数(上四分位数[Q1],下四分位数[Q3]),定性资料运用频数(频率)表示。双侧P < 0.05认为有统计学意义。
3. 结果
3.1. EBV相关性IM患儿急性期CXCR5+ CD8+ T细胞的变化情况
IM急性期循环中CD8+ T细胞绝对值计数显著增加,这被认为是控制EBV感染的关键因素 [2] 。CXCR5+ CD8+ T细胞作为CD8+ T细胞的一个小亚群,并可以继续分化为多种不同功能的细胞亚群针对特定的感染和免疫环境。我们的数据显示,IM患儿急性期CD3+ T细胞和CD3+ CD8+ T细胞的绝对值计数明显高于HC组(P < 0.0001) (图2(A)、图2(C)),这些细胞占淋巴细胞的比例上也观察到了类似的结果(P < 0.0001) (图2(B)、图2(D))。此外,我们观察到CXCR5+ CD8+ T细胞的绝对值计数在IM急性期显著增加(P < 0.0001) (图2(E)),有趣的是,IM患儿急性期CXCR5+ CD8+ T/CD8+ T细胞比值低于HC组儿童(P = 0.0006) (图2(F)),图2(G)为CXCR5+ CD8+ T细胞典型流式图。
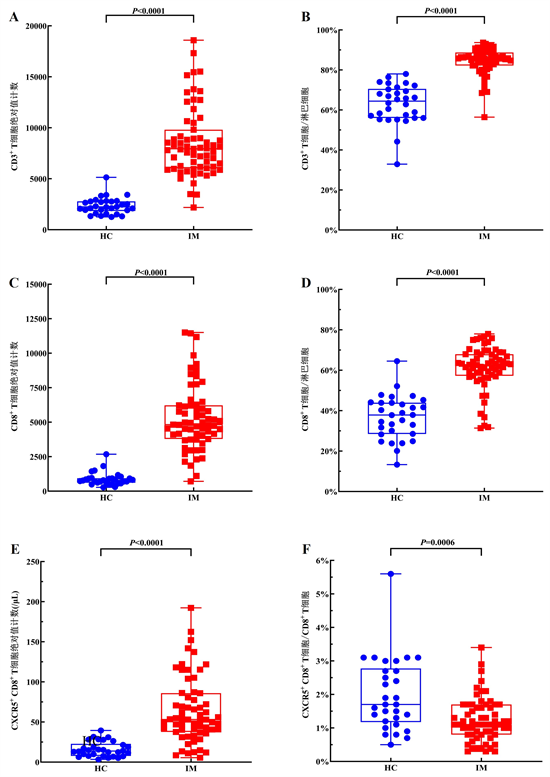

Figure 2. The difference of T lymphocyte subsets between experimental group and healthy control group
图2. 实验组与健康对照组T淋巴细胞亚群的差异情况
3.2. EBV相关性IM患儿急性期CD19+ B细胞的变化情况及其与CXCR5+ CD8+ T细胞的关系
除了探索T淋巴细胞亚群情况外,我们还检测了IM疾病状态下CD19+ B细胞的变化情况。与HC组儿童相比,IM患儿CD19+ B细胞的绝对值计数(P < 0.0001)及CD19+ B细胞/淋巴细胞显著降低(P < 0.0001) (图3(A)、图3(B)),图3(C)为CD19+ B细胞典型流式图。Spearman相关性分析显示,IM患儿中CXCR5+ CD8+ T细胞与CD19+ B细胞在绝对值计数上呈负相关(P = 0.0092) (图4(A)),我们还发现CXCR5+ CD8+ T细胞绝对值计数与EBV DNA载量呈负相关(P = 0.03) (图4(B))。

Figure 3. Differences of CD19+ B lymphocyte subsets between the experimental group and the control group
图3. 实验组与对照组CD19+ B淋巴细胞亚群的差异情况

Figure 4. Correlation between CXCR5+ CD8+ T cell absolute number and B cell absolute number and EBV viral load
图4. CXCR5+ CD8+ T细胞绝对值计数与B细胞绝对值计数及EBV病毒载量之间的相关性
3.3. CXCR5+ CD8+ T细胞与IM疾病状态的关系
EBV感染患儿可表现出多种症状或并发症,包括淋巴结肿大、肝脾肿大和肝损伤指标升高等,这些与CD8+ T细胞产生的免疫紊乱密切相关,并能反映出疾病的严重程度 [13] [14] 。最近的研究表明,CXCR5+ CD8+ T细胞可能在炎症和自身免疫性疾病中发挥促进疾病状态的作用。由于CXCR5+ CD8+ T细胞对IM疾病状态的影响尚不清楚,我们分析了CXCR5+ CD8+ T细胞的过度反应是否参与了IM症状或并发症的产生。我们将EBV相关性IM急性期患儿以CXCR5+ CD8+ T细胞的绝对值计数中位值为界分为CXCR5+ CD8+ T细胞高、低表达两组,两组在一般临床资料上(年龄、性别)不存在统计学差异(P > 0.05),高表达组中出现肝脾肿大24例(75%)、淋巴结肿大25例(78.13%),低表达组中肝脾肿大14例(45.16%)、淋巴结肿大16例(51.61%),高表达组中的肝脾肿大(P = 0.0155) (图5(A))、淋巴结肿大(P = 0.0273) (图5(B))的几率高于低表达组。此外,我们还讨论了CXCR5+ CD8+ T细胞与肝损伤指标间的关系。值得注意的是,ALT和AST均与CXCR5+ CD8+ T细胞绝对计数呈正相关(P = 0.0272和0.0006) (图5(C)和图5(D))。


Figure 5. Correlation between CXCR5+ CD8+ T cells and EBV-associated IM disease progression
图5. CXCR5+ CD8+ T细胞与EBV相关性IM疾病进展的相关性
3.4. CXCR5+ CD8+ T细胞的诊断和预测价值
利用ROC曲线分析探讨CXCR5+ CD8+ T细胞对IM的诊断价值和肝细胞损伤的预测价值。结果显示,CXCR5+ CD8+ T细胞绝对值计数和CXCR5+ CD8+ T/CD8+ T细胞均具有IM诊断价值,曲线下面积(Area Under Curve, AUC)均大于0.7 (图6(A))。当CXCR5+ CD8+ T细胞绝对值计数和CXCR5+ CD8+ T/CD8+ T细胞的临界值分别为31.67/μL和1.50%时,诊断IM的敏感性和特异性分别为82.54%和96.88%、66.15%和68.75% (表2)。同样,CXCR5+ CD8+ T细胞绝对值计数对IM的肝细胞损伤(ALT > 40 U/L)具有预测价值,AUC大于0.7 (图6(B))。当CXCR5+ CD8+ T细胞绝对值计数的临界值为50.85/μL时,肝损伤识别的敏感性和特异性分别为84.62%和64% (表3),而CXCR5+ CD8+ T/CD8+ T细胞对肝细胞损伤的ROC分析差异无统计学意义。
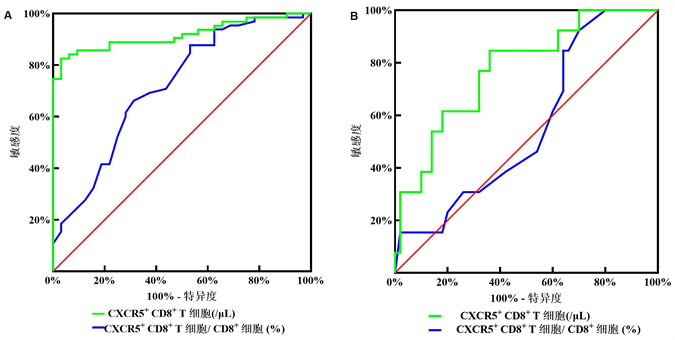
Figure 6. The diagnostic value of CXCR5+ CD8+ T cells for EBV-associated IM and the predictive value of EBV-associated liver injury
图6. CXCR5+ CD8+ T细胞对于EBV相关性IM的诊断价值及EBV相关性肝损伤的预测价值
Table 2. Diagnostic value of CXCR5+ CD8+ T cells for IM
表2. CXCR5+ CD8+ T细胞对IM的诊断价值
ROC曲线分析,P < 0.05为差异有统计学意义。
Table 3. Predictive value of CXCR5+ CD8+ T cells for hepatocyte damage in IM
表3. CXCR5+ CD8+ T细胞对IM肝细胞损伤的预测价值
ROC曲线分析,P < 0.05为差异有统计学意义。
4. 讨论
在本研究中,我们证实了IM患儿外周血中CD3+ T、CD3+ CD8+ T细胞的绝对值计数及各自占淋巴细胞百分比显著增加,提示EBV感染诱导CD8+ T细胞活化,产生了较强的细胞免疫应答,这与以往的研究结果一致 [1] [14] 。EBV感染诱导CD8+ T细胞的爆发性增殖也可能刺激CXCR5+ CD8+ T细胞绝对值计数的增加。我们的研究结果显示,急性EBV感染时CXCR5+ CD8+ T细胞的绝对值计数相较于健康儿童显著增加,而CXCR5+ CD8+ T细胞/CD8+ T细胞降低。我们认为以下因素可能原因导致了CXCR5+ CD8+ T细胞没有像CD8+ T细胞那样成比例增加。首先,CXCR5具有趋化特性,允许特异性的CD8+ T细胞在病毒感染期间迁移到淋巴滤泡内进行病毒的清除 [4] [8] 。趋化因子CXC配体13 (Chemokine CXC ligand 13, CXCL13)为CXCR5的唯一配体,它决定着表达CXCR5细胞的运动与归巢,CXCL13主要由B淋巴细胞滤泡内的基质细胞和树突状细胞分泌,因此CXCR5的表达对于CD8+T细胞向B淋巴细胞滤泡内趋化、迁移具有决定性作用 [15] 。研究表明,CXCR5+ CD8+ T细胞与CXCR5− CD8+ T细胞相比,反应迁移能力增加了20倍 [15] 。其次,滤泡中CXCR5+ CD8+ T细胞具有增殖能力和干细胞样特征,这些细胞可以作为祖细胞进一步分化为CXCR5− CD8+ T细胞,并且比CXCR5表达始终为阴性的CD8+ T细胞具有更强的细胞毒功能 [8] 。此外,CXCR5+ CD8+ T细胞可能通过分化为更活跃的CXCR5− CD8+T细胞亚群来参与对EBV感染的防御,从而具有更强大的细胞毒性功能。此外,抗病毒过程中CXCR5+ CD8+ T细胞的损耗可能是CXCR5+ CD8+ T细胞/CD8+ T细胞比值降低的另一个重要原因。
为了进一步探讨CXCR5+ CD8+ T细胞对于IM免疫微环境的作用,我们进一步研究了CXCR5+ CD8+ T细胞和CD19+ B细胞亚群之间的关系。值得注意的是,IM患儿CD19+ B细胞绝对值计数及其占淋巴细胞的比例均低于健康对照,这与之前的研究结果部分一致。刘等人的研究发现,CD19+ B细胞占淋巴细胞的比例明显降低,而CD19+ B细胞的绝对值计数没有明显变化 [16] 。Sallusto等人也报道了CD19+ B细胞的绝对值计数在IM急性期减少 [17] ;然而,Chen等人发现IM患儿中CD19+ B细胞的绝对数值计数及其占淋巴细胞的百分比明显减低 [14] 。研究表明,EBV感染的B细胞可以刺激具有特异性细胞毒活性的CD8+ T细胞增殖,这对于促进感染B细胞的凋亡至关重要,该过程还能抑制B淋巴细胞的增殖和分化 [18] [19] 。这些结果可能有助于解释为什么在IM急性期患儿CD8+ T细胞的选择性增加;然而,B细胞的绝对值计数却明显减少。此外,已有研究表明CXCR5+ CD8+ T细胞可选择性进入B细胞滤泡,消灭感染的Tfh和CD19+ B细胞,并通过产生功能性细胞因子参与细胞免疫 [9] [15] 。我们的研究结果显示,IM患儿CXCR5+ CD8+ T细胞的绝对值计数与B细胞绝对值计数、EBV DNA载量呈负相关,这些结果可能表明CXCR5+ CD8+ T细胞对清除EBV感染至关重要。过度的细胞免疫反应是EBV相关性IM患者出现免疫功能障碍的重要原因,患者临床症状的严重程度与其免疫状况直接相关 [20] 。目前,有研究发现细胞毒性T细胞(Cytotoxic T lymphocyte, CTL)坏死和拥挤与IM的肝损害密切相关。此外,CTL释放细胞因子IL-6和INF-γ,可增强其对靶细胞的敏感性,甚至可以引起级联反应导致肝衰竭 [21] ,我们发现EBV相关性IM患儿转氨酶与CXCR5+ CD8+ T细胞的绝对值计数呈正相关,我们推测CXCR5+ CD8+ T细胞可能参与了EBV相关性肝损伤的发病。EBV感染后B细胞激活可诱导淋巴结肿大和肝脾肿大 [21] 。既往研究表明,CXCR5+ CD8+ T细胞除了具有细胞毒性外,还具有调节性T细胞(Regulatory cells, Treg)、滤泡辅助T细胞 (Follicular helper T cell, Tfh)样特征,这些特征与炎症和自身免疫性疾病密切相关。CXCR5+ CD8+ T细胞可以为B细胞提供辅助作用,引起的B细胞耐受性的丧失导致体液免疫功能障碍,从而促进自身免疫性疾病的发生、发展 [22] 。我们的研究结果表明,在CXCR5+ CD8+ T细胞高表达组中,淋巴结肿大、肝脾肿大的几率明显高于低表达组,提示CXCR5+ CD8+ T细胞可能参与了IM的发展。因此,我们推测上述损伤可能由CXCR5+ CD8+ T细胞的过度免疫反应引起。
在本研究中,我们尝试着分析了CXCR5+ CD8+ T细胞的临床应用。通过对ROC曲线的分析,CXCR5+ CD8+ T细胞的绝对值计数和CXCR5+ CD8+ T细胞/CD8+ T细胞均可作为EBV相关IM的诊断指标。此外,CXCR5+ CD8+ T细胞的绝对值计数对EBV相关性肝损害损伤具有预测价值,这对于防止IM患者漏诊,实现早期干预避免并发症的产生具有重要意义。
5. 结论
综上所述,我们的数据表明CXCR5+ CD8+ T细胞亚群可能参与了EBV相关IM的急性期的发病机制,而其过度激活可能与疾病的进展有关。这些发现为儿童急性EBV感染的免疫应答机制提供了新的线索。此外,我们的研究还发现CXCR5+ CD8+ T细胞亚群的检测有助于EBV相关IM的早期诊断并准确能够预测EBV相关性肝损伤。
6. 不足
1) 未进一步研究CXCR5+ CD8+ T细胞在EBV相关IM恢复期的分布特点及临床意义。2) 未进行体外细胞实验验证CXCR5+ CD8+ T细胞具体的抗EBV机制。
基金项目
山东省医药卫生科技发展项目(202206010374);烟台市科技计划项目服务书(2022YD001)。
文章引用
薛 健,王建勇,张晓录,谷钰峰,邢海燕,辛 毅,王晓莉,李爱敏. CXCR5+ CD8+ T细胞在儿童传染性单核细胞增多症中的反应特点及临床价值
Responding Characteristics and Clinical Value of CXCR5+ CD8+ T Cells in Children with Infectious Mononucleosis[J]. 临床医学进展, 2023, 13(05): 8145-8155. https://doi.org/10.12677/ACM.2023.1351140
参考文献
- 1. Luzuriaga, K. and Sullivan, J.L. (2010) Infectious Mononucleosis. The New England Journal of Medicine, 362, 1993-2000. https://doi.org/10.1056/NEJMcp1001116
- 2. Balfour, H.H., Dunmire, S.K. and Hogquist, K.A. (2015) Infectious Mononucleosis. Clinical & Translational Immunology, 4, e33. https://doi.org/10.1038/cti.2015.1
- 3. Qiu, L., Wang, H., Yu, Q., et al. (2019) Protective Role of Follicular CXCR5(+)CD8(+) T Cells against Dengue Virus 2 Infection. International Journal of Infectious Diseases, 83, 12-19. https://doi.org/10.1016/j.ijid.2019.03.024
- 4. Jiang, H., Li, L., Han, J., et al. (2017) CXCR5(+) CD8(+) T Cells Indirectly Offer B Cell Help and Are Inversely Correlated with Viral Load in Chronic Hepatitis B Infection. DNA and Cell Biology, 36, 321-327. https://doi.org/10.1089/dna.2016.3571
- 5. Leong, Y.A., Chen, Y., Ong, H.S., et al. (2016) CXCR5(+) Follicular Cytotoxic T Cells Control viral Infection in B Cell Follicles. Nature Immunology, 17, 1187-1196. https://doi.org/10.1038/ni.3543
- 6. Mylvaganam, G.H., Rios, D., Abdelaal, H.M., et al. (2017) Dynamics of SIV-Specific CXCR5+ CD8 T Cells during Chronic SIV Infection. Proceedings of the National Academy of Sciences of the United States of America, 114, 1976-1981. https://doi.org/10.1073/pnas.1621418114
- 7. Ayala, V.I., Deleage, C., Trivett, M.T., et al. (2017) CXCR5-Dependent Entry of CD8 T Cells into Rhesus Macaque B-Cell Follicles Achieved through T-Cell Engineering. Journal of Virology, 91, e02507-16. https://doi.org/10.1128/JVI.02507-16
- 8. He, R., Hou, S., Liu, C., et al. (2016) Follicular CXCR5-Expressing CD8(+) T Cells Curtail Chronic Viral Infection. Nature, 537, 412-428. https://doi.org/10.1038/nature19317
- 9. Im, S.J., Hashimoto, M., Gerner, M.Y., et al. (2016) Defining CD8+ T Cells That Provide the Proliferative Burst after PD-1 Therapy. Nature, 537, 417-421. https://doi.org/10.1038/nature19330
- 10. Valentine, K.M. and Hoyer, K.K. (2019) CXCR5+ CD8 T Cells: Protective or Pathogenic? Frontiers in Immunology, 10, Article No. 1322. https://doi.org/10.3389/fimmu.2019.01322
- 11. Lam, J.K.P., Hui, K.F., Ning, R.J., et al. (2018) Emergence of CD4+ and CD8+ Polyfunctional T Cell Responses against Immunodominant Lytic and Latent EBV Antigens in Children with Primary EBV Infection. Frontiers in Microbiology, 9, Article No. 416. https://doi.org/10.3389/fmicb.2018.00416
- 12. Meckiff, B.J., Ladell, K., Mclaren, J.E., et al. (2019) Primary EBV Infection Induces an Acute Wave of Activated Antigen-Specific Cytotoxic CD4(+) T Cells. The Journal of Immunology, 203, 1276-1287. https://doi.org/10.4049/jimmunol.1900377
- 13. Katz, B.Z., Reuter, C., Lupovitch, Y., et al. (2019) A Validated Scale for Assessing the Severity of Acute Infectious Mononucleosis. The Journal of Pediatrics, 209, 130-133. https://doi.org/10.1016/j.jpeds.2019.01.035
- 14. Chen, L., Chen, X., Yao, W., et al. (2021) Dynamic Distribution and Clinical Value of Peripheral Lymphocyte Subsets in Children with Infectious Mononucleosis. Indian Journal of Pe-diatrics, 88, 113-119. https://doi.org/10.1007/s12098-020-03319-7
- 15. Quigley, M.F., Gonzalez, V.D., Granath, A., et al. (2007) CXCR5+ CCR7- CD8 T Cells Are Early Effector Memory Cells That Infiltrate Tonsil B Cell Follicles. European Jour-nal of Immunology, 37, 3352-3362. https://doi.org/10.1002/eji.200636746
- 16. Liu, J., Zhou, Y., Yu, Q., et al. (2015) Higher Frequency of CD4+CXCR5+ICOS+PD1+ T Follicular Helper Cells in Patients with Infectious Mononucleosis. Medicine (Baltimore), 94, e2061. https://doi.org/10.1097/MD.0000000000002061
- 17. Sallusto, F., Lenig, D., Förster, R., et al. (1999) Two Subsets of Memory T Lymphocytes with Distinct Homing Potentials and Effector Functions. Nature, 401, 708-712. https://doi.org/10.1038/44385
- 18. Roliński, J., Grywalska, E., Pyzik, A., et al. (2018) Interferon Alpha as Antivi-ral Therapy in Chronic Active Epstein-Barr Virus Disease with Interstitial Pneumonia—Case Report. BMC Infectious Diseases, 18, Article No. 190. https://doi.org/10.1186/s12879-018-3097-6
- 19. Castillo, J.J., Beltran, B.E., Miranda, R.N., et al. (2018) EBV-Positive Diffuse Large B-Cell Lymphoma, Not Otherwise Specified: 2018 Update on Diagnosis, Risk-Stratification and Management. American Journal of Hematology, 93, 953-962. https://doi.org/10.1002/ajh.25112
- 20. Dunmire, S.K., Verghese, P.S. and Balfour, H.H. (2018) Primary Epstein-Barr Virus Infection. Journal of Clinical Virology, 102, 84-92. https://doi.org/10.1016/j.jcv.2018.03.001
- 21. Wu, Y., Ma, S., Zhang, L., et al. (2020) Clinical Manifesta-tions and Laboratory Results of 61 Children with Infectious Mononucleosis. Journal of International Medical Research, 48. https://doi.org/10.1177/0300060520924550
- 22. Fousteri, G. and Kuka, M. (2020) The Elusive Identity of CXCR5(+) CD8 T Cells in Viral Infection and Autoimmunity: Cytotoxic, Regulatory, or Helper Cells? Molecular Im-munology, 119, 101-105. https://doi.org/10.1016/j.molimm.2020.01.007
NOTES
*薛健和王建勇对本文有同等贡献。
#通讯作者。
