Advances in Clinical Medicine
Vol.
13
No.
08
(
2023
), Article ID:
70958
,
7
pages
10.12677/ACM.2023.1381867
非霍奇金血管免疫母细胞T细胞淋巴瘤99mTc-MDP SPECT/CT显像: 肥大性肺性骨关节病1例
赵赶超1,朱应琼2,郑晨曦3,袁磊4,李奕璇3,关谊2*
1重庆市奉节县人民医院肿瘤科,重庆
2重庆市奉节县人民医院内分泌与代谢科,重庆
3重庆医科大学附属第二医院核医学科,重庆
4重庆医科大学附属第二医院内分泌与代谢科,重庆
收稿日期:2023年7月21日;录用日期:2023年8月14日;发布日期:2023年8月21日

摘要
1例血液系统疾病患者,全身骨显像为肥大性骨关节病,由于患者病情复杂,始终诊断不明,诊疗过程中全身骨显像检查为临床诊疗提供重要线索,患者最终得到合适治疗;由此病例对比既往我科7例全身骨显像提示肥大性骨关节病的病例,同时对肥大性骨关节病做出讨论。
关键词
肥大性肺性骨关节病,全身骨显像,SPECT/CT

Non-Hodgkin’s Angioimmunoblast T-Cell Lymphoma 99mTc-MDP SPECT/CT Imaging for Hypertrophic Pulmonary Osteoarthropathy: A Case Report
Ganchao Zhao1, Yingqiong Zhu2, Chenxi Zheng3, Lei Yuan4, Yixuan Li3, Yi Guan2*
1Department of Oncology, Fengjie County People Hospital, Chongqing
2Department of Endocrinology, Fengjie County People Hospital, Chongqing
3Department of Nuclear Medicine, The Second Hospital of Chongqing Medical University, Chongqing
4Department of Endocrinology, The Second Hospital of Chongqing Medical University, Chongqing
Received: Jul. 21st, 2023; accepted: Aug. 14th, 2023; published: Aug. 21st, 2023

ABSTRACT
A patient with hematological diseases was diagnosed as hypertrophic osteoarthropathy by whole-body bone imaging. Because of the patient’s complicated condition, the diagnosis was still unknown. The whole-body bone imaging examination provided important clues for clinical diagnosis and treatment, and the patient was finally treated appropriately. This case is compared with 7 cases of hypertrophic osteoarthropathy diagnosed by whole body bone imaging in our department, and the hypertrophic osteoarthropathy is discussed at the same time.
Keywords:Hypertrophic Pulmonary Osteoarthropathy, Whole Body Bone Imaging, SPECT/CT

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肥大性肺性骨关节病[Hypertrophic Pulmonary Osteoarthropathy (HPO)]发病机制尚不清楚,与众多因素有关,多见于肺部疾病引起,尤其继发于肺癌多见 [1] ,少见于其他肺外疾病如心脏疾病、胃肠道疾病、骨髓纤维变性、血液恶性肿瘤等 [2] 。血液恶性肿瘤中的非霍奇金血管免疫母细胞T细胞淋巴瘤,属于侵袭性淋巴瘤的一种 [3] [4] ,临床表现多样 [5] ,诊断及治疗困难 [6] [7] [8] ,预后差 [4] [9] 。该病可导致骨破坏,而在临床工作中,往往会忽视骨影像学改变在帮助诊断该种疾病中的积极作用。并且血液恶性肿瘤所致的HPO在临床中亦非常罕见 [2] 。全身骨显像作为诊断各种代谢性骨病的重要方法 [10] ,其对HPO的特征性识别具有非常重要的参考价值 [11] 。本案例报道了一例表现不典型、诊断困难的血管免疫母细胞T细胞淋巴瘤,因诊断的关键环节中全身骨显像检查提示HPO,为最终明确病因提供了重要线索。
患者,女,77岁,因头痛、头晕3周,加重伴咳嗽2周入院。患者头痛、头晕症状为阵发性不规律发作,伴活动后胸闷、乏力,爬楼后症状加重,卧床休息,症状反复。2周前患者受凉后上诉症状加重,伴有咳嗽、咳痰症状,偶有粘稠黄浓痰,当地社区医院予以静滴青霉素抗感染治疗,上诉症状无明显好转,3天前出现双下肢水肿症状,患者遂于我院肾内科就诊,予以患者螺内酯片利尿治疗。患者双下肢水肿减轻。仍有头痛、头晕、胸闷、咳嗽,咳痰。患者既往高血压病史10年及重度骨质疏松病史2年,均有规范诊治随访。体格检查:血压:108/60 mmHg,双侧颈部有多发淋巴结肿大,最大为2.0 cm × 1.0 cm,质地稍硬,活动度可,有压痛,双下肢轻度凹陷性水肿。实验室检查:入院12天,反复电解质紊乱,期间复查5次电解质,血钠波动在126.9 mmol/L~130.0 mmol/L (参考范围:137.0 mmol/L~145.0 mmol/L),血氯波动在92.5 mmol/L~100.3 mmol/L (参考范围:98.0 mmol/L~107.0 mmol/L),主要表现为低钠低氯;使用抗生素的情况下血象并未恢复正常,白细胞波动在9.86 × 109/L~11.68 × 109/L (参考范围:3.5 × 109/L~9.5 × 109/L),中性粒细胞百分比波动在76.2%~83.8% (参考范围:45%~75%)。颈部彩超提示双侧颈部I-V区淋巴结肿大。胸部正侧位片未见明显异常,颌面部增强CT提示颈部淋巴结及鼻咽顶后壁病变(图1)。患者诊断不明,全身疼痛,遂于我科行全身骨显像检查。
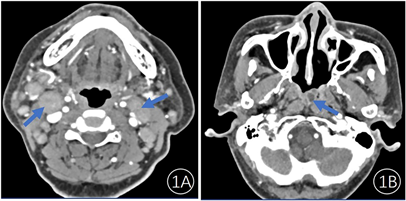 (1A) 图显示双侧腮腺前方间隙及颈部间隙见多发肿大淋巴结影,较大者位于颈部II区,左侧较大者大小约14 × 25 mm (1A箭头示),右侧大小约18 × 19 mm (1A箭头示),增强扫描呈明显欠均匀强化。(1B) 显示鼻咽软组织增厚并顶后壁环形强化灶(1B箭头示),脓肿?肿瘤性病变不能完全除外
(1A) 图显示双侧腮腺前方间隙及颈部间隙见多发肿大淋巴结影,较大者位于颈部II区,左侧较大者大小约14 × 25 mm (1A箭头示),右侧大小约18 × 19 mm (1A箭头示),增强扫描呈明显欠均匀强化。(1B) 显示鼻咽软组织增厚并顶后壁环形强化灶(1B箭头示),脓肿?肿瘤性病变不能完全除外
Figure 1. Maxillofacial enhanced CT image
图1. 患者颌面部增强CT显像图
99mTc-MDP (由北京原子高科重庆公司生产,放化纯 > 95%) SPECT (美国GE公司Millennium VG SPECT/CT (Ser No 10594, Manufactured 15-SEP-03))全身骨显像(静脉注射99mTc-MDP 20mci,采集条件:能峰140 kev,窗宽20%,矩阵256 × 1024,Zoom,1.0)提示:肥大性肺性骨关节病(图2)。追踪随访患者,完成肿瘤标记物、淋巴结活检(图3A)、间断3次骨髓穿刺,结果相似,其中典型如(图3B,图3D)均未明确诊断,胸部 + 全腹增强CT见颈根部、双侧腋窝、纵隔、腹主动脉旁、腹膜、双侧腹股沟区(图3C)多发肿大淋巴结,部分相融合,考虑淋巴瘤,最后将淋巴结病理标本送至首都医科大学附属北京友谊医院病理科会诊,病理诊断为:(颈部淋巴结)非霍奇金血管免疫母细胞T细胞淋巴瘤。随后行mini CMOP方案(环磷酰胺、脂质体米托蒽醌、长春地辛、泼尼松)化疗;辅以护胃、止吐、护肝、碱化等治疗,现患者本疗程化疗结束,病情基本平稳,定期至血液科完成后续的治疗。
 图像显示双侧尺骨、桡骨远端,双侧胫骨近端及远端,双侧肘关节、双侧膝关节、双侧踝关节条片状放射性增高,部分呈“双轨征”,诊断为肥大性肺性骨关节病
图像显示双侧尺骨、桡骨远端,双侧胫骨近端及远端,双侧肘关节、双侧膝关节、双侧踝关节条片状放射性增高,部分呈“双轨征”,诊断为肥大性肺性骨关节病
Figure 2. Whole-body scintigraphy (WBS)
图2. 患者全身骨显像
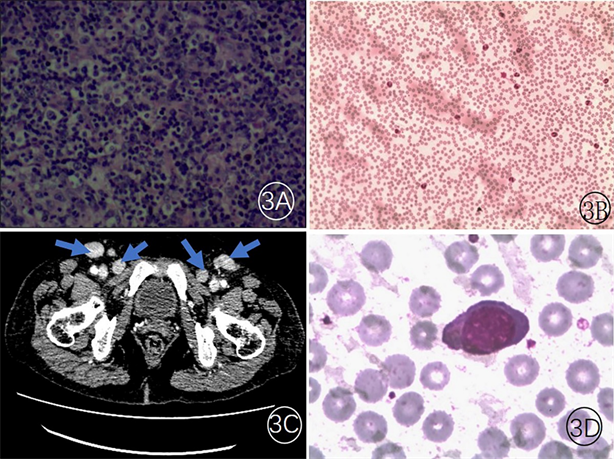 (3A HEX100)淋巴组织显示T区增生,滤泡网不完整,肿瘤性病变不能完全除外。2022-04-21血细胞病理形态学检查(3B瑞士染色X10,3D瑞士染色X100)成熟中性粒细胞占比增高,以分叶核粒细胞为主,部分细胞可见空泡;成熟红细胞轻度大小不均;散在血小板可见;可见2%异型淋巴细胞(胞浆蓝、量中等,染色质粗,部分细胞可见拖尾,胞浆内可见少量紫红色颗粒)。增强CT图像(3C)见双侧腹股沟区(3C箭头示)多发肿大淋巴结,部分相融合,考虑淋巴瘤可能
(3A HEX100)淋巴组织显示T区增生,滤泡网不完整,肿瘤性病变不能完全除外。2022-04-21血细胞病理形态学检查(3B瑞士染色X10,3D瑞士染色X100)成熟中性粒细胞占比增高,以分叶核粒细胞为主,部分细胞可见空泡;成熟红细胞轻度大小不均;散在血小板可见;可见2%异型淋巴细胞(胞浆蓝、量中等,染色质粗,部分细胞可见拖尾,胞浆内可见少量紫红色颗粒)。增强CT图像(3C)见双侧腹股沟区(3C箭头示)多发肿大淋巴结,部分相融合,考虑淋巴瘤可能
Figure 3. Cervical lymph node biopsy (3A), pathomorphological examination of blood cells (3B, 3D) and enhanced CT in inguinal region (3C)
图3. 患者颈部淋巴结病理检查图(3A)、血细胞形态学检查(3B, 3D)及腹股沟区增强CT (3C)
2. 讨论
肥大性肺性骨关节病(HPO),简称肺性骨病,属于肥大性骨关节病[hypertrophic osteoarthropathy (HOA)]继发型。HOA是一种因其他疾病而导致全身性骨、关节及软组织异常的临床综合征,即Marie-Bamberger综合征,由Bamberger和Marie最早分别于1889年和1890年描述 [12] 。文献表明HPO典型发病年龄为55~75岁,没有明显种族或性别优势。HPO与相关疾病的关系及发病机制尚不清楚,病因学说较多。一些学者认为HPO可伴发于60余种肺内或肺外疾病 [12] ,包括胸膜肺疾病、肝胆消化系统疾病、血液系统恶性肿瘤等 [2] ,主要与胸部恶性肿瘤和肺部炎症性疾病有关,并多发生于周围型肺癌 [13] [14] [15] ,肺疾患引起HPO与病灶产生毒素 [16] 、自主神经功能紊乱、末梢循环异常有关 [17] ,与肺疾患的良、恶性无关,与肺疾患的病程发展有一定联系 [18] [19] 。还有学者认为HPO发病机制在很大程度上归因于神经源性通路或由循环生长因子触发的血管通路,其中血小板衍生生长因子(PDGF)、血管内皮生长因子(VEGF)作用明显 [2] [20] 。HPO多继发于其他疾病 [21] [22] ,表现没有特异性,比较典型的临床表现为沿长骨干有压痛或烧灼感,受累关节僵硬、肿胀及疼痛,以及伴有杵状指 [23] [24] 。
关于HPO,影像学检查是诊断的主要手段,其中全身骨显像是一种更灵敏的检查,甚至有文献认为使用锝99m (99mTc)亚甲基二膦酸盐(MDP)进行骨闪烁显像是金标准 [11] 。HPO全身骨显像特点:1) 四肢长骨尤其下肢骨呈对称弥漫性改变;2) 关节周围对称性浓聚;3) “轨道征”或“双条征”。HPO本身为良性病变,但有研究报道肺性肥大性骨关节病合并骨转移的大约为20%。在原发病灶如肺癌病灶切除之后,HPO的症状及骨显像的典型表现随之消失;而在肺部肿瘤复发后HPO的表现又可随之复发 [10] 。因此放射性核素扫描作为治疗反应的随访指标具有巨大的实用性,因为骨显像结果随着潜在病因的成功治疗而消退 [14] [25] 。文献报道,鼻咽癌肺转移患者可合并HPO,认为骨显像有HPO可作为诊断鼻咽癌肺转移的辅助指标,本病例也有鼻咽部病变,因患者无法耐受手术,未能明确性质,仍需追踪随访此病灶 [20] 。HPO治疗以积极治疗原发疾病为主,可联合使用非甾体类药物及双膦酸盐类药物缓解症状 [26] 。
本例患者病情复杂,临床表现不典型,尤其是诊断不明且其他影像学检查和病理检查不充分的时候,全身骨显像诊断相当困难。追踪我院既往1年内7例全身骨显像提示肺性骨病的影像,这7例均有明确肿瘤病史甚至肺部肿瘤病史,包括胃及食管癌合并肺转移、肺腺癌治疗前后、卵巢癌合并肺栓塞、肺鳞癌合并阻塞性肺炎,此病例有相似的骨显像影像学表现(图4A,图4B),但没有明确的病史,再次对比以及结合后来患者的相关检查及治疗,仍诊断为HPO,可治疗3月后复查全身骨显像。
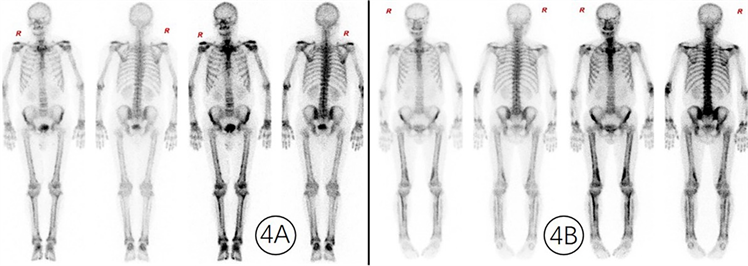 (4A) 曹某,男65岁,肺腺癌,全身骨显像提示HPO;(4B) 患者史某,男,70岁,胃及食管癌合并肺转移全身骨显像提示HPO
(4A) 曹某,男65岁,肺腺癌,全身骨显像提示HPO;(4B) 患者史某,男,70岁,胃及食管癌合并肺转移全身骨显像提示HPO
Figure 4. Whole-body scintigraphy in two cases: hypertrophic pulmonary osteoarthropathy
图4. 我科既往2例全身骨显像(4A, 4B)提示肥大性肺性骨关节病的图像
在临床诊疗中,没有明确肿瘤病史或肺部疾病或其他全身疾病患者,如全身骨显像显示有HPO的影像学表现,能否立即明确诊断是值得探讨的问题。尤其是部分诊断不明的特殊患者选择全身骨显像的时机也很重要,本例患者就是全身骨显像提示HPO,反向提示患者很可能存在肿瘤性疾病,给临床提供了重要信息,随后完善相关检查,最终明确诊断,获得相应的治疗。
总之,HPO对临床疾病的诊治可提供重要线索,也是一项重要的随访指标,而用99mTc-MDP进行骨显像是主要检查手段。
利益冲突
所有作者声明无利益冲突。
作者贡献声明
赵赶超、朱应琼:研究实施、论文撰写;郑晨曦、李奕璇:图像整理、分析;关谊、袁磊:研究指导、论文修改。
文章引用
赵赶超,朱应琼,郑晨曦,袁 磊,李奕璇,关 谊. 非霍奇金血管免疫母细胞T细胞淋巴瘤99mTc-MDP SPECT/CT显像:肥大性肺性骨关节病1例
Non-Hodgkin’s Angioimmunoblast T-Cell Lymphoma 99mTc-MDP SPECT/CT Imaging for Hypertrophic Pulmonary Osteoarthropathy: A Case Report[J]. 临床医学进展, 2023, 13(08): 13362-13368. https://doi.org/10.12677/ACM.2023.1381867
参考文献
- 1. 王晔, 李醒亚. 骨显像的变化对肥大性肺性骨关节病治疗的指导意义[J]. 河南医学研究, 2016, 25(3): 424-426.
- 2. Chakraborty, R.K. and Sharma, S. (2022) Secondary Hypertrophic Osteoarthropathy. StatPearls, Treasure Island. http://www.ncbi.nlm.nih.gov/books/NBK513342/
- 3. Federico, M., Rudiger, T., Bellei, M., et al. (2013) Clinicopath-ologic Characteristics of Angioimmunoblastic T-Cell Lymphoma: Analysis of the International Peripheral T-Cell Lym-phoma Project. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 31, 240-246. https://doi.org/10.1200/JCO.2011.37.3647
- 4. Horwitz, S.M., Ansell, S., Ai, W.Z., et al. (2022) T-Cell Lym-phomas, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. Journal of the National Comprehensive Cancer Network, 20, 285-308. https://jnccn.org/view/journals/jnccn/20/3/article-p285.xml
- 5. Yabe, M., Dogan, A., Horwitz, S.M. and Mos-kowitz, A.J. (2019) Angioimmunoblastic T-Cell Lymphoma. In: Querfeld, C., Zain, J. and Rosen, S., Eds., T-Cell and NK-Cell Lymphomas, Springer, Cham, 99-126. https://doi.org/10.1007/978-3-319-99716-2_5
- 6. Attygalle, A., Al-Jehani, R., Diss, T.C., et al. (2002) Neoplastic T Cells in Angioimmunoblastic T-Cell Lymphoma Express CD10. Blood, 99, 627-633. https://ashpublications.org/blood/article/99/2/627/53363/Neoplastic-T-cells-in-angioimmunoblastic-Tcell https://doi.org/10.1182/blood.V99.2.627
- 7. Lunning, M.A. and Vose, J.M. (2017) Angioimmunoblastic T-Cell Lymphoma: The Many-Faced Lymphoma. Blood, 129, 1095-1102. https://doi.org/10.1182/blood-2016-09-692541
- 8. Rai, M.P., Bedi, P.S., Marinas, E.B. and Khan, N.N.S. (2018) Angioimmunoblastic T-Cell Lymphoma: A Rare Subtype of Peripheral T-Cell Lymphoma. Clinical Case Reports, 6, 750-752. https://onlinelibrary.wiley.com/doi/10.1002/ccr3.1388 https://doi.org/10.1002/ccr3.1388
- 9. Advani, R.H., Skrypets, T., Civallero, M., et al. (2021) Outcomes and Prognostic Factors in Angioimmunoblastic T-Cell Lymphoma: Final Report from the International T-Cell Project. Blood, 138, 213-220. https://doi.org/10.1182/blood.2020010387
- 10. 安瑞, 黄钢, 匡安仁, 等. 核医学[M]. 第3版. 北京: 人民卫生出版社, 2019.
- 11. Kaur, H., Muhleman, M. and Balon, H.R. (2018) Hypertrophic Osteoarthropathy on Bone Scintig-raphy. Journal of Nuclear Medicine Technology, 46, 147-148. http://tech.snmjournals.org/lookup/doi/10.2967/jnmt.117.199315 https://doi.org/10.2967/jnmt.117.199315
- 12. 潘中允, 安锐, 等. 实用核医学[M]. 北京: 人民卫生出版社, 2014.
- 13. Davis, M.C. and Sherry, V. (2011) Hypertrophic Osteoarthropathy as a Clinical Manifestation of Lung Can-cer. Clinical Journal of Oncology Nursing, 15, 561-563. https://doi.org/10.1188/11.CJON.561-563
- 14. Ito, T., Goto, K., Yoh, K., et al. (2010) Hypertrophic Pulmonary Osteoarthropathy as a Paraneoplastic Manifestation of Lung Cancer. Journal of Thoracic Oncology: Official Publication of the International Association for the Study of Lung Cancer, 5, 976-980. https://doi.org/10.1097/JTO.0b013e3181dc1f3c
- 15. 孙志勇, 周帅, 黄叶, 周后蓉, 陈大才, 王婷, 王庆旭. 全身骨显像评估肺癌继发性肥大性骨关节病变[J]. 西南军医, 2021, 23(3): 252-255.
- 16. Alonso-Bartolomé, P., Martínez-Taboada, V.M., Pina, T., Blanco, R. and Rodriguez-Valverde, V. (2006) Hypertrophic Osteoarthropathy Secondary to Vascular Prosthesis Infection: Report of 3 Cases and Review of the Litera-ture. Medicine, 85, 183-191. https://doi.org/10.1097/01.md.0000224714.27508.8b
- 17. Zhang, Z., Zhang, C. and Zhang, Z. (2013) Primary Hypertrophic Osteoarthropathy: An Update. Frontiers of Medicine, 7, 60-64. https://doi.org/10.1007/s11684-013-0246-6
- 18. Krugh, M. and Vaidya, P.N. (2022) Hypertrophic Osteoarthropa-thy. StatPearls, Treasure Island. http://www.ncbi.nlm.nih.gov/books/NBK540968/
- 19. Meyer, H.J., Leifels, L., Bach, A.G. and Surov, A. (2017) Sec-ondary Hypertrophic Osteoarthropathy Caused by Non-Pleural or Pulmonary Tumors. Medicine, 96, e7985. https://doi.org/10.1097/MD.0000000000007985
- 20. 李少林, 王荣福, 张永学, 等. 核医学[M]. 第8版. 北京: 人民卫生出版社, 2013.
- 21. Auroux, M. and Adelaide, L. (2020) Hypertrophic Pulmonary Osteoarthropathy Reveal-ing a Solitary Fibrous Tumor. Mayo Clinic Proceedings, 95, 1567-1568. https://linkinghub.elsevier.com/retrieve/pii/S0025619620306054 https://doi.org/10.1016/j.mayocp.2020.03.036
- 22. Sugimoto, H. and Nakata, K. (2020) Hypertrophic Pulmonary Osteoarthropathy: An Unusual Manifestation of Lung Cancer. QJM: An International Journal of Medicine, 113, 895-896. https://academic.oup.com/qjmed/article/113/12/895/5805398 https://doi.org/10.1093/qjmed/hcaa093
- 23. Callemeyn, J., Van Haecke, P., Peetermans, W.E. and Blockmans, D. (2016) Clubbing and Hypertrophic Osteoarthropathy: Insights in Diagnosis, Pathophysiology, and Clinical Significance. Acta Clinica Belgica, 71, 123-130. http://www.tandfonline.com/doi/full/10.1080/17843286.2016.1152672 https://doi.org/10.1080/17843286.2016.1152672
- 24. Essouma, M., Nkeck, J.R., Agbor, V.N. and Noubiap, J.J. (2022) Epidemiology of Digital Clubbing and Hypertrophic Osteoarthropathy: A Systematic Review and Meta-Analysis. Journal of Clinical Rheumatology: Practical Reports on Rheumatic & Musculoskeletal Diseases, 28, 104-110. https://doi.org/10.1097/RHU.0000000000001830
- 25. 吴彩兰, 李艳. 肺性肥大性骨关节病的骨显像特征及临床意义[J]. 中国老年学杂志, 2011, 31(8): 1301-1302.
- 26. Nahar, I., Al-Shemmeri, M. and Hussain, M. (2007) Sec-ondary Hypertrophic Osteoarthropathy: New Insights on Pathogenesis and Management. The Gulf Journal of Oncology, 1, 71-76.
NOTES
*通讯作者。